替格瑞洛对大鼠胃溃疡愈合的影响及其机制研究
2016-08-30刘晨晨樊叶关月姜宗丹汪志兵王劲松黄文斌张振玉
刘晨晨樊 叶关 月姜宗丹汪志兵王劲松黄文斌张振玉#
南京医科大学附属南京医院(南京市第一医院)消化科1(210006) 病理科2济宁市第一人民医院消化科3
替格瑞洛对大鼠胃溃疡愈合的影响及其机制研究
刘晨晨1,3*樊叶1关月1姜宗丹1汪志兵1王劲松2黄文斌2张振玉1#
南京医科大学附属南京医院(南京市第一医院)消化科1(210006)病理科2济宁市第一人民医院消化科3
背景:新型抗血小板药物替格瑞洛对消化道有潜在损伤风险。目的:探讨替格瑞洛对大鼠胃溃疡愈合的影响及其可能机制。方法:96只雄性Sprague-Dawley大鼠随机分为对照组和替格瑞洛低剂量、高剂量组,制作乙酸胃溃疡模型,造模后第3 d开始分别予0.5% CMC-Na、21 mg/kg和42 mg/kg替格瑞洛灌胃干预。于第3、5、7、9 d 分批处死大鼠,评估胃溃疡愈合和黏膜损伤情况,以免疫组化法和蛋白质印迹法检测溃疡边缘胃黏膜血管内皮生长因子(VEGF)、表皮生长因子(EGF)和增殖细胞核抗原(PCNA)表达,TUNEL法检测细胞凋亡情况。结果:第9 d时,替格瑞洛干预组胃溃疡面积和黏膜损伤指数均显著大于对照组(P<0.05),且高剂量组显著大于低剂量组(P<0.05),同时溃疡边缘胃黏膜中VEGF、EGF、PCNA表达降低,细胞凋亡增加,与对照组相比差异均有统计学意义(P<0.05),但替格瑞洛高、低剂量组在VEGF表达、细胞凋亡方面无明显差异(P>0.05)。结论:替格瑞洛可延迟大鼠胃溃疡愈合,其机制可能是通过下调胃黏膜中的VEGF、EGF表达、抑制细胞增殖、促进细胞凋亡而减缓溃疡修复过程。
替格瑞洛;胃溃疡;血管内皮生长因子类;表皮生长因子;细胞增殖;细胞凋亡
Correspondence to:ZHANG Zhenyu,Email:njzzy808@163.com
Background:Ticagrelor is a novel anti-platelet agent that may cause gastrointestinal adverse events.Aims:To investigate the effect of ticagrelor on gastric ulcer healing in rats and its possible mechanism.Methods:Ninety-six male Sprague-Dawley rats were randomly divided into three groups:control group,low-dose ticagrelor group and high-dose ticagrelor group.Gastric ulcer was induced by using acetic acid and 0.5% CMC-Na,21 mg/kg ticagrelor and 42 mg/kg ticagrelor were given intragastrically from the 3rd day of model construction,respectively.Animals were sacrificed in batches on the 3rd,5th,7th and 9th day.The ulcer healing and mucosal injury were assessed macro- and microscopically.Immunohistochemistry and Western blotting were used to determine the expressions of vascular endothelial growth factor (VEGF),epidermal growth factor (EGF) and proliferating cell nuclear antigen (PCNA) in mucosal tissue at ulcer margin,and gastric cell apoptosis was detected by TUNEL assay.Results:On the 9th day,the area of gastric ulcer and mucosal injury index in ticagrelor groups were significantly higher than those in control group (P<0.05),and those in high-dose ticagrelor group were significantly higher than those in low-dose group (P<0.05).Meanwhile,the expressions of VEGF,EGF and PCNA in mucosal tissue at ulcer margin were decreased in ticagrelor groups,and apoptotic cells was increased (P all <0.05).No significant differences in VEGF expression and cell apoptosis were found between low-dose and high-dose ticagrelor groups (P>0.05).Conclusions:Ticagrelor delays gastric ulcer healing in rats possibly through reducing VEGF and EGF expression,inhibiting cell proliferation as well as promoting cell apoptosis,thus collectively hindering the ulcer healing process.
抗血小板药物在心脑血管疾病的一、二级预防中起重要作用。替格瑞洛(ticagrelor)是一种口服抗血小板药物,能可逆性地结合并抑制腺苷二磷酸(ADP)受体P2Y12,从而起到抗血小板作用,是治疗急性冠状动脉综合征(ACS)的新型药物[1-2],因能快速、有效地抑制血小板而被多个国内外指南推荐使用。PLATO研究[1]显示,与氯吡格雷相比,替格瑞洛可显著减少ACS患者的心血管不良事件而不增加主要出血事件,但在次要出血和轻微出血方面,替格瑞洛则有增多的趋势,尽管差异未达统计学意义,但替格瑞洛对消化道的潜在损伤风险仍不容忽视。本研究应用实验性胃溃疡大鼠模型,探讨替格瑞洛对胃溃疡愈合的影响及其可能机制。
材料与方法
一、实验动物和主要试剂
雄性Sprague-Dawley大鼠96只,3月龄,体质量180~220 g,由南京医科大学附属南京医院动物实验中心提供,动物使用许可证号:SYXK(苏)2009-0015。饲养条件:温度(24±2) ℃,湿度55%±5%,噪音<50 dB,每12 h一次明暗循环,平衡饲料分笼饲养,每笼8只,自由饮水。替格瑞洛为阿斯利康公司产品,批号2403821240,以0.5% CMC-Na配制成悬浊液。兔血管内皮生长因子(VEGF)多克隆抗体、山羊表皮生长因子(EGF)多克隆抗体(Santa Cruz Biotechnology,Inc.),鼠增殖细胞核抗原(PCNA)单克隆抗体(北京中杉金桥生物技术有限公司),EnVision免疫组化检测试剂盒(DAKO),TUNEL凋亡检测试剂盒(Roche Diagnostics)。
二、方法
1.动物分组和药物干预:96只大鼠随机分为3组:对照组和替格瑞洛低剂量、高剂量组,每组32只。大鼠适应性观察7 d后开始造模,造模后第3 d(即溃疡形成第1 d)开始予药物干预,对照组予 0.5% CMC-Na灌胃,替格瑞洛低剂量和高剂量组分别 予替格瑞洛21 mg/kg(按人类长期口服剂量 75 mg/d 折算)和 42 mg/kg 灌胃,禁食18 h后每天上午给药一次,直至处死。造模后第3、5、7、9 d每组随机选取8只大鼠,禁食不禁水24 h后10%水合氯醛腹腔麻醉、处死,取胃组织进行后续实验。
2.乙酸胃溃疡模型制作:造模前禁食不禁水24 h,参照文献报道的方法[3-4],以10%水合氯醛麻醉大鼠,腹部手术将胃拉出腹腔,以内径6 mm的塑料管紧贴胃体与幽门交接处浆膜面,注入100%乙酸75 μL,作用26 s后移除,依次缝合腹壁各层。
3.标本处理和病理学检查:分离胃周围血管和组织,结扎食管末端和十二指肠上端后将胃取出,沿大弯侧切开,冷0.9% NaCl溶液洗净胃黏膜,观察溃疡愈合情况,留取大体照片。溃疡周围组织部分以4%多聚甲醛溶液固定24 h,常规脱水、透明、石蜡包埋、切片,HE染色,光学显微镜下观察组织学改变;另一部分-80 ℃保存待测。
4.评估指标
①溃疡面积:胃黏膜洗净后以滤纸吸干、展平,先将溃疡轮廓描记于透明胶片上,再拷贝至mm2方格纸上,计算溃疡面积。
②胃黏膜损伤指数(lesion index,LI):采用Guth标准计算胃黏膜LI[5]。斑点样损伤,1分;损伤长度<1 mm,2分;1~2 mm,3分;2~4 mm,4分;≥4 mm,5分;损伤宽度>2 mm时积分值翻倍。
③胃黏膜VEGF表达:采用免疫组化EnVision二步法进行检测。石蜡切片常规脱蜡、水化,按试剂盒说明书进行操作。结果判断参照Brown等[6]采用的方法并略作修改,每张切片选取5个200倍视野,每视野随机观察100个细胞,计数阳性细胞并判断染色强度。每视野阳性细胞数:<5,0分;5~25,1分;26~50,2分;>50,3分。染色强度:无着色,0分;淡黄色,1分;棕黄色,2分;棕褐色,3分。免疫组化评分为两项评分之和:0分,阴性(-);1~3分,弱阳性(+);4~5分,中度阳性(++);6分,强阳性(+++)。细胞计数由2名病理医师独立完成,差值在10%以上则重新计数。
④胃黏膜EGF、PCNA表达:采用蛋白质印迹法进行检测。取约100 mg溃疡周围胃黏膜组织,蛋白裂解液裂解、提取总蛋白;总蛋白与上样缓冲液混合,SDS-PAGE凝胶电泳,转膜,封闭后加入EGF、PCNA抗体,4 ℃过夜,加入HRP标记的二抗,ECL法显影、照相,ImageJ 软件分析蛋白相对表达量。
⑤胃黏膜细胞凋亡:采用TUNEL法进行检测。石蜡切片常规脱蜡、水化,按试剂盒说明书进行操作。每张切片选取5个200倍视野,每视野随机观察100个细胞,染色阳性物质呈棕黄色,计算阳性细胞百分率,即凋亡指数(apoptosis index,AI)。
三、统计学分析
结 果
一、乙酸胃溃疡模型溃疡愈合情况
造模后第3 d,对照组、替格瑞洛低剂量和高剂量组分别有1只、2只和1只大鼠死亡,解剖见胃溃疡深大、穿孔,腹腔黏连严重,之后未再有大鼠死亡,各组溃疡面积均随时间延长而逐渐缩小(P<0.05)。第3 d、第5 d时各组间溃疡面积无明显差异(P>0.05);第7 d时替格瑞洛干预组显著大于对照组(P<0.05),但高、低剂量组间无明显差异(P>0.05);第9 d时替格瑞洛干预组显著大于对照组(P<0.05),且高剂量组显著大于低剂量组(P<0.05),该时点三组胃黏膜LI变化趋势与溃疡面积相一致(两两比较P均<0.05)(表1、图1)。因此采用第3 d、第9 d标本行各项指标分析。
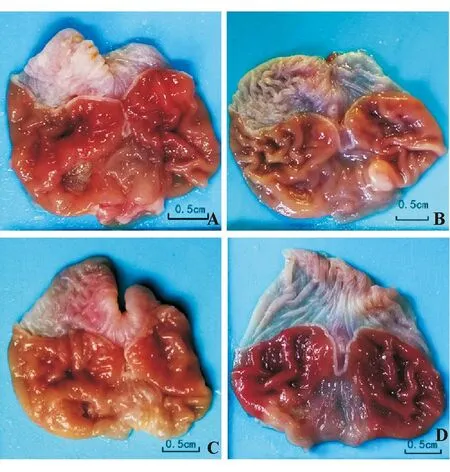
A:第3 d;B、C、D:第9 d;B:对照组;C:替格瑞洛低剂量组;D:替格瑞洛高剂量组
图1各组大鼠胃大体形态变化
二、胃黏膜组织学变化
第3 d时,大鼠胃黏膜结构失去连续性和完整性,可见上皮细胞脱落、破碎,出现大片坏死灶,溃疡可深达黏膜肌层,腺体结构破坏,大量炎性细胞浸润。第9 d时,对照组溃疡瘢痕性愈合,黏膜表面见轻微坏死灶,基本局限于黏膜层,腺体排列稍紊乱,周边黏膜炎性细胞浸润减轻;替格瑞洛低剂量组见浅层小片状坏死灶,少数深达肌层,腺体排列紊乱,周边仍有大量炎性细胞浸润;替格瑞洛高剂量组仍有片状坏死灶,部分深达肌层,多数仍有腺体结构紊乱、炎性细胞浸润等表现(图2)。
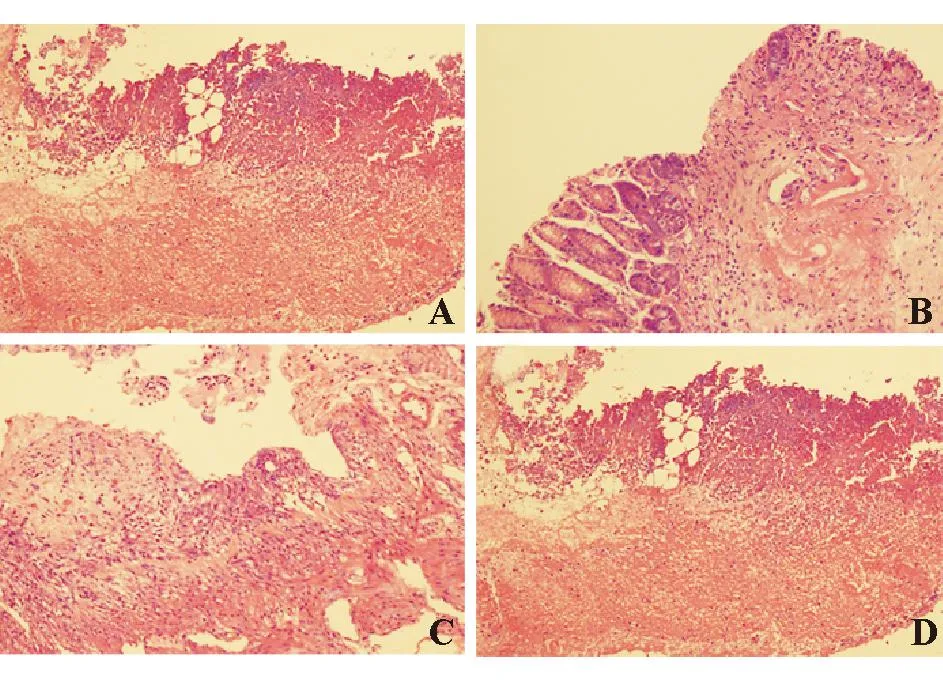
A:第3 d;B、C、D:第9 d;B:对照组;C:替格瑞洛低剂量组;D:替格瑞洛高剂量组
图2各组大鼠胃黏膜组织学变化(HE染色,×100)
三、胃黏膜VEGF表达
免疫组化检测显示,VEGF免疫阳性物质主要定位于细胞质,呈粗细不等、深浅不一的棕色颗粒。第3 d时溃疡边缘胃黏膜中仅有少量VEGF表达,强阳性率为0%,表达评分为2.375±1.188。第9 d时,对照组强阳性率87.5%(7/8),表达评分5.875±0.354;替格瑞洛低剂量组强阳性率37.5%(3/8),表达评分4.250±1.581;替格瑞洛高剂量组强阳性率 25.0%(2/8),表达评分4.000±1.414;替格瑞洛干预组强阳性率和表达评分均显著低于对照组(P<0.05),但高、低剂量组间差异无统计学意义(P>0.05)(图3)。
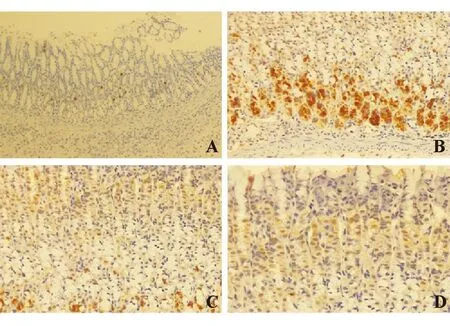
A:第3 d;B、C、D:第9 d;B:对照组;C:替格瑞洛低剂量组;D:替格瑞洛高剂量组
图3各组大鼠胃黏膜VEGF表达(EnVision二步法,×200)
四、胃黏膜EGF、PCNA表达
蛋白质印迹法检测显示,第9d时替格瑞洛干预组溃疡边缘胃黏膜中EGF、PCNA相对表达量较对照组显著降低(P<0.05),且高剂量组显著低于低剂量组(P<0.05)(图4)。
表1 各组大鼠胃溃疡面积和胃黏膜LI比较±s)
五、胃黏膜细胞凋亡
TUNEL法检测显示,棕黄色阳性物质主要定位于凋亡细胞核内,浓缩的核质紧贴于核膜,呈均匀染色。第3 d时溃疡边缘胃黏膜中凋亡细胞较多,黏膜全层均有显色,呈弥漫性分布,AI 44.00±5.15。第9 d时,对照组凋亡细胞较少,主要位于表面上皮,呈散在分布,AI 27.50±4.11;替格瑞洛低剂量组凋亡细胞仍较多,黏膜全层均可见,多数为弥漫性分布,少数散在分布,AI 40.87±3.14;替格瑞洛高剂量组凋亡细胞更多,全层弥漫性分布,偶见散在分布,AI 41.62±3.81;替格瑞洛干预组AI显著高于对照组(P<0.05),但高、低剂量组间差异无统计学意义(P>0.05)(图5)。
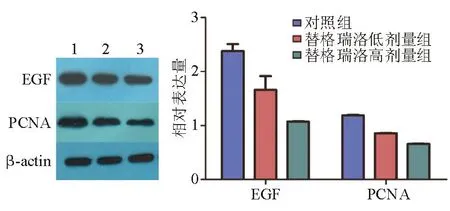
1:对照组;2:替格瑞洛低剂量组;3:替格瑞洛高剂量组
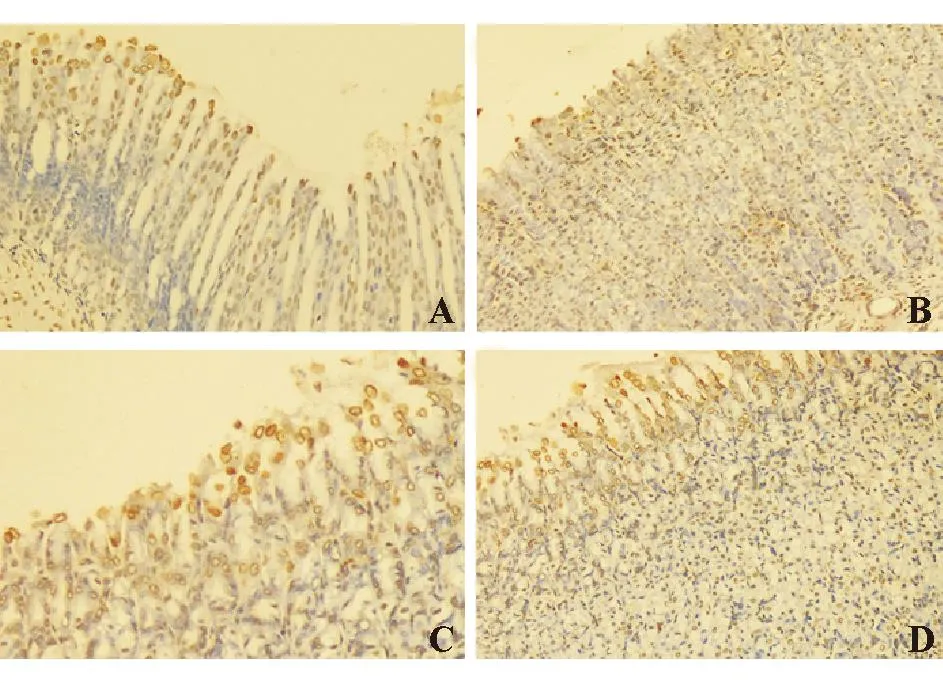
A:第3 d;B、C、D:第9 d;B:对照组;C:替格瑞洛低剂量组;D:替格瑞洛高剂量组
图5各组大鼠胃黏膜细胞凋亡情况(TUNEL法,×200)
讨 论
抗血小板药物是治疗心脑血管疾病的基石,由其引起的消化道损伤也是临床上常见的棘手问题。替格瑞洛是继氯吡格雷之后的新型防治心脑血管疾病药物[1],在ACS患者中,其心血管获益大于氯吡格雷,但出血事件(包括消化道损伤出血)风险并不低于氯吡格雷。目前临床上多联合应用质子泵抑制剂(PPI)防治抗血小板药物引起的消化道损伤,但研究发现联用PPI甚至PPI本身可能会增加心血管不良事件风险,且长期使用PPI可引起骨质疏松、肠道菌群紊乱等不良反应[7-9]。
本实验通过予实验性胃溃疡大鼠模型替格瑞洛干预,探讨替格瑞洛对胃溃疡的愈合是否有延迟作用及其可能机制。胃溃疡的愈合是一个十分复杂的过程,涉及坏死物质的清除、肉芽组织生长、新生血管、纤维组织、瘢痕组织形成以及上皮修复等过程,黏膜缺失的填充、黏膜下组织结构的重建是多种细胞、生长因子和细胞外基质相互作用的结果。EGF是一种可促进细胞增殖、分化和黏膜修复的生长因子,在维持胃肠道黏膜完整性方面具有重要作用,可通过促进DNA、RNA和蛋白质合成加速损伤黏膜的修复,有研究表明溃疡愈合质量与EGF表达密切相关[10]。VEGF亦为促进溃疡愈合的重要因子,主要通过调节各种黏膜保护因子与损伤因子之间的平衡而参与黏膜修复[11]。一方面,VEGF可增加微血管通透性,通过稀释胃内有害物质而发挥黏膜保护作用;另一方面,其还可刺激腺体和血管生成,从而促进溃疡愈合[12]。VEGF表达于多种人和动物组织中,正常情况下表达水平较低,但在一些代谢旺盛、血供丰富的组织中往往呈较高水平表达。本实验发现,予胃溃疡大鼠模型替格瑞洛干预后,胃黏膜大体和组织学表现均提示替格瑞洛可延迟溃疡愈合,伴有溃疡边缘胃黏膜中EGF、VEGF表达降低,因此认为替格瑞洛可通过抑制胃黏膜中的EGF、VEGF表达而导致溃疡愈合延迟。
PCNA是一种仅在增殖细胞中表达、合成的酸性核蛋白,是评价细胞增殖的重要指标[13]。胃黏膜细胞的增殖能力是影响溃疡愈合的重要因素,本实验中经替格瑞洛干预后,胃溃疡大鼠模型溃疡边缘胃黏膜中PCNA表达显著降低,由此推测替格瑞洛可能通过抑制溃疡边缘细胞增殖而延迟溃疡愈合。正常情况下,组织器官中存在细胞增殖与凋亡的动态平衡,该平衡的打破将导致疾病发生[14],研究[15-17]显示由多种原因引起的胃黏膜细胞凋亡是胃溃疡的基本病理改变,但具体机制不明。为此,本研究以TUNEL法检测了各组大鼠的溃疡边缘胃黏膜细胞凋亡情况,结果显示替格瑞洛干预可使溃疡边缘胃黏膜细胞凋亡显著增多,因此认为促进胃黏膜细胞凋亡是替格瑞洛延迟溃疡愈合的重要因素之一。
本实验中替格瑞洛高剂量组的胃黏膜大体和组织学损伤均重于低剂量组,溃疡边缘胃黏膜EGF、PCNA表达显著低于低剂量组,但在VEGF表达和细胞凋亡方面与低剂量组相比无明显差异,替格瑞洛延迟大鼠胃溃疡愈合的作用是否呈剂量依赖性尚需进一步研究探讨。
综上所述,替格瑞洛可延迟大鼠胃溃疡愈合,其机制可能是通过下调胃黏膜中的VEGF、EGF表达、抑制细胞增殖、促进细胞凋亡而减缓溃疡修复过程。本研究仅从动物实验水平初步探讨了抗血小板药物替格瑞洛对消化道的潜在损伤风险及其可能机制,确切机制仍有待后续更深入的基础和临床研究加以阐明。
1Wallentin L,Becker RC,Budaj A,et al; PLATO Investigators,Freij A,Thorsén M.Ticagrelor versus clopidogrel in patients with acute coronary syndromes[J].N Engl J Med,2009,361 (11):1045-1057.
2Schömig A.Ticagrelor -- is there need for a new player in the antiplatelet-therapy field?[J].N Engl J Med,2009,361 (11):1108-1111.
3Brzozowski T,Kwiecień S,Konturek PC,et al.Comparison of nitric oxide-releasing NSAID and vitamin C with classic NSAID in healing of chronic gastric ulcers; involvement of reactive oxygen species[J].Med Sci Monit,2001,7 (4):592-599.
4Okabe S,Amagase K.An overview of acetic acid ulcer models -- the history and state of the art of peptic ulcer research[J].Biol Pharm Bull,2005,28 (8):1321-1341.
5Guth PH,Aures D,Paulsen G.Topical aspirin plus HCl gastric lesions in the rat.Cytoprotective effect of prostaglandin,cimetidine,and probanthine[J].Gastroenterology,1979,76 (1):88-93.
6Brown RS,Wahl RL.Overexpression of Glut-1 glucose transporter in human breast cancer.An immunohisto-chemical study[J].Cancer,1993,72 (10):2979-2985.
7Abraham NS.Proton pump inhibitors:potential adverse effects[J].Curr Opin Gastroenterol,2012,28 (6):615-620.
8Kreutz RP,Stanek EJ,Aubert R,et al.Impact of proton pump inhibitors on the effectiveness of clopidogrel after coronary stent placement:the clopidogrel Medco outcomes study[J].Pharmacotherapy,2010,30 (8):787-796.
9Charlot M,Ahlehoff O,Norgaard ML,et al.Proton-pump inhibitors are associated with increased cardiovascular risk independent of clopidogrel use:a nationwide cohort study[J].Ann Intern Med,2010,153 (6):378-386.
10Konturek PC,Konturek SJ,Brzozowski T,et al.Epidermal growth factor and transforming growth factor-alpha:role in protection and healing of gastric mucosal lesions[J].Eur J Gastroenterol Hepatol,1995,7 (10):933-937.
11Ferrara N,Davis-Smyth T.The biology of vascular endothelial growth factor[J].Endocr Rev,1997,18 (1):4-25.
12Szabo S,Deng X,Khomenko T,et al.Gene expression and gene therapy in experimental duodenal ulceration[J].J Physiol Paris,2001,95 (1-6):325-335.
13Tsuji S,Kawano S,Sasayama Y,et al.Gastric mucosal cell proliferation and TGF alpha in the healing of peptic ulcers in human subjects[J].J Clin Gastroenterol,1995,21 Suppl 1:S30-S35.
14Thompson CB.Apoptosis in the pathogenesis and treatment of disease[J].Science,1995,267 (5203):1456-1462.
15Yaguchi T,Saito M,Yasuda Y,et al.Caspase-4 activation in association with decreased adenosine deaminase activity may be a factor for gastric ulcer[J].Digestion,2010,81 (1):62-67.
16刘婧,李兆申,许国铭,等.细胞凋亡和增殖在大鼠应激性溃疡发病中的作用[J].中华消化杂志,2003,23 (10):595-598.
17Chiou SK,Hodges A,Hoa N.Suppression of growth arrest and DNA damage-inducible 45alpha expression confers resistance to sulindac and indomethacin-induced gastric mucosal injury[J].J Pharmacol Exp Ther,2010,334 (3):693-702.
(2015-09-10收稿;2015-10-24修回)
Effect of Ticagrelor on Gastric Ulcer Healing in Rats and its Possible Mechanism
LIU Chenchen1,3,FAN Ye1,GUAN Yue1,JIANG Zongdan1,WANG Zhibing1,WANG Jinsong2,HUANG Wenbin2,ZHANG Zhenyu1.
1Department of Gastroenterology,2Department of Pathology,Affiliated Nanjing Hospital of Nanjing Medical University (Nanjing First Hospital),Nanjing (210006);3Department of Gastroenterology,Jining First People’s Hospital,Jining,Shandong Province
Ticagrelor;Stomach Ulcer;Vascular Endothelial Growth Factors;Epidermal Growth Factor;Cell Proliferation;Apoptosis
DOI:10.3969/j.issn.1008-7125.2016.07.004
*Email:njliucc@163.com
#本文通信作者,Email:njzzy808@163.com
