犬猫皮肤癣菌病致病菌种鉴定及药敏试验
2016-08-30孙伟东金艺鹏
王 静,孙伟东,金艺鹏
(1.中国农业大学动物医学院,北京 海淀 100193;2.天津市保灵动物保健品有限公司,天津 宁河 301500)
犬猫皮肤癣菌病致病菌种鉴定及药敏试验
王静1,孙伟东2,金艺鹏1
(1.中国农业大学动物医学院,北京 海淀 100193;2.天津市保灵动物保健品有限公司,天津 宁河 301500)
本试验使用皮肤癣菌通用引物(CHS1 1S,CHS1 1R)与寡核苷酸序列(GACA)4方法鉴定致病菌株,并根据Nc⁃cls推荐的方法(M38-A2)对临床分离株进行药敏试验,以指导准确鉴定菌种、快速诊断及正确用药。
皮肤癣菌;菌种鉴定;药敏试验
1 材料
1.1样本来源2014年8月至2015年1月间,来中国农业大学动物医院化验室进行皮肤采样化验的犬猫。
1.2标准菌株须毛癣菌标准株ATCC-28185,犬小孢子菌标准菌株ATCC-36299,克柔念珠菌ATCC-6258。
1.3培养基沙堡劳氏培养基,土豆培养基。
2 方法
2.1菌种鉴定将所采集的毛发接种于沙堡劳氏培养基上,每天观察并记录真菌的生长速度、表面状态、背面颜色等,根据这些特征对真菌进行初步的鉴定。使用玻璃珠法提取疑似皮肤癣菌的DNA,并根据相关文献,使用皮肤癣菌通用引物[1]CHS1 1S:(5′-CAT CGA GTA CAT GTG CTC GC-3′);CHS1 1R:(5′-CTC GAG GTC AAA AGC ACG CC-3′)进行扩增,鉴别皮肤癣菌与非皮肤癣菌。再用寡核苷酸序列[2](GACA)4:(5′-GAC AGA CAG ACA GAC A-3′)鉴别皮肤癣菌的种属。
2.2抗真菌药的制备根据以往的研究结果及M38-A2方法[3],受试药物的终浓度范围为:伊曲康唑0.001~0.5 μg/mL;特比萘芬0.001~0.5 μg/ mL;酮康唑0.0313~16 μg/mL。因此,它们的储存液浓度应分别为:伊曲康唑与特比萘芬50 μg/ mL;酮康唑1 600 μg/mL。
将无菌的储存液分装至无菌的聚丙烯小管内,密封,存放于-80℃的温度下。药敏试验当天,将储存液用二甲基亚砜稀释成各种中间浓度,再用RPMI1640培养基50倍稀释为终浓度。
2.3真菌接种液的制备将受试菌株在土豆培养基上活化并转种2次以上,以确保其纯度和活性。培养温度为28℃,活化时间大约7~10 d,直至显微镜检查可见多量孢子产生。用0.85%无菌生理盐水冲洗培养基表面,制备悬液。将菌悬液静置15~20 min后,较大颗粒会沉于底部,取上层液体。用Whatman40号滤纸过滤。用血细胞计数板计算孢子数目,调整孢子量,使菌落形成单位(CFU)为(1-3)×105CFU/mL。用RPMI1640培养基将菌液稀释50倍,得到2倍于终浓度的接种悬液,浓度为(2-6)×103CFU/mL。
2.496孔微型板加样将不同浓度的抗真菌药物按照浓度梯度由高到低排列在第1-10孔,每孔加入100 μL的2倍于终浓度的抗真菌药液,第11孔加入100 μL的RPMI1640培养基,第12孔加入最低浓度的抗真菌药物100 μL。
加药完成后,在第1-11孔,每孔加入100 μL的2倍于终浓度的菌液。第12孔加入经RPMI1640培养基稀释50倍后的0.85%无菌盐水作为阴性对照孔。将96孔微型板放入真菌培养箱,在28℃的温度、90%湿度的条件下孵育6 d,至菌落生长良好。为使试验可靠,每个菌株重复做药敏试验1次。
2.5最小抑菌浓度的判定根据Nccls M38-A2,采用肉眼观察判定最小抑菌浓度(MIC)。读取MIC时,通过肉眼观察每个孔中真菌的生长情况,将其与生长对照孔(第11孔)对照,对于酮康唑、伊曲康唑和特比萘芬,当皮肤癣菌菌株与生长对照孔相比,达到了80%或更高的抑制时,可判定为MIC。
3 结果
3.1皮肤癣菌种属鉴定结果采样期间,分离培养出疑似皮肤癣菌共117例。其中,79株扩增条带为450 bp左右,确认为皮肤癣菌。27株未扩增出条带,并非皮肤癣菌(见图1);79株皮肤癣菌均扩增出以900 bp为主,伴有400 bp、600 bp、2 500 bp大小的条带。鉴定为犬小孢子菌(见图2)。
3.2药敏试验结果见表1。
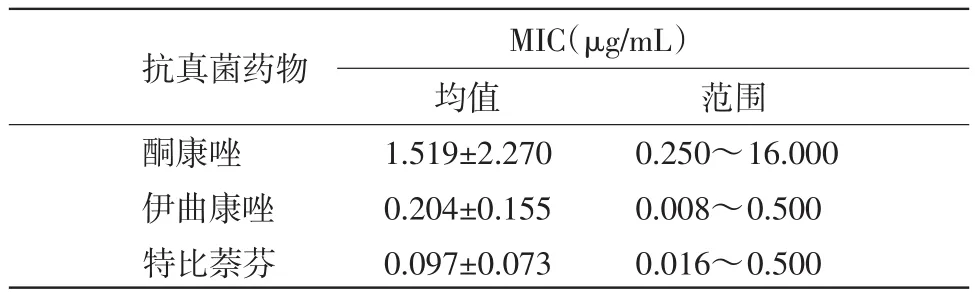
表1 不同抗真菌药物对犬小孢子菌的MIC(μg/mL)

图1 通用引物PCR扩增电泳图谱
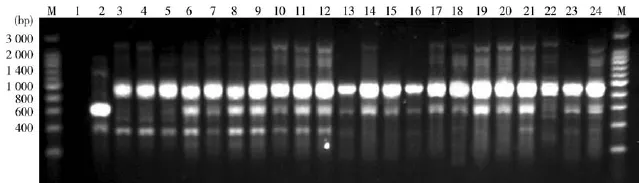
图2 寡核苷酸序列PCR扩增电泳图谱
经Kruskal-wailis检验3种抗真菌药物MIC均值,3种抗真菌药物对79株犬小孢子菌的药敏结果有极显著差异(P<0.01)。
4 讨论
4.1分子生物学方法鉴定结果的解读使用通用引物(CHS 1S,CHS 1R)鉴定真菌是否为皮肤癣菌的方法,被多次证实是简便、有效的[1,4-5]。使用这对引物,可将21种皮肤癣菌扩增出440 bp左右的片段[4],具有皮肤癣菌特异性,可以鉴别皮肤癣菌与非皮肤癣菌。本次试验中,须毛癣菌标准株、犬小孢子菌标准株及临床株均出现一条约450 bp的扩增条带,且念珠菌的标准株无扩增条带,与Kano等报道的约440 bp的扩增产物基本一致[1]。
使用短核苷酸序列(GACA)4作为惟一引物是鉴别皮肤癣菌种类的十分有效的分子学方法[2,6]。本次试验中,须毛癣菌标准株的条带特征与犬小孢子菌标准株和临床株有很大区别。结果显示,犬小孢子菌的条带比较复杂,数量多、范围大,不同的分离株条带有所差异,但大致相同。这些犬小孢子菌生存的地理位置与之前文献的研究有所不同,除此之外,条带特征(包括须毛癣菌标准株、犬小孢子菌标准株、犬小孢子菌临床株)一致[2,7],证明以(GACA)4为惟一引物的PCR方法是具有良好重复性的方法。
希腊的一项研究调查了城市与乡村健康犬被毛的皮肤癣菌携带情况。研究发现,从城市的犬被毛上分离出的皮肤癣菌均为犬小孢子菌,而从乡村所分离出的菌种以石膏样小孢子菌、须毛癣菌为首[8]。根据鉴定结果,试验中,在临床所收集到的皮肤癣菌,均为犬小孢子菌。犬小孢子菌是亲动物性皮肤癣菌,也是临床上从患病犬猫身上分离出的最多的皮肤癣菌。
4.2抗真菌药物的抑菌效果本试验结果显示,对犬小孢子菌的体外药敏试验中,特比萘芬是最有效的药物,MIC的平均值及范围都较小。这说明特比萘芬对犬小孢子菌的敏感度较高,与国内外多个研究结果一致[9-10]。特比萘芬是第二代丙烯胺类抗真菌药物,对皮肤癣菌有着较好的作用,同时,它对肝脏损害极少,与其他药物的相互作用也相当低。近年来一些文献显示,特比萘酚对犬皮肤癣菌病具有良好的治疗效果[9,15]。因此,特比萘酚有可能成为今后宠物皮肤癣菌病的特效药物之一。
唑类抗真菌药中,伊曲康唑所需抑菌浓度较低,其次是酮康唑。这与Santos的研究结果一致[10]。伊曲康唑及酮康唑都是对皮肤癣菌比较有效的抗真菌药,但是酮康唑对犬猫具有肝毒性,因此,服药前及疗程中,都应将肝功能检测作为常规监测。
目前,体外药敏试验的结果与实际的临床疗效之间的研究较少[11],MIC与临床疗效之间的关系是非常复杂的,以现有的试验结果而言,无法得出特比萘芬的临床疗效最好的结论。
4.3试验条件的探讨本试验的整体步骤是根据NCCLS对丝状真菌的药敏试验所建议的步骤进行的。但是在某些细节方面,做出了一些改变。首先,在配置接种液的步骤中,Nccls建议将菌悬液静止15~20 min,使真菌的菌丝沉底,取上层漂浮孢子作为接种液。但是静止并不能保证菌丝和孢子完全分离,因此,本试验使用8 μm的滤纸将菌液滤过,达到分离孢子的目的。这种方法对测定MIC终点可能有着非常重要的意义。曾有报道研究发现,某些皮肤癣菌的大分生孢子比菌丝的壁厚,因此他们对抗真菌药物的敏感性可能会有所不同[12]。因而,小分生孢子与菌丝对抗真菌药物的敏感性可能也不相同[13]。
其次,在试验中,本试验所选择的孵育温度与Nccls的建议(35℃)有所不同。这是因为,根据以往实验室培养真菌的经验,28℃的温度下,真菌的生长速度较快。所以此次仍然沿用以往的做法。最理想的孵育温度究竟是28℃还是35℃,一直以来均是一个争论点。普遍认为,绝大多数皮肤癣菌在28℃~30℃的条件下,生长的最好[14]。但是很多学者提出,更高的温度会更好[13]。Santos 与Norris认为无论是28℃还是35℃,在作为单一变量变化时,均不会显著影响药敏试验的结果[14]。而Ferna认为,在28℃的条件下,真菌可以更好的生长[14]。
Nccls所建议的孵育时间为4 d。但在预试验环节,约5 d时才开始可以看到培养基中点状的菌落,但此时菌落非常细小,不易观察。6 d时,菌落变大,且不同浓度下菌落的大小及数量有明显的梯度变化。7 d时,菌落面积进一步增加,但梯度比较模糊。因此,本试验决定选择接种后6 d作为孵育时间,根据真菌具体的生长情况,做出相应调整。有关孵育时间,以往的文献显示,受试真菌若为皮肤癣菌,则最佳孵育时间在3~20 d不等[13]。数据分析表明,增加孵育时间,不论是4 d增加至7 d,或是7 d增加至10 d,都会造成MIC判读结果的不同[13]。因此应选择尽量统一的时间点进行判读。
本试验选择Nccls所推荐的RPMI1640作为培养基。有文献表明,RPMI1640培养基可以给予皮肤癣菌充分的生长条件[14]。因为沙堡劳氏葡萄糖液体培养基(SDB)价格较为便宜,并且是实验室常用试剂,所以不少学者曾用SDB代替RPMI1640进行接种,但用于皮肤癣菌的案例较少[12]。
[1]Kano R,Hirai A,Muramatsu M,R,et al.Direct detection of der⁃matophytes in skin samples based on sequences of the chitin syn⁃thase 1(CHS1)gene[J].Journal of veterinary medical science,2003,65(2):267-270.
[2]Faggi E,Pini G,Campisi E,et al.Application of PCR to distin⁃guish common species of dermatophytes[J].Journal of clinical mi⁃crobiology,2001,39(9):3382-3385.
[3]Standard A.NCCLS document M38-A.National Committee for Clinical Laboratory Standards[S].Wayne PA,2002.
[4]Kano R,Nakamura Y,Watari T,et al.Molecular analysis of chi⁃tin synthase 1(CHS1)gene sequences of Trichophyton mentagro⁃phytes complex and T rubrum[J].Current microbiology,1998.37 (4):236-239.
[5]Kano R,Aihara S,Nakamura Y,et al.Chitin synthase 1(Chs1)gene sequences of Microsporum equinum and Trichophyton equi⁃num[J].Veterinary microbiology,2001.78(1):85-90.
[6]Roque H D,Vieira R,Rato S,et al.Specific primers for rapid de⁃tection of Microsporum audouinii by PCR in clinical samples[J]. Journal of clinical microbiology,2006,44(12):4336-4341.
[7]Bowen A R,Chen-Wu J L,Momany M,et al.Classification of fungal chitin synthases[J].Proceedings of the National Academy of Sciences,1992,89(2):519-523.
[8]Miller W H,Griffin C E,Campbell K L,et al.Muller and Kirk's Small Animal Dermatology7:Muller and Kirk's Small Animal Der⁃matology[C].2013:Elsevier Health Sciences.
[9]金艺鹏,林德贵.盐酸特比萘芬对犬猫皮肤真菌病的疗效观察[J].中国兽医杂志,2003,39(6):21-23.
[10]Santos D,J Hamdan.Evaluation of broth microdilution antifungal susceptibility testing conditions for Trichophyton rubrum.[J].Jour⁃nal of clinical microbiology,2005,43(4):1917-1920.
[11]Rex J H.Reference Method for Broth Dilution Antifungal Suscep⁃tibility Testing of Filamentous Fungi:Approved Standard[J].Clini⁃cal and Laboratory Standards Institute,2008.
[12]Guarro J,Llop C,Aguilar C,et al.Comparison of in vitro antifun⁃gal susceptibilities of conidia and hyphae of filamentous fungi[J]. Antimicrobial agents and chemotherapy,1997,41(12):2760-2762.
[13]Santos D,M Barros,J Hamdan.Establishing a method of inocu⁃lum preparation for susceptibility testing of Trichophyton rubrum and Trichophyton mentagrophytes[J].Journal of clinical microbiol⁃ogy,2006,44(1):98-101.
[14]Fernández-Torres B,Cabanes F J,Carrillo-Munoz A J,et al.Col⁃laborative evaluation of optimal antifungal susceptibility testing conditions for dermatophytes[J].Journal of clinical microbiology,2002,40(11):3999-4003.
[15]陆桂平.盐酸特比萘芬和复方酮康唑对犬真菌病的临床疗效观察[J].养犬,2008,01:17-18.
Identification and drug susceptibility of pathogenic strains of canineand felinewith dermatophytosis
WANG Jing1,SUN Wei-dong2,JIN Yi-peng1
(1.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China;2.Tianjinshi Baoling Animal Health Products Ltd.Co,Tianjin 301500,China)
In this study,used universal primer CHS1 1S,CHS1 1R and the repetitive oligonucleotide(GACA)4 as a primer to identify dermatophytes.In addition,the study used Nccls proposed in vitro susceptibility test for the clinical isolates(M38-A2).The aim of the study was to identify the clinical isolates accurately and rapidly and to find the effective antifungal drugs for clinical therapy.
dermatophytes;species identification;susceptibility testing
JIN Yi-peng皮肤癣菌病是犬猫临床上极其常见的皮肤疾病,具有一定的传染能力。而目前国内对小动物皮肤癣菌病的诊断,仍停留在形态学观察(包括直接镜检及真菌培养)层面。本试验使用分子生物学技术,将犬猫感染、致病的皮肤癣菌准确鉴定至种的水平,并试验已鉴定出种属的皮肤癣菌对伊曲康唑、酮康唑及特比萘芬的敏感性,以指导快速诊断、正确用药与治疗,提高治愈率。
S858.292,S858.293
A
0529-6005(2016)07-0071-03
2015-05-27
王静(1989-),女,兽医师,硕士,从事小动物皮肤病临床工作,E-mail:wweverywhere@foxmail.com
孙伟东(1990-),女,兽医师,硕士,从事兽药注册工作,E-mail:swd.happylife@163.com
注:孙伟东与王静对本文具有同等贡献
金艺鹏,E-mail:yipengjin@sina.com
