乙型肝炎病毒蛋白诱导白细胞介素32表达情况的研究
2016-08-29张晶晶谢永富胡建峰刘会晶孙宏勋河北医科大学第三医院检验科河北石家庄050051
张晶晶,谢永富,胡建峰,刘会晶,孙宏勋(河北医科大学第三医院 检验科,河北 石家庄 050051)
乙型肝炎病毒蛋白诱导白细胞介素32表达情况的研究
张晶晶,谢永富,胡建峰,刘会晶,孙宏勋
(河北医科大学第三医院 检验科,河北 石家庄 050051)
目的探讨乙型肝炎病毒蛋白诱导白细胞介素32(IL-32)的表达以及临床意义。方法用Lipofectamine 2000TM介导转染HepG2细胞。转染48 h后,采用聚合酶链反应(RT-PCR),蛋白免疫印迹法(Western blot)分别检测HepG2细胞中IL-32的mRNA及蛋白的表达量。结果RT-PCR结果显示转染HBV的HepG2细胞中IL-32 mRNA的表达量比转染空载体(未转染)的细胞中IL-32 mRNA高2.3倍;Western blot结果显示与空载体转染的HepG2细胞比较,转染pIRES2-HBV-EGFP的HepG2细胞中IL-32蛋白质表达增高,且差异有统计学意义(P<0.05)。结论HBV促进IL-32蛋白的表达,从而证实乙型肝炎的严重程度与IL-32的表达有关。
乙型肝炎病毒蛋白;IL-32;表达;研究
乙型肝炎病毒(hepatitis B virus,HBV)感染是目前严重威胁人类健康的病毒之一。HBV感染肝细胞后不仅极易引起急性肝炎、慢性肝炎和肝硬化等疾病,而且还会提高肝癌的发生率[1]。HBV感染宿主后,正常的免疫应答可以清除乙肝病毒,表现为急性一过性的感染。若是细胞免疫功能低下或紊乱者,则无法清除乙肝病毒,最终将成为慢性感染者[2]。白细胞介素32(Interleukin,IL-32)是一种重要的炎症因子,主要经免疫细胞表达,IL-32为促炎因子。IL-32在丙型肝炎病毒、人乳头状瘤病毒引起的炎症性疾病中发挥重要作用[3-4]。IL-32是否参与乙型病毒性肝炎的发病,国内外研究甚少,本研究在分子生化水平对HBV是否诱导IL-32的表达进行初步探索。
1 材料与方法
1.1实验材料
细胞株:人肝癌细胞株HepG2细胞(购自北京协和技术所细胞库),主要试剂:主要试剂及来源见表1。
1.2实验方法
1.2.1细胞培养HepG2细胞培养在含10%胎牛血清、10%青链双抗的DMEM培养基中,于37℃、5%二氧化碳CO2条件下培养,待贴壁细胞处于生长期时进行传代。
1.2.2质粒转染细胞用脂质体 Lipofectamine 2000TM介导转染,在转染前1 d换用不含双抗的培养液,调整HepG2细胞浓度为1×105个/rat,将其接种于24孔板中,每孔1 ml。用OPTI-MEM稀释质粒和脂质体,当细胞贴壁密度达到90%融合时,把质粒、脂质体混合物加至细胞中。转染6 h后更换培养液为含双抗的培养液,第2天荧光下观察转染率达50%。
1.2.3RT-PCR检测HBV转染IL-32 mRNA的表达量将上述细胞培养48 h后,除去培养液,用PBS(phosphate-buffered saline,PBS)洗2次,然后加入Trizol。按试剂盒说明提取总RNA。采用分光光度法(A260/280 nm值)检测每一个RNA样本的质量。利用反转录试剂盒对总RNA进行逆转录。采用SYBR GreenⅠ染料法对IL-32基因的表达量进行检测,反应体系为25μl:2×Power SYBR Green PCR Master Mix(Applied Bio-system)10μl,10μmol/L的正反向引物各加1μl,模板为总RNA逆转录所得的cDNA,用灭菌双蒸水补足至25μl。各处理组分别做3~4个平行样品,每个样品再分别平行做3个重复。各个样品的反应条件为:95℃、3 min,40个循环:95℃、15 s,60℃、45 s;60℃延伸步骤进行荧光信号的采集。反应结束后,收集本反应体系的融解曲线,以此分析PCR产物的特异性。目的基因相对表达量分析方法采用 2-△△CT法计算。IL-32引物参照KOBAYASHI等[5]:正向引物5'-CGACTTCAAAGAGG GCTACC-3',反向引物5'-GAGTGAGCTCTGGGTGC TG-3';β-actin引物:正向引物5'-TCGTCCACCGCA AATGCTTCTAG-3',反向引物5'-ACTGCTGTCACCT FCACCGTTCC-3',采用双△t法计算结果。
1.2.4蛋白免疫印迹法(Western blot)检测HBV转染IL-32蛋白的表达量影响收集未转染以及转染48 h的细胞,冲洗2次,置放射免疫沉淀分析缓冲液中萃取蛋白,置冰上30 min。采用超声匀浆器处理标本,用未转染细胞做对照,采用Lowry法测定蛋白浓度。采用10%SDS-PAGE(150 V,2 h)分离蛋白,并转到硝酸纤维膜上,用5%的牛血清白蛋白封闭1 h,加1∶2 000的Mouse anti-IL-32单抗孵育过夜,第2天,冲洗掉一抗,在用1∶5 000的辣根过氧化酶结合的Goat anti-mouse IgG孵育1 h。采用增强化学发光法检测蛋白质。Mouse-anti-β-actin单克隆抗体作为内对照。

表1 试剂列表
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1HBV对IL-32 mRNA的表达量的影响
实时荧光定量PCR结果显示,转染HBV 48 h后的HepG2细胞,比转染空载体(未转染)的细胞中的IL-32 mRNA表达量高2.3倍(见图1,2和表2),并且溶解曲线显示IL-32,以及β-actin的引物特异性良好,进一步显示数据具有可靠性。
结果可见,通过对未转染细胞和转染细胞中βactin统计分析可以看出,β-actin表达在两组比较差异无统计学意义,而对未转染细胞和转染细胞中RNA IL-32 mRNA的含量可以看出未转染细胞RNA IL-32 mRNA表达明显高于转染细胞,差异有统计学意义,见表2。
2.2HBV对IL-32蛋白的表达量的影响
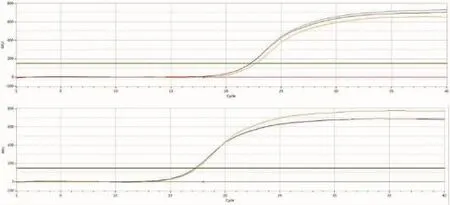
图1 未转染细胞中IL-32及β-actin的扩增曲线

图2 转染细胞中IL-32及β-actin的扩增曲线
Western blot结果显示,转染48h的HepG2细胞,与空载体转染的HepG2细胞比较,转染HBV的HepG2细胞中IL-32蛋白质表达显著增高(P<0.05)。见表3和图3。
表2 HBV对IL-32 mRNA的表达量影响 (dRn±s)
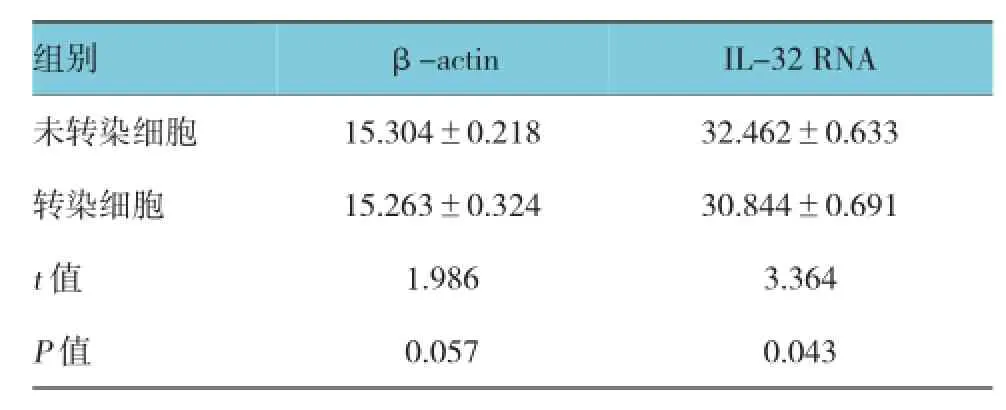
表2 HBV对IL-32 mRNA的表达量影响 (dRn±s)

表3 HBV对IL-32蛋白的表达量的影响

图3 Western blot结果图
3 讨论
近年的研究[6-7]证实,细胞因子在HBV感染所引起的肝损伤中发挥重要作用。许春梅等[8]检测HBV患者血清中IL-32水平,发现IL-32水平与HBV感染者的炎症严重程度相关,并且随炎症程度的加重IL-32呈上升趋势。PAN等[9]证明HBV的X蛋白(HBx)通过IL-32的启动子(从-746到+25)以剂量依赖的方式增强IL-32的表达。IL-32是2005年KIMETAL[10]在用基因芯片方法研究IL-18可诱导基因时发现的一种新型白细胞介素。越来越多的研究表明,IL-32在机体的免疫调节方面发挥着重要作用,它与慢性炎症性疾病、细菌感染性疾病、肿瘤和病毒感染性疾病等密切相关[11]。疾病中所起的作用不同,IL-32可以诱导IL-1β、IL-6、IL-8、TNFα及MIP-2等细胞因子的表达,与HCV[3]、HPV等[12]多种病毒感染引起的疾病的发病密切相关。IL-32基因位于人染色体16p13.3上,有8个外显子,有6种以上剪接变异体,目前比较明确的是 IL-32α、IL-32β、IL-32γ、IL-32δ、IL-32ε和IL-32ζ6种[13]。
IL-32可由多种细胞刺激产生,如T淋巴细胞可在丝裂原等的刺激下、在IL-12和IL-18的共同作用下或在TNF-α的作用下产生,NK细胞可在IL-12和IL-18的共同作用下产生,单核细胞和B细胞均可在活化T细胞的辅助下产生,上皮细胞在IFN-γ的作用下亦可产生等[14]。本研究中显示转染HBV的HepG2细胞比未转染的HepG2细胞中的 IL-32 mRNA的表达量高2.3倍,说明HBV促使IL-32 mRNA的表达,是由于HBV感染引起肝损伤与增加炎症因子的表达有关。同时,本研究结果显示,转染HBV的HepG2细胞中IL-32蛋白比未转染HBV的细胞中IL-32蛋白表达量高,说明HBV促进HepG2细胞中的IL-32蛋白的表达。本研究发现,转染HBV表达载体的HepG2细胞内及培养上清液中均表达IL-32,分泌表达的IL-32可通过诱导其他炎症细胞因子的表达而引起炎症疾病的发生,进一步从蛋白水平说明HBV感染引起肝损伤与增加炎症因子的表达有关。
综上所述,本文通过检测转染及未转染HBV的HepG2细胞中的IL-32 mRNA及蛋白的表达量,探究HBV对IL-32的表达,研究结果证明HBV对IL-32的mRNA及蛋白的表达均有促进作用。
[1]CROWTHER C,MOWA M B,ELY A,ARBUTHNOT P B.Inhibition of hepatitis B virus replication in vivo using helper-dependent adenovirus vectors to deliver antiviral RNAi expression cassettes[J].Antivir Ther,2013,25(1):72-86.
[2]BILITY M T I,CHENG L I,ZHANG Z,et al.Hepatitis B virus infection and immunopathogenesis in a humanized mouse model: inductionofhuman-specificliverfibrosisandM2-like macrophages[J].PLoS Pathog,2014,20(3):29-60.
[3]MOSCHEN A R,FRITZ T,CLOUSTON A D,et al.Interleukin-32:anewproinflammatorycytokineinvolvedinhepatitisC virus-related liver inflammation and fibrosis[J].Hepatology,2011,53(6):1819-1829.
[4]LEE S,KIM J H,KIM H,et al.Activation of the interleukin-32 pro-inflammatory pathway in response To human papilloma virus infection and over-expression of interleukin-32 controls the expression of the human papilloma virus oncogene[J].Immunology,2011,132(3):410-420.
[5]KOBAYASHI H,LIN P C.Molecular characterization of IL-32 in human endothelial cell[J].Cytokine,2011,46(3):351-358.
[6]ZHOU Y,WANG S,MA J W,et al.Hepatitis B virus protein X-induced expression of the CXC chemokine IP-10 is mediated through activation of NF-kappa B and increases migration of leukocytes[J].J Biol Chem,2010,285(16):12159-12168.
[7]ZHANG K,XU Q H,CHEN L B,et al.The measurement and significanceofserumchcmeokineRANTESinpatientswith chronic hepatitis B[J].Chin J Exp Clin Virol,2012,22(12):293-295.
[8]许春梅,左维泽,沈兰超.白介素-32在HBV感染者的变化及其临床意义[J].现代生物医学进展,2010,10(2):298-301.
[9]PAN X,CAO H,LU J,et al.Interleukin-32 expression induced by hepatitis B virus protein X is mediated through activation of NF-κB[J].Mol Immunol,2011,48(12/13):1573-1577.
[10]KIM S H,HAN SY,AZAM T,et al.Interleukin-32:a cytokine and inducer of TNF-alpha[J].Immunity,2005,22(1):131-142.
[11]田兆菊,王英,陈强,等.白细胞介素-32与疾病的关系研究进展[J].免疫学杂志,2012,28(11):994-997.
[12]LEE S,KIM J H,KIM H,et al.Activation of the interleukin-32 proinflammatory pathway in response to human papilloma virus infection and over-expression of interleukin-32 controls the expression of the human papilloma virus oncogene[J].Immunology,2011,132:410-420.
[13]CHOI J D,BAE S Y,HONG J W,et al.Identification of the most active interleukin-32 isoform[J].Immunology,2009,126(4): 535-542.
[14]NETEA M G,AZAM T,FERWERDA G,et al.IL-32 synergizeswithnucleotideoligomerizationdomain(NOD)1and NOD2 ligands for IL-1 beta and IL-6 production through a caspase 1-dependent mechanism[J].USA Proc Natl Acad Sci,2010,102(45):16309-16314.
(张蕾编辑)
Expression of IL-32 induced by hepatitis B virus protein
Jing-jing Zhang,Yong-fu Xie,Jian-feng Hu,Hui-jing Liu,Hong-xun Sun
(Department of clinical laboratory,the Third Hospital of Hebei Medical University,Shijiazhuang,Hebei 050051,China)
Objective To investigate whether protein of hepatitis B virus induced the expression ofIL-32. Methods HepG2 was mediated transfected by Lipofectamine 2000 TM.After 48 hours,the expressions of IL-32 mRNA and protein in HepG2 cells were detected by RT-PCR and western blot respectively.Results RT-PCR result showed expressions of IL-32 mRNA in HepG2 cells transfected with HBV were 2.3 times higher than the cells transfected with empty vector(non-transfected).Western blot result showed that,compared with the IL-32 protein in untransfected HepG2 cells,expression ofIL-32protein in transfected pIRES2-HBV-EGFP HepG2 cells was increased,and the difference was statistically significant(P<0.05).Conclusion The expression ofIL-32mRNA,IL-32protein in HepG2 cells is promoted by HBV.
hepatitis B virus protein;IL-32;expression;study
R575.1
A
10.3969/j.issn.1005-8982.2016.16.007
1005-8982(2016)16-0035-04
2016-04-08
谢永富,E-mail:xieteng811@sohu.com;Tel:13503339862
