白细胞介素8对高糖诱导的人脂肪间充质干细胞损伤的保护作用*
2016-08-29沈雷沙峰孙权张鹏孙石柱张晓东姚立杰李静平
沈雷,沙峰,孙权,张鹏,孙石柱,张晓东,姚立杰,李静平
(齐齐哈尔医学院 解剖教研室,黑龙江 齐齐哈尔 161006)
白细胞介素8对高糖诱导的人脂肪间充质干细胞损伤的保护作用*
沈雷,沙峰,孙权,张鹏,孙石柱,张晓东,姚立杰,李静平
(齐齐哈尔医学院 解剖教研室,黑龙江 齐齐哈尔 161006)
目的探讨白细胞介素8(IL-8)对高糖诱导人脂肪间充质干细胞(hAdMSC)损伤的保护作用。方法含250 mmol/L葡萄糖的培养基建立细胞高糖模型;P65质粒转染人IL-8基因到hAdMSC为IL-8转染组,仅转染P65质粒者为P65对照组,在IL-8转染组中添加PD98059为Erk抑制剂组。利用MTT细胞增殖实验、ELISA或流式细胞技术检测各组hAdMSC增殖的光密度值(OD值)、Caspase-3、Erk或VEGF等蛋白的表达。结果与P65对照组比较,IL-8转染组hAdMSC增殖OD值明显升高,Caspase-3蛋白表达下降(P<0.01);IL-8转染组Erk蛋白活性和VEGF蛋白含量明显高于P65对照组(P<0.01);但与IL-8转染组比较,Erk抑制剂组hAdMSC增殖的OD值降低,Caspase-3蛋白表达升高(P<0.01)。结论IL-8在高糖环境下,通过Erk通路,发挥对hAdMSC的保护作用。
高糖;白细胞介素8;人脂肪间充质干细胞;Erk通路
研究发现,全球糖尿病患者人数目前约为3.22亿人,到2035年将达到5.92亿[1]。中国人口老龄化问题日益严重,老年人糖代谢比较紊乱、机体功能减退,是糖尿病的好发人群[2];高血糖会使体内活性氧等自由基大量增多,活跃的自由基造成体内细胞结构紊乱,活性和功能降低[3],进而引发全身多种组织和器官发生严重的糖尿病并发症[4]。目前发现,间充质干细胞(mesenchymal stem cells,MSC)具有来源广泛、免疫低、多分化性等优点,是治疗糖尿病血管、神经等复杂病变的首选种子细胞[5]。研究还发现,高糖环境会对移植的细胞、体内宿主细胞造成严重的损伤[6],如何避免高糖损伤,是值得研究的科学问题。
宫颈癌细胞在缺氧刺激下会大量表达白细胞介素8(Interleukin-8,IL-8),IL-8会促进肿瘤细胞增殖、促进血管内皮细胞归巢和血管新生,达到抗缺氧的效果[7],但是在糖尿病性高糖环境中,IL-8是否也会发挥抑制MSC损伤、促进MSC增殖研究却鲜见报道。结合文献报道,本研究拟以人IL-8修饰人脂肪间充质干细胞,既发挥IL-8保护细胞抗高糖损伤的作用,又能促进体内细胞归巢,对治疗糖尿病等缺氧性疾病具有重要意义。
1 材料与方法
1.1主要试剂和仪器
人脂肪间充质干细胞(human Adipose derived mesenchymal stem cells,hAdMSC)购于武汉普诺赛生物公司,以色列Bioind公司生产的BI胎牛血清,青链霉素和α-MEM培养基均购自美国Hyclone公司,人IL-8引物:正向5'-CTGGCTTATCTTACCATCAT-3',反向5'-TCAAATACGGAGTGACGAA-3',由大连宝生公司合成测序。DH5α大肠杆菌和P65质粒由本教研室提供,LipofectamineTM3000购自美国Invitrogen公司,葡萄糖、MTT和PD98059均购自美国Sigma公司,小鼠抗人IL-8和小鼠抗人Erk/磷酸化Erk(P-Erk)抗体均购自美国Santa Cruz公司,人VEGF-ELISA试剂盒购自美国RD公司,Erk、P-Erk活性检测试剂盒购置Cell Signaling公司,Annexin V-FITC/PI细胞凋亡双标试剂盒购置杭州碧云天生物公司,流式细胞分选仪(美国BD公司)。
1.2实验方法
1.2.1细胞培养和分组hAdMSC用含10%胎牛血清的α-MEM培养基培养;在α-MEM培养基中添加250 mmol/L葡萄糖为hAdMSC高糖培养基。在高糖模型下,无任何刺激者为对照组,仅转染P65质粒者为P65对照组,P65质粒转染人IL-8基因到hAd MSC为 IL-8转染组,在 IL-8转染组中添加50μmol/L PD98059为Erk抑制剂组,正常条件下培养MSC者为正常对照组。
1.2.2IL-8基因稳定转染MSC稳定转染一般步骤为:培养3×105hAdMSC,采用LipofectamineTM3000试剂盒将P65IL-8重组质粒转染MSC。培养2 d后,用含300μg/ml G418的α-MEM培养液进行筛选,2周后收集阳性细胞,获得稳定转染IL-8的MSC,利用蛋白免疫印迹法(Western blot)实验进行鉴定[8]。
1.2.3Western blot检测人IL-8的表达裂解各组细胞,12 000 r/min,提取蛋白液,SAB法进行蛋白定量;凝胶电泳60 min后;转膜至硝酸纤维素薄膜;山羊血清封闭60min;再添加小鼠抗人IL-8(1∶150)等抗体,HRP标记山羊抗小鼠IgG(1∶200);ECL试剂等步骤检测蛋白表达,Image-Pro Plus 6.0.1软件分析各蛋白条带的灰度值,计算蛋白相对灰度值,β-actin为内参对照。
1.2.4MTT法检测细胞增殖情况按hAdMSC分组情况,96孔板的每孔内接种2×104hAdMSC,用100μl的hAdMSC培养基培养48 h后,0.01mmol/L PBS清洗,每孔加入20μl 5 mg/ml的MTT,孵育4 h后,添加100μl DMSO,充分振荡,使用450 nm波长测定每个样品吸光度(OD值)。
1.2.5流式细胞技术实验检测各组细胞凋亡率按照实验分组情况,培养每组5×106hAdMSC,0.25%胰蛋白酶-EDTA消化细胞,0.01 mol/L PBS清洗,按照细胞凋亡双标试剂盒致使进行细胞标记后,用流式细胞仪检测细胞凋亡率。
1.2.6VEGF蛋白含量和P-Erk/Erk蛋白活性检测按照实验分组情况,培养5×107hAdMSC,0.01 mol/L PBS清洗,以含0.1%胎牛血清的hAdMSC高糖培养基,在37℃、5%二氧化碳条件下培养12 h,收集各组细胞的上清液,ELISA试剂盒进行检测VEGF含量,分别利用Erk/P-Erk活性检测试剂盒检测各组hAdMSC中P-Erk/Erk蛋白活性。
1.3统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,进行χ2检验,P<0.05为差异有统计学意义。每次试验至少重复3次。
2 结果
2.1IL-8的表达
P65对照组IL-8的表达与正常对照组比较,差异无统计学意义(P>0.05);与P65对照组比较,IL-8转染组的IL-8蛋白相对含量提高1.679倍,差异有统计学意义(P<0.01)。见表1和图1。
2.2IL-8对hAdMSC增殖和凋亡的影响
高糖环境下,IL-8转染组hAdMSC增殖的OD值是P65对照组的3.172倍,两者比较差异有统计学意义(P<0.01);而Erk抑制剂组的hAdMSC增殖的OD值则是IL-8组的0.571倍,两者比较差异有统计学意义(P<0.01),见图2A和表2;IL-8转染组的细胞凋亡率是高糖对照组的0.365倍,两者比较差异有统计学意义(P<0.01);而Erk抑制剂组的细胞凋亡率则是IL-8组的1.296倍,两者比较差异有统计学意义(P<0.01),见图2B、2C和表2。
2.3各组hAdMSC的P-Erk/Erk和VEGF蛋白的表达
IL-8转染组P-Erk/Erk相对灰度值是P65对照组的1.313倍(P<0.01);Erk抑制剂组P-Erk/Erk相对灰度值是IL-8转染组的0.679倍(P<0.01),见表3和图3A、3B;IL-8转染组VEGF蛋白含量是P65对照组的2.118倍(P<0.01);Erk抑制剂组VEGF蛋白含量是IL-8转染组的0.338倍(P<0.01),见表3和图3C。
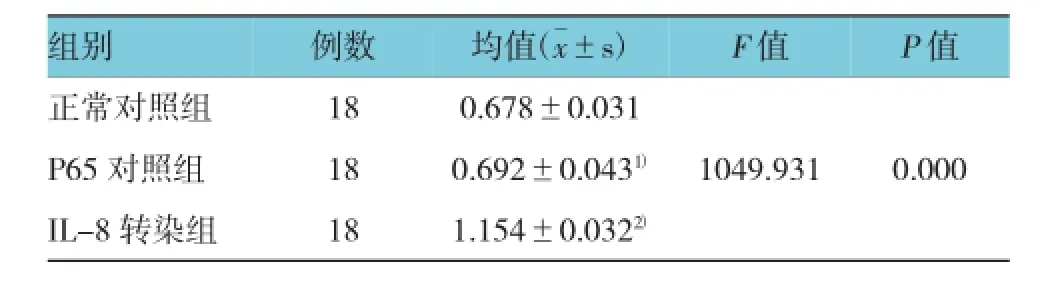
表1 各组hAdMSC表达的IL-8方差分析

图1 hAdMSC的IL-8蛋白表达

图2 IL-8对hAdMSC增殖和凋亡的影响
表2 各组hAdMSC增殖和凋亡的方差分析 (n=18,±s)
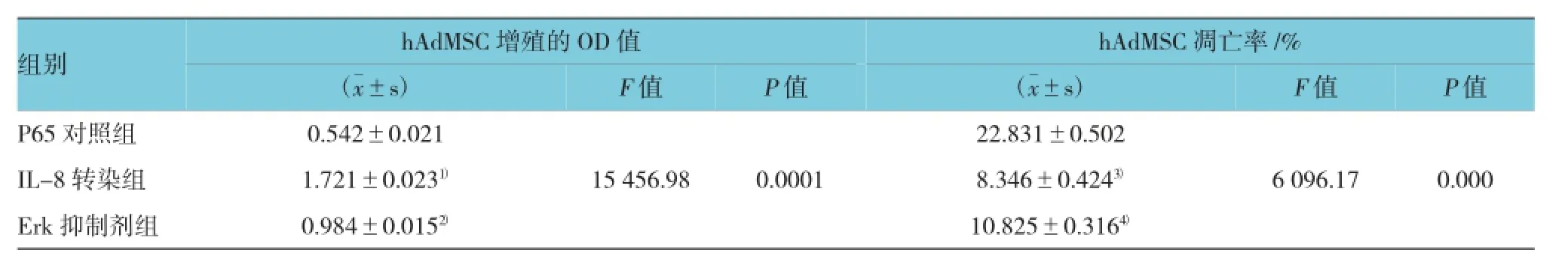
表2 各组hAdMSC增殖和凋亡的方差分析 (n=18,±s)
注:1)P65对照组与IL-8转染组hAdMSC增殖的OD值比较,P<0.01;2)IL-8转染组与Erk抑制剂组hAdMSC增殖的OD值比较,P<0.01;3)P65对照组与IL-8转染组hAdMSC凋亡率的比较,P<0.01;4)IL-8转染组与Erk抑制剂组hAdMSC凋亡率的比较,P<0.01
表3 各组hAdMSC的p-Erk/Erk相对灰度值和VEGF蛋白的方差分析 (n=24,±s)
注:1)P65对照组与IL-8转染组P-Erk/Erk相对灰度值比较,P<0.01;2)IL-8转染组与Erk抑制剂组P-Erk/Erk相对灰度值比较,P<0.01;3)P65对照组与IL-8转染组VEGF蛋白含量比较,P<0.01;4)IL-8转染组与Erk抑制剂组VEGF蛋白含量比较,P<0.01

图3 IL-8对各组hAdMSC表达P-Erk/Erk、VEGF蛋白的影响
3 讨论
糖尿病是严重的多系统多器官损伤的慢性疾病,YANG等在《N Engl J Med》撰文,认为糖尿病及心、肾、脑等部位的并发症是中国及其世界进步和发展的严重阻碍因素之一[9],虽然各国均投入大量的人力、物力和财力进行糖尿病相关研究,但是,糖尿病及其并发症仍然是棘手的医学难题[9]。究其原因,主要是由于高血糖状态造成体内物质代谢紊乱,氧自由基增多,血管神经变性等改变[10],因此,如果从内在因素考虑糖尿病及其并发症的形成和病理过程,有可能加大治疗效果。
间充质干细胞是一类存在于脂肪、骨髓和角膜等部位,具有多分化特性、多组织适应性、多来源途径的干细胞,由于其免疫性较低,移植MSC避免伦理问题的纠纷,成为细胞治疗的重要细胞[11]。近年来的研究发现,存在于人体脂肪组织的脂肪间充质干细胞,由于含量较多,易于获得,因此成为组织工程首先考虑的种子细胞。研究发现,AdMSC可以有效地促进血管新生,加速伤口愈合[12],并发现,MSC表面表达多种趋化因子受体,CXCL12和CXC1等多种趋化因子,多招募MSC归巢具有重要作用[13]。2014年Science杂志报道,伤口周围巨噬细胞、中性粒细胞等细胞会释放大量IL-8等趋化因子,IL-8起到招募血管内皮细胞、成纤维细胞归巢,加速细胞外基质形成等作用,对伤口愈合具有积极作用[14]。但是,在糖尿病皮肤溃疡组织周围,由于高血糖导致细胞功能降低,IL-8等趋化因子释放大量减少,致使糖尿病皮肤溃疡迁延愈合甚至不愈合[14]。由此启发,如果外源性给与IL-8,有可能诱导细胞归巢,加速糖尿病并发症修复的速度。
本实验发现正常环境下,培养的MSC上清液中可以表达IL-8,与P65对照组比较,差异无统计学意义,也有研究发现,骨髓和骨膜等部位来源的MSC可以表达少量IL-8等因子[15]。进行转染IL-8的MSC上清液中IL-8含量增加,说明转染成功。
研究发现,与P65对照组比较,转染IL-8的hAdMSC能够高效表达 IL-8蛋白,IL-8转染组hAdMSC的细胞增殖OD值明显比缺氧对照组升高,IL-8转染组的细胞凋亡率比缺氧对照组降低,这提示,高糖环境下,IL-8能够与hAdMSC表面的CXCL1/2受体结合[15],激活了相应信号通路。本研究以PD98059阻断Erk通路,发现Erk抑制剂组的细胞增殖OD值与凋亡率表达与IL-8转染组均呈现反向关系,Erk蛋白在IL-8转染组和Erk抑制剂组表达均较高;而与IL-8转染组比较,Erk抑制剂组P-Erk蛋白表达明显降低,证明IL-8通过Erk蛋白通路发挥对高糖诱导人脂肪间充质干细胞损伤的保护作用。ELISA研究发现,IL-8转染组VEGF蛋白表达均高于P65对照组,而Erk抑制剂组VEGF蛋白的表达则降低,这可能是由于IL-8与hAdMSC表面的受体结合,激活MAPK-Erk信号通路,导致VEGF基因表达,进而使VEGF和IL-6表达升高[16],当然,IL-8也可以通过Akt通路促进细胞活化[7],相关机制还需要深入研究。
综上所述,IL-8转染的hAdMSC可以发挥抗高糖导致的MSC损伤,对hAdMSC具有保护性作用。下一步将拟用高效液相色谱技术确定IL-8刺激hAdMSC的有效分泌因子,并建立糖尿病皮肤溃疡动物模型,观察IL-8联合MSC对该动物模型皮肤溃疡愈合作用,为开发IL-8等趋化因子的应用奠定实验基础。
[1]GUARIGUATA L,WHITING D R,HAMBLETON I,et al.Global estimates of diabetes prevalence for 2013 and projections for 2035[J].Diabetes Res Clin Pract,2014,103(2):137-149.
[2]李桂玲,李彩福.同伴支持教育对社区糖尿病老年人自我管理能力的干预效果评价[J].当代医学,2015(31):98-99.
[3]DANGI-GARIMELLA S.A big step forward in treating chronic diabetic foot ulcers[J].Am J Manag Care,2014,20(4):E8.
[4]史丽,苏胜偶,赵占胜,等.血糖波动与糖尿病并发症的研究进展[J].中国老年学杂志,2010,30(17):2557-2559.
[5]SUN H,YANG H L.Calcium phosphate scaffolds combined with bone morphogenetic proteins or mesenchymal stem cells in bone tissue engineering[J].Chin Med J(Engl),2015,128(8):1121-1127.
[6]SARGENT J.Diabetes:functional impairment of bone marrow progenitor cells in diabetes mellitus[J].Nat Rev Endocrinol,2014,10(7):379.
[7]LIU L B,XIE F,CHANG K K,et al.Hypoxia promotes the proliferation of cervical carcinoma cells through stimulating the secretion of IL-8[J].Int J Clin Exp Pathol,2014,7(2):575-583.
[8]张剑凯,朱楚洪,糜建红,等.锌指蛋白A20基因对内皮细胞缺氧损伤的保护作用[J].中国临床解剖学杂志,2008,26(2):163-165.
[9]YANG W,LU J,WENG J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12): 1090-1101.
[10]BERKOW J W,RICKETTS R L.Spontaneous diabetes mellitus in dogs[J].J Am Vet Med Assoc,1965,146:1101-1105.
[11]STODDART M J.Mesenchymal stem cells as a source of repair cytokines:mesenchymal stem cells as the conductor[J].J Am Acad Orthop Surg,2015,23(7):452-453.
[12]PARK I S,CHUNG P S,AHN J C.Adipose-derived stromal cell cluster with light therapy enhance angiogenesis and skin wound healing in mice[J].Biochem Biophys Res Commun,2015,462(3): 171-177.
[13]SI X Y,LI J J,YAO T,et al.Transforming growth factor-beta1 in the microenvironment of ischemia reperfusion-injured kidney enhances the chemotaxis of mesenchymal stem cells to stromal cell-derived factor-1 through upregulation of surface chemokine(C-X-C motif)receptor 4[J].Mol Med Rep,2014,9(5):1794-1798.
[14]SUN B K,SIPRASHVILI Z,KHAVARI P A.Advances in skin grafting and treatment of cutaneous wounds[J].Science,2014,346(6212):941-945.
[15]JANSEN E J,EMANS P J,GULDEMOND N A,et al.Human periosteum-derived cells from elderly patients as a source for cartilage tissue engineering[J].J Tissue Eng Regen Med,2008,2(6):331-339.
[16]KANOH S,TANABE T,RUBIN B K.Dapsone inhibits IL-8 secretion from human bronchial epithelial cells stimulated with lipopolysaccharide and resolves airway inflammation in the ferret[J]. Chest,2011,140(4):980-990.
(张蕾编辑)
Protective effect of interleukin-8 on injury of human adipose derived mesenchymal stem cells induced by high glucose*
Lei Shen,Feng Sha,Quan Sun,Peng Zhang,Shi-zhu Sun,Xiao-dong Zhang,Li-jie Yao,Jing-ping Li
(Department of Anatomy,Qiqihar Medical School,Qiqihar,Heilongjiang 161006,China)
Objective To investigate the protective effect of interleukin-8(IL-8)on high glucose induced injury of human adipose derived mesenchymal stem cells(hAdMSC)induced by high glucose.Methods High glucose model with 250 mmol/l glucose medium was established.In IL-8 transfection group,human IL-8 gene was transfected into hAdMSC by p65 plasmid.In the control group,and P65 plasmid was transfected,and in Erk Inhibitor group,PD98059 was added into IL-8 transfection group.MTT cell proliferation assay,ELISA and flow cytometry was used to detect hAdMSC proliferation of the optical density(OD)or Caspase-3,Erk and VEGF protein.Results Compared with the p65 control group,OD of IL-8 transfection group was increased significantly and the proliferation of hAdMSC was increased,Caspase-3 protein expression was decreased,P<0.01.Erk protein activity and VEGF protein in IL-8 transfected group were significantly higher than those in p65 control group,P<0.01.But compared with the IL-8 group,OD of hAdMSC proliferation in Erk inhibitor group was decreased,expression of Caspase-3 protein was increased,P<0.01.Conclusions In the high glucose environment,IL-8 plays a protective role for human adipose derived mesenchymal stem cells through the Erk signal pathway.
high glucose;interleukin-8;human adipose derived mesenchymal stem cells;Erk signal
R641
A
10.3969/j.issn.1005-8982.2016.16.004
1005-8982(2016)16-0018-05
2015-12-14
国家自然科学基金项目(No:81541137);黑龙江省教育厅指令科研课题(No:12541901)
