在热化学教学中融入反应焓的量化计算研究
2016-08-23黄辉胜
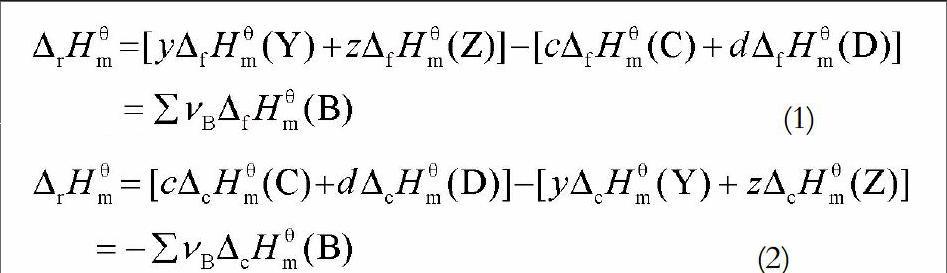
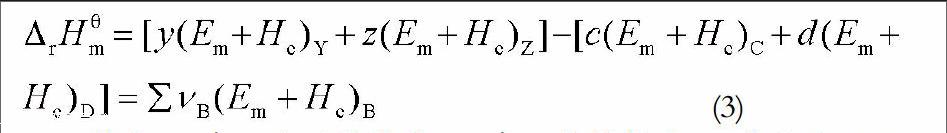
【摘要】教学和科研是相辅相成的,科研可以促进教学。本文以物理化学课程的教学为例,将化学反应焓计算的最新科研成果融入到热化学教学中。这不但能够丰富课堂教学内容、扩大学生知识面、提高教学质量和教学效果,还可以充分展现科学研究的魅力、让学生真正体会到科学知识的发展与更新、激发学生的科学好奇心。
【关键词】物理化学 反应焓 教学 科研 计算化学
【中图分类号】G64 【文献标识码】A 【文章编号】2095-3089(2016)06-0164-02
物理化学是化学类专业的重要基础课程,其基本原理被广泛地应用于其它分支学科。因而学好本课程,可以加深对无机化学、有机化学、分析化学等先行课程的理解。物理化学也是一门理论性很强的交叉学科,涉及一定的数学和物理学知识,推演出的公示很多,使初学者感到抽象难懂,普遍反映是比较难学的一门课程[1]。随着人们对物理化学现象本质的认识以及计算机技术的飞速发展,近些年来许多物理化学原理和方法得到了进一步的发展和完善。为了促使大学教师及时更新知识、丰富教学内容、提高教学水平,非常有必要在课程教学中融入相关学科领域的最新科研成果,最终达到科研促进教学的目的。鉴于此,作者将反应焓的量子化学计算研究融入到物理化学课程的热化学教学中,这极大地提高了物理化学的教学水平和教学效果,同时有助于培养学生的科研兴趣、增强学生的思维创新性。
1.物理化学教材中关于反应焓的计算
众所周知,化工生产离不开化学反应,而化学反应常常伴随着热量的交换与传递。测定或计算一个化学反应的热对于实际生产是非常重要的。由于实际生产经常是在等压或者等容条件下进行的,因此很有必要对这两种情况下的热即Qp和Qv展开学习和研究。又因为Qp和Qv之间存在直接的定量关系,所以只需要获得其中一种热效应值就可以了,一般倾向于讨论Qp。在非体积功为零的条件下,Qp与反应焓变△H在数值上是相等的,故恒压反应热又可称之为反应焓。目前,物理化学教材[1]中关于化学反应焓的计算,主要是利用标准摩尔生成焓和标准摩尔燃烧焓这两种基础热数据计算标准摩尔反应焓。通过标准摩尔反应焓可以进一步计算化学反应过程的Qp、Qv以及体系的△rH和△rU等。因此,标准摩尔反应焓的计算是物理化学课程的一个重要知识点,所涉及的相关内容也是物理化学课程的教学难点。
对于298.15 K下的反应cC + dD → yY + zZ,其标准摩尔反应焓等于:
也就是说,298.15 K下的标准摩尔反应焓等于相同温度下参加反应的各个组分的标准摩尔生成焓与其化学计量系数乘积的代数和。结合νB的取值情况,其实质是:一个化学反应的标准摩尔反应焓等于各产物的标准摩尔生成焓之和减去各反应物的标准摩尔生成焓之和。
如果利用标准摩尔燃烧焓计算上述化学反应的标准摩尔反应焓,那么相应的计算公式为:
显然,一个化学反应的标准摩尔反应焓等于参加反应的各个组分的标准摩尔燃烧焓与其化学计量系数乘积的代数和的负值。
2.反应焓的量子化学计算方法
根据文献“Thermochemistry in Gaussian”白皮书[2]可知,对于一个化学反应来说,如果反应物和生成物中各种原子的个数均相等,那么在计算该化学反应过程的反应热时,有关原子的信息就可以抵消,其反应热的计算只需要分子的数据。具体的计算公式如下:
其中Em表示分子总能量,Hc表示热焓校正,二者之和可以直接从Gaussian程序的输出文件中读取。此处量子计算化学研究的对象一般是单个气态分子,因此上述公式中的Em准确地说是气态单分子的总能量,Hc是气态单分子的热焓校正值。由此可见,这里所说的化学反应都是在气相中进行的,即参与反应的各个组分均为气态。这也正是该理论计算方法的局限性和不足之处。但是,对于某些液相或者固相反应来说,同样可以利用该方法粗略地估算其标准摩尔反应焓。
3.乙醇脱水制取乙烯的化学反应焓
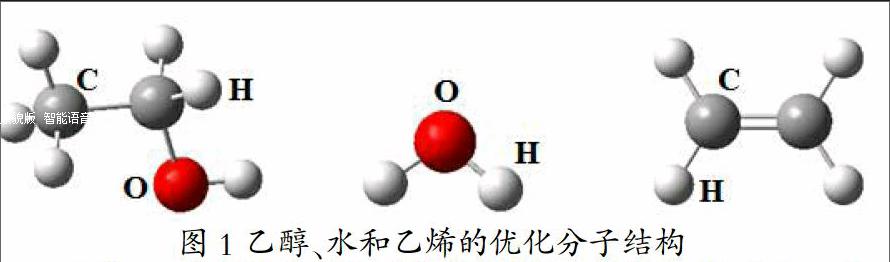
以乙醇脱水制取乙烯的气相化学反应为例,介绍量子化学方法计算标准摩尔反应焓的步骤和具体过程。首先,利用GaussView软件分别绘制乙醇、水和乙烯的分子结构,编辑各自的输入文件。然后,采用Gaussian03程序优化它们的分子结构,并且进行振动分析以判断它们为势能面上的稳定点。图1给出了乙醇、水和乙烯在B3LYP/6-311++G?鄢?鄢理论水平下的优化分子结构。
此外,通过查阅物理化学教材[1]的附录获得乙醇、水和乙烯的气相标准摩尔生成焓分别为-235.10kJ/mol、-241.82kJ/mol和52.26kJ/mol,进而采用公式(1)计算乙醇脱水制取乙烯的标准摩尔反应焓等于45.54kJ/mol。其次,打开它们的Gaussian输出文件,得到每个组分的分子总能量Em与其热焓校正值Hc之和,再利用公式(3)计算该反应在298.15 K时的标准摩尔反应焓。在此基础上,计算各种理论水平下的误差,相关热化学数据的理论值及其误差列于表1。
从表1可以看出,标准摩尔反应焓的理论值与计算方法和基组密切相关。首先,分析一下基组对计算结果的影响。如表1所示,对于相同的混合密度泛函方法B3LYP来说,基组越大,计算结果基本上越准确,而且弥散函数对精度的影响大于极化函数。在B3LYP方法和6-311++G?鄢?鄢基组水平时,乙醇脱水制取乙烯的标准摩尔反应焓等于42.23 kJ/mol,此时误差的绝对值最小,仅比实验值小7%。其次,我们比较了6-311++G?鄢?鄢基组水平下,各种密度泛函方法的计算结果。由表1可知,当基组相同时,局域密度近似方法LSDA的误差最大,达到了117%,而广义梯度近似方法PBE的误差等于23%,显然混合密度泛函方法B3LYP的误差最小,仅为-7%。由此可见,密度泛函方法和基组的选择对标准摩尔反应焓有重要影响。因而,在计算化学反应的标准摩尔反应焓时,需要对方法和基组进行筛选。通过以上分析可知,B3LYP方法和6-311++G?鄢?鄢基组能够较好地预估含有碳、氢、氧这三种元素的有机化合物所涉及的化学反应的标准摩尔反应焓。
总之,将标准摩尔反应焓的最新量子计算化学科研成果融入物理化学课程的热化学教学中,不仅可以充实课堂教学内容,而且更加重要的是可以让学生体会到科学知识的发展与更新,感受到科学研究的魅力。这样也使得学生接触到了书本之外的理论知识,有助于提高他们课外阅读的积极性和主动性,潜移默化地培养学生对科学研究的兴趣与爱好。作为高校教师,应该努力把最新的科研成果融入到教学中,以提高教学质量和教学效果,真正达到科研促进教学的目的。
参考文献:
[1]天津大学物理化学教研室. 物理化学(简明版)[M]. 北京: 高等教育出版社, 2010.
[2]Ochterski J W. Thermochemistry in Gaussian[M]. Pittsburgh: Gaussian Inc., 2000.
作者简介:
黄辉胜 (1982—),男,重庆武隆人,博士,副教授,研究方向为含能材料、理论和计算化学。
