长枝木霉菌株T05抑菌活性与拮抗机制1)
2016-08-17吉海龙伊洪伟池玉杰
吉海龙 伊洪伟 池玉杰
(东北林业大学,哈尔滨,150040) (重庆市农业科学院果树研究所) (东北林业大学)
长枝木霉菌株T05抑菌活性与拮抗机制1)
吉海龙伊洪伟池玉杰
(东北林业大学,哈尔滨,150040)(重庆市农业科学院果树研究所)(东北林业大学)
研究了长枝木霉(Trichodermalongibrachiatum)菌株T05的抑菌活性与拮抗机制,包括菌落的对峙培养试验,挥发性物质和4种分生孢子提取物的抑菌试验。对峙培养试验表明,T05对灰霉病菌(灰葡萄孢(Botrytiscinerea))和杨树烂皮病菌(污黑腐皮壳(Valsasordida))均表现出很强的抑菌活性,抑菌率分别高达88.4%和91.9%;其产生的挥发性物质对B.cinerea有较强的抑菌活性,抑菌率高达91.9%,而对V.sordida抑菌作用较弱,最高为37.2%;甲醇、乙醇、NaOH、超声波破碎水抽提4种分生孢子提取物对V.sordida的抑菌试验表明,NaOH提取物100倍液的抑菌率最高,为76.3%,而甲醇和乙醇提取物的抑菌效果稍弱,超声波水法的提取物仅对病菌有微弱的抑制作用。
长枝木霉;抑菌活性;拮抗机制;灰霉病菌;杨树烂皮病菌
We studied the antifungal activity and antagonistic mechanism ofTrichodermalongibrachiatumstrain T05, including confrontation culture test of dual colonies, antifungal test of volatile substance, and antifungal test of four kinds of conidium extracts. By the confrontation test, T05 had a strong antifungal activity to gray mold fungusBotrytiscinereaand poplar canker fungusValsasordida, and the highest inhibition rates were 88.4% and 91.9%, respectively. The volatile substance produced by T05 had a stronger antifungal activity toB.cinereaand the highest inhibition rate was 91.9%, but it had a weaker antifungal activity toV.sordidaand the highest inhibition rate was only 37.2%. We applied three kinds of solvents-methanol, ethanol, NaOH, and ultrasonic-water, to extract the antifungal active substances of conidia, and measured the inhibition effects of different conidial extracts toV.sordida. The extract with NaOH diluting 100 folds had the highest inhibition rate of 76.33%, whereas, the inhibition rate of extracts with methanol and ethanol was little lower than that with NaOH. But the extracts with ultrasonic-water only had weak inhibition effects.
灰霉病由半知菌的灰葡萄孢(Botrytiscinerea)侵染引起,是一种世界性重要病害,其特点是寄主广泛,能够引起多种植物的坏死。杨树烂皮病又称杨树腐烂病,主要危害杨树,其危害严重,发生普遍。该病在新植杨树中发生较重,严重降低了造林成活率[1]。以往防治这些重要植物病害的途径主要以化学防治为主,但是大量化学药剂的使用不仅对环境造成污染,同时增加了病原菌的抗药性,因此,研究抗植物病原菌的有益拮抗微生物及其代谢产物的抑菌机理,是一种重要的生防途径。木霉菌(Trichodermaspp.)是一种适应能力强、抗病广、拮抗机制多样化的生防菌[2-3],在自然界存在丰富,在灰葡萄孢的防治中已经取得不错的效果,报道显示木霉菌主要作用机制包括营养和空间竞争作用、重寄生作用、抑菌溶菌作用、抗菌作用等[4]。哈茨木霉(T.harzianum)、绿色木霉(T.viride)、黄绿木霉(T.aureoviride)、钩状木霉(T.hamatum)等对灰葡萄孢的拮抗作用及抑菌活性显著,其抑菌率最高可达98%[5]。目前防治植物病原菌的木霉菌剂多以分生孢子等无性孢子为主要成分,研究这些无性孢子抑菌活性物质的提取与抑菌活性,有助于深入了解孢子防病的机制[6]。本试验研究了长枝木霉(T.longibrachiatum)菌株T05对灰霉病菌和杨树烂皮病菌的抑菌活性、挥发性物质和4种分生孢子提取物的抑菌效果,从而进一步揭示其抑菌机制,为今后该菌株在灰霉病和杨树烂皮病等的田间生物防治提供理论依据。
1 材料与方法
1.1菌种来源和培养基
菌种来源:长枝木霉菌株T05,是自我采集、自行分离得到的1株木霉菌株;杨树烂皮病菌(污黑腐皮壳(Valsasordida),无性阶段金黄壳囊孢(Cytosporachrysosperma))自我采集于哈尔滨市道边杨树并分离得到;灰霉病菌(灰葡萄孢)由他人惠赠。以上所有菌种保存于PDA斜面上存放于东北林业大学森林病虫病理实验室(4 ℃)。
培养基:PDA培养基(去皮马铃薯200 g煮汁,琼脂20 g,葡萄糖20 g,加水定容至1 L);木屑麦麸培养基(木屑质量分数为78%,麦麸质量分数为20%,石膏质量分数为1%,蔗糖质量分数为1%,含水率60%~70%)。
1.2T05与2种病原菌的对峙培养试验
1.2.1T05与2种病原菌的生长速率测定
将PDA平板上培养5 d的T05及生长良好的B.cinerea和V.sordida菌落边缘用无菌打孔器打成直径10 mm的菌饼,分别接入已制备好的PDA平板中央,放入恒温培养箱中25 ℃培养,每个处理3个重复,每隔12 h用十字交叉法测量各菌落直径,计算其生长速率。生长速率(cm·d-1)=菌落平均直径/生长时间。
1.2.2T05与2种病原菌平板对峙培养及拮抗系数测定
用无菌的打孔器分别打取直径10 mm的T05及2种病原菌菌饼,同时分别对称接种在制备好的PDA平板两端,二者之间距离为3 cm,以一端只接2个病原菌菌饼为对照,每个处理和对照均3个重复。置于恒温培养箱中25 ℃培养,每12 h测量菌落相向半径并观察木霉菌对病原菌的覆盖情况。计算抑菌率并统计拮抗系数。拮抗系数等级分级标准参照产祝龙等的分级标准[7]:Ⅰ,木霉菌菌落占据培养皿面积=100%;Ⅱ,3/4<木霉菌落占据培养皿面积<100%;Ⅲ,2/3<木霉菌落占据培养皿面积<3/4;Ⅳ,1/3<木霉菌落占据培养皿面积<2/3;Ⅴ,0<木霉菌落占据培养皿面积<1/3;Ⅵ,病原菌菌落占据培养皿面积为100%。抑菌率计算公式为:抑菌率=((对照菌落半径-病原菌相向半径)/对照菌落半径)×100%。
1.2.3T05与2种病原菌菌丝间相互作用的显微观察
在无菌条件下,用微量移液枪移取融化状态下的PDA培养基少许,均匀涂布在载玻片上,然后用接种环分别挑取菌株T05和2种病原菌菌块,距离1.5~2.0 cm。定期在显微镜下观察并拍照,并描述T05与2种病原菌相互作用后菌落的形态特征。
1.3T05挥发物对2种病原菌的抑菌效果
采用对扣法。将PDA平板上培养5 d的T05与2种病原菌,用直径10 mm的打孔器打菌饼,在直径9 cm培养皿的盖和底上倒PDA培养基,于中心处分别接种T05与2种病原菌菌饼,以不接T05而只接病原菌为对照,设3个重复,用封口膜封口,于25 ℃下恒温培养,每隔12 h用十字交叉法测量菌落生长直径。抑菌率计算公式为:抑菌率=((病原菌对照菌落直径-处理菌落直径)/对照菌落直径)×100%。
1.4T05分生孢子提取物对V. sordida的抑制作用
1.4.1菌种培养、扩繁与分生孢子的收集
将菌株T05接种到直径9 cm的PDA平板中心,在25 ℃下培养5~7 d,产孢后用无菌水将分生孢子洗脱下来(菌丝顶端或中间还有厚垣孢子,但被洗脱下来的主要是分生孢子),调配成1×107个孢子/mL的悬浮液,在无菌条件下将10 mL该孢子悬浮液接种到装有木屑麦麸培养基的袋中,于28 ℃下恒温培养用以进一步扩繁菌种,待长满孢子后用无菌水将孢子洗脱,用两层纱布除去木屑麦麸,取滤液于5 000 r·min-1下离心30 min,收集沉淀物(孢子)供提取用。
1.4.2分生孢子抑菌物质提取
甲醇法:取10 g孢子沉淀物加入150 mL甲醇,充分振荡混匀,在常温下浸泡24 h,于3 000 r·min-1下离心15 min,收集上清液,用旋转蒸发仪((60±1)℃)水浴减压浓缩,获得膏状提取物记为A。
乙醇法:同甲醇法,只是将甲醇换成乙醇(φ=95%),且于5 000 r·min-1下离心15 min,减压浓缩后获得的膏状提取物记为B。
碱法:同甲醇法,只是将甲醇换成NaOH(φ=1%),且于5 000 r·min-1下离心15 min,用旋转蒸发仪((70±1)℃)水浴减压浓缩,获得膏状提取物记为C。
超声波水法:又根据超声波强度、相对离心力大小及不同的提取次数分为3种(组)处理方式。①将10 g孢子沉淀物加入到150 mL去离子水中充分振荡混匀,在功率6下用超声波粉碎仪将孢子细胞破碎15 min,于10 000 r·min-1下离心30 min,收集上清液按上法减压浓缩((50±1)℃),获得膏状提取物记为D1。②方法同①,只是在功率4下用超声波粉碎仪将孢子细胞破碎5 min,于3 000 r·min-1下离心15 min,分别收集沉淀物和上清液,上清液按上法减压浓缩后获得膏状提取物记为D2。③取②收集的沉淀物,方法同②,只收集上清液,按上法减压浓缩后获得膏状提取物记为D3。
1.4.3提取物抑菌活性的测定
用无菌水将上述各种方法的提取物稀释成2、20倍母液,各取1 mL分别加入至49 mL PDA培养基中摇匀,分倒在3个培养皿中制成平板,使其最终稀释倍数为100、1 000倍,以加入1 mL无菌水代替母液作为对照;取培养7 d的V.sordida菌饼(直径5 mm)1块接种于平板中央,置于恒温培养箱中25 ℃培养,每处理3次重复。5 d后用十字交叉法测量病菌菌落直径,按下式计算抑菌率,抑菌率=((对照菌落直径-处理菌落直径)/对照菌落直径)×100%。A1、A2分别代表甲醇法提取物分别稀释100、1 000倍,其他提取物命名规则相同。
2 结果与分析
2.1T05与2种病原菌的对峙培养试验
2.1.1T05与2种病原菌的生长速率与营养空间占领能力
由表1可知,T05和病原菌单独培养时,T05的生长速度最快,60 h~3 d后菌丝布满培养皿,其生长速率在48 h时达到最大,为3.80 cm·d-1,平均生长速率达到了2.79 cm·d-1。而B.cinerea和V.sordida的最大生长速率分别为0.90、1.95 cm·d-1,平均生长速率仅为0.68、1.47 cm·d-1,二者的生长速度明显低于T05。T05的平均生长速率分别是2种病原菌的4倍和2倍,表明在基质中营养丰富的初期,T05生命力极强并能够迅速占领营养空间,显示了很强的对营养和空间的竞争力,在与其他同类生物对营养基质竞争作用中占据天然优势。
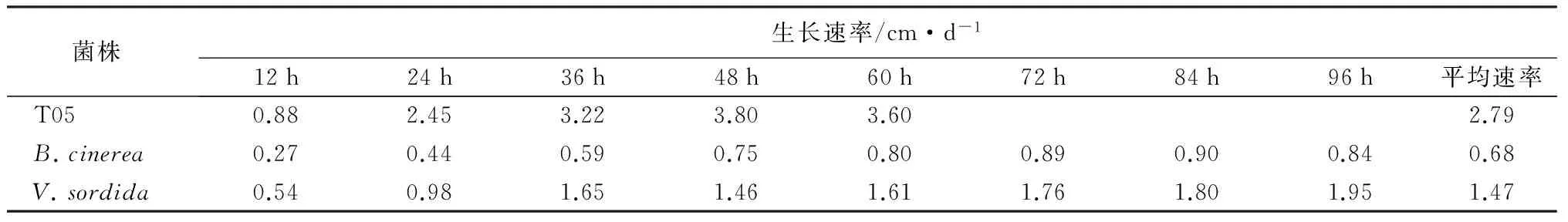
表1 T05和2种病原菌的生长速率
2.1.2T05与2种病原菌平板对峙培养及拮抗系数
在对峙培养过程中,木霉菌株T05比2种病菌生长都快得多,都是在36 h后2种菌丝开始交接,交接后2种病原菌菌落几乎停止生长,且初期交接处产生较明显的抑菌圈;当对峙培养48 h时,T05开始逐步围绕病原菌周围生长,占领病原菌的生长空间;72~84 h后T05向病原菌菌落中心扩展和延伸,使病原菌菌落逐步缩小,逐渐被消解(图1)。与V.sordida接触后,T05对病菌显示了很强的对峙能力和竞争力,先在V.sordida菌丝下紧贴培养基生长,随后向菌落中心扩展和延伸,最后逐渐覆盖病菌,10 d后将其全部覆盖,充分表现了对V.sordida的抑制作用。从表2可以看出:T05对2种病原菌的抑菌率和拮抗活性从36 h开始随时间的推移逐步增加,从60 h开始,其对B.cinerea和V.sordida表现出很强的拮抗活性,对其抑菌率分别高达66.2%~91.9%和63.2%~88.4%,拮抗系数都达到Ⅱ级。

表2 T05对B. cinerea和V. sordida的拮抗活性
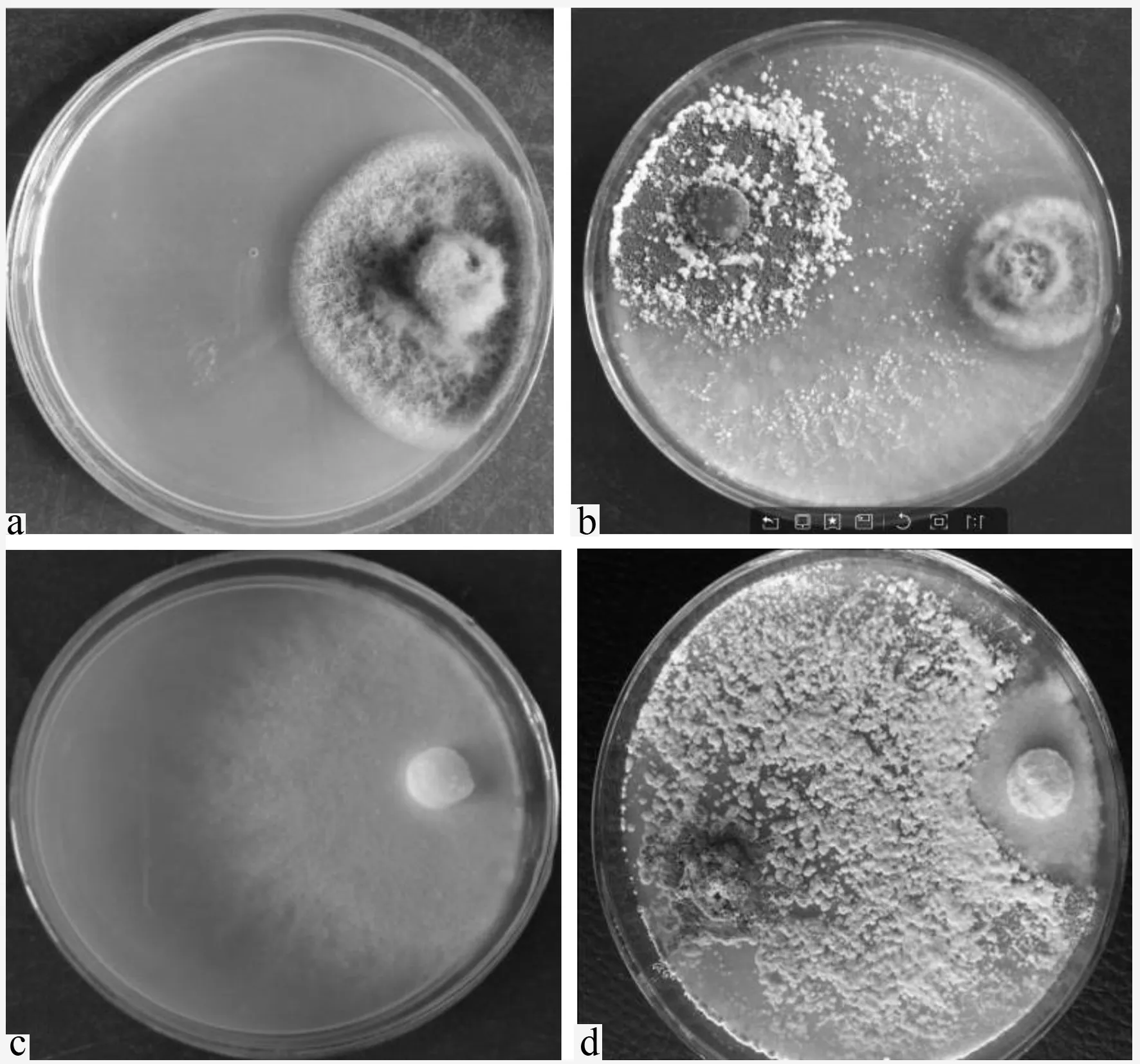
a.B.cinerea,CK;b.T05与B.cinerea对峙;c.V.sordida,CK;d.T05与V.sordida。
图1T05与B.cinerea和V.sordida84 h对峙培养
2.1.3T05与2种病原菌菌丝间相互作用的显微观察
通过观察发现,T05菌丝以植入、缠绕、覆盖等方式生长在病原菌上(图2);木霉不仅通过迅速生长与病菌竞争营养空间,其菌丝还侵入到病菌菌丝内吸取营养,使病菌菌丝生长受到限制。T05与V.sordida对峙一段时间后,镜检交界处菌丝可发现病菌菌丝明显扭曲、变干、变细,呈环状,表现出衰落、萎缩、退化(图3)。T05菌丝缠绕在病原菌菌丝上,并在其上产孢。随着木霉菌覆盖V.sordida菌落面积的增大,V.sordida菌落内观察到的木霉产孢簇和孢子也越来越多。
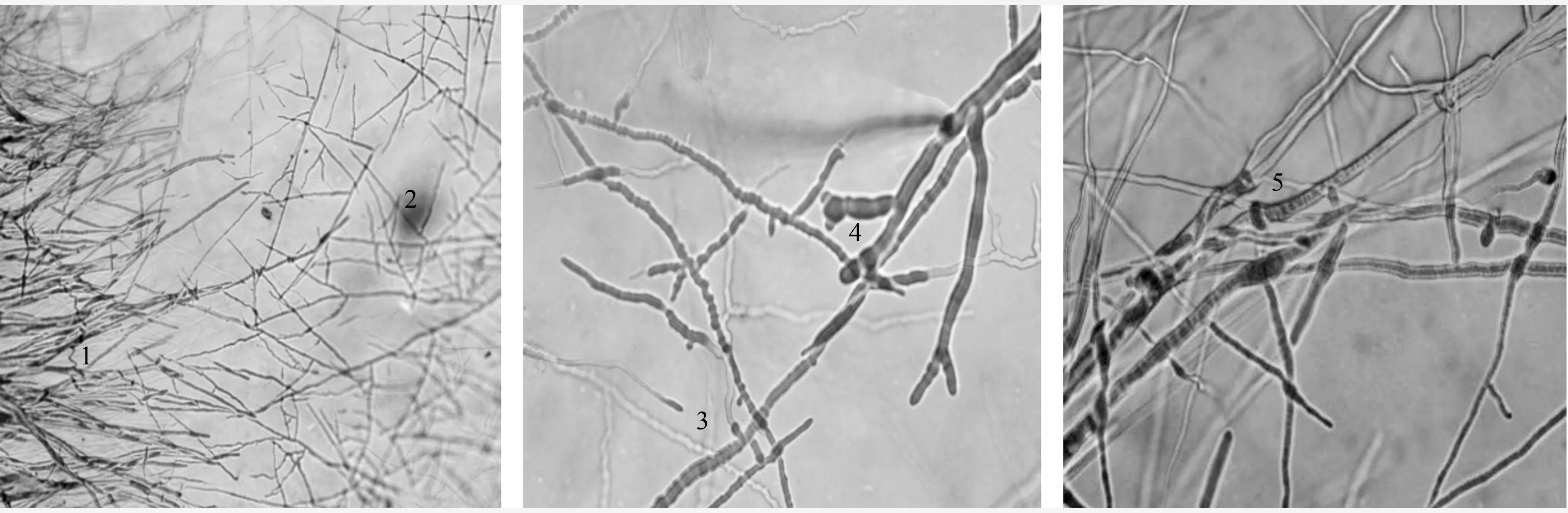
1.B. cinerea(物镜10×);2和4.T05;3.V. sordida(物镜20×);5.T05缠绕B. cinerea(物镜60×)。
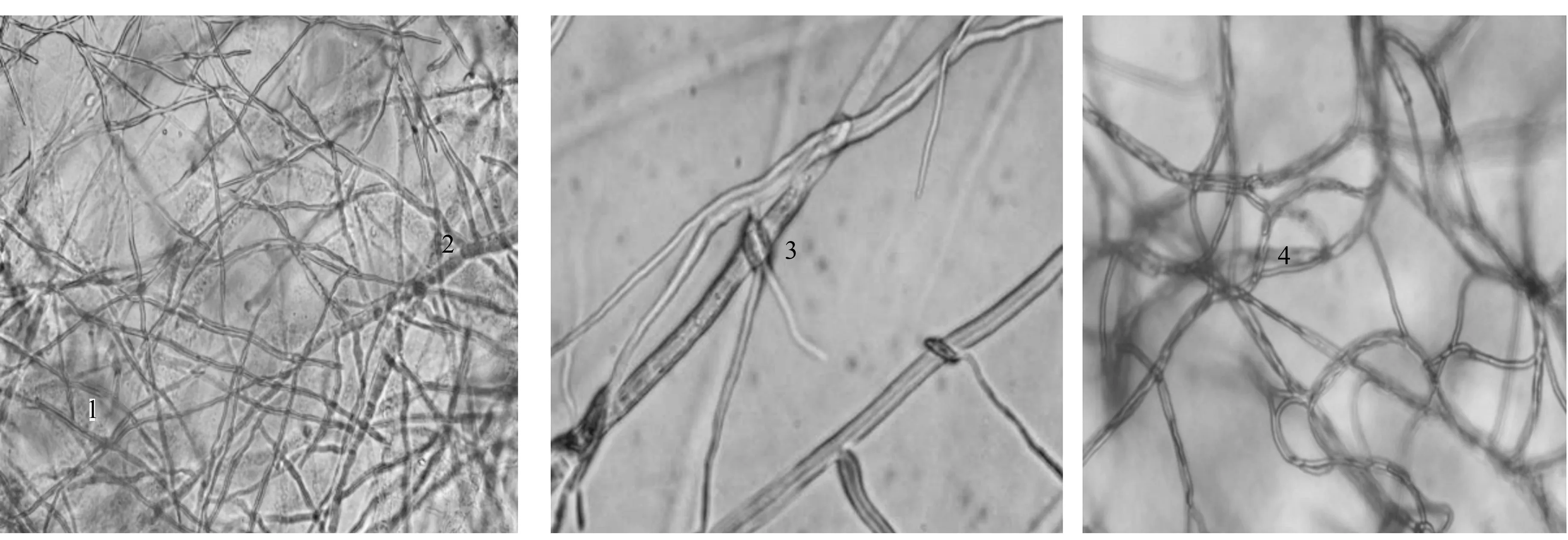
1.V. sordida(物镜20×);2.T05;3.T05重寄生B. cinerea(物镜100×);4.V. sordida后期呈环状生长、表现出衰落(物镜100×)。
2.1.4T05挥发物对2种病原菌的抑菌效果
在培养过程中发现,T05产生的挥发性物质对B.cinerea表现出较强的抑菌活性,在对扣培养初期B.cinerea开始有一定的生长,随后逐渐停止生长,后期菌丝变得发暗、发黄、干枯(图4)。由表3可知,T05挥发性物质对B.cinerea的抑菌能力随时间的推移逐渐增大,在108 h时其抑菌率高达91.9%,最终B.cinerea死亡。而T05产生的挥发性物质虽然也对V.sordida有一定的抑制能力,但抑菌力相对较弱,培养过程中V.sordida的菌落能持续生长,直至满皿,T05挥发性物质对V.sordida的抑菌率在96 h达到最高,为37.2%。

表3 T05挥发物对B. cinerea和V. sordida的拮抗活性

a.96 h时T05挥发物对B. cinerea的抑制情况;b.96 h的B. cinerea,CK;c.96 h时T05挥发物对V. sordida的抑制情况;d.96 h的V. sordida,CK。
2.2分生孢子提取物对V. sordida的抑制作用
用甲醇、乙醇、NaOH和超声波水法对菌株T05的分生孢子进行提取,得到的抑菌结果见表4。从表4可以看出,①甲醇、乙醇和NaOH三种不同溶剂的分生孢子提取物对V.sordida都有较强的抑制作用,对母液稀释100倍的抑菌效果显著好于稀释1 000倍的,其中将NaOH提取物稀释100倍的抑菌率最高为76.33%,而甲醇和乙醇的提取物其抑菌效果稍弱。对3种不同溶剂抑菌作用的方差分析表明,各处理之间在显著性水平α=0.05时差异显著(表5)。②第2、3组超声波水法的分生孢子提取物D2和D3仅对V.sordida有较弱的抑制作用,其中第3组稀释100倍的D31抑菌率最高,为17.92%,而第2组中稀释1 000倍比稀释100倍的抑制作用更强。但是反常的是,第1组提取物D1不仅不能抑制V.sordida的生长,反而能促进其生长,其中微量的提取物(稀释1 000倍)比稀释100倍的促生作用更强。因此,单独对超声波水法的3组处理方式进行了方差分析,结果表明这3组处理方式在显著性水平α=0.05时差异不显著(表5)。
表4不同溶剂与超声波水法分生孢子提取物对V.sordida的抑菌率
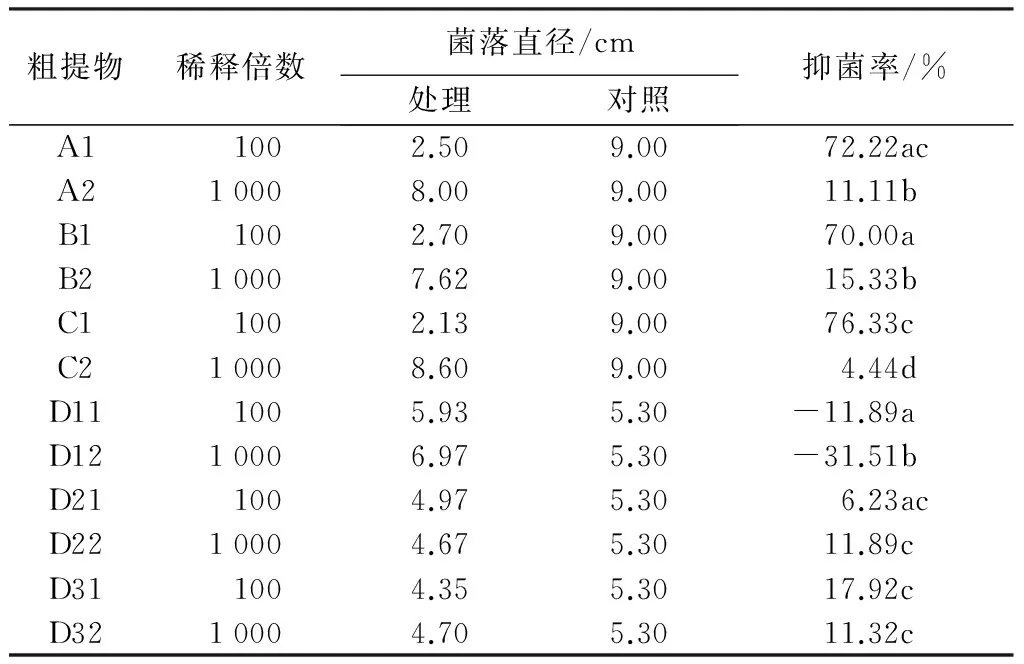
粗提物稀释倍数菌落直径/cm处理对照抑菌率/%A1 1002.509.0072.22acA210008.009.0011.11bB11002.709.0070.00aB210007.629.0015.33bC11002.139.0076.33cC210008.609.004.44dD111005.935.30-11.89aD1210006.975.30-31.51bD211004.975.306.23acD2210004.675.3011.89cD311004.355.3017.92cD3210004.705.3011.32c
注:抑菌率数据后,同列不同小写字母表示在5%水平上差异显著(Duncan氏新复极差检验,DMRT)。
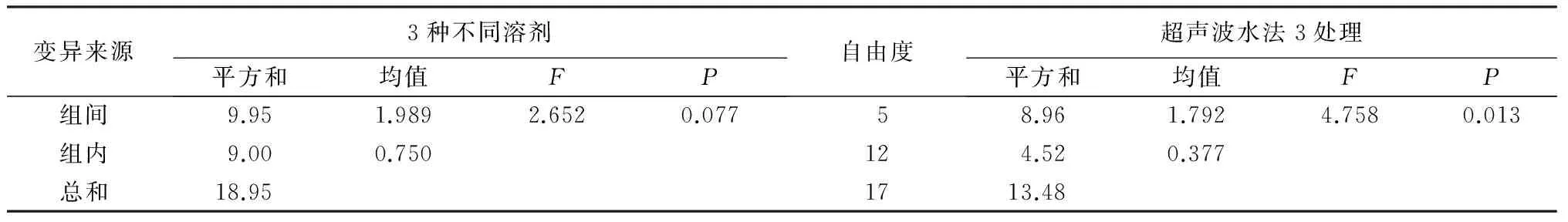
表5 不同溶剂与超声波水法分生孢子提取物对V. sordida菌落生长抑制方差分析结果
3 结论与讨论
由长枝木霉菌株T05的生长速率和与2种病原菌的对峙培养发现,在基质中含有丰富营养的初期,T05生长快,最大生长速率为3.80 cm·d-1,其平均生长速率分别是B.cinerea和V.sordida的4倍和2倍,能够迅速生长并占领营养空间,显示了对营养和空间具有很强的竞争能力,在与2种病原菌对营养空间的占领中占据天然优势;在与病菌对峙期间,T05也表现出极强的生命力、对峙能力和竞争力,后期能向病原菌菌落中心扩展和延伸。显微镜观察交界处菌丝,发现T05菌丝紧贴病菌菌丝生长或者缠绕病菌菌丝,后期覆盖或深入病原菌菌落内部生长,在菌丝上生长并产孢,使病菌菌丝被缠绕的部位出现明显萎缩、退化,最终使菌丝断裂、解体直至死亡[8-9],该结果与Sivan et al.[10]的研究结果类似。对峙期间,菌株T05对2种病菌均表现出很强的拮抗活性,抑菌率分别高达66.2%~91.9%和63.2%~88.4%,拮抗系数均达到Ⅱ级。陈利军等[11]指出木霉产生的挥发性物质对病原菌也有一定的抑菌作用,对番茄灰霉病菌B.cinerea的抑制作用达到61.78%,其挥发性物质的主要成分为6-戊基-2H-吡喃-2-酮(6PP),本试验也研究了菌株T05的挥发性物质对2种病原菌的抑菌效果,其对V.sordida的抑制效果相对较弱,推断T05对V.sordida的抑制作用可能主要来源于营养与空间的竞争及非挥发性成分,但其挥发性物质对B.cinerea有明显地抑制作用(图4)。菌株T05对病原菌的总体拮抗机制和抑菌活性来源于菌丝和分生孢子等菌体自身的抑菌作用、挥发性物质的抑菌作用、次生代谢产物的抑菌作用等。
木霉分生孢子对植物病原真菌和细菌的生长也有很强的抑制作用,为找出提取分生孢子中抗菌活性物质的适宜溶剂与方法,以便为进一步开发抗植物病害的木霉生物杀菌剂奠定基础,本试验采用3种溶剂和不同强度、不同相对离心力及不同提取次数的超声波破碎法对长枝木霉菌株T05的分生孢子进行了抗菌物质提取,用各提取物对V.sordida进行的抑菌试验表明,甲醇、乙醇和NaOH三种不同溶剂的分生孢子提取物稀释100倍后对V.sordida都有较强的抑制作用,其中NaOH提取物的抑菌率最高,为76.33%,而分生孢子经超声波破碎后的水提取物不能得到有效地抑制V.sordida生长的物质。超声波水法的分生孢子提取物的抑菌效果不好,一方面有可能是这些方法不能够有效地提取到抑菌物质,或者是这些方法破坏了分生孢子提取物的活性。宋桂经等[12]用醇法和碱法将分生孢子中具有抑菌作用的物质分离提取,这些提取物的抑菌作用仍很强,本试验也表明碱法提取T05的分生孢子也是一种较好的提取方式,这为制备木霉分生孢子制剂提供了基础依据。
[1]王松波,胡永芹,许洪波,等.杨树烂皮病发病规律及防治方法[J].吉林林业科技,2011,40(3):48-50.
[2]VINALE F, SIVASITHAMPARAM K, GHISALBERTI E L, et al.Trichoderma-plant-pathogen interactions[J]. Soil Biology and Biochemistry,2008,40(1):1-10.
[3]BHUYAN S A, DAS B C, BORA L C. Antagonistic effect ofTrichodermaviride,TrichoderamharzianumandAspergillusterreusonRhizoctoniasolanicausing sheath blight of rice[J]. Journal of Agricultural Science Society of North East India,1994,7(1):125-127.
[4]郭润芳,刘晓光,高克祥,等.拮抗木霉菌在生物防治中的应用与研究进展[J].中国生物防治,2002,18(4):180-184.
[5]康萍芝,张丽荣,沈瑞清.木霉菌对灰葡萄孢菌的拮抗作用[J].内蒙古农业科技,2008(6):49-51.
[6]陈凯,杨合同,李纪顺,等.绿色木霉菌LTR-2孢子提取物的抑菌活性及化学成分分析[J].微生物学通报,2007,34(3):455-458.
[7]产祝龙,丁克坚,檀根甲,等.哈茨木霉对水稻恶苗病菌的拮抗作用[J].植物保护,2003,29(3):36-39.
[8]韩勇军.哈茨木霉对禾谷镰孢病原菌的抑菌活性研究[J].湖北农业科学,2010,49(2):49-50.
[9]史凤玉,朱英波,杨文兰.长枝木霉T8对水稻纹枯病菌拮抗的作用研究[J].中国农学通报,2005,21(2):264-265,271.
[10]SIVAN A, CHET I. The possible role of competition betweenThichodermaharzianumandFusariumoxysporumon rhizosphere colonization[J]. Phytopathology,1989,79(2):198-203.
[11]陈利军,胡孔峰,史洪中.一株木霉菌挥发性物质的抑菌活性测定及成分分析[J].生物技术,2010,20(4):78-79.
[12]宋桂经,孙彩云,宋小焱.康氏木霉BY-88分生孢子的抑菌作用及其抑菌物质的分离[J].中国生物防治,1998,14(2):68-71.
Antifungal Activity and Antagonistic Mechanism ofTrichodermalongibrachiatumT05//
Ji Hailong
(Northeast Forestry University, Harbin 150040, P. R. China); Yi Hongwei(Fruit Tree Institute of Chongqing Agriculture Academy); Chi Yujie(Northeast Forestry University)//Journal of Northeast Forestry University,2016,44(1):114-119.
Trichodermalongibrachiatum; Antifungal activity; Antagonistic mechanism;Botrytiscinerea;Valsasordida(Cytosporachrysosperma)
吉海龙,男,1991年11月生,东北林业大学林学院,硕士研究生。E-mail:1156449598@qq.com。
池玉杰,东北林业大学林学院,教授。E-mail:chiyujienefu@126.com。
2015年7月16日。
S718.81
责任编辑:程红。
