NiFe2O4为载氧体的生物质半焦化学链燃烧热力学模拟研究*
2016-08-13郑安庆李海滨
刘 帅,黄 振,何 方†,郑安庆,沈 阳,李海滨
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院可再生能源重点实验室,广州 510640;3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4. 中国科学院大学,北京 100049)
NiFe2O4为载氧体的生物质半焦化学链燃烧热力学模拟研究*
刘 帅1,2,3,4,黄 振1,2,3,何 方1,2,3†,郑安庆1,2,3,沈 阳1,2,3,4,李海滨1,2,3
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院可再生能源重点实验室,广州 510640;3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4. 中国科学院大学,北京 100049)
本文建立了以铁酸镍(NiFe2O4)为载氧体的生物质半焦化学链燃烧模型,利用HSC Chemistry 5.0软件对生物质半焦和NiFe2O4载氧体之间的化学链燃烧反应进行了热力学计算,模拟载氧体被半焦还原以及载氧体被空气氧化两个步骤的氧化还原过程,得到燃料反应器的优化操作参数为:载氧体和生物质半焦的摩尔比(O/BC)为1.5,燃料反应器的温度为 800℃。热力学分析显示,NiFe2O4在化学链燃烧反应中是按照 NiFe2O4→Ni-Fe2O3→Ni-Fe3O4→Ni-FeO→Ni-Fe的顺序逐级被还原的。氧化过程的模拟说明,在空气气氛中,失去的晶格氧可以恢复到初始的程度,而实验手段得到的氧化产物的 X射线衍射图则证明,通过氧化,被还原的载氧体可以大部分恢复到NiFe2O4尖晶石结构。
NiFe2O4;载氧体;生物质半焦;化学链燃烧模型;热力学模拟
0 前 言
由于化石能源的大量消耗,由含碳燃料燃烧所引起的 CO2等温室气体的排放加剧了全球气候变暖。为了分离含碳燃料燃烧过程中产生的 CO2,一种新型的燃烧技术——化学链燃烧技术(chemical looping combustion, CLC)被提出并运用于CO2的捕集和储存(CO2capture and storage, CCS)[1-2]。化学链燃烧系统主要由一个燃料反应器和一个空气反应器组成,金属氧化物作为载氧体在这两个反应器之间循环。在燃料反应器中,载氧体提供晶格氧用于含碳燃料的燃烧,生成CO2和H2O,通过冷凝去除H2O,实现 CO2的自动分离;在空气反应器中,被还原的载氧体在空气气氛中被重新氧化至初始状态并再次进入燃料反应器中与燃料反应,从而形成完整的化学链循环过程[3-4]。
研究表明,载氧体是化学链燃烧技术的关键因素之一,在CLC过程中既能提供燃料燃烧所需的氧,还起到热载体和催化剂的作用[3,5]。目前研究较多的载氧体主要包括Ni、Fe、Cu、Mn、Co等过渡金属的氧化物[6]。其中,Fe基载氧体具有较高的载氧能力、耐高温和抗积碳性能,且来源广泛、廉价易得,对环境没有污染,但是较低的反应活性是Fe基载氧体面临的最大挑战[2,7-8]。Ni基载氧体虽然具有较高的反应活性,但其反应过程中易烧结、易产生积碳,且具有一定的毒性,这些缺点阻碍了此类载氧体的发展和应用。不难看出,这两种载氧体的优缺点在很大程度上可以互补。目前针对单金属氧化物在化学链燃烧过程中存在的不足,越来越多的研究者青睐于开发由多金属氧化物组成的混合载氧体或者多金属复合氧化物,因为多元金属氧化物能显著提高载氧体的反应活性,并有效降低积碳的产生[1]。研究者将Fe2O3和NiO制备成Fe-Ni复合氧化物,将其用作化学链燃烧的载氧体取得了很好的效果,并将Fe-Ni复合氧化物良好的反应活性归因于一种新物相铁酸镍(NiFe2O4)的生成[8-10]。实验表明反尖晶石结构的NiFe2O4载氧体具有比Fe2O3更高的反应活性[8,10],是一种具有良好发展前景的复合金属载氧体。
由于生物质的挥发分含量较高,所以被认为是比较适用于化学链技术转化的固体燃料。本实验室近年来开展了生物质化学链燃烧和化学链气化方面的研究工作。在生物质化学链燃烧过程中,生物质最初热解生成气、固、液三相产物,其中以半焦为主要成分的固相产物能否完全转化是整个生物质化学链燃烧过程的控制步骤[11]。基于最小自由能法的热力学计算采用反应系统总Gibbs 自由能在平衡时极小的这个判据来确定平衡时的组分,是应用最广的复杂化学平衡计算方法,对实验研究具有一定的指导意义,为研究体系提供需要的热力学参数。本文采用HSC Chemistry 5.0热力学软件,基于吉布斯自由能最小化原理,对 NiFe2O4为载氧体的生物质半焦化学链燃烧过程进行了热力学分析和过程模拟,研究了载氧体/生物质半焦比(O/BC)、燃料反应器温度等操作参数对生物质半焦 CLC 过程的影响,并对还原载氧体中晶格氧的恢复进行了考察。
1 热力学模型的建立和条件简化
图1所示为本文中建立的以NiFe2O4为载氧体的生物质半焦化学链燃烧模型。其过程是 NiFe2O4载氧体在燃料反应器中失去晶格氧将生物质半焦氧化为CO2和H2O,水蒸气经过冷凝后实现CO2的自动分离;然后被还原的载氧体进入到空气反应器中被空气氧化恢复晶格氧至初始状态,再返回到燃料反应器中,开始下一次循环。
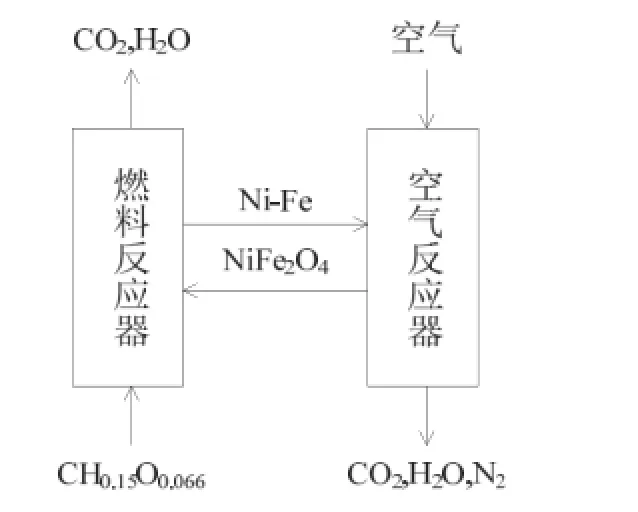
图1 基于N 烧模型Fig. 1 The mcombustion with NiFe2O4
为突出研究重点,本研究中适当简化了一些过程条件:忽略了生物质半焦中极微量的 S、N元素和灰分,生物质半焦以CH0.15O0.066化学式表示其组成;燃料反应器中的固体组分有半焦(CH0.15O0.066)、NiFe2O4、NiO、Ni、Fe2O3、Fe3O4、FeO、Fe,气体组分有 CO2、CO、CH4、H2O、H2;空气反应器中包含的固体组分有NiFe2O4、NiO、Ni、Fe2O3、Fe3O4、FeO、Fe,气体组分有O2、N2。
2 热力学分析和计算
建立研究模型之后,首先分析该多相体系中可能会发生的化学反应,燃料反应器内由于还含有少量的H、O元素,生物质半焦在高温下可能会继续发生深度热解反应,生成主要的固体产物C和极少量的气体(CO2、CO、CH4、H2):
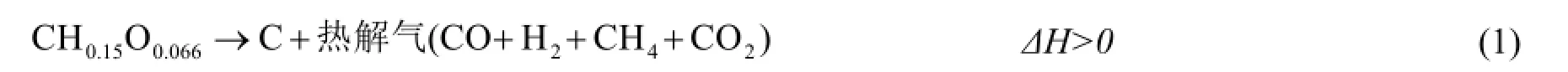
燃料反应器内载氧体可能会发生的反应有(T = 973.15 K):

此外,上述反应生成的CO2和H2O也可能会发生如下反应(T = 973.15 K):

空气反应器内可能发生的反应有(T = 973.15 K):

由以上分析可以看出,生物质半焦化学链燃烧是一个包含了一系列气固反应、固固反应和气体与气体之间的水汽、重整反应的复杂过程,是这些反应综合作用的结果。热力学计算是为了更清楚地知道该过程进行的状态和反应发生的机理,特别是了解热力学条件下Ni元素和Fe元素在燃料反应器和空气反应器中的价态变化规律。根据热力学知识,当一个反应的吉布斯自由能小于0,平衡常数大于1(即ΔG < 0,K > 1)时,该反应在此条件下能自发进行;且自由能越小或平衡常数越大,该反应就越容易发生[12]。本文研究了燃料反应器和空气反应器中载氧体可能发生的反应的ΔG和lgK随温度的变化趋势,从而了解不同温度下载氧体失去和恢复晶格氧的程度,如图2所示。
反应(2)~(17)是 NiFe2O4载氧体在燃料反应器中可能发生的反应,将其分为4组:(2)~(5),(6)~(9),(10)~(13),(14)~(17)。这4组反应分别是CH4、H2、CO和C将NiFe2O4还原至不同程度的状态。图2a和图2b反映了这16个反应的ΔG 和lgK随温度变化的趋势。从图中可以得出:这16个反应在相应条件下ΔG<0、 lgK>0,说明它们都是可以自发进行的,且温度越高,越容易发生;每组中的4个反应的ΔG依次减小,lgK依次增大,且随温度变化的趋势逐渐减小,说明每组中靠前的反应更容易发生。由此可以推测 NiFe2O4在生物质半焦化学链燃烧过程中是按照 NiFe2O4→ Ni-Fe2O3→Ni-Fe3O4→ Ni-FeO → Ni-Fe的顺序逐级被还原的。
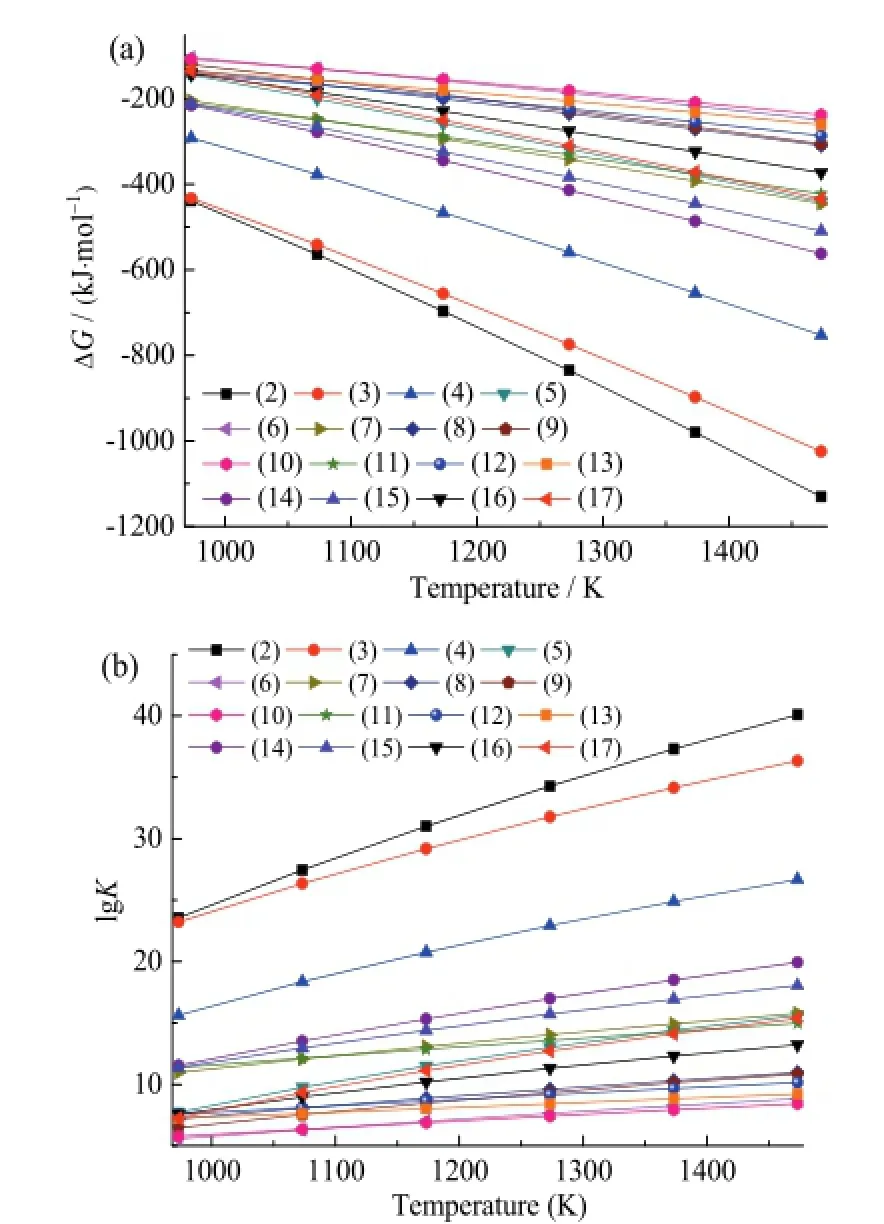
图2 燃料反应器内各反应的ΔG和lgK随温度的变化趋势Fig. 2 The trend of ΔG and lgK with temperature in the fuel reactor
3 过程模拟及参数优化
在完成了对系统可能发生的化学反应的热平衡分析后,进一步对生物质半焦化学链燃烧过程进行模拟。本文主要考虑的系统影响因素有:燃料反应器中的载氧体/半焦比(O/BC)和反应温度,并将碳转化率(Cchar)和 CO2在含碳气体产物中的百分比作为性能评价的最主要指标,分别按式(27)和式(28)计算,其中下标0表示该物质在反应前的起始状态,下标t表示物质反应结束后的最终状态。
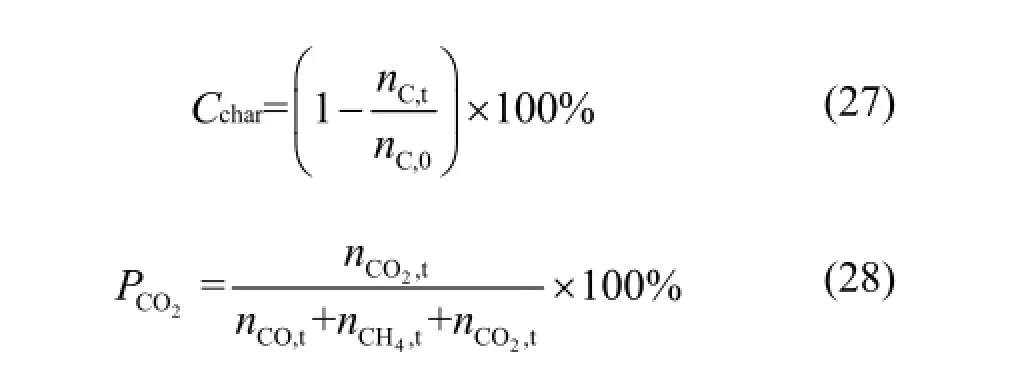
值得注意的是热力学模拟只是单纯从热力学角度在设定的理想条件下研究反应体系中化学反应过程发生的最大程度,不考虑实验和实际应用中的动力学因素,包括反应器的大小、原料的品质和规格、颗粒的流动状态、传热和传质等。因此,热力学模拟优化得到的操作参数可以为实际研究提供理论参考,但不能完全代替实验研究。
3.1载氧体/生物质半焦比(O/BC)的优化
O/BC是生物质半焦化学链燃烧过程中的重要操作参数。燃烧反应中载氧体的供氧量应大于生物质完全氧化所需要的晶格氧,得到产物CO2和H2O。首先模拟燃料反应器在 800℃的常压下产物组成随O/BC的变化趋势,设CH0.15O0.066的量为1 mol,NiFe2O4的初始量为0且以0.1 mol的增量逐步增加至2 mol。
从图3a和图3c可以看出,气体产物中H2、CH4和H2O的量一直很低,这是因为生物质半焦中氢的含量很低,但是当 O/BC很小的时候,由于生成气体产物总量很小,H2的相对浓度就较高。当 O/BC小于0.8时,碳转化率Cchar随O/BC的增加迅速增大;当O/BC大于0.8以后,碳转化率Cchar趋于100%。在整个过程中,CO的曲线呈现先上升后下降的趋势,这是因为随着体系中晶格氧的量逐渐增多,C会倾向于被完全氧化生成 CO2,故2COP的值一直在增大。当O/BC达到1.5左右时,生物质半焦被完全氧化生成CO2,2COP接近于100%。如图3b所示,随着O/BC逐渐增大,系统内晶格氧越来越多,NiFe2O4被还原的程度逐渐减小,导致轻度还原的产物(NiO、Fe3O4)变多,深度还原的产物(FeO、Fe)减少。
综上所述,通过热力学模拟可以发现,在生物质半焦化学链燃烧过程中最优的O/BC比值为1.5,此时半焦被完全转化,CO2是气体产物的主要成分。然而,在实际操作中,由于反应器类型、动力学等因素的影响,该比值应大于1.5。
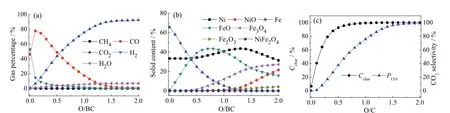
图3 载氧体/生物质半焦摩尔比(O/BC)对CLC系统性能的影响Fig. 3 The effects of the molar ratio of oxygen carrier to biomass char (O/BC) on the CLC system
3.2燃烧反应温度的优化
温度是热力学模拟中的一个重要因素。本节选取O/BC比为固定值1.5,考察燃料反应器内的温度对体系反应性的影响。如图4a和图4b所示,在600 ~ 1 300℃范围内,碳转化率都接近100%,2COP的值也都在93%以上,半焦几乎被完全氧化生成CO2,气体产物组成随温度的变化并不明显。固体产物主要有 Ni、NiO、FeO和 Fe3O4,随着温度的升高,Ni和Fe3O4的含量逐渐减少,NiO和FeO的曲线逐渐上升,这是因为根据勒夏特列原理高温有利于吸热反应(30)的发生,减弱了放热反应(29)的正平衡[13-14]。从图 4c可以看出,当反应器的温度在800℃以上,碳转化率接近 100%,CO2的选择性则随温度的升高而降低,但在600 ~ 1 300℃范围内均保持在93%以上,差别不大。
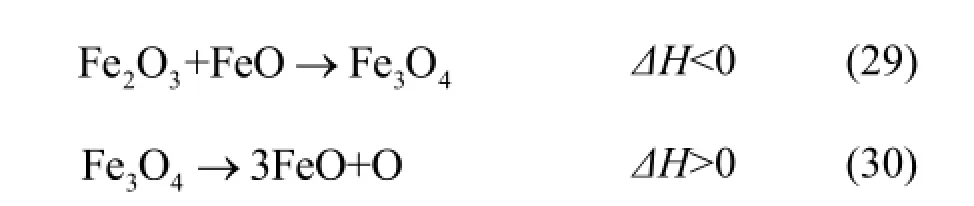
在热力学模拟中O/BC为1.5时,虽然600℃已经可以实现高效的生物质半焦化学链燃烧,然而实际的生物质化学链燃烧中存在焦油裂解和传质等问题,温度通常选择在800℃以上[3,6]。所以综合考虑,优化的燃料反应器温度选为800℃。
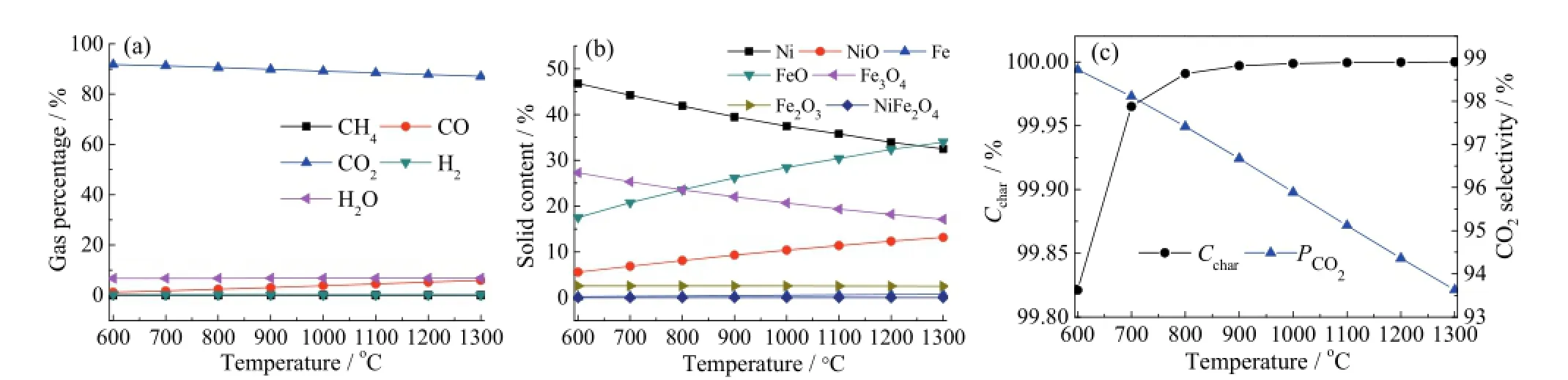
图4 燃料反应器温度对CLC系统性能的影响Fig. 4 The effects of the temperature of the fuel reactor on the CLC system
3.3晶格氧恢复过程的热力学模拟
在化学链燃烧过程中,载氧体除具有传递晶格氧和催化功能外,还起一定的载热作用,携带一部分热量供燃料反应器使用[3,5],因此通常空气反应器的温度要高于燃料反应器。考虑到燃料反应器的优化温度选为 800℃,本研究将空气反应器的温度定为890℃来模拟晶格氧在空气气氛下的恢复过程。设Ni的初始量为1 mol,Ni/Fe = 0.5,O2的初始量为0并以0.1 mol的增量逐步增加到2 mol,研究晶格氧在热力学条件下可以恢复的最大程度。
前文的热力学计算结果显示,同一温度下反应(22)的吉布斯自由能ΔG明显比反应(23)低,所以在氧化阶段会先生成FeO,再生成NiO,与模拟结果的趋势一致,如图5所示。当O2/Ni<1.0时,氧化过程的主要产物是FeO。随着O2的增多,固体产物中Fe3O4和NiO的量逐渐增大。当O2/Ni>2.0,固体产物主要由Fe2O3和NiO组成。由此推断空气气氛下载氧体失去的晶格氧可以完全恢复。然而,图5中固体的最终产物主要是Fe2O3和NiO,NiFe2O4的含量始终为 0,这是因为热力学模拟的物相变化与实际实验存在一定的差异,并不能完全反映NiFe2O4晶格氧的实际失去与恢复状态。
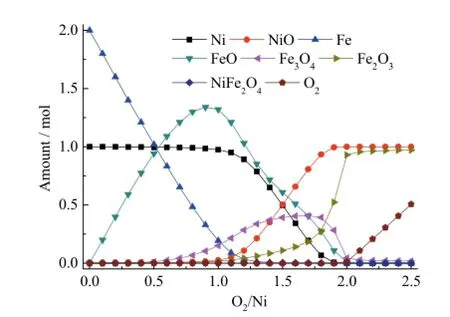
图5 890℃下晶格氧的恢复程度随O2/Ni的变化趋势Fig. 5 The trend of the recovery degree of lattice oxygen with the value of O2/Ni at 890°C
基于此,我们用溶胶-凝胶法制备前驱物,将其高温煅烧后得NiFe2O4载氧体。在850℃下,载氧体先与生物质半焦在N2气氛下反应,然后通入空气氧化被还原的载氧体。图6a和图6b分别是还原后的NiFe2O4和被重新氧化的载氧体的XRD谱图。从图6a可以看出,被还原的载氧体主要是以一种化学式为 Fe0.64Ni0.36的 Fe-Ni合金形式存在,对照标准卡(JCPDS PDF 00-047-1405)可知,在2θ ≈ 43.605o、50.795o、74.679o的衍射峰分别对应于晶面(111)、(200)、(220)。然而,从热力学软件的数据库里找不到 Fe-Ni合金这类物质,只能认为载氧体还原的最终产物为单质Fe和单质Ni。又从图6b可以看出,空气气氛下重新获得晶格氧的载氧体大部分特征峰与NiFe2O4标准卡(JCPDS PDF 00-010-0325)一致,其中在18.4o、30.3o、35.7o、37.3o、43.4o、53.8o、57.4o、62.9o、71.5o、74.6o和75.6o的衍射峰分别对应于NiFe2O4的(111)、(220)、(311)、(222)、(400)、(422)、(511)、(440)、(620)、(533)和(622)晶面,只有两个极微弱的特征峰属于Fe2O3,表明该氧化产物的组成大部分是尖晶石结构的NiFe2O4,该实验结果证明 NiFe2O4载氧体的还原氧化过程是可以实现的。可以推测,NiFe2O4载氧体被还原为Fe-Ni合金后可以通过空气高温氧化而恢复 NiFe2O4尖晶石结构。而图5中热力学计算结果显示,空气氧化后的载氧体以Fe2O3和NiO形态存在,是由于HSC Chemistry 5.0软件中没有Fe-Ni合金的数据,在计算时只能输入单质Fe和单质Ni来代替,所以计算结果只能显示氧化再生的最终产物为Fe2O3和NiO。实际上,其最终产物主要以NiFe2O4形态存在的。
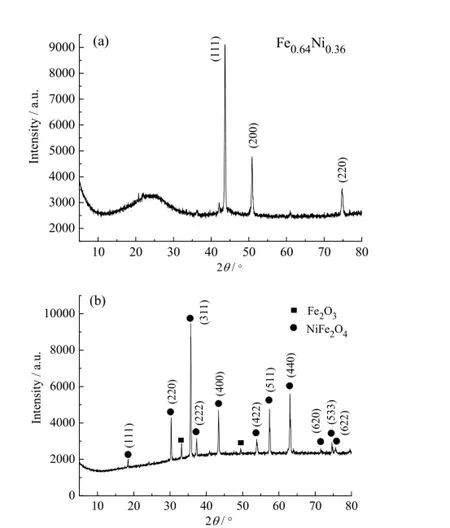
图6 与生物质半焦反应后被还原的NiFe2O4载氧体(a)和在空气气氛下重新被氧化的载氧体(b)的XRD谱图Fig. 6 The XRD pattern of the reduced NiFe2O4with biomass char (a) and the reoxidized product in air (b)
4 结 论
本文建立了 NiFe2O4为载氧体的生物质半焦化学链燃烧模型,借助HSC Chemistry软件对燃料反应器和空气反应器分别进行热力学计算与过程模拟,得出以下主要结论:
(1)在生物质半焦化学链燃烧过程中,NiFe2O4载氧体是按照NiFe2O4→Ni-Fe2O3→Ni-Fe3O4→Ni-FeO→Ni-Fe的顺序逐级被还原的,载氧体与生物质半焦的最优摩尔比(O/BC)为 1.5,燃料反应器的最优温度选取为800℃;
(2)氧化过程中,被还原的载氧体(主要组成为Fe-Ni合金)在890℃下基本可以被氧化到初始价态,实验结果也表明空气气氛下被还原的载氧体可以恢复到NiFe2O4尖晶石结构。
[1] ADANEZ J, ABAD A, GARCIA-LABIANO F, et al. Progress in chemical-looping combustion and reforming technologies[J]. Progress in energy and combustion science, 2012, 38(2): 215-282. DOI: 10.1016/j.pecs. 2011.09.001.
[2] GUPTA P, VELAZQUEZ-VARGAS L G, FAN L S. Syngas redox (SGR) process to produce hydrogen from coal derived syngas[J]. Energy & fuels, 2007, 21(5): 2900-2908. DOI: 10.1021/ ef060512k.
[3] PUIG-ARNAVAT M, BRUNO J C, CORONAS A. Review and analysis of biomass gasification models[J]. Renewable and sustainable energy reviews, 2010, 14(9): 2841-2851. DOI: 10.1016/ j.rser.2010.07.030.
[4] KUO Y L, HSU W M, CHIU P C, et al. Assessment of redox behavior of nickel ferrite as oxygen carriers for chemical looping process[J]. Ceramics international,2013, 39(5): 5459-5465. DOI: 10.1016/j.ceramint. 2012.12.055.
[5] HUANG Z, HE F, FENG Y P, et al. Characteristics of biomass gasification using chemical looping with iron ore as an oxygen carrier[J]. International journal of hydrogen energy, 2013, 38(34): 14568-14575. DOI: 10.1016/j.ijhydene.2013.09.022.
[6] FAN L S, ZENG L, LUO S W. Chemical-looping technology platform[J]. AIChE journal, 2015, 61(1): 2-22. DOI: 10.1002/aic.14695.
[7] LI F X, KIM H R, SRIDHAR D, et al. Syngas chemical looping gasification process: oxygen carrier particle selection and performance[J]. Energy & fuels, 2009,23(8): 4182-4189. DOI: 10.1021/ef900236x.
[8] HUANG Z, HE F, FENG Y P, et al. Biomass char direct chemical looping gasification using nio-modified iron ore as an oxygen carrier[J]. Energy & fuels, 2014, 28(1): 183-191. DOI: 10.1021/ef401528k.
[9] PEÑA J A, LORENTE E, ROMERO E, et al. Kinetic study of the redox process for storing hydrogen: reduction stage[J]. Catalysis today, 2006, 116(3): 439-444. DOI: 10.1016/j.cattod. 2006.05.068.
[10] YANG S, KIM K, BAEK J I, et al. Spinel Ni(Al, Fe)2O4solid solution as an oxygen carrier for chemical looping combustion[J]. Energy & fuels, 2012, 26(7): 4617-4622. DOI: 10.1021/ef300712u.
[11] BALAT M, BALAT M, KIRTAY E, et al. Main routes for the thermo-conversion of biomass into fuels and chemicals. Part 2: gasification systems[J]. Energy conversion and management, 2009, 50(12): 3158-3168. DOI: 10.1016/ j.enconman.2009.08.013.
[12] CARRERO-MANTILLA J, LLANO-RESTREPO M. Chemical equilibria of multiple-reaction systems from reaction ensemble Monte Carlo simulation and a predictive equation of state: combined hydrogenation of ethylene and propylene[J]. Fluid phase equilibria, 2006,242(2): 189-203. DOI: 10.1016/j.fluid. 2006.02.007.
[13] MITTAL V K, BERA S, NITHYA R, et al. Solid state synthesis of Mg-Ni ferrite and characterization by XRD and XPS[J]. Journal of nuclear materials, 2004, 335(3): 302-310. DOI: 10.1016/j.jnucmat.2004.05.010.
[14] MITTAL V K, CHANDRAMOHAN P, BERA S, et al. Cation distribution in NixMg1-xFe2O4studied by XPS and Mössbauer spectroscopy[J]. Solid state communications,2006, 137(1/2): 6-10. DOI: 10.1016/j.ssc.2005.10.019.
Thermodynamic Analysis of Biomass Char Chemical Looping Combustion with NiFe2O4as Oxygen Carrier
LIU Shuai1,2,3,4, HUANG Zhen1,2,3, HE Fang1,2,3, ZHENG An-qing1,2,3,SHEN Yang1,2,3,4, LI Hai-bin1,2,3
(1. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China;2. Key Laboratory of Renewable Energy, Chinese Academy of Sciences, Guangzhou 510640, China;3. Guangdong Provincial Key Laboratory of New and Renewable Energy Research and Development, Guangzhou 510640, China;4. University of Chinese Academy of Sciences, Beijing 100049, China)
A model of biomass char chemical looping combustion was built using NiFe2O4as oxygen carrier. Thermodynamic analysis and process simulation of the combustion were performed with software of HSC Chemistry 5.0 based on Gibbs free energy minimization principle. The simulation result for the reduction stage showed that the system performed best with the molar ratio of oxygen carrier to biomass char (O/BC) being 1.5 at the reactor temperature of 800°C. The thermodynamic analysis showed that the oxygen carrier was gradually reduced as a sequence of NiFe2O4→Ni-Fe2O3→Ni-Fe3O4→Ni-FeO→Ni-Fe. The simulation result for the oxidation stage demonstrated that the lattice oxygen could recover to the original degree thermodynamically, while the XRD pattern of the oxidized NiFe2O4particles confirmed that the reduced oxygen carrier could be re-oxidized to form NiFe2O4spinel under the atmosphere of air from an experimental point of view.
NiFe2O4; oxygen carrier; biomass char; chemical looping combustion model; thermodynamic analysis
何 方(1975-),男,博士,研究员,主要从事生物质化学链气化方面的研究。
TK6;TQ546
A
10.3969/j.issn.2095-560X.2016.03.002
2095-560X(2016)03-0172-07
2016-02-24
2016-05-06
国家自然科学基金(51406214, 51406208);广东省科技计划项目(2012B050500007,2013B050800008)
刘 帅(1990-),女,硕士研究生,主要研究化学链制氢和载氧体的制备。
