槲皮素-AAPH氧化产物结构鉴定及其对HepG2细胞氧化还原状态的影响
2016-08-11温斐婷成向荣陈侃俊乐国伟施用晖
温斐婷,成向荣,陈侃俊,王 菲,乐国伟,施用晖
(江南大学食品学院,江苏无锡 214122)
槲皮素-AAPH氧化产物结构鉴定及其对HepG2细胞氧化还原状态的影响
温斐婷,成向荣,陈侃俊,王 菲,乐国伟*,施用晖
(江南大学食品学院,江苏无锡 214122)
[目的]探究AAPH诱导的槲皮素氧化产物对HepG2细胞氧化还原状态的影响。[方法]用紫外-可见波长扫描、HPLC-MS方法分析AAPH和槲皮素在37 ℃下反应12 h生成的产物结构;以槲皮素-AAPH反应产物处理HepG2细胞24 h,测定其对细胞存活率、ROS水平及细胞总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)活性、超氧化物歧化酶(SOD)活性、GSH/GSSG比值及丙二醛(MDA)含量的影响,并测定Nrf2、Keap1、NQO1、Prdx1相关抗氧化基因的mRNA表达。[结果] AAPH与槲皮素体系在反应12 h后于294 nm波长处有特征吸收,LC-MS解析结果表明该体系反应生成了含4种主要氧化产物的混合物。与空白组相比,槲皮素与AAPH氧化产物孵育显著降低了细胞存活率,同时细胞内ROS水平和MDA含量升高,细胞内T-AOC水平、GSH-Px及SOD活性显著降低,并显著下调Nrf2、NQO1、Prdx1 mRNA表达,上调Keap1 mRNA表达。[结论]槲皮素氧化产物可造成HepG2细胞出现氧化应激。
槲皮素;氧化产;HepG2细胞;氧化应激
以槲皮素为代表的黄酮类物质是重要的植物化合物,其膳食摄入对人体心脑血管保护具有特殊意义[1]。但随着研究的深入,已有不少体外评价实验和动物试验发现某些黄酮类化合物在高浓度、长时间作用时表现出生物毒性,且其毒性与促氧化作用密不可分[2-3]。黄酮类化合物的还原形式主要起抗氧化作用,但其氧化形式半苯醌、苯醌和甲基醌有很强的促氧化作用,会导致谷胱甘肽(GSH)减少,与尼克酰胺腺嘌呤二核苷酸磷酸[NAD(P)H]和其他细胞还原剂的协同氧化,并伴随活性氧(ROS)的产生[4-5]。
有研究指出,槲皮素清除自由基的中间产物具有生物毒性,可能是导致高浓度槲皮素促氧化现象出现的原因之一。在清除自由基的过程中,槲皮素吸收1或2个·H形成半苯醌和苯醌,而半苯醌和苯醌的活性形式可直接诱导DNA氧化损伤[6]。此外,高浓度槲皮素(>0.2 mmol/L)会促进O2-·和H2O2的产生,导致活性酶SH-基团的氧化[7]。但目前直接针对槲皮素清除自由基过程中生成的氧化产物进行细胞毒性研究的报道较少。2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)是常用的ROS诱导剂,能够在机体内持续稳定地促进ROS 生成[8]。笔者以AAPH作为氧化剂,模拟了槲皮素的自由基清除过程,并初步鉴定了两者在化学体系中的反应产物结构,探究了该产物对HepG2细胞氧化还原状态的影响,旨在为探讨高浓度槲皮素促氧化倾向的潜在机制提供理论依据。
1 材料与方法
1.1材料
1.1.1试剂。人肝癌细胞株HepG2,中国科学院上海生物化学与细胞生物学研究所;槲皮素,美国Sigma公司;AAPH,上海阿拉丁生物科技公司;DMEM培养基,美国Gibco公司;小牛血清,浙江省杭州四季青生物材料工程研究所;青霉素、链霉素、胰蛋白酶、二甲基亚砜(DMSO)、噻唑蓝(MTT)、2’,7’-二氯荧光素二乙酸酯(DCFH-DA)荧光探针,美国Sigma公司产品;CAT、SOD、MDA、T-AOC、GSH-PX测定试剂盒,南京建成生物工程研究所;BCA蛋白浓度测定试剂盒、Trizol试剂盒,上海生工生物工程公司;M-MLV逆转录酶,Promega公司;基因引物,上海捷瑞生物工程有限公司。
1.1.2仪器。UV2300双光束紫外可见分光光度计,上海天美科学仪器有限公司;高效液相色谱(HPLC)仪、质谱(MS)仪,美国Waters公司;二氧化碳恒温细胞培养箱,Thermo公司;7900 HT Fast Real-Time PCR仪,美国ABI公司;5804R台式高速冷冻离心机,德国Eppendorf公司。
1.2方法
1.2.1槲皮素-AAPH氧化产物制备及紫外扫描。取槲皮素100 μmol/L与AAPH 600 μmol/L于37 ℃水浴反应,分别于0、3、6、9、12 h取样,进行紫外-可见光全波长扫描(200~600 nm),确定槲皮素氧化产物的特征吸收波长。
按Q∶AAPH=1∶6的浓度比,取槲皮素5 mmol/L与AAPH 30 mmol/L于37 ℃水浴,分别于0、6、9、12 h取样进行高效液相色谱测定。
1.2.2高效液相色谱条件及质谱条件。高效液相色谱仪,Waters Acquity UPLC;检测器:Waters Acquity PDA;色谱柱:BEH-C18(250.0 mm×4.6 mm);流动相A:甲醇;流动相B:0.1%甲酸;流动相的等度洗脱条件为:45%B+55%A(20 min);检测波长为200~600 nm;分析波长为294 nm;进样量为10 μL;流速0.3 mL/min;柱温保持在37 ℃。
质谱离子方式为负离子;毛细管电压:3.0 kV;锥孔电压:20 V;离子源温度:100 ℃;溶剂温度:250 ℃;脱溶剂气体流速:500 L/h。锥孔气体流速:50 L/h,碰撞能量:30 eV,质量范围:50~1 500 m/z;检测器电压:1 700 V。
1.2.3细胞培养。HepG2细胞培养于含有10%小牛血清、100 U/L青霉素、100 g/mL链霉素的DMEM培养基中,于37 ℃、体积分数为5%的CO2饱和湿度培养箱中常规培养。待细胞长至80%融合时,弃去旧培养基,加入3 mL 0.25%胰蛋白酶消化液消化,按1×106个/板传入培养皿。
1.2.4试验分组及处理。槲皮素5 mmol/L与AAPH 30 mmol/L于37 ℃水浴反应9 h,制备槲皮素-AAPH氧化产物。细胞贴壁后分别采用不同条件处理,试验分组如下:正常对照组(CON),槲皮素氧化产物处理组0.1 μmol/L(QO0.1)、1.0 μmol/L(QO1)、10.0 μmol/L(QO10)、50.0 μmol/L(QO50)、100.0 μmol/L(QO100)、200.0 μmol/L(QO200)、300.0 μmol/L(QO300)。
1.2.5MTT法测定细胞存活率。HepG2细胞以8 000个/孔接种于96孔板,贴壁24 h后,换无血清培养基,分别加入0.1、1.0、10.0、50.0、100.0、200.0、300.0 μmol/L槲皮素氧化产物,继续培养6、12、24、48 h后,加入0.5 mg/mL MTT,孵育4 h。以150 μL DMSO溶解沉淀,在525 nm波长下测定吸光度。
存活率=试验组OD值/正常对照组OD值×100%
1.2.6DCFH-DA法测定活性氧自由基(ROS)。细胞分别加入0.1、1.0、10.0、50.0、100.0 μmol/L槲皮素氧化产物,继续培养12、24、48 h后,每孔加入100 μL终浓度为10.0 μmol/L的DCFH-DA 探针,避光孵育30 min,M5荧光酶标仪检测细胞荧光强度(激发波长488 nm,发射波长525 nm)。
ROS水平=(试验组荧光值/试验组细胞存活率)/(正常对照组荧光值/正常对照组细胞存活率)
1.2.7抗氧化酶活性测定。HepG2细胞以1.7×105个/孔浓度接种于6孔板中,分组及处理同“1.2.6”,孵育结束后加RPMI细胞裂解液150 μL于冰上裂解细胞,4 ℃、10 000 r/min离心10 min,收集细胞上清液。采用BCA法测定蛋白浓度。细胞内T-AOC、GSH-Px、SOD及MDA含量均按照试剂盒说明书测定。
1.2.8qRT-PCR检测基因mRNA表达。Trizol法提取细胞总RNA,反转录为cDNA,-20 ℃保存。qRT-PCR测定相关基因的mRNA水平。PCR扩增条件:95 ℃预变性 5 min;95 ℃变性20 s,62 ℃退火30 s,72 ℃延伸20 s,72 ℃终末延伸2 min,循环40次。基因引物序列见表1。

表1 基因的引物序列
2 结果与分析
2.1槲皮素-AAPH氧化产物结构鉴定槲皮素100.0 μmol/L与600.0 μmol/L AAPH于37 ℃水浴反应,溶液经过紫外-可见分光光度计全波长扫描后所得图谱如图1所示,随着反应时间增加,槲皮素在254和374 nm处的特征吸收峰吸光值持续下降,而294 nm处的吸收持续上升,在12 h后可看到明显的吸收峰,表明新生成的槲皮素氧化产物紫外特征吸收波长为294 nm。
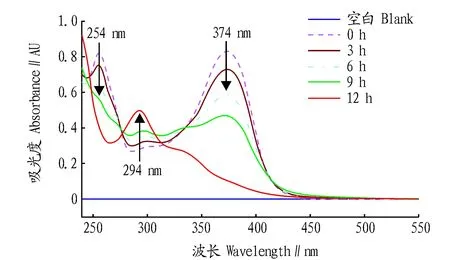
图1 槲皮素氧化产物紫外-可见全波长扫描图谱Fig.1 UV-vis spectra of quercetin oxidation
由图2、3可见,随着反应时间增加,在2.07、2.67、3.97、6.57 min 4个时间点峰面积都增加,表明这几个时间点是槲皮素氧化产物的特征出峰时间。选取高效液相色谱图谱中4个特征峰进行物质分析,结果如图4所示,2.07和3.97 min的物质为槲皮素被氧化后,在A环发生裂解后B环和C环分别加氢生成的产物,分子量分别为154和170。2.67 min的物质为槲皮素A环的双键被氧化,分别加合上甲氧基和氧的产物,分子量为350。6.57 min的物质为槲皮素B环上的2个羟基脱掉2个氢生成的邻醌,分子量为300。

图2 槲皮素-AAPH反应不同时间产物的高效液相图谱Fig.2 HPLC chromatogram on each reaction time of quercetin oxidation products

注:*表示两组间存在显著差异。Note:*stands for significant difference between two groups.图3 槲皮素-AAPH氧化产物液相图不同保留时间的峰面积变化Fig.3 Changes of peak areas on each retention time in HPLC chromatogram of quercetin oxidation products
2.2槲皮素氧化产物对细胞存活率及ROS水平的影响正常生理状况下,细胞内ROS生成和清除处于动态平衡,但是一旦抗氧化功能降低或者ROS过多都能引起细胞氧化应激使细胞受到损伤。用不同浓度的槲皮素氧化产物分别对HepG2细胞进行孵育,孵育6 h后,与对照组相比,低浓度的槲皮素氧化产物组细胞存活率未发生显著变化,但氧化产物200.0和300.0 μmol/L浓度下细胞存活率显著下降,且时间越长,下降越显著;孵育24 h后,300.0 μmol/L浓度组细胞存活率降至70.34%。随着孵育时间的增加,较低浓度的氧化产物也使细胞存活率显著降低;孵育48 h后,0.1 μmol/L浓度下存活率下降显著,半数致死剂量为300.0 μmol/L。0.1、1.0 μmol/L的低浓度槲皮素氧化产物孵育12 h,细胞ROS水平与空白组相比无显著差异,但随着槲皮素氧化产物浓度和作用时间的增加,细胞ROS水平极显著增加(图5)。说明高浓度的槲皮素氧化产物能使细胞在短时间内出现较大死亡,而低浓度在长时间孵育下也能够造成细胞一定程度的死亡。
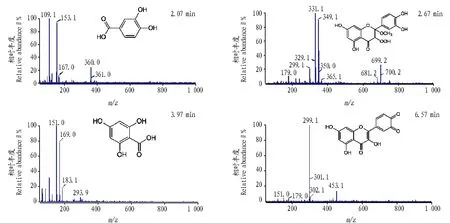
图4 槲皮素氧化产物特征峰的 MS 分析Fig.4 MS spectrum of fractions at different retention time from HPLC

图5 槲皮素氧化产物对HepG2细胞存活率及ROS水平的影响Fig.5 The influence of quercetin oxidation products to HepG2 cell viability and the ROS
2.3槲皮素氧化产物对细胞氧化还原状态的影响SOD、GSH-Px是细胞受到外界刺激产生的内源性的抗氧化酶类,清除胞内活性氧物质,对维持氧化与抗氧化平衡起着重要作用,其活性可间接反映细胞内氧化应激水平[9-10]。T-AOC能全面衡量机体防御体系氧化还原状态。MDA是细胞膜脂质被活性氧氧化后的产物,是评价细胞氧化损伤程度的重要标志物,其升高可直接反映受到的氧化应激损伤。
由图6可知,槲皮素氧化产物孵育细胞12 h后,0.1、1.0、10.0 μmol/L低、中浓度组中细胞T-AOC水平与SOD活力相较CK组无显著变化,100.0 μmol/L浓度组有轻微下降。但随孵育时间延长,T-AOC水平出现显著下降,连续孵育48 h后,低浓度组细胞内SOD活力也显著下降。与CK组相比,50.0、100.0 μmol/L高浓度组中细胞T-AOC水平在12 h孵育后即出现显著下降。

注:*表示P<0.05;**表示P<0.01;***表示P<0.001。Note:* stands for P<0.05;** stands for P<0.01; *** stands for P<0.001.图6 槲皮素氧化产物对HepG2细胞氧化还原状态的影响Fig.6 The effect of quercetin oxidation products on antioxidant index of HepG2 cell
0.1、1.0、10.0 μmol/L低、中浓度的槲皮素氧化产物孵育12 h,细胞内GSH-Px活力较CK组显著增加;但随孵育时间延长,酶活力下降,24 h时10.0 μmol/L组的GSH-Px活力已低于CK组水平;当孵育48 h时,细胞内GSH-Px活性出现急剧下降。和低浓度组不同,100.0 μmol/L高浓度组中细胞GSH-Px活力则是在12 h孵育后即出现显著下降。产生这种现象的原因可能是由于低浓度的槲皮素氧化产物在短时间孵育的条件下并未对细胞造成较大影响,细胞内少量的ROS导致GSH-Px活性出现应激性的上调。但在孵育48 h后,ROS产生量超过了细胞的清除能力,GSH-Px活性受到抑制,10.0 μmol/L浓度组酶活出现急剧下降。
细胞内MDA含量则随着加入的槲皮素氧化产物浓度的升高而升高,并与孵育时间成正比,提示槲皮素氧化产物浓度的升高和孵育时间的增长均造成了细胞内脂肪氧化加剧,进一步说明细胞内抗氧化机制已经不能清除ROS,细胞内形成了氧化应激。
2.4槲皮素及其氧化产物对细胞氧化还原相关mRNA表达的影响ROS能够损伤细胞内大分子物质并破坏其生理功能,为了缓解细胞所遭受的损伤,细胞内存在一整套复杂的氧化应激应答系统。转录调节因子核细胞系因子2相关因子(Nrf2)是细胞抵抗氧化应激反应的关键基因,与Keap1作用,转录翻译产生一些抗氧化物,如SOD、血红素氧合酶(HO-1)、NADPH苯醌氧化还原酶1(NQO-1)等II相解毒酶,以及过氧化还原酶(Prdx)、金属硫蛋白(MT-1)等抗氧化酶,从而对抗ROS引发的氧化应激,保护正常细胞不受破坏[11-13]。该研究对 Nrf2 以及其部分下游靶基因mRNA表达。
由图7可知,在与槲皮素氧化产物共同孵育24 h后,1.0与10.0 μmol/L低浓度组细胞中Nrf2基因表达出现显著上调,而50.0与100.0 μmol/L高浓度组细胞中Nrf2出现显著下调,说明在长时间作用下,低浓度槲皮素氧化产物造成细胞出现氧化应激,Nrf2代偿性表达上调,但高浓度槲皮素氧化产物则直接抑制了Nrf2的表达。而细胞中Keap1基因表达均由于槲皮素氧化产物的加入而显著上调,并随着其浓度的升高上调越显著。
NADPH苯醌氧化还原酶1(NQO-1)[11]可借助NADP催化体内醌类化合物发生还原反应。由图7可知,低浓度的槲皮素氧化产物可以显著上调NQO-1的表达,而50.0 μmol/L的氧化产物对NQO-1的影响与CK组无显著差异,100.0 μmol/L组则显著下调NQO-1的表达。过氧化物还原酶(Prdx)在细胞中的氧化还原状态调节中起着重要作用。过氧化物还原酶是通过硫氧还蛋白系统清除细胞内新陈代谢所产生的过氧化物[14]。图7显示,槲皮素氧化产物低浓度组均造成了细胞内Prdx表达的显著升高,提示该试验条件下造成了细胞出现氧化应激。而高浓度的槲皮素氧化产物则对细胞内Prdx基因表达出现下调。
3 结论
通过紫外-可见分光光谱和LC-MS法初步鉴定了槲皮素-AAPH氧化产物的结构,并测定了槲皮素氧化产物对HepG2细胞存活率和自由基水平的影响,以及氧化还原状态、抗氧化通路相关基因的测定。结果表明,槲皮素氧化产物会加剧细胞的氧化应激,具有一定的细胞毒性,高浓度的槲皮素有可能是通过其在清除自由基过程中形成的大量氧化产物而造成促氧化现象的出现。

注:*表示P<0.05;**表示P<0.01;***表示P<0.001。Note:* stands for P<0.05;** stands for P<0.01; *** stands for P<0.001.图7 槲皮素氧化产物对HepG2细胞Nrf2、Keap-1、NQO-1及Prdx表达的影响Fig.7 The influence of quercetin oxidation products to Nrf2,Keap-1,NQO-1 and Prdx expression of HepG2 cell
[1] 陆柏益,张英,吴晓琴.黄酮类化合物的潜在毒性作用[J].中国中药杂志,2006,31(7):533-536.
[2] 汤立建,赵良才,李庆林,等.黄芩黄酮类成分抗肿瘤作用及机制研究进展[J].中国中药杂志,2007,32(1):21-26.
[3] 汪何雅,赵显峰,王茵,等.黄酮类化合物的潜在毒性[J].卫生研究,2007,36(5):640-642.
[4] NEMEIKAITE-CENIENE A,IMBRASAITE A.Quantitative struc-ture-activity relationships in prooxidant cytotoxicity of poly-phenols:Role of potential of phenoxyl radical/phenol redoxcouple[J].Arch Biochem Biophys,2005,441(2):182-190.
[5] FUKUMOTO L R,MAZZA G.Assessing antioxidant and prooxi-dant activities of phenolic compunds[J].J Agric Food Chem,2000,48(8):3597-3604.
[6] FIORUCCI S,GOLEBIOWSKI J,CABROL-BASS D,et al.DFT studyof quercetin activated forms involved in antiradical,antioxi-dant,and prooxidant biological processes[J].J Agric Food Chem,2007,55(3):903-911.
[7] SCHMALHAUSEN E V,ZHLOBEK E B,SHALOVA I N,et al.An-tioxidant and prooxidant effects of quercetin on glyceralde-hyde-3-phosphate dehydrogenase[J].Food Chem Toxicol,2007,45(10):1988-1993.
[8] BELLOMO G,VAIRETTI M,STIVALA L,et al.Demonstrationof nuclear ompartmentalization of glutathione inhepatocytes[J].Proceedings of national academy of science USA,1992,89:4412-4416.
[9] SUGINO N.The role of oxygen radical-mediated signaling pathway sinendome trial function[J].Placenta,2007,28:133-136.
[10] ANDRIANTSITOHAINA R,DULUC L,GARCIA-RODRIGUEZ J C,et al.Systems biology of antioxidants[J].Clinical science,2012,123(3):173-192.
[11] KOBAYASHI A,OHTA T,YAMAMOTO M.Unique function of the Nrf2-Keap1 pathway in the inducible expression of antioxidant and detoxifying enzymes[J].Methods in enzymology,2003,378:273-286.
[12] ALEKSUNES L M,KNIGHT T R,KLAASSEN C D,et al.Nuclear factor-e2-related factor 2 expression in liver is critical for induction of nad(p)h:Quinone oxidoreductase 1 during cholestasis[J].Cell stress & chaperones,2006,11(4):356-363.
[13] KOBAYASHI M,YAMAMOTO M.Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J].Adv Enzyme Regul,2006,46:113-140.
[14] NEUMANN C A,KRAUSE D S,CARMAN C V,et al.Essential role for the peroxiredoxin Prdx1 in erythrocyte antioxidant defence and tumour suppression[J].Nature,2003,424(6948):561-565.
Structure Identification of the Quercetin Oxidation Products Induced by AAPH and Effects on the Redox State of HepG2 Cells
WEN Fei-ting, CHENG Xiang-rong, CHEN Kan-jun, LE Guo-wei*et al
(School of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122)
[Objective] The aim was to explore how the quercetin oxidation products induced by AAPH influence the redox state of HepG2 cells. [Method] Quercetin was mixed with APPH as oxidant under 37 ℃ for 12 h. The structural characterization were analyzed by UV scan and LC-MS. HepG2 cells were treated with reaction product of quercetin-AAPH and incubated for 24 h. Viable cells were harvested, and the cell viability, ROS level, glutathione (GSH) and glutathione disulphide (GSSG) content, malandialdehyde (MDA) level, total antioxidant capacity (T-AOC), superoxide dismutase (SOD) and catalase (CAT) activity were assayed with the appropriate test kits, the oxidant stress related genes were assayed by DNA microarray. [Result] The chromatogram showed peaks eluting at 294 nm after 12 h reaction and the structural analysis result indicated that mixture of four oxidation products were obtained in the reaction system. Compared with the blank group, Quercetin-AAPH oxidation products elevated the ROS and MDA generation, and reduced cell viability, T-AOC, CAT, GSH-Px and SOD and GSH/GSSG activity significantly. Nrf2, NQO-1, Prdx expression level was down-regulated and Keap-1, Nox-2, Cox-2 expression level was up-regulated in the meanwhile. [Conclusion] These findings indicate that quercetin oxidation products could prompt HepG2 cells to generate more oxidative stress.
Quercetin; Oxidation products; HepG2 cells; Oxidative stress
温斐婷(1990- ),女,广西玉林人,硕士研究生,研究方向:营养与功能因子。*通讯作者,教授,博士,从事营养与功能因子研究。
2016-04-26
Q 2
A
0517-6611(2016)17-034-05
