电解锰粉制备高纯氯化锰除杂工艺研究*
2016-08-11刘秋斌吴伯荣陈飞彪北京理工大学材料学院北京0008中国汽车技术研究中心江西师范大学化学化工学院
刘秋斌,陈 佚,吴伯荣,陈飞彪(.北京理工大学材料学院,北京0008;.中国汽车技术研究中心;.江西师范大学化学化工学院)
电解锰粉制备高纯氯化锰除杂工艺研究*
刘秋斌1,陈佚2,吴伯荣1,陈飞彪3
(1.北京理工大学材料学院,北京100081;2.中国汽车技术研究中心;3.江西师范大学化学化工学院)
以电解锰粉为原料,与盐酸反应,经过氧化氢除铁、硫化氢除镍铅、重结晶除镍硅硒,制取了高纯度氯化锰。针对实验结果,通过电化学势与化学反应平衡,对杂质的去除过程进行了机理分析。研究表明,通过锰粉置换、水解沉淀和生成难溶物等作用,铁铅磷能去除彻底;对难去除的镍硅硒,经过两次结晶,去除率均在94%以上。最终得到的高纯氯化锰纯度大于99.99%,6种杂质元素(铁、镍、铅、磷、硅、硒)质量分数均小于1.5 μg/g。
电解锰;高纯;除杂;氯化锰
随着电子技术、精细化工、功能材料等领域的快速发展,对高纯金属锰及锰盐的需求越来越大[1]。熔融电解高纯氯化锰是得到高纯金属锰的有效途径。高纯氯化锰还可用作特殊实验试剂,如在光谱法检测锰产品杂质元素含量时可作为背景添加用在标线绘制中[2]。
目前氯化锰生产多采用锰矿石或富锰渣为原料[3-4],酸浸液中钙、镁等元素含量较高,一般利用其与 F-、SO42-、C2O42-、HPO42-等阴离子形成难溶物去除[5-7]。但是,这些沉淀物溶度积较大,过滤后的溶液中仍有少量残留,而且该方法还引入了杂质离子,因此用这种原料难以生产出高纯度氯化锰。电解锰纯度较高,杂质主要为碳、硫、磷、硅、铁、硒以及镍、铅、铜、汞等重金属[8],采用电解锰为原料可制得纯度为99%以上的氯化锰。电解锰与盐酸反应过程中,碳以气体或沉淀形式容易去除,铜、汞等不与盐酸反应的重金属杂质也可直接滤除。硫元素主要以硫酸根形式存在,不过低浓度硫酸根不容易去除,也没有稳定可靠的方法检测其含量[9]。在利用电解锰制备高纯度氯化锰方面,有文献介绍电解锰酸溶后经过滤、浓缩、结晶、分离可得到高纯度氯化锰[3],但对酸溶后溶液的深入除杂鲜有报道。为提升氯化锰附加值,笔者介绍了以电解锰粉为原料制备纯度为99.99%以上高纯氯化锰的工艺研究结果,通过电化学势与化学反应平衡对Ni、Fe、Pb、Se、P、Si这6种杂质元素的去除过程进行了研究。相对于氯化锰纯度要求不高的除杂,高纯氯化锰的除杂过程中,需充分考虑加入除杂剂后新杂质的引入及杂质含量的检测问题。
1 实验部分
1.1试剂和仪器
试剂:硝酸(优级纯),盐酸(优级纯),过氧化氢(优级纯),硫化铁(分析纯),盐酸(分析纯)。仪器:PHS-3BW型pH计,R系列旋转蒸发仪,SC-3612型低速离心机,DR-2008型分光光度计,安捷伦7500a型电感耦合等离子体质谱仪(ICP-MS)。
1.2实验步骤
1)酸溶。将110 g电解锰粉置于烧瓶中,加少量水溶解。在搅拌状态下,将质量分数约为18%的盐酸缓慢滴加至烧瓶内,在反应即将完成时停止滴加盐酸,并确保pH为5时仍有少量锰粉剩余。继续搅拌至pH约为6时过滤,加少量水至溶液体积为1L。
2)过氧化氢除铁。用盐酸调节溶液pH至3,加入适量H2O2,充分搅拌后用碳酸锰调节pH至4~5,静置数小时后过滤。
3)硫化氢除镍铅。通入由硫化铁与盐酸反应产生的硫化氢气体,溶液产生黑色沉淀,静置数小时过滤。将溶液煮沸,加入适量H2O2,滤除黄色沉淀。
4)重结晶。将溶液用旋转蒸发仪在75℃浓缩,开始析出细晶粒时停止加热,置于75℃热水浴中自然冷却至室温,同时慢速搅拌。所得晶体用离心机脱除附着水分,再用二次水溶解后用相同方法重新结晶一次。得到的结晶即为高纯度的四水氯化锰。
1.3分析测试
溶液中Fe、Ni、Pb、Se含量由ICP-MS测得,Si、P含量参考GB/T 8654.3—1988《金属锰化学分析方法:钼蓝光度法测定硅量》和GB/T8654.5—1988《金属锰化学分析方法:钼蓝光度法测定磷量》测得。反应制得的氯化锰溶液中Mn2+浓度为2 mol/L,为保证除杂过程中杂质含量数据的可对比性,在原料分析及重结晶过程中,氯化锰浓度均稀释为2 mol/L。
2 结果与讨论
2.1整个除杂过程杂质去除效果
实验原料为湖南某厂生产的电解锰粉。硫化氢除镍铅过程中,Fe3+会与S2-发生氧化还原反应,因此锰粉与盐酸反应后先除铁,然后除镍铅,最后通过重结晶剔除较难去除的杂质。各个步骤后,杂质的质量浓度变化见图1。
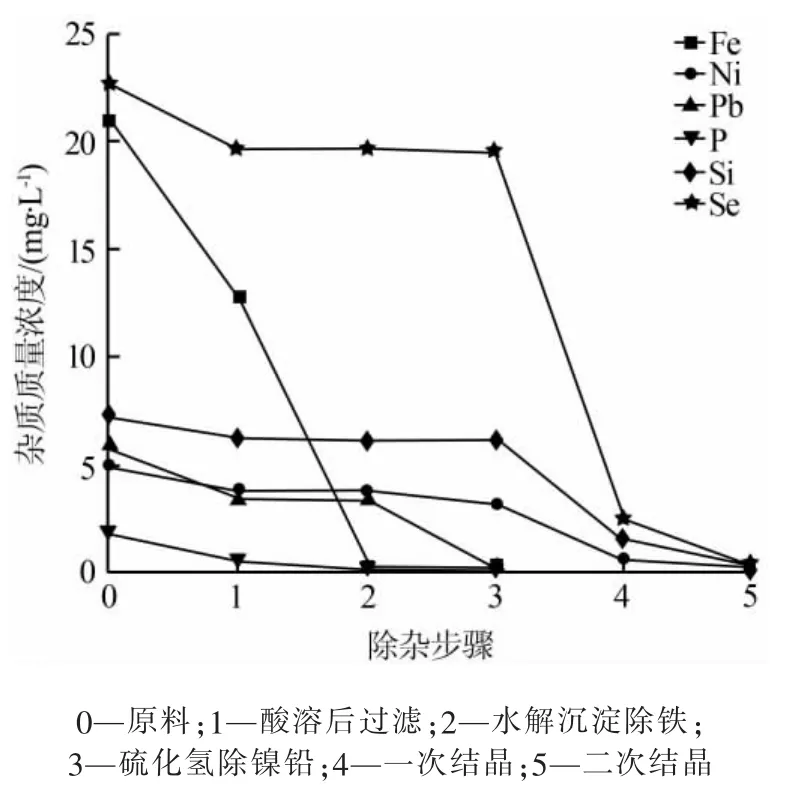
图1 除杂过程中各种杂质质量浓度变化
2.2分步除杂过程杂质去除效果
2.2.1酸溶过程
锰粉与盐酸反应后在pH为6时过滤,各种杂质的含量均有不同程度的下降(见表1)。杂质去除方式包括以下3种:锰的置换作用、形成难溶碱性化合物、不参与反应直接滤除。
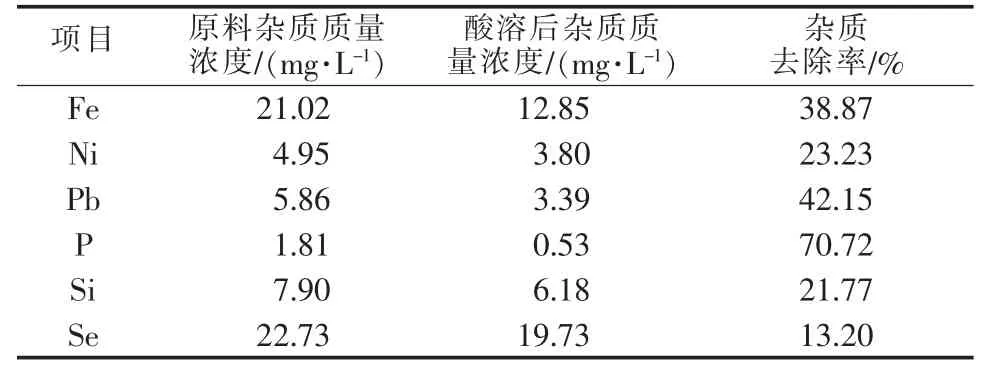
表1 酸溶过滤后各种杂质的去除效果
1)锰粉的置换作用。Fe2+、Fe3+、Ni2+、Pb2+的还原电位比Mn2+高很多,因而在反应末期残留少量的电解锰粉可以置换出这3种金属(Mn+Men+→Mn2++ Me),同时置换出的金属也可能与氢离子重新反应后溶解(Me+2H+→Me2++H2↑)。25℃时不同金属离子浓度下上述反应的电化学势如图2所示。由图2可知,即使 Ni2+、Fe2+、Fe3+、Pb2+的浓度低至 1× 10-12mol/L,锰置换反应的电化学势也可达到0.4 V以上,表明锰置换铁、镍、铅可以进行得很彻底。不过,被锰粉置换出的金属单质也可能与H+反应,同时锰粉与H+更容易发生反应而被快速消耗,导致实际上这3种杂质的去除率均未超过45%。这3种金属中Fe的去除率最高,主要是因为在搅拌的过程中空气中的氧气将部分Fe2+氧化成Fe3+,并最终以Fe(OH)3的形式滤除。在pH为6.18时,由能斯特方程计算金属与H+反应平衡时Pb2+的平衡质量浓度为3.77 μg/L、Ni2+的平衡质量浓度为5.85 mg/L,因而过滤后的溶液中Pb2+的质量浓度比Ni2+更低。

图2 置换反应离子浓度与对应电位
2)形成难溶碱性化合物。大部分磷酸盐和磷酸一氢盐都是难溶的,而硅酸盐除硅酸钠、硅酸钾外几乎都不可溶,因此P、Si可以和锰离子及其他重金属离子形成难溶磷酸盐和硅酸盐后去除。pH越大,溶液中P、Si越容易以正盐酸根存在,从而形成更难溶的正盐。以磷酸根为例,磷酸发生三级电离:10-13。由此可计算出溶液中各磷酸根浓度的比值:c(H3PO4)∶c(H2PO4-)∶c(HPO42-)∶c(PO43-)=1∶(Ka1⊖/pH=6.18时,c(H3PO4)∶c(H2PO4-)∶c(HPO42-)∶c(PO43-)=1∶(1.15× 104)∶(1.10×103)∶(7.24×10-4);c(H2SiO3)∶c(HSiO3-)∶c(SiO32-)=1∶(2.57×10-4)∶(6.17×10-10)。酸溶过滤后(pH=6.18),P的去除率达到70.72%,过滤后的溶液中P的质量浓度仅为0.53 mg/L;而Si的去除率只有21.77%,过滤后的溶液中Si的质量浓度仍有6.18 mg/L。这正是因为磷酸比硅酸的酸性强,更容易解离出含氢少的酸根。
理论上pH越大Si、P越容易去除彻底,但pH>7.5时即开始形成氢氧化锰沉淀。锰粉与氢离子反应后溶液pH可由锰粉的量调节,实验中发现pH超过6时即上升困难,产生较多白色沉淀。经分析认为,锰粉与氢离子反应过于迅速,pH较大时锰微粒周围的H+很快被消耗完。部分锰微粒与水发生如下反应Mn+H2O→Mn(OH)2↓+2H+,抑制了pH继续增大。产生的氢氧化锰既增加了锰粉消耗也不利于后续过滤。因此,溶液在pH为6左右时过滤比较合适。
3)直接滤除。电解锰在生产过程中加入了0.03~0.04 g/L二氧化硒作为添加剂,以增大氢过电位,提高电流效率。电解时,部分二氧化硒被还原成单质硒与电解锰一起沉积在阴极,部分二氧化硒则直接随溶液夹藏在电解锰中[8]。盐酸与电解锰粉反应时,硒单质不参与反应,可以直接滤除。由表1可知,硒质量浓度从22.73 mg/L降到19.73 mg/L,去除率只有13.20%。这可能是因为电解时被还原成单质硒的二氧化硒占比不多,而且硒化学性质很活泼,在接触到空气特别是加热搅拌时容易被氧化成亚硒酸根。
2.2.2过氧化氢除铁过程
过氧化氢可将Fe2+氧化成Fe3+,调高pH后Fe3+将以氢氧化铁形式去除。除铁步骤后Fe基本上得以去除,同时P也被去除了大部分(见表2)。
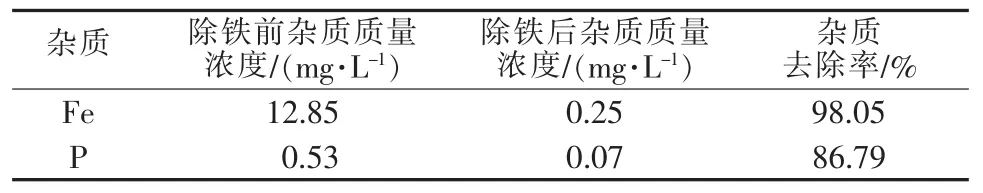
表2 过氧化氢除铁过程杂质去除效果
实际上,Fe2+、Fe3+、Ni2+、Pb2+均能与OH-形成氢氧化物沉淀[Men++H2O→Me(OH)n↓+H+]。在不同pH下,将金属离子的平衡浓度作图(见图3)。Fe3+在pH 为4以上时可以沉淀得很彻底,但其他金属离子在酸性条件下并不产生氢氧化物沉淀。pH为5时,Fe的质量浓度从12.85 mg/L降至0.25 mg/L,去除率达
到98.05%。P含量下降幅度也达86.79%,这是因为再次形成了正磷酸盐或磷酸一氢盐沉淀。
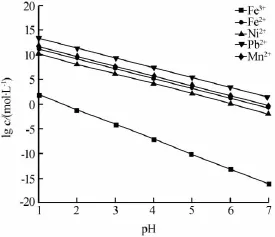
图3 水解反应金属离子平衡浓度与pH关系
此步骤中pH调节是关键部分。调低pH可用优级纯的盐酸甚至采用蒸馏后再溶于二次水得到的更高纯的盐酸。调高pH则可选用氢氧化锰、碳酸锰或高纯锰粉,但购置药品的纯度往往不合实验要求,容易引入新的杂质。实验将除杂完成后的氯化锰溶液与碳酸钠反应生成碳酸锰,并用二次水洗涤沉淀至用AgNO3未检测出氯离子为止。由此得到的碳酸锰质量稳定,且免除了高纯药品的购置费用。
2.2.3硫化氢除镍铅过程
硫化铅、硫化镍溶度积较小,可以通入硫化氢气体使Pb2+、Ni2+与S2-生成硫化物沉淀。此步骤Pb去除率达到96.45%、Ni被去除了15.16%。同时Ni、Fe、P含量也出现不同程度的下降(见表3)。
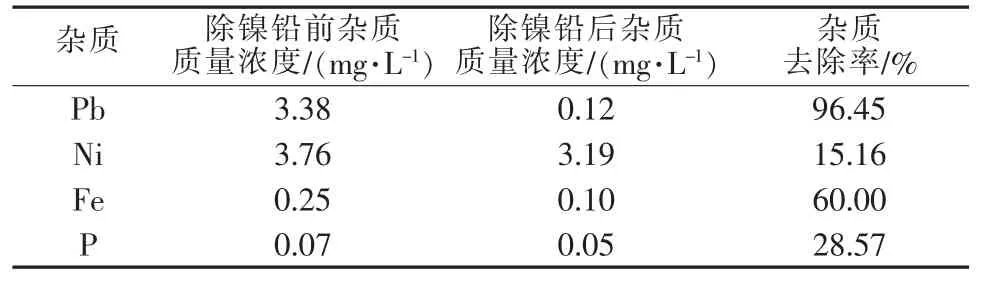
表3 硫化氢除镍铅过程杂质去除效果
杂质去除过程可由如下解释:25℃时硫化氢在水中溶解度约为0.1 mol/L,饱和时pH约为4。在pH>5的溶液中通入硫化氢,氢离子主要由硫化氢电离产生,Ni2+与S2-发生如下反应:Pb2++S2-葑PbS,Ni2++S2-葑NiS。平衡时Pb2+质量浓度为2.90×10-9mg/L,Ni2+质量浓度为1.26 mg/L,因此Pb能被去除彻底,而Ni只去除了15.16%。另外,由于pH>4,Fe3+可再次与OH-形成沉淀除去,P也部分以磷酸盐形式去除。
利用硫化氢除镍铅会引入部分S2-杂质,因此可将过滤后的溶液煮沸以降低H2S的溶解度,再根据H2S在沸水中的溶解量,按照1∶1物质的量比加入H2O2将H2S氧化成单质硫沉淀后去除。
2.2.4重结晶过程
经过上述除杂过程Ni、Si、Se仍不能被有效去除,可以采用重结晶的方法去除。两次结晶后Ni、Si、Se的变化如表4所示。经过重结晶,3种杂质的质量浓度降至0.10~0.32mg/L,去除率均在94%以上。
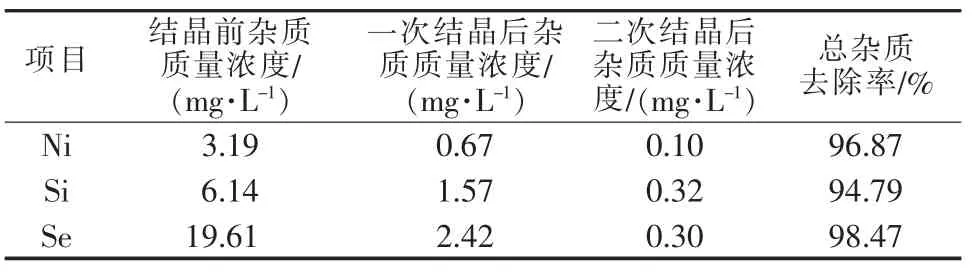
表4 重结晶过程杂质去除效果
重结晶会产生母液,第一次结晶后的母液可用于对Ni、Si、Se含量要求不高的场合,第二次结晶后母液可回流到除镍铅后溶液中再度参与重结晶过程。
2.3产品质量
结晶两次后得到的四水氯化锰晶体即为最终产品,每克氯化锰中的杂质含量如表5所示。通过铬酸钡分光光度法和硫酸钡分光比浊法共同检测可知,S质量分数为1~5 μg/g。7种主要杂质质量分数总计≤9 μg/g,氯化锰产品纯度大于99.99%。
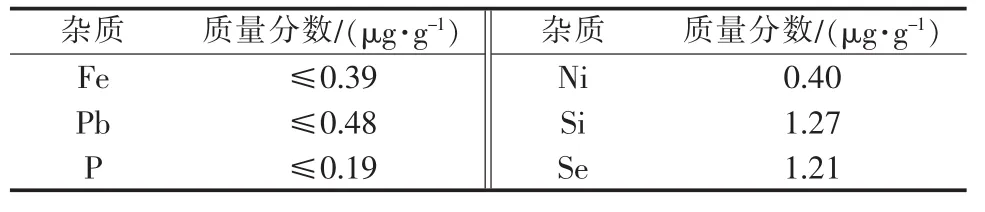
表5 氯化锰产品杂质含量
3 结论
1)采用电解锰粉为原料,经酸溶、除铁、除镍铅和重结晶过程,可制得纯度在99.99%以上的高纯氯化锰产品。经江西西林科新材料有限公司扩大实验验证,满足工业生产实践要求。2)电解锰粉与盐酸反应后可利用少量残余锰粉置换重金属,其反应电化学势很高,但由于锰粉及重金属与H+的竞争反应,去除率均不超过45%。3)以H2O2为氧化剂,调节pH>4时可将Fe去除彻底;通入硫化氢除重金属,Pb去除了96.45%,Ni只能去除15.16%;溶液在弱酸条件下经过数次过滤后,P以磷酸正盐或一氢盐形式也被去除完全;对难去除的Ni、Si、Se,经过两次结晶3种杂质去除率均在94%以上。4)在除杂过程中,利用盐酸、碳酸锰、过氧化氢和硫化氢为除杂剂,除S2-外基本不引入杂质,且S2-可以通过煮沸加入H2O2除去。
[1]易振鸿.电解金属锰深加工产业的发展前景[J].中国锰业,2005,23(3):22-24.
[2]Yao Jun,Atakora Djak,Ladislau Kekedy-Nagy,et al.Direct and simultaneous determination of several impurity elements in manganese tetroxide using ICP-AES[J].Journal of Wuhan University of Technology:Mater.Sci.Ed.,2006,21(1):4-8.
[3]梅光贵,张文山,曾湘波等.中国锰业技术[M].长沙:中南大学出版社,2011:600-603.
[4]周志明,苏文征,李坤.由富锰渣制备无水氯化锰的工艺探索[J].无机盐工业,2007,39(3):50-52.
[5]李军旗,王家伟,毛小浩,等.氟化锰脱除氯化锰溶液中镁的研究[J].有色金属:冶炼部分,2012(1):20-23.
[6]冯茹,童张法,陈志传,等.氯化锰浸出液的净化除杂研究[J].中国锰业,2011,29(1):20-23.
[7]李军旗,张国才,毛小浩,等.氯化锰溶液的净化工艺[J].有色金属,2011,63(2):172-174.
[8]陈南雄,廖赞伟.电解液成分对电解金属锰生产过程的影响[J].中国锰业,2008,26(4):5-8.
[9]冉广芬,马海州.硫酸根分析技术及应用现状[J].盐湖研究,2009,17(4):58-62.
联系方式:wubr2528@sina.com
Study on preparing high purity manganese chloride from electrolytic manganese powder
Liu Qiubin1,Chen Yi2,Wu Borong1,Chen Feibiao3
(1.School of Materials Science&Engineering,Beijing Institute of Technology,Beijing 100081,China;2.China A utomotive Technology&Research Center;3.College of Chemistry and Chemical Engineering,Jiangxi Normal University)
High purity manganese chloride was prepared after the impurity removal process,which adopted electrolytic manganese as the raw material.The process included using H2O2to eliminate Fe,H2S to eliminate Ni and Pb,and recrystallization to eliminate Ni,Si,and Se.According to the experimental results,mechanism analysis was given by analyzing the electrochemical potential and chemical reaction equilibrium.The research showed that,Fe,Pb,and P can be removed completely by the reaction of replacement,hydrolysis and precipitation.Ni,Si and Se,which were very stable,can also be removed above 94%after crystallized two times.The purity of the product finally got was greater than 99.99%.Contents of the six impurity elements mentioned above were all less than 1.5 μg/g.
electrolytic manganese;high purity;impurity removal;manganese chloride
TQ137.12
A
1006-4990(2016)06-0020-04
国家科技支撑计划项目(2012BAE07B00)。
2016-01-20
刘秋斌(1990—),男,硕士,研究方向为环境能源材料及环境化工。
吴伯荣
