贝伐单抗对体外培养的人视网膜色素上皮细胞增殖及纤维化的影响
2016-08-08李婵,任伟
李 婵,任 伟
贝伐单抗对体外培养的人视网膜色素上皮细胞增殖及纤维化的影响
李婵1,任伟2
1Department of Ophthalmology;2Department of Surgery, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China
Correspondence to:Chan Li. Department of Ophthalmology, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China.13991219091@163.com
Received:2016-04-26Accepted:2016-07-05
•AIM: To investigate the effects of Bevacizumab on the proliferation and the expression of E-Cadherin and fibronectin in human retinal pigment epithelial cell(ARPE-19)invitro.
•METHODS: Different concentrations (0, 0.625, 1.25, 2.5, 5.0mg/mL) of bevacizumab were exposed to ARPE-19 cells, then cell viability was analyzed by CCK-8, cell cycle was determined by flow cytometry, and the expression of E-Cadherin and fibornectin was detected by Western blot and RT-PCR.
•RESULTS: The concentration as 2.5mg/mL or 5.0mg/mL of bevacizumab was shown to effectively suppress the proliferation and cell cycle of ARPE-19 cell (P<0.05). In addition, 2.5mg/mL or 5.0mg/mL of bevacizumab could downregulate the expression of E-cadherin and promote the transcription of fibronection gene (P<0.05).
•CONCLUSION: High concentration of bevacizumab was able to inhibit ARPE-19 proliferation, downregulate E-Cadherin expression and promote fibronectin expression, indicating epithelial-mesenchymal transition induced by bevacizumab in ARPE-19 cell.
Citation:Li C,Ren W. Effects of Bevacizumab on the proliferation and epithelial-mesenchymal transition in human retinal pigment epithelial cellsinvitro.GuojiYankeZazhi(IntEyeSci) 2016;16(8):1449-1452
摘要
目的:观察贝伐单抗对体外培养的人视网膜色素上皮细胞ARPE-19增殖及钙黏连蛋白(E-cadherin)和纤维连接蛋白(fibronectin)表达变化的作用,探讨贝伐单抗对ARPE-19增殖及纤维化的影响。
方法:用不同浓度(0、0.625、1.25、2.5、5.0mg/mL)的贝伐单抗干预体外培养人视网膜色素上皮细胞ARPE-19,采用CCK-8法分别于24、48、72h检测细胞活性;流式细胞仪检测细胞周期;应用免疫蛋白印迹法(Western blotting)及逆转录聚合酶链反应(RT-PCR)检测ARPE-19中E-cadherin和fibronectin的蛋白及mRNA的表达变化。
结果:浓度为2.5、5.0mg/mL贝伐单抗能有效抑制ARPE-19细胞的增殖及细胞周期,差异有统计学意义(P<0.05)。2.5、5.0mg/mL贝伐单抗能抑制E-cadherin基因,促进fibronectin基因的转录及表达,差异有统计学意义(P<0.05)。
结论:高浓度的贝伐单抗能够抑制ARPE-19细胞的增殖,下调纤维化相关因子E-cadherin,同时上调fibronectin的表达,提示高浓度的贝伐单抗可以引起ARPE-19细胞纤维化。
关键词:贝伐单抗;人视网膜色素上皮细胞;增殖;纤维化
引用:李婵,任伟.贝伐单抗对体外培养的人视网膜色素上皮细胞增殖及纤维化的影响.国际眼科杂志2016;16(8):1449-1452
0引言
渗出性年龄相关性黄斑变性是发达国家第一位的致盲眼病,其主要特征是黄斑部视网膜下脉络膜新生血管(choroidal neovascularization,CNV)等生成,并伴有反复出血、渗出等病理改变。一旦这些新的异常血管开始生长,经常会引起出血,导致进一步的愈合反应和视网膜下纤维化。玻璃体腔注射血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体是目前此种疾病的一线治疗方法[1]。贝伐单抗是人源化抗VEGF的IgG单克隆抗体,被美国食品药品安全局批准用于治疗结肠癌,现在被广泛用于脉络膜新生血管性疾病的治疗[2]。但随着抗VEGF药物的广泛应用及随访时间的延长,抗VEGF治疗的副作用也逐渐显现。越来越多的研究报道,抗VEGF治疗后无论是CNV还是视网膜新生血管均可发生较严重的纤维化[3-4]。抗血管新生药物的应用加剧了CNV病理纤维发生,但潜在的机制仍不清楚。因此,本研究将观察贝伐单抗对体外培养的人视网膜色素上皮细胞ARPE-19增殖及钙黏连蛋白(E-cadherin)和纤维连接蛋白(fibronectin)表达变化的作用,探讨贝伐单抗对ARPE-19增殖及纤维化的影响。
1材料和方法
1.1材料人视网膜色素上皮细胞系ARPE-19(美国ATCC公司),贝伐单抗(美国罗氏),DMEM/F12培养基、胎牛血清、青霉素及链霉素溶液、胰蛋白酶(美国Hyclone公司),CCK-8试剂盒(上海七海生物公司),碘化丙啶PI、RNaseA(美国Sigma公司),流式细胞仪FACSCalibur(BD Biosciences),一抗(鼠抗人anti-E-cadherin、兔抗人anti-fibronectin)及二抗(美国Abcam公司),Real-Time PCR试剂盒(日本Takara公司)。
1.2方法
1.2.1细胞培养及实验分组ARPE-19细胞系购自美国ATCC公司,按说明复苏,用DMEM/F12培养液(含10%胎牛血清和1%青霉素-链霉素)在37℃,体积分数5% CO2培养箱内培养,每48h更换新鲜培养液,待细胞融合长满瓶底80%左右,按1∶3比例消化传代。按贝伐单抗干预终浓度分为0、0.625、1.25、2.5、5.0mg/mL共5组。
1.2.2 CCK8检测各组人视网膜色素上皮细胞活性ARPE-19细胞经胰蛋白酶消化后以5×103/孔接种在96孔板,于细胞培养箱中继续培养12h后,更换新鲜培养基按实验分组用不同浓度贝伐单抗干预细胞,每组每个时间点均设置5个复孔。分别于24、48、72h后,每孔加入10μL的CCK-8试剂,继续培养2h后,使用自动酶联免疫分析仪,在450nm吸收波长处测量各组细胞的吸光度值(A450),计算每组的平均值。实验独立重复3次。
1.2.3流式细胞仪检测各组人视网膜色素上皮细胞周期ARPE-19细胞经胰蛋白酶消化后以5×105/孔接种在6孔板,于细胞培养箱中继续培养12h后,更换新鲜培养基按实验分组用不同浓度贝伐单抗干预细胞,24h后用胰酶消化成单细胞悬液后混入冰75%无水乙醇,4℃静置过夜,离心弃上清,PBS漂洗3次,100μg/mL PI 0.5mL及100μg/mL RNase A 0.5mL作用30min(37°C,避光),用流式细胞仪FACSCalibur(BD Biosciences)分析,激发波长为488nm及630nm,上述步骤至少重复3次实验。
1.2.4 RT-PCR检测各组人视网膜色素上皮细胞E-cadherin和fibronectin的mRNA表达水平不同浓度贝伐单抗干预24h后收集细胞,按照试剂盒说明提取各组细胞mRNA。根据反转录试剂盒说明书对提取的E-cadherin和fibronectin的mRNA进行反转录。引物由上海生工生物技术公司合成,GAPDH为内参,引物序列见表1。PCR反应条件:95℃预变性30s,95℃变性5s,60℃退火30s,共40个循环。获取各组样品的标准曲线,以GAPDH为内参分析其Ct值。实验重复3次。引物由上海生工生物技术公司合成,所有PCR反应由PCR仪完成,GAPDH为内参,计算各组相对定量值(RQ值)。
1.2.5 Western blotting测定各组人视网膜色素上皮细胞E-cadherin和fibronectin蛋白的表达不同浓度贝伐单抗干预24h后收集细胞,提取各组细胞总蛋白。BCA蛋白定量试剂盒测定蛋白浓度,按每个样本5μg总蛋白上样,100g/L SDS-聚丙烯酰胺凝胶电泳;4℃下100mA电转膜3h,50g/L脱脂奶粉室温封闭1h,E-cadherin和fibronectin一抗(浓度为1∶1000)4℃孵育过夜。第2d滴加辣根过氧化物酶标记的二抗(山羊抗兔IgG,浓度为1∶100000)室温孵育1h。免疫反应结束后用Western blotting荧光剂发光、显影。Gel-Del凝胶成像系统照相,应用Image J图像分析软件,通过目的基因与内参条带的吸光度值比值进行目的蛋白的相对含量分析。
表1RT-PCR SYBR Green法引物序列

目的基因引物序列(5→3)E-cadherinF:CCCACCACGTACAAGGGTCR:CTGGGGTATTGGGGGCATCfibronectinF:GCGAGAGTGCCCCTACTACAR:GTTGGTGAATCGCAGGTCAGAPDHF:GGAGTCCACTGGCGTCTTCR:GCTGATGATCTTGAGGCTG

图1不同浓度的贝伐单抗对ARPE-19细胞株活性的影响。

2结果
2.1不同浓度的贝伐单抗对各组人视网膜色素上皮细胞活性的变化CCK8检测结果显示,用不同浓度的贝伐单抗干预ARPE-19细胞株24h时,其中0mg/mL组(0.2254±0.01734)、0.625mg/mL组(0.2300±0.01707)、1.25mg/mL组(0.2268±0.01591)、2.5mg/mL组(0.2264±0.01169)的组间无统计学差异(P>0.05),5.0mg/mL组(0.1954±0.01194)细胞活性下降,差异有统计学意义(P<0.05)。在作用48h时,其中0mg/mL组(0.2438±0.02255)、0.625mg/mL组(0.2432±0.01844)、1.25mg/mL组(0.2480±0.02573)的组间无统计学差异(P>0.05),2.5mg/mL组(0.2072±0.01038)和5.0mg/mL组(0.1914±0.00832)细胞活性下降,差异有统计学意义(P<0.05)。在作用72h时,其中0mg/mL组(0.2922±0.01238)、0.625mg/mL组(0.3002±0.01794),1.25mg/mL组(0.3100±0.01239)的组间无统计学差异(P>0.05),2.5mg/mL组(0.1806±0.01958)和5.0mg/mL组(0.1528±0.01555)细胞活性明显下降,差异有统计学意义(P<0.05,图1)。
2.2流式细胞仪检测细胞周期流式结果显示(χ2检验):不同浓度的贝伐单抗干预ARPE-19细胞株24h后,其中0mg/mL组(S期占22.34%±3.11%)、0.625mg/mL组(S期占17.11%±2.68%)、1.25mg/mL组(S期占20.07%±3.12%)的组间S期百分比无统计学差异(P>0.05);2.5mg/mL组(S期占8.22%±1.21%)、5.0mg/mL组(S期占5.52%±0.58%)的组间S期百分比明显下降,具有统计学差异(P<0.05,图2)。
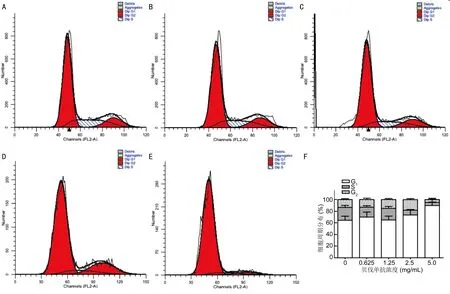
图2不同浓度的贝伐单抗对ARPE-19细胞株细胞周期的影响A:0mg/mL组;B:0.625mg/mL组;C:1.25mg/mL组;D:2.5mg/mL组;E:5.0mg/mL组;F:流式细胞仪检测细胞周期变化。
2.3各组人视网膜色素上皮细胞中E-cadherin和fibronectin的mRNA表达水平RT-PCR结果显示,不同浓度的贝伐单抗干预ARPE-19细胞株24h后,2.5mg/mL组及5.0mg/mL组E-cadherin mRNA表达降低,具有统计学差异(P<0.05);而0、0.625、1.25mg/mL组E-cadherin mRNA表达无明显变化,无统计学差异(P>0.05)。2.5mg/mL组及5.0mg/mL组fibronectin mRNA表达升高,具有统计学差异(P<0.05);而0、0.625、1.25mg/mL组fibronectin mRNA表达无明显变化,无统计学差异(P>0.05,图3)。
2.4各组人视网膜色素上皮细胞中E-cadherin和fibronectin蛋白的表达Western blotting结果显示,不同浓度的贝伐单抗干预ARPE-19细胞株24h后,2.5mg/mL组及5.0mg/mL组E-cadherin蛋白表达降低,具有统计学差异(P<0.05),但2.5mg/mL组与5.0mg/mL组之间降低不明显,无统计学差异(P>0.05);而0、0.625、1.25mg/mL组E-cadherin蛋白表达无明显变化,无统计学差异(P>0.05)。2.5mg/mL组及5.0mg/mL组fibronectin蛋白表达升高,具有统计学差异(P<0.05),但2.5mg/mL组与5.0mg/mL组之间升高不明显,无统计学差异(P>0.05);而0、0.625、1.25mg/mL组fibronectin蛋白表达无明显变化,无统计学差异(P>0.05,图4)。

图3不同浓度的贝伐单抗对ARPE-19细胞株E-cadherin和fibronectin的mRNA表达水平的影响aP<0.05vs0mg/mL组。
3讨论
Spitzer等[5]在贝伐单抗对不同种类视网膜细胞毒性研究中发现,0.008~2.5mg/mL贝伐单抗在24h时对小鼠视网膜神经节细胞(RGC5)、脉络膜内皮细胞和ARPE19均未见毒性作用,但在2.5mg/mL贝伐单抗作用48h时观察到ARPE19的细胞数和细胞活性轻度下降,提示在0.25mg/mL的常规临床用药剂量下是相对安全的,同时发现高剂量(2.5mg/mL)的贝伐单抗可能对ARPE19是有害的。后续在Brar等[6]研究结果中同样显示2.0mg/mL贝伐单抗在24h时可以抑制猴脉络膜内皮细胞(RF6A),但对RGC5和ARPE19均未见毒性作用。

在本研究中我们发现,0.625~2.5mg/mL贝伐单抗作用24h时对ARPE19细胞活性未见明显影响,但在图4各组人视网膜色素上皮细胞中E-cadherin和fibronectin蛋白的表达A:E-cadherin和fibronectin蛋白条带图;B:E-cadherin和fibronectin蛋白表达的柱形图(aP<0.05vs0mg/mL 组)。
5.0mg/mL时细胞活性轻度下降。干预时间延长到48h时,在2.5mg/mL和5mg/mL组均可观察到细胞活性的轻度下降。进一步延长干预时间到72h时,2.5mg/mL和5mg/mL组均显示出明显的细胞活性抑制。表明高浓度的贝伐单抗对ARPE19有明显的毒性作用,且呈时间相关性。流式细胞检测表明贝伐单抗作用24h时,2.5mg/mL和5mg/mL组S期细胞百分比明显降低,G1/S期阻滞。进一步表明高浓度贝伐单抗通过阻滞G1/S期抑制细胞增殖。而近期研究表明贝伐单抗能够通过诱导p53表达,上调p16、p21、p27的表达,进而抑制cyclinD和E,以及CDK2,4,6的表达,最终减少ppRb表达以及导致细胞周期G1/S期阻滞[7]。
Bloch等[8]研究发现,AMD患者在应用抗VEGF药物后1a或者更短的时间内出现了黄斑中心凹下的纤维化。Heier[9]随访发现,应用抗VEGF药物治疗2~6a后有超过50%患者黄斑部发生了严重纤维化。目前,新生血管纤维化牵拉条带形成引起的牵拉性视网膜脱离,已成为影响抗VEGF药物治疗效果的重要原因[10-14]。体外研究中发现,贝伐单抗能够上调人RPE细胞中CTGF、bFGF、TGF-β2及MMP-2的表达,可能有促进纤维化的作用[15]。上皮细胞生物学标记物钙黏附蛋白(E-cadherin)及间质细胞生物学标记物fibronectin是EMT特异性的生物学标志。E-cadherin是一种主要存在于人和动物上皮的黏附分子,主要功能是维持正常上皮细胞形态和结构完整性。fibronectin具有促进细胞黏附、迁移、增殖、分化的作用,进而能促进成纤维细胞、内皮细胞生长。本次研究发现:高浓度的贝伐单抗能够下调纤维化相关因子E-cadherin,同时上调fibronectin的表达,提示高浓度的贝伐单抗可以引起ARPE-19细胞纤维化。
本研究观察了不同浓度贝伐单抗对ARPE-19细胞增殖及纤维化的作用,证明高浓度的贝伐单抗能够抑制ARPE-19细胞的增殖,下调纤维化相关因子E-cadherin,同时上调fibronectin的表达,提示高浓度的贝伐单抗可以引起ARPE-19细胞纤维化。
参考文献
1 Yi WH, Wei RL, Cai JP,etal. The expression and significance of VEGF and TGF-13,in orbital cavernous hemangioma.IntJOphthalmol(GuojiYankeZazhi) 2004;4(2):247-249
2 Group CR,Martin DF,Maguire MG,etal.Ranibizumab and bevacizumab for neovascular age-related macular degeneration.NEnglJMed2011;364(20):1897-1908
3 Van Geest RJ,Lesnik-Oberstein SY,Tan HS,etal. A shift in the balance of vascular endothelial growth factor and connective tissue growth factor by bevacizumab cau-ses the angiofibrotic switch in proliferative diabetic retinopathy.BrJOphthalmol2012;96(4):587-590
4 Heier JS.Pathology beyond neovascularization: new targets in age-relat-ed macular degeneration.Retina2009;29(6):39-41
5 Spitzer MS, Wallenfels-Thilo B, Sierra A,etal. Antiproliferative and cytotoxic prop-erties of bevacizumab on different ocular cells.BrJOphthalmol2006;90(10):1316-1321
6 Brar VS, Sharma RK, Murthy RK,etal. Evaluation of differential toxicity of varying doses of bevacizumab on retinal ganglion cells, retinal pigment epithelial cells, and vascular endothelial growth factor-enriched choroidal endothelial cells.JOculPharmacolTher2009;25(6):507-511
7 Kuo CN, Chen CY, Lai CH,etal. Cell cycle regulation by bevacizumab in ARPE-19 human retinal pigment epithelial cells.MolMedRep2012;6(4):701-704
8 Bloch SB,Larsea M. Fibrosis of extramacular angioid streaks following ranibizumab treatment of subfoveal choroidal neovascularization.ActaOphthalmologica2011;89(1):e102-e104
9 Heier JS.Pathology beyond neovascularization: new targets in age-related macular degeneration.Retina2009;29(6):39-41
10 de Juan E,Hickingbotham D,McCuen BW 2nd,etal. The pic-forceps for removal of epiretinal membranes.AmJOphthalmol1984;98(4):518-519
11 Aiello CP. Endothetial growth factor induced retinal permeability is mediated by an orally effective a-isoform-sdection inhibitor.Diabetes1997;46(9):1473-1480
12 Pe’er J, Shweiki D, Itin A,etal. Hypoxia-induced expression of vascular endothelial growth factor by retinal cells is a common factor in neovascularizing ocular diseases.LabInvest1995;72(6):638-645
13 Rosenfeld PJ, Schwartz SD, Blumenkranz MS,etal. Maximum tolerated dose of a humanized anti-vascular endothelial growth factor antibody fragment for treating neovascular age-related macular degeneration.Ophthalmology2005;112(6):1048-1053
14 Land K, Spaide RF, Freund KB,etal. Treatment of choroidal neovascularization in pathologic myopia with intravitreal bevacizumab.Retina2006;26(8):960-963
15张敏,储三军,曾繁星,等.Bevacizumab对视网膜色素上皮细胞纤维化相关因子表达的影响.眼科新进展 2014;34(4):318-321
作者单位:(710068)中国陕西省西安市,陕西省人民医院1眼科;2外科
作者简介:李婵,女,主治医师,研究方向:眼表及视网膜疾病。
通讯作者:李婵.13991219091@163.com
收稿日期:2016-04-26 修回日期: 2016-07-05
DOI:10.3980/j.issn.1672-5123.2016.8.11
•KEYWORDS:bevacizumab; human retinal pigment epithelial cell; proliferation; epithelial-mesenchymal transition
Effects of Bevacizumab on the proliferation and epithelial-mesenchymal transition in human retinal pigment epithelial cellsinvitro
Chan Li1, Wei Ren2
Abstract
