基于表达谱芯片技术分析老龄化对小鼠卵母细胞发育能力的影响
2016-07-25傅祥伟朱士恩
常 卓,傅祥伟,朱士恩
(1.中国农业大学 动物科技学院,北京 100094;2.北京市畜牧总站,北京 100101)
基于表达谱芯片技术分析老龄化对小鼠卵母细胞发育能力的影响
常卓1,2,傅祥伟1,朱士恩1
(1.中国农业大学 动物科技学院,北京 100094;2.北京市畜牧总站,北京 100101)
摘要:探讨了生殖老化对小鼠卵母细胞后期发育及基因表达水平的影响。结果表明,与青年小鼠相比,老龄小鼠MII期卵母细胞经体外受精后早期胚胎原核形成的时间发生延迟(1 h),囊胚发育率有显著差异(61.98% vs.70.95%,P<0.05)。提取老龄和青年CD1小鼠MII期卵母细胞总RNA,使用基因表达谱芯片对其进行分析。结果表明,生殖老化导致1 737个基因表达表现出显著差异,其中64.9%的基因表达上调,35.1%的基因表达下调,生殖老化导致Hdac10等基因产生极显著的表达差异,小鼠卵母细胞质量下降,最终影响其后期发育能力。
关键词:卵母细胞;生殖老化;减数分裂;基因表达;小鼠
生物体在机体其它器官老化前生殖机能就已开始退化,即发生生殖老化现象。与雄性哺乳动物不同的是,雌性哺乳动物在渡过其寿命的1/3时已发生生殖老化,生殖机能表现出显著下降,表现在卵母细胞的数量和质量上,如卵巢早衰、减数分裂中染色体分离异常以及线粒体功能障碍等[1]。而人们对于生殖老化影响卵母细胞后期发育的情况知之甚少。
Hamatani和Pan等人曾通过表达谱芯片技术分析青老年小鼠卵母细胞全基因组表达,但在杂交前使用RNA线性扩增的方法得到cRNA[2,3]。而本实验不进行RNA线性扩增,免去繁琐的扩增过程和扩增中可能会导致的核酸污染,更重要的是避免扩增不均一而放大或减小基因表达差异,最终得出不准确的结果。本实验主要研究生殖老化对小鼠卵母细胞后期发育潜力是否造成影响,并进一步以老龄和青年CD1小鼠MII期卵母细胞为实验材料进行基因表达谱分析,探索生殖老化影响卵母细胞后期发育的分子机理。
1材料和方法
1.1实验动物
选取同时购入的青年(6~8周)和老龄(40~44周)CD1小鼠(购自北京维通利华实验动物技术有限公司)作为青年组和老龄组,饲养环境为控温20~25℃;控光14 h光照(6:00~20:00)和10 h黑暗(20:00~6:00),自由采食、饮水,经1周的适应性饲养后进行实验。操作均符合实验动物福利等相关法规。
1.2GV期卵母细胞收集及体外成熟培养
将小鼠采用脱颈法处死,无菌采集其卵巢置于含有4 mg/mL牛血清白蛋白(BSA)、37℃的操作液(M2)中。在实体显微镜下剥离卵巢附带的结缔组织等并清洗2~3次。将清洗后的卵巢置于M2操作液中,使用1 mL注射器的针头(直径0.45 mm)将其撕碎,在实体显微镜下回收卵丘-卵母细胞复合体(COCs)。将COCs移入300 IU/mL的透明质酸酶溶液中,在37℃恒温台上消化2 min,用M2操作液充分洗净卵母细胞周围的颗粒细胞,挑选形态正常的GV期卵母细胞计数、备用。
将以上采集的青年组和老龄组GV期卵母细胞在37℃的体外成熟液(M16)滴中洗涤3次以后,移入覆盖石蜡油的M16液(30 μL/滴)中,平均每滴15~20枚。然后将其置于37℃、5%CO2和100%湿度的条件下进行体外成熟培养至MII期。挑选形态正常的MII期卵母细胞计数、备用。
1.3MII期卵母细胞体外受精
选取健康的8~10 w CD1雄性小鼠,采用脱颈法处死,分别取出两侧附睾尾置于37℃恒温台上的无菌滤纸上,用滤纸吸附表面的脂肪和血迹。将附睾尾于提前平衡过夜的HTF受精液滴中剪开后使精子上浮,然后置于37℃、5%CO2和100%湿度的条件下孵育1~1.5 h,精子得以充分获能。
将青年组和老龄组MII期卵母细胞在37℃的HTF受精液中洗涤3次以后,移入HTF受精液滴(75 μL/滴)中,平均每滴25~30枚。使用移液器吸取10 μL精子悬浮液加入含有卵母细胞的液滴中,使精子密度为5×106个/mL。受精4 h后,将卵母细胞从受精液滴中移出,在37℃的HTF培养液中充分洗净,并移入覆盖石蜡油的新鲜HTF培养液滴(75 μL/滴)中,于37℃、5%CO2和100%湿度的条件下培养,观察其发育能力,统计胚胎原核形成的比例、胚胎卵裂率和囊胚发育率。
1.4表达谱芯片测定
各收集600枚青年组和老龄组形态正常的MII期卵母细胞,用口吸管吸取至1.5 mL PCR管中,瞬时离心使卵母细胞沉降至管底,弃除管内多余操作液,于-80℃冰箱中作为芯片样品保存。根据QIAGEN RNeasy Mini Kit试剂盒说明进行芯片样品总RNA提取和纯化、cDNA制备、荧光标记cRNA合成、cRNA纯化等操作操作。使用分光光度计对已纯化的cRNA浓度进行测定,A260/A280比值在1.9~2.2即为符合标准的cRNA。对cRNA样品片段化和芯片杂交,经洗涤后进行扫描。采用Feature Extraction 10.7.1.1软件处理得到的原始图像,并提取原始数据,使用Genespring12.5软件标准化处理原始数据,转化为log以2为底的对数,最后在二维直角坐标系平面中绘制散点图,进行分析。
1.5数据统计
本试验所有数据分析均采用SPSS12.0软件中的独立样本t-test进行分析。P<0.05表示有显著差异。
2结果
2.1生殖老化对小鼠MII期卵母细胞后期发育的影响
对116枚老龄组和113枚青年组MII期卵母细胞进行体外受精后,选取不同时间在实体显微镜下观察原核形成的情况。如图1所示,与青年组相比,老龄组卵母细胞受精后原核形成较为延迟,老龄组受精后5 h的原核形成率(33.62%)显著低于青年组4 h的原核形成率(41.77%);老龄组受精后6 h时原核形成率(59.56%)与青年组5 h时原核形成率(55.19%)差异不显著。此外,表1所示,体外受精胚胎的卵裂率无显著差异,但囊胚发育率存在显著差异(61.98%±1.77 vs.70.95%±1.61,P<0.05)。
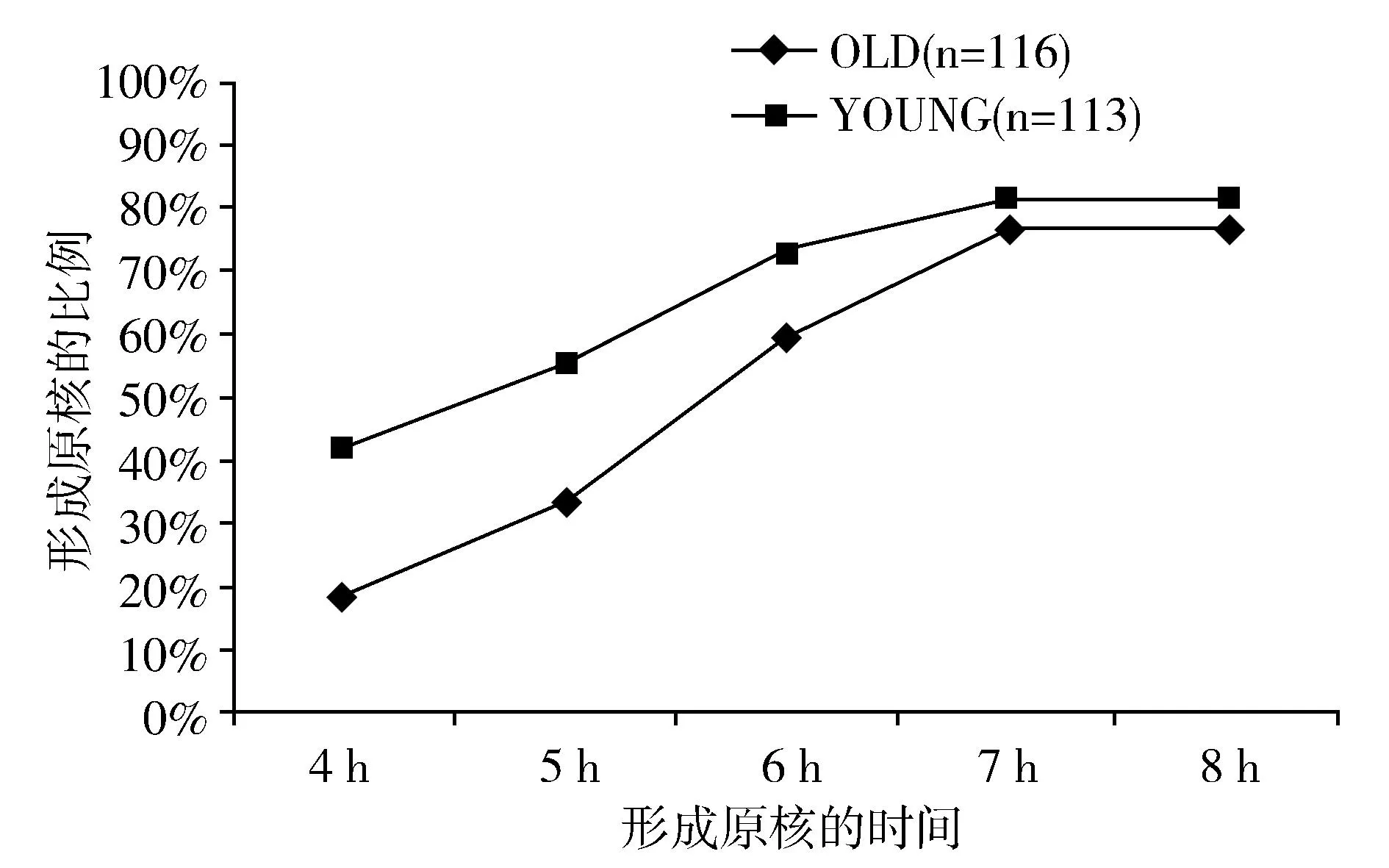
图1 老龄和青年CD1小鼠卵母细胞体外受精后原核形成的动态曲线
表1生殖老化对CD1小鼠MII期卵母细胞体外受精后发育能力的影响

卵母细胞/枚卵裂率(%±SE)囊胚发育率(%±SE)老龄组11688(75.93±2.19)a72(61.98±1.77)a青年组11390(79.73±1.07)a80(70.95±1.61)b
注:同列不同上标小写字母表示差异显著(P<0.05)
2.2生殖老化对小鼠MII期卵母细胞基因表达的影响
a)差异表达基因统计和筛选
选择老龄组和青年组样本信号均与背景有显著差异的探针为有效探针,然后对有效探针对应的基因再次进行筛选,标准为差异倍数FC值≥2.0。
结果如表2所示,一共有30 606个探针为有效探针,其中1 737个基因的FC值≥2.0,表达上调基因609个,表达下调基因1 128个;FC值≥3.0的基因共计104个(16个表达上调基因和88个表达下调基因);FC值≥5.0的基因共计33个(5个表达上调基因和28个表达下调基因),均为cDNA片段或产物为长链非编码RNA(lincRNA)。因此生殖老化导致小鼠MII期卵母细胞中5.68%的基因表达显著改变,其中64.9%的基因表达下调,35.1%的基因则表达上调。
参考Su等人的标准[4],Fshr、Has2和Ptgs2这三种卵丘颗粒细胞特有的基因FC值均小于5.0,因此实验结果不受颗粒细胞基因表达的干扰。
表2老龄和青年小鼠卵母细胞差异表达基因统计

有效探针差异表达显著基因(%)表达上调基因FC≥2.0(%)FC≥3.0(%)FC≥5.0(%)表达下调基因FC≥2.0(%)FC≥3.0(%)FC≥5.0(%)306061737(5.68%)609(35.1%)1651128(64.9%)8828
b)差异表达基因分析
选择FC≥3.0的基因在Gene Ontology分析结果中查找其功能。88个表达下调基因中,除57个基因为cDNA片段或产物为lincRNA外,7个基因功能未知,24个基因参与的生理过程见表3;16个表达上调基因中,除10个基因为cDNA片段或产物为lincRNA外,1个基因功能未知,5个基因参与的生理过程见表4。这些基因的FC在3.0以上,而且参与细胞代谢的多个过程,说明其转录水平的改变对卵母细胞的正常机能影响较大。
表3FC≥3.0的表达下调基因
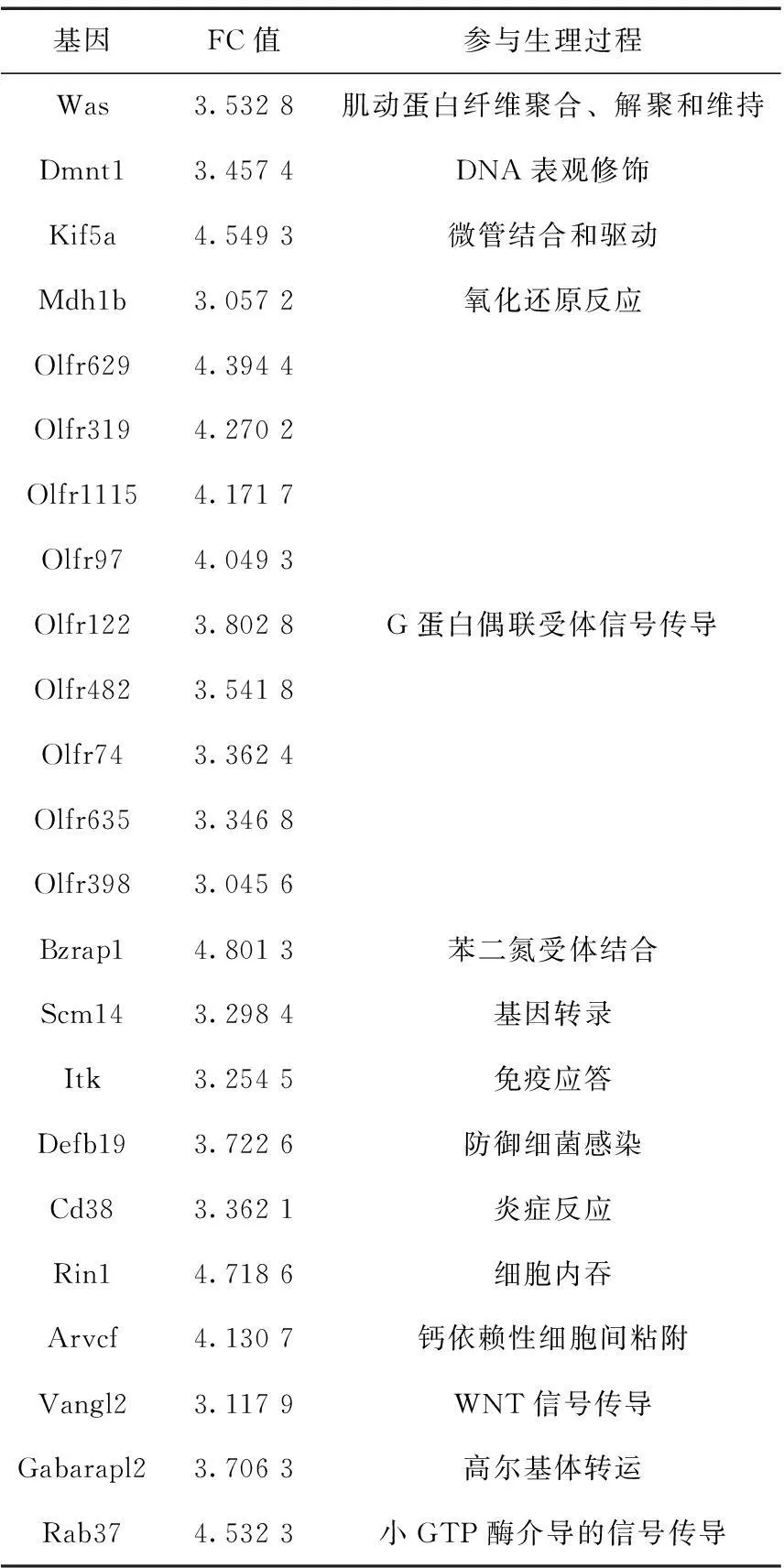
基因FC值参与生理过程Was3.5328肌动蛋白纤维聚合、解聚和维持Dmnt13.4574DNA表观修饰Kif5a4.5493微管结合和驱动Mdh1b3.0572氧化还原反应Olfr6294.3944Olfr3194.2702Olfr11154.1717Olfr974.0493Olfr1223.8028Olfr4823.5418Olfr743.3624Olfr6353.3468Olfr3983.0456G蛋白偶联受体信号传导Bzrap14.8013苯二氮受体结合Scm143.2984基因转录Itk3.2545免疫应答Defb193.7226防御细菌感染Cd383.3621炎症反应Rin14.7186细胞内吞Arvcf4.1307钙依赖性细胞间粘附Vangl23.1179WNT信号传导Gabarapl23.7063高尔基体转运Rab374.5323小GTP酶介导的信号传导
表4FC≥3.0的表达上调基因
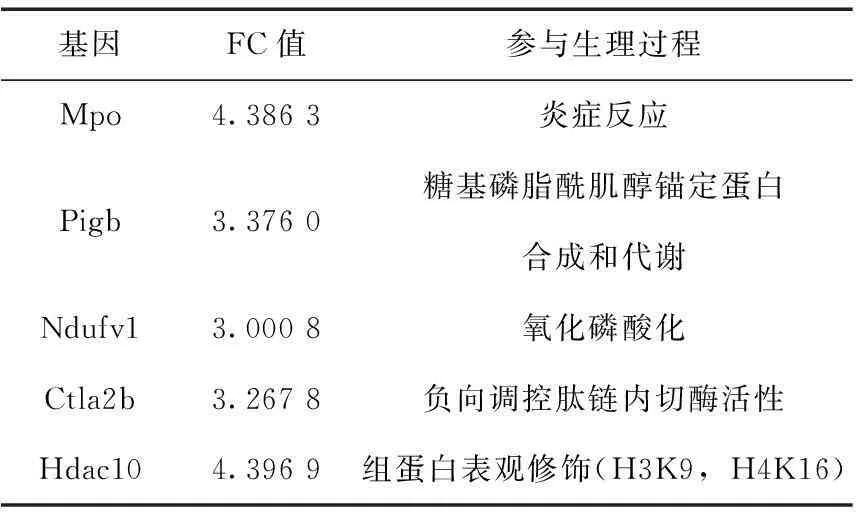
基因FC值参与生理过程Mpo4.3863炎症反应Pigb3.3760糖基磷脂酰肌醇锚定蛋白合成和代谢Ndufv13.0008氧化磷酸化Ctla2b3.2678负向调控肽链内切酶活性Hdac104.3969组蛋白表观修饰(H3K9,H4K16)
3讨论
雌性哺乳动物随着年龄增加,其生殖能力下降。研究证明,这种生殖老化乃至失去生殖力的现象表现在多个方面,包括生殖激素的水平下降或紊乱、卵巢卵泡库储备下降、卵母细胞数量持续减少、卵母细胞质量下降以及子宫内膜接受性减弱等[5,6]。以昆明白小鼠为实验模型,选取6~8周、36周和48周分别定为青年组、中年组和老年组,各组进行卵母细胞体外成熟培养。实验结果表明,老年组卵母细胞体外受精后原核形成的时间比青年组和中年组时间延迟1 h[7];老年仓鼠自然交配后合子形成原核的时间较青年仓鼠也存在约1 h的延迟[8];老化的牛卵母细胞与解冻后的精子进行IVF,合子的原核也推迟出现[9]。从本实验结果可看出,由老龄和青年CD1小鼠卵母细胞体外受精所得胚胎的囊胚发育率均具有显著差异,且整体处理组卵母细胞形成原核的时间延迟约1 h,说明生殖老化导致卵母细胞质量下降,进而影响后期发育能力,与前人实验结果相一致[10~13]。
目前已有许多文献报道以卵母细胞作为实验材料使用表达谱芯片技术进行研究[14~16],如Pan等人使用表达谱芯片对各个发育时期卵泡内的卵母细胞转录谱进行分析,研究卵母细胞成熟过程中重要生理过程的机制。之前也有报道使用芯片技术研究生殖老化导致的染色体非整倍性等异常现象[2,3]。本实验中,老龄小鼠卵母细胞内约有5.68%的基因转录水平发生明显变化,与Hamatani等人结果类似[2],老龄小鼠卵母细胞DNA受ROS积累等不利因素影响而更容易被损伤[17,18],组蛋白H3K9和H4K16等位点的乙酰化参与修复DNA损伤,从而保证受精后各种关键事件的按时发生[20],组蛋白去乙酰化酶HDAC10能够特异性对H3K9和H4K16进行去乙酰化,而生殖老化对H3K9和H4K16乙酰化水平无影响[21,22],与HDAC10的作用不冲突。因此老龄小鼠卵母细胞Hdac10表达的上调导致H3K9和H4K16乙酰化水平降低,可能会降低合子内母源组蛋白乙酰化修复受损伤DNA的作用,推迟原核形成。
4参考文献
[1]Djahanbakhch O M,Ezzati,et al.Reproductive ageing in women. J Pathol,2007,211(2):219-31.
[2]Hamatani T,and G Falco,et al.Age-associated alteration of gene expression patterns in mouse oocytes. Hum Mol Genet,2004,13(19):2263-78.
[3]Pan H,P Ma,et al.Age-associated increase in aneuploidy and changes in gene expression in mouse eggs. Dev Biol,2008,316(2):397-407.
[4]Su Y Q,K Sugiura,et al.Selective degradation of transcripts during meiotic maturation of mouse oocytes. Dev Biol,2007,302(1):104-17.
[5]Faddy M J,R G Gosden,et al.Accelerated disappearance of ovarian follicles in mid-life:implications for forecasting menopause. Hum Reprod,1992,7(10):1342-6.
[6]Fitzgerald C,A E Zimon,et al.Aging and reproductive potential in women. Yale J Biol Med,1998,71(5):367-81.
[7]Cui L B,X Y Zhou,et al.The Kunming mouse:as a model for age-related decline in female fertility in human. Zygote,2013,21(4):367-76.
[8]Suzuki H,M Moriguchi,et al.Delay in ovulation and fertilization and asynchronous pronuclear development in aged hamsters. The Journal of reproduction and development,1996,42(1):15-22.
[9]Koyama K,S S Kang,et al.Aging-related Changes in In Vitro-matured Bovine Oocytes:Oxidative Stress,Mitochondrial Activity and ATP Content after Nuclear Maturation. J Reprod Dev,2014.
[10]Tan S L,N Maconochie,et al.Cumulative conception and live-birth rates after in vitro fertilization with and without the use of long,short,and ultrashort regimens of the gonadotropin-releasing hormone agonist buserelin. Am J Obstet Gynecol,1994,171(2):513-20.
[11]Tarin J J,V Gomez-Piquer,et al.Association of female aging with decreased parthenogenetic activation,raised MPF,and MAPKs activities and reduced levels of glutathione S-transferases activity and thiols in mouse oocytes. Mol Reprod Dev,2004,69(4):402-10.
[12]Takeo S,H Goto,et al.Effect of maternal age on the ratio of cleavage and mitochondrial DNA copy number in early developmental stage bovine embryos. J Reprod Dev,2013,59(2):174-9.
[13]Fu X,J Cheng,et al.The association between the oocyte pool and aneuploidy:a comparative study of the reproductive potential of young and aged mice. J Assist Reprod Genet,2014,31(3):323-31.
[14]Pan H,M J O’Brien,et al.Transcript profiling during mouse oocyte development and the effect of gonadotropin priming and development in vitro. Dev Biol,2005,286(2):493-506.
[15]Murchison E P,P Stein,et al.Critical roles for Dicer in the female germline. Genes Dev,2007,21(6):682-93.
[16]Ma J,M Flemr,et al.MicroRNA activity is suppressed in mouse oocytes. Curr Biol,2010,20(3):265-70.
[17]Agarwal A,S Gupta,et al.Role of oxidative stress in female reproduction. Reprod Biol Endocrinol,2005,3:28.
[18]Chao H T,S Y Lee,et al.Repeated ovarian stimulations induce oxidative damage and mitochondrial DNA mutations in mouse ovaries. Ann N Y Acad Sci,2005,1042:148-56.
[19]Xiao J,Y Liu,et al.Effects of the insemination of hydrogen peroxide-treated epididymal mouse spermatozoa on gammaH2AX repair and embryo development. PLoS One,2012,7(6):e38742.
[20]Misri S,S Pandita,et al.Telomeres,histone code,and DNA damage response. Cytogenet Genome Res,2008,122(3-4):297-307.
[21]Akiyama T,M Nagata,et al.Inadequate histone deacetylation during oocyte meiosis causes aneuploidy and embryo death in mice. Proc Natl Acad Sci U S A,2006,103(19):7339-44.
[22]Yu J N,M Wang,et al.Chromosome changes of aged oocytes after ovulation. Yi Chuan,2007,29(2):225-9.
cDNA Microarray-Based Analysis of Effects of Aging on Developmental Competence of Murine Oocyte
CHANG Zhuo1,2,FU Xiang-wei1,ZHU Shi-en1*
(1.College of Animal Science and Technology,China Agricultural University,Beijing 100193,China;2.Beijing General Station of Animal husbandry,Beijing 100101,China)
Abstract:The purpose is to investigate the correlation between the old and young mouse oocyte early embryonic development and the molecular alteration of the old mouse oocyte.Compared with young mice oocytes,the early embryonic pronucleus formation of old mice oocytes after in vitro fertilization(IVF)delays 1 h,ratios of blastocysts appear significant difference(IVF:61.98% vs.70.95%,P<0.05).Furthermore,results of cRNA microarray-based analysis show that within the increasing of age,1737 genes expression showed significant difference(fold-change is not less than 2).Ratios of up-regulated and down-regulated genes are 64.9% and 35.1% respectively,which make oocyte quality decline.Therefore,differentially expression of genes which affected by the reproductive aging,such as Hdac10,makes oocyte quality decline,and has an great impact on the development competence ultimately.
Key words:oocyte;reproductive aging;meiosis;genetic expression;mouse
收稿日期:2016-04-26
基金项目:国家自然科学基金(项目编号31372307)
作者简介:常卓(1989-),女,硕士研究生,畜禽遗传资源保护与利用。 通信作者:朱士恩(1956-),男,教授,博士生导师。E-mail:zhushien@cau.edu.cn
中图分类号:S814.3
文献标识码:A
文章编号:1005-2739(2016)04-0007-05
