可溶性人胎盘生长因子ELISA检测试剂盒的建立及性能分析
2016-07-24高小平刘小章
张 晟 高小平 陆 华 刘小章*
1.四川大学华西基础医学与法医学院(610041);2.四川省人口和计划生育科学研究所
·技术与方法·
可溶性人胎盘生长因子ELISA检测试剂盒的建立及性能分析
张 晟1高小平2陆 华2刘小章2*
1.四川大学华西基础医学与法医学院(610041);2.四川省人口和计划生育科学研究所
目的:研发人血清及尿液可溶性胎盘生长因子(sPLGF)的ELISA检测试剂盒并进行性能测试。方法:以抗人PLGF单克隆抗体包被微孔板,加入重组sPLGF和生物素标记的检测抗体,形成抗原抗体复合体,加入链亲合素辣根过氧化物酶和底物TMB实现比色反应;从线性范围、准确度、精密度、样品基质及样品前处理方法等指标进行性能评价,并与市售进口同类产品进行比较。结果:捕获抗体的最适包被量为400ng/well,包被条件为4℃孵育16~20h,检测抗体的最适工作浓度为1μg/ml,样品最适反应条件为37℃孵育2h,适合的封闭液及样品稀释液组合为3%BSA-PBS和0.1%BSA-PBS;验证该试剂盒的有效检测范围为15.6~2000pg/ml,准确度为85%~115%;批次内变异系数CV≤10%,批次间变异系数CV≤15%;其检测范围、准确度、精密度、灵敏度及样品适用范围等与市售进口试剂盒基本一致。结论:本项目开发的人sPLGF检测试剂盒实现了人血清和尿液中的内源sPLGF的定量检测,其检测性能稳定、可靠,具有比进口试剂盒检测范围更广、价格更低的优势,可用于临床检测血液及尿液中的内源性sPLGF水平。
人胎盘生长因子; 夹心ELISA;检测试剂盒;性能测试
胎盘生长因子(PLGF)具有调控滋养细胞生长和分化的作用[1-4]。已有研究证实,PLGF分泌异常与先兆子痫[5]、胎儿宫内发育迟缓[6]、胎盘早剥[7]等胎盘功能障碍密切相关。与孕龄相同的正常妊娠妇女比较,先兆子痫妊娠妇女血清中sPLGF水平显著降低[8-10]。PLGF作为预测先兆子痫的生物标志物的观点提出后[11-12],大、小规模的临床研究主要是利用ELISA方法检测血清中游离的sPLGF水平[13],而检测尿液中游离sPLGF也可能成为预测先兆子痫的替代方法[14]。此外,研究发现习惯性流产妇女孕早期血清sPLGF水平显著下降,且与羊水细胞非整倍体染色体的检出率高度相关,包括13-三体、18-三体和21-三体[15-18]。目前,国内采用ELISA检测血清或尿液中游离sPLGF的相关报道较少,国产检测试剂盒的研发缓慢。本研究建立用于人血清及尿液中sPLGF检测的ELISA试剂盒,并对其检测范围、准确度、精密度及其稳定性等性能进行检测,与市售进口试剂盒进行比对。
1 材料和方法
1.1 主要试剂与仪器
小鼠抗人PLGF单克隆抗体(MAB264,R&D公司)、生物素标记山羊抗人PLGF 多克隆抗体 (BAF264,R&D公司)、重组人可溶性PLGF (sPLGF,264-PGB,R&D公司)、链亲和素辣根过氧化物酶(DY998,R&D公司)、TMB(T4444,Sigma公司)、碳酸盐缓冲液(pH9.6,自配)、PBS(pH7.4,自配)、牛血清白蛋白(罗氏公司)、Tween-20(上海生工生物工程股份有限公司)、脱脂奶粉(伊利集团)、胎牛血清(Thermo-Fisher公司)、可拆式96孔ELISA板(Corning公司)。M5多功能酶标仪(Molecular Devices,Spectramax M5)、电热恒温培养箱(上海森信实验仪器有限公司, DK-S26)、涡旋混合仪(MX-E)、pH计(METTLER TOLEDO)、电子天平(METTLER TOLEDO)。
1.2 缓冲溶液
①碳酸盐包被缓冲液:Na2CO31.59 g、NaHCO32.93 g溶于1000 ml超纯水,pH 9.6~9.8,4℃保存。②PBS溶液:NaCl 8 g、KCl 0.2 g、Na2HPO42.9 g,KH2PO40.2 g,溶解于1000 ml超纯水中,调节pH至7.4,室温保存。③PBS-T溶液:PBS,0.05%Tween-20,室温保存。④2N H2SO4终止液:将27.8 ml H2SO4缓缓加入472.2 ml纯水中备用,室温保存。
1.3 实验方法
1.3.1 双抗夹心ELISA条件的选择和优化 根据双抗体夹心ELISA设计原理,筛选并确定聚苯乙烯材料96微孔板为固相载体;选择高特异性、高亲和力的小鼠抗人PLGF单克隆抗体为捕获抗体,生物素标记的山羊抗人PLGF多克隆抗体为检测抗体,链亲和素标记的辣根过氧化酶为藕联酶,四甲基联苯胺(TMB)为酶促反应底物,稀硫酸溶液为终止液。
1.3.1.1 捕获抗体最适工作浓度的确定 采用“矩阵法”以不同浓度的捕获抗体检测不同浓度的sPLGF进行正交试验,包被不同量 (10、20、50、100、200、400、8000、1000ng/well)的捕获抗体,分别加入不同浓度的Human sPLGF标准品,用以检测抗体检测sPLGF结合量。
1.3.1.2 检测抗体最适工作浓度的确定 采用“棋盘法”用不同浓度的检测抗体检测不同浓度的Human sPLGF进行正交试验。包被适合浓度的捕获抗体,分别加入不同浓度的Human sPLGF标准品,分别用工作浓度(0.1、0.2、0.4、0.6、1.0、2.0μg/ml)的检测抗体检测sPLGF的量。
1.3.1.3 样品适合孵育时间的确定 包被以“矩阵法”获得的最适浓度4μg/ml,100μl/well的捕获抗体,3%BSA-PBS封闭后分别加入不同浓度的Human sPLGF标准品分别孵育不同时间点,用“棋盘法”获得的最适工作浓度1μg/ml的检测抗体检测sPLGF结合量。
1.3.2 试剂盒性能分析
1.3.2.1 线性范围 依照上述已建立的检测方法,检测不同浓度的Human sPLGF标准品,分别进行3次独立实验,计算3次实验的平均值及标准偏差,分析检测值的准确度(%)及CV(%),并分析线性相关系数(R2)且应≥0.990。
1.3.2.2 准确度及批内精密度 运用已建立的检测体系检测线性范围的最高(ULOQ)、高、中、低以及最低(LLOQ)5个不同浓度的Human sPLGF样品,每个样品设3个平行孔,根据标准曲线计算待测样品的检测浓度,计算准确度及3个平行孔间变异系数CV。
1.3.2.3 批次间精密度 运用已建立的检测体系对不同浓度的待测样品分别测定5次,各个样品每次测试均设4个平行孔,计算待测样品的准确度以及20个平行孔间的CV。
1.3.2.4 样品基质的影响 评估PBS、正常人血清及尿液基质对检测结果的影响,以用PBS、正常血清和尿液配制的样品稀释液分别配制不同浓度的样品,比较其检测浓度与配制浓度的差异。
1.3.3 样品前处理研究 分析不同临床样品(血清、尿液)前处理方式包括离心、沉降、pH调整等对ELISA检测结果的影响。分别按3种方法处理正常血清或尿液。①方法A: 血清采样后立即常温2000g离心15min,转移上清备用;尿液采样后放置1h自然沉降,取上清液备用。②方法B:血清采样后室温放置30min,常温2000g离心15min,取上清液备用;尿液采样立即4 ℃,1000g离心10min,取上清液备用。③方法C:血清采样后室温放置30min,4℃,2000g离心15min,转移上清备用;尿液采样立即4 ℃1000g离心10min,调整pH7.2~7.4,取上清液备用。分别向上述3种不同处理方式获得的正常血清或尿液添加已知浓度的sPLGF配制成不同浓度的待测样品(S1、S2、S3),用已建立的试剂盒检测上述待测样品中sPLGF的含量,每个样品设3个平行孔,分析各样品的准确度及3个平行孔间的CV。
1.3.4 试剂盒检测初步比对研究 分别配制线性范围的ULOQ、高、中、低以及LLOQ 5个不同浓度的样品,分别利用本试剂盒与市售进口试剂盒(R&D公司)同步检测,比较其性能特点。
1.4 统计学方法

2 结果
2.1 捕获抗体最适工作浓度
捕获抗体的包被量为200~800ng/well,检测不同浓度的PLGF时,空白OD值相对较低,检测值线性关系相对最佳,确定400ng/well为捕获抗体的最适包被量(图1)。
2.2 检测抗体最适工作浓度
检测抗体的工作浓度为1μg/ml时,空白OD值相对较低,线性关系相对最佳。确定1μg/ml为检测抗体的最适工作浓度(图2)。
2.3 样品适合孵育条件
确定37℃,2h为样品孵育的适合条件(图3)。
2.4 标准曲线
本研究方法在2000~15.6 pg/ml范围内线性良好。标准曲线的R2=0.999,标准曲线的权重均在100±15%内,估算其最低检测限MDD为12pg/ml(表1,图4)。
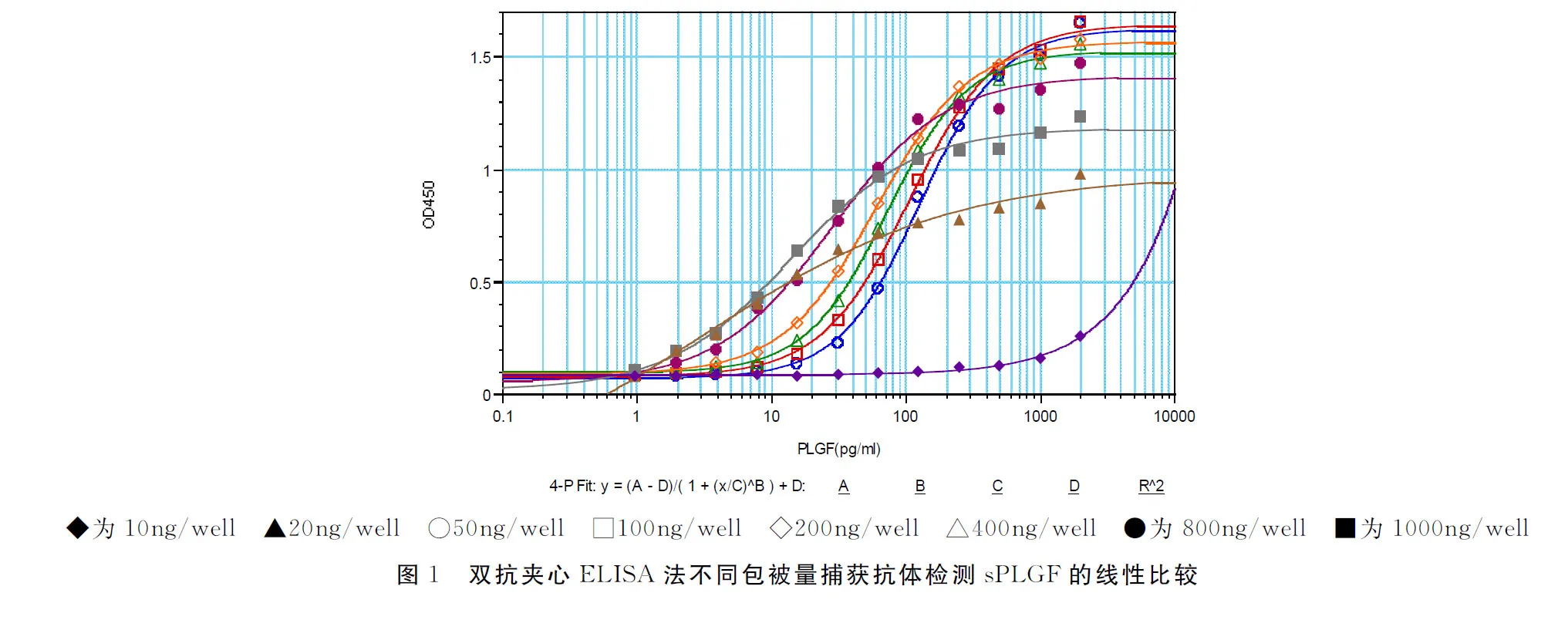
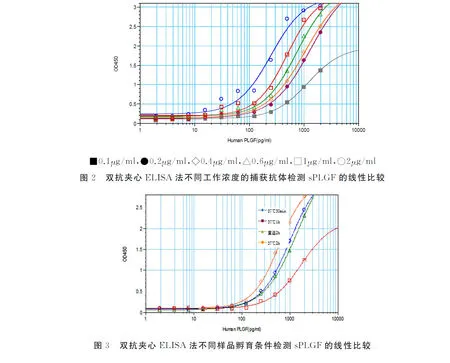
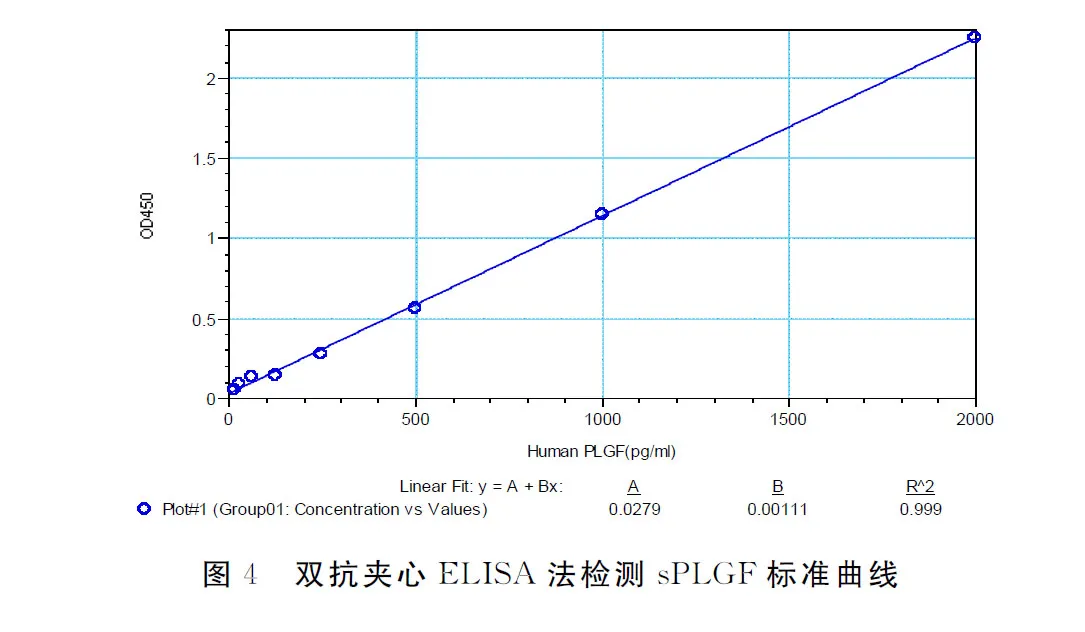

表1 双抗夹心ELISA法检测sPLGF的标准曲线及线性相关系数
图4 双抗夹心ELISA法检测sPLGF标准曲线
2.5准确度及批内精密度
标准曲线的ULOQ、LLOQ样品准确度为80%~120%,批次内平行组间CV均≤15%;标准曲线范围内的高、中、低浓度样品的准确度均在配制浓度的85%~115%,批次内平行组间精密度(CV)均≤10%(表2)。高(1500pg/ml)、中(500pg/ml)、低(50pg/ml)浓度的sPLGF 检测结果分别为1438.7±213.2、469.4±62.8 、42.9±6.2 pg/ml,准确度分别为95.9%、93.9%、85.8%,均在配制浓度的85%~115%;批次间平行组的CV分别为14.8%、13.3%、14.5%,均≤15%。

表2 双抗夹心ELISA检测sPLGF的准确度及批次内精确度
2.6 样品基质
正常人血清或尿液基质不会影响sPLGF与抗PLGF抗体之间的结合,能形成良好线性关系,表明样品基质对sPLGF检测结果无明显影响(图5)。
2.7 样品前处理
方法B处理后不同浓度样品(S1、S2、S3)的检测准确度均在配制浓度的85%~115%,批次内平行组间CV均≤10%,检测值的准确度和批次内CV均优于另外两种方法,确定方法B为样品合适的处理方式(图6,表3)。
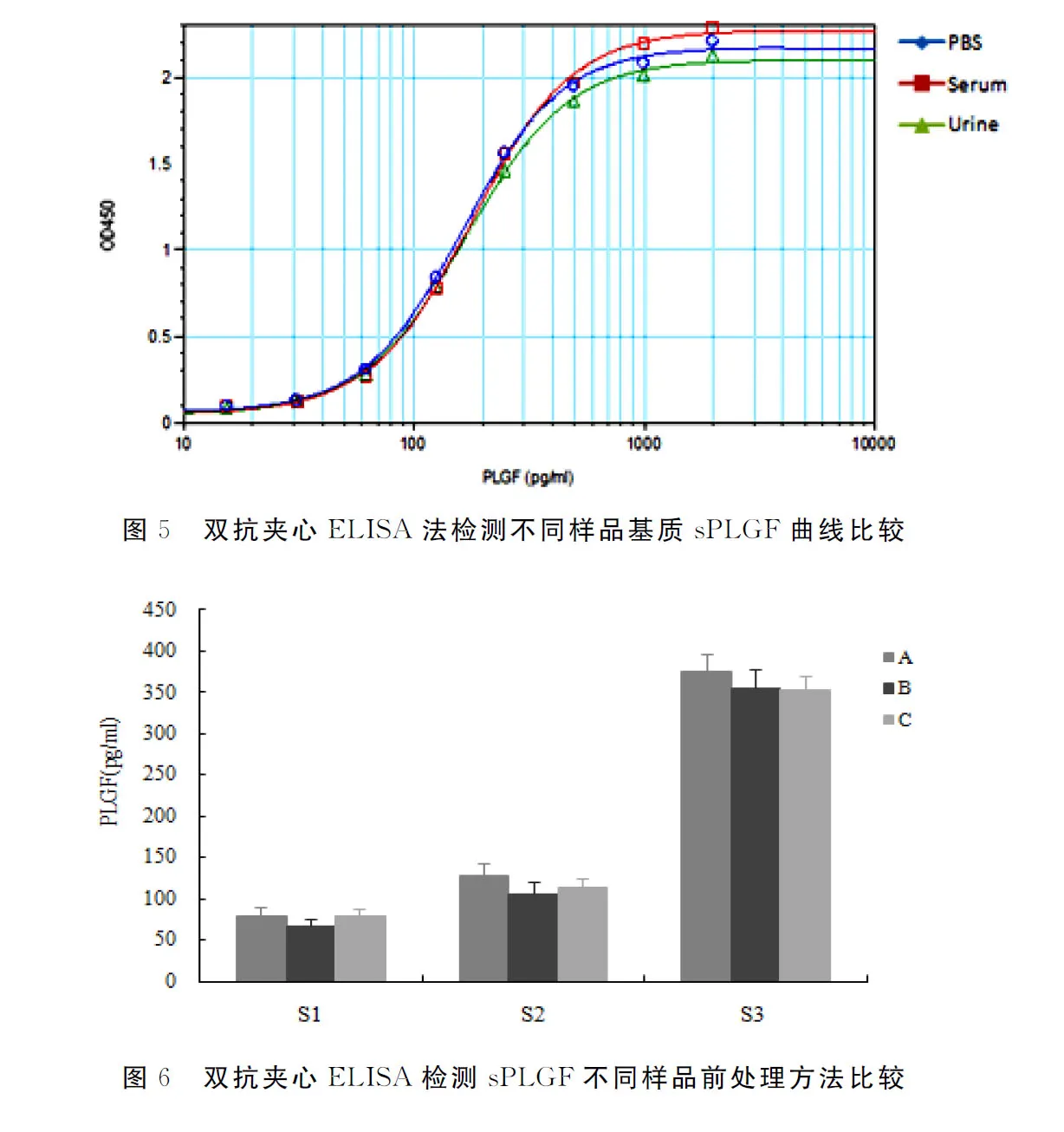
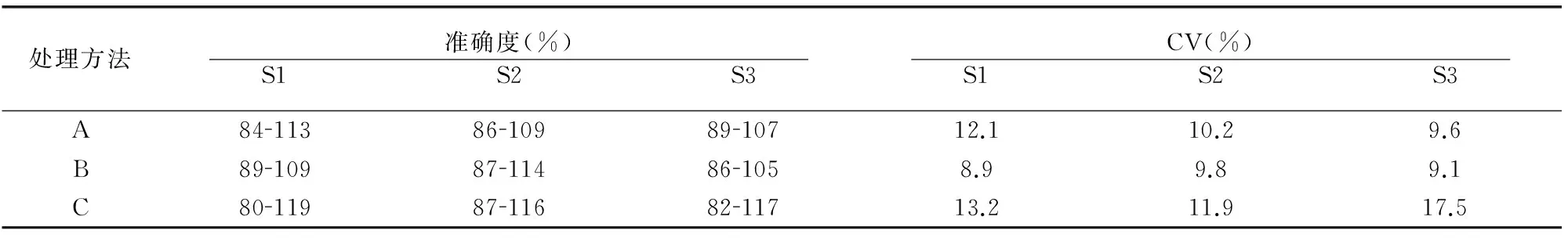
表3 双抗夹心ELISA法检测sPLGF不同前处理方法检测性能比较
2.8 检测性能
研发试剂盒和进口试剂盒检测样品均为细胞上清、血清、血浆、尿液及组织匀浆,在检测sPLGF的准确度、批次间精密度、样品范围及操作时间等指标方面相当,且sPLGF检测线性范围比进口试剂盒更广,检测费用更低(表4)。

表4 研发试剂盒与进口试剂盒检测性能比较
3 讨论
血清sPLGF水平检测已不局限于高危人群先兆子痫的预测,有研究发现孕早期sPLGF水平降低与胎儿宫内发育迟缓、非整倍体染色体胎儿显著相关[15-18]。在唐氏综合征筛查中,增加血清sPLGF检测指标可提高目前采用的母血清人绒毛膜促性腺激素β亚单位(β-hCG)、妊娠相关血浆蛋白A(PAPP-A)等检测方法的灵敏度[19,20]。此外,卵巢子宫内膜异位症、多囊卵巢综合征患者卵泡液sPLGF水平的变化也拓展了sPLGF检测技术在其它疾病诊断中的应用[20]。
本研究应用二步法双抗体夹心ELISA的原理,通过系统的方法学研究,建立了一种定量检测人血清和尿液中sPLGF的夹心ELISA检测试剂盒,确定了参数标准,包括捕获抗体最适包被量(400ng/well)、检测抗体最适工作浓度(1μg/ml)、样品孵育最适反应条件(37℃孵育2h)、适合的封闭液及样品稀释液组合(3%BSA-PBS和0.1%BSA-PBS)等。本研究也发现,临床收集的血清及尿液样本若不进行前处理则会影响检测结果,尤其造成某些样品的假阳性,如血清样品发生轻度及以上的溶血现象,尿液样品出现絮状沉淀,均可能造成检测的假阳性。但对血清以及尿液采取离心、沉降、pH调整等适当处理,可完全避免了假阳性的发生。
总之,研制的试剂盒性能测试表明,检测线性浓度范围广(15.6~2000pg/ml),准确度较高(85%~115%),检测数据稳定性良好(批次内变异系数CV≤10%,批次间变异系数CV≤15%)。检测性能包括准确度、精密度、样品范围及操作时间等方面指标与进口试剂盒相当,且具有检测适合范围更广、价格更低等优势,可用于临床检测血液及尿液中的内源性sPLGF水平。
[1] Zucchini C, De Sanctis P, Facchini C, et al. Performance of Circulating Placental Growth Factor as A Screening Marker for Diagnosis of Ovarian Endometriosis: A Pilot Study[J]. Int J Fertil Steril, 2016, 9(4):483-489.
[2] Maglione D, Guerriero V, Viglietto G, et al. Two alternative mRNAs coding for the angiogenic factor, placenta growth factor (PlGF), are transcribed from a single gene of chromosome 14 [J]. Oncogene, 1993, 8(4): 925-931.
[3] Khaliq A, Li X F, Shams M, et al. Localisation of placenta growth factor (PlGF) in human term placenta [J]. Growth Factors, 1996, 13(3-4): 243-250.
[4] Vuorela P, Hatva E, Lymboussaki A, et al. Expression of vascular endothelial growth factor and placenta growth factor in human placenta [J]. Biol Reprod, 1997, 56(2):489-494.
[5] Espinoza J, Romero R, Nien JK, et al. Identification of patients at risk for early onset and/or severe preeclampsia with the use of uterine artery Doppler velocimetry and placental growth factor [J]. Am J Obstet Gynecol, 2007, 196(4):326.1-13.
[6] Cetin I, Mazzocco MI, Giardini V, et al. PLGF in a clinical setting of pregnancies at risk of preeclampsia and/or intrauterine growth restriction [J].J Matern Fetal Neonatal Med, 2016,19:1-6.
[7] Signore C, Mills JL, Qian C, et al. Circulating angiogenic factors and placental abruption [J]. Obstet Gynecol, 2006, 108(2):338-344.
[8] Kusanovic JP, Romero R, Chaiworapongsa T, et al. A prospective cohort study of the value of maternal plasma concentrations of angiogenic and anti-angiogenic factors in early pregnancy and midtrimester in the identification of patients destined to develop preeclampsia [J]. J Matern Fetal Neonatal Med, 2009, 22(11):1021-1038.
[9] Romero R, Nien JK, Espinoza J, et al. A longitudinal study of angiogenic (placental growth factor) and anti-angiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor-1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate [J]. J Matern Fetal Neonatal Med, 2008, 21(1):9-23.
[10] Levine RJ, Maynard SE, Qian C, et al. Circulating angiogenic factors and the risk of preeclampsia [J]. N Engl J Med, 2004, 350(7):672-683.
[11] Hagmann H, Thadhani R, Benzing T, et al. The promise of angiogenic markers for the early diagnosis and prediction of preeclampsia [J]. Clin Chem, 2012, 58: 837-845.
[12] Baumann MU, Bersinger NA, Surbek DV. Serum markers for predicting pre-eclampsia [J]. Mol Aspects Med, 2007, 28(2):227-244.
[13] Myers JE, Kenny LC, McCowan LM, et al. Angiogenic factors combined with clinical risk factors to predict preterm pre-eclampsia in nulliparous women: a predictive test accuracy study [J]. BJOG, 2013,120 (10):1215-1223.
[14] Aggarwal PK, Jain V, Sakhuja V, et al. Low urinary placental growth factor is a marker of pre-eclampsia [J]. Kidney Int, 2006, 69(3):621-624.
[15] Zaragoza E, Akolekar R, Poon LC, et al. Maternal serum placental growth factor at 11-13 weeks in chromosomally abnormal pregnancies[J]. Ultrasound Obstet Gynecol. 2009 Apr; 33(4):382-386.
[16] Nicolaides KH, Syngelaki A, Poon LC, et al. First-trimester contingent screening for trisomies 21, 18 and 13 by biomarkers and maternal blood cell-free DNA testing[J]. Fetal Diagn Ther, 2014, 35(3):185-192.
[17] Wright D, Syngelaki A, Bradbury I, et al. First-trimester screening for trisomies 21, 18 and 13 by ultrasound and biochemical testing[J]. Fetal Diagn Ther, 2014; 35(2):118-126.
[18] Nucci M, Poon LC, Demirdjian G, et al. Maternal serum placental growth factor (PLGF) isoforms 1 and 2 at 11-13 weeks' gestation in normal and pathological pregnancies[J]. Fetal Diagn Ther, 2014; 36(2):106-116.
[19] Kagan KO, Hoopmann M, Abele H, et al. First-trimester combined screening for trisomy 21 with different combinations of placental growth factor, free β-human chorionic gonadotropin and pregnancy-associated plasma protein-A [J]. Ultrasound Obstet Gynecol, 2012, 40(5):530-535.
[20] Han J, Li DZ. Maternal serum PLGF (placental growth factor) in Chinese women in the first trimester undergoing screening for Down syndrome[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 201:166-170.
[21] Tal R, Seifer DB, Grazi RV, et al. Follicular fluid placental growth factor is increased in polycystic ovarian syndrome: correlation with ovarian stimulation[J]. Reprod Biol Endocrinol. 2014, 12:82.
[责任编辑:张 璐]
Performance analysis of a ELISA kit for detection of soluble placental growth factor
Zhang Sheng1, Gao Xiaoping2, Lu Hua2, Liu Xiaozhang2,*
1.SichuanUniversity,WestChinaCollegeofPreclinicalMedicineandForensicMedicine(610041); 2.SichuanInstituteofPopulationandFamilyPlanning
Objective: To develop an ELISA kit for detecting soluble placental growth factor (sPLGF) in human serum and urine, and analyze its performance. Methods: A specific monoclonal antibody to human sPLGF was pre-coated onto a microplate. Recombinant sPLGF and biotin-conjugated detection antibody were added to form a complex. A streptavidin HRP was covalently linked to the detection antibody, allowing for a colorimetric reaction in the presence of substrate TMB. The performance index of the kit, including line range, accuracy, intra-assay precision, inter-assay precision, sensitivity, and sample substrate and preprocessing were detected and compared with an imported commercial kit (R&D). Results: The optimal coating amount of capture antibody was 400 ng/well of the ELISA kit. The coating conditions were as following: the wells were pre-coated at 4℃ for 16-20 hours; the optimum working concentration of the detection antibody was 1μg/ml; the samples were incubated at 37℃ for 2 hours; and the best blocking buffer and assay diluents were 3% BSA/ PBS or 0.1% BSA/PBS buffer. The detection and quantification of human sPLGF was verified within the range of 15.6-2000 pg/ml. The linearity of the assay was 85%-115%. The intra-assay and inter-assay variability with coefficients of variation were ≤ 10 % and ≤15%, respectively. The performance was comparable to the commercial kit (R&D) with a good consistency in most aspects as line range, recovery, precision and sensitivity and sample scope of application. Conclusion: The developed human sPLGF ELISA kit realizes the quantitative measurement of endogenous sPlGF level in human serum and urine samples. This quantitative immunoassay kit is stable and reliable with advantages of wider testing range and lower cost compared to the imported kit, which can be used clinically to determine human sPLGF in serum and urinary.
Placental growth factor, Sandwich ELISA, Detection Kit, Performance analysis
四川省科研院所科技成果转化资金项目(13010137)
2016-06-14
2016-10-12
10.3969/j.issn.1004-8189. 2016.12
*通讯作者:hilda_xiaozhangliu@163.com
*Correspondingauthor:Email:hilda_xiaozhangliu@163.com
