脑蛋白水解物治疗阿尔茨海默病的研究进展
2016-07-24邓湘俊黄夏梦左长京余鹏王霆
邓湘俊,黄夏梦,左长京,余鹏,王霆Δ
(1.中南大学药学院,湖南 长沙 410013;2.广州一品红制药有限公司,广东 广州 510760;3.第二军医大学附属长海医院 核医学科,上海 200433)
脑蛋白水解物治疗阿尔茨海默病的研究进展
邓湘俊1,2,黄夏梦2,左长京3,余鹏1,王霆1,2Δ
(1.中南大学药学院,湖南 长沙 410013;2.广州一品红制药有限公司,广东 广州 510760;3.第二军医大学附属长海医院 核医学科,上海 200433)
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性中枢神经系统退行性疾病。该病起病缓慢,早期典型表现为判断力下降、缺乏主动性、喜怒无常等,临床表现以记忆力减退、认知功能障碍为主。脑蛋白水解物为一种通过无脂质猪脑蛋白的标准化酶分解得到的神经营养性多肽混合物,富含多种氨基酸、小分子多肽以及镁、磷、硒等多种元素。多项研究显示脑蛋白水解物能显著改善AD患者的记忆、焦虑、疲劳、眩晕等症状。本文对脑蛋白水解物治疗阿尔茨海默病的研究进展进行了综述,为脑蛋白水解物的综合开发与临床应用提供参考。
阿尔茨海默病;脑蛋白水解物;研究进展
阿尔茨海默病(Alzheimer’s disease,AD)为原发退行性脑变性疾病,病程缓慢但不可逆,临床表现以智能损害为主。随着我国社会人口老龄化的不断发展,AD患病率呈快速上升趋势,AD对老年人的身体健康与生活质量造成严重影响,已成为我国重大的家庭和社会问题[1-4]。
脑蛋白水解物为一种神经营养性多肽混合物,可通过无脂质猪脑蛋白的标准化酶分解获得。脑蛋白水解物中游离氨基酸约占75%,低分子量(<10 K)多肽约占25%,富含镁、钾、磷、硒等多种元素[5-7]。脑蛋白水解物治疗阿尔茨海默病的疗效显著,多项研究显示脑蛋白水解物能显著改善患者的记忆、疲劳、眩晕、焦虑等症状[8-10]。本文对脑蛋白水解物治疗阿尔茨海默病的研究进展进行了综述,为脑蛋白水解物的进一步综合开发与临床应用提供参考。
1 阿尔茨海默病(Alzheimer’s disease,AD)
AD为一种慢性中枢神经系统退行性疾病,迄今为止其发病原因尚不确切,可能因素主要包括躯体疾病(癫痫、甲状腺及免疫疾病等)、头部创伤、家族遗传、独居、经济困难等。AD的发病机制比较复杂,目前主要认为有β-淀粉样蛋白毒性机制和某些蛋白被异常修饰机制[11-14]。
β-淀粉样蛋白能诱发神经系统炎症变化而产生特异毒性。研究显示β-淀粉样蛋白大量沉积于AD患者脑部形成淀粉样蛋白斑,β-淀粉样蛋白所致神经元纤维缠结和细胞死亡则会引起患者记忆减退、意识模糊[15]。动物实验显示β-淀粉样蛋白在细胞内沉积能引起AD,但沉积于细胞外则不引发该病[16]。高脂饮食会导致机体抗氧化能力降低,而机体抗氧化能力降低能促使β-淀粉样蛋白生成增多进而诱发AD;低密度脂蛋白相关受体1(low density lipoprotein receptor-related protein 1,LRP1)可通过间接作用快速内吞淀粉样蛋白前体蛋白(amyloid precursorprotein,APP),进而促进β-淀粉样蛋白生成可能导致AD的最终发生[17-19]。
Tau蛋白是广泛存在于神经细胞中的微管相关蛋白,正常生理条件下的Tau蛋白与微管蛋白结合后能有效促进微管形成,Tau蛋白还可参与调节神经细胞轴突内的物质运输[20]。AD发生过程中的Tau蛋白受多种因素影响而过度磷酸化,使其丧失有效聚合力并引发神经原纤维缠结,最终导致微管与突触功能障碍以及神经元的不可逆损伤[21]。

图1 β-淀粉样蛋白及Tau蛋白与阿尔茨海默病(AD)[22]Fig.1 Amyloid-β protein&Tau proteinand Alzheimer’s disease
β-淀粉样蛋白与Tau蛋白之间存在重要联系。β-淀粉样蛋白和Tau蛋白可相互作用,分别产生淀粉样沉积斑和神经元纤维缠结,导致正常神经细胞发生病变甚至凋亡。β-淀粉样蛋白沉积引发Tau蛋白发生病变,而Tau病变则以反馈机制促进β-淀粉样蛋白沉积,形成恶性循环[22]。见图1。糖原合酶3β(glycogen synthase3β,GSK-3β)是Tau蛋白磷酸化的关键酶,β-淀粉样蛋白能有效提高GSK-3β的活性并促进其表达,导致Tau蛋白过度磷酸化[23]。
2 基础研究
脑蛋白水解物为具有神经营养作用的多肽混合物,可通过抑制β-淀粉样蛋白的生成与沉积,以及对神经细胞的保护,改善AD神经退行性病变。
Torrance等[24]建立模拟AD神经病理的淀粉样前体蛋白APP转基因小鼠模型(3月龄),对脑蛋白水解物的神经保护作用与减少β-淀粉样蛋白作用的机制进行研究。结果显示治疗6个月后,与对照组小鼠腹腔注射生理盐水5 mL/(kg·d)相比,治疗组小鼠腹腔注射脑蛋白水解物5 mL/(kg·d)水迷宫空间学习表现显著改善,且其大脑中异常性突触和淀粉样蛋白明显减少,这些效应与APP全链及C末端片段的水平降低相关,脑蛋白水解物能降低磷酸化APP水平及APP在神经炎过程的积累。脑蛋白水解物通过对APP成熟过程及其向β-淀粉样蛋白形成位点转运过程的调节,减少β-淀粉样蛋白的生成和沉积,改善APP转基因模型小鼠的AD样病理状态。
Rockenstein等[25]建立THY-1启动子控制表达突变APP的AD小鼠模型,研究脑蛋白水解物促进模型小鼠(3月龄)齿状回(dentate gyrus,DG)海马颗粒下层区域神经再生的可能机制。结果表明,经脑蛋白水解物治疗,周期为3个月,腹腔注射剂量为5 mL(kg·d)的APP转基因小鼠的海马神经出现显著恢复,并在增强突触形成和改善记忆方面发挥重要作用。脑蛋白水解物通过保护神经母细胞、降低细胞凋亡率,改善APP转基因小鼠的神经变异。
脑蛋白水解物对AD的疗效在治疗中断后仍然存在,该机制可能涉及脑蛋白水解物的神经营养因子样活性。Rockenstein等[26]通过人淀粉样前体蛋白(human amyloid precursor protein,hAPP)转基因AD小鼠模型(3月龄),研究脑蛋白水解物(活性组分浓度为215.2 mg/mL)治疗AD,模型小鼠腹腔注射剂量为5 mL/(kg·d),周期为3个月,中断的后效应。结果显示,治疗中断3个月后脑蛋白水解物改善模型小鼠的水迷宫记忆障碍及神经退行性病变的效应仍然存在,并持续到治疗中断6个月后才完全消失;免疫组化分析表明,治疗中断3个月后模型小鼠的新皮层和海马体内淀粉样斑块负荷减少的效应不再明显,这也提示脑蛋白水解物对β淀粉样蛋白沉积的影响与治疗中断后存在的疗效是相对独立的。
脑蛋白水解物的神经营养作用可能涉及调节促神经生长因子/神经生长因子的平衡,以及对胆碱能神经元的保护。Ubhi等[27]建立hAPP转基因AD小鼠模型(3月龄),研究脑蛋白水解物对神经营养因子的作用,主要包括神经生长因子(nerve growth factor,NGF)等。免疫组化分析显示治疗3个月后,与对照组小鼠腹腔注射生理盐水剂量为5 mL/(kg·d)相比,经脑蛋白水解物治疗,活性组分浓度为215.2 mg/mL,腹腔注射剂量为5 mL/(kg·d)的小鼠海马内NGF免疫反应显著增加,NGF水平明显升高;小鼠经脑蛋白水解物治疗后,其基底核胆碱能神经细胞缺陷得到明显改善。
神经干细胞(Neural stem cells,NSCs)移植作为治疗AD的潜在方式受到广泛关注,但其应用的最大障碍是移植细胞成活率偏低。Rockenstein等[28]通过APP转基因AD小鼠模型(3月龄)考察脑蛋白水解物作为神经干细胞治疗的辅助剂的疗效。结果显示治疗周期结束后(分别为3、6、9个月),与对照组腹腔注射生理盐水剂量为5 mL/(kg·d)相比,经脑蛋白水解物治疗,活性组分浓度为215.2 mg/mL,腹腔注射剂量为5 mL/(kg·d)的转基因小鼠及非转基因小鼠的神经干细胞移植存活率均有显著提高,且神经干细胞的脑源性神经营养因子(BDNF)和蛋白免疫反应明显增多;提示脑蛋白水解物能保护移植的神经干细胞,可考虑作为治疗AD的神经干细胞移植术的有效辅助应用。
3 临床研究
3.1 单独用药治疗 脑蛋白水解物改善轻度至中度AD患者的认知功能障碍及综合临床症状疗效显著,展现出较好的效益风险比[29]。
一项有关脑蛋白水解物有效性与安全性的随机、双盲、安慰剂对照研究中[30],269名受试者分别接受脑蛋白水解物治疗(包括3个剂量组:10 mL组69例,30 mL组70例,60 mL组71例)和安慰剂治疗(69例),治疗周期共12 w,其中前4 w内受试者均接受5天/周既定剂量静脉输液给药,后8 w内为2天/周既定剂量静脉输液给药。采用临床医生印象变化量表(clinician interview based impression of severity,CIBIC+)和AD评估量表的认知功能次级量表(Alzheimer’s disease assessment scale-cognitive,ADAS-cog)评价疗效。结果显示自开始给药24w时,10 mL剂量组的认知功能改善(ADAS-cog,P=0.38)及综合症状恢复(CIBIC+,P>0.001)均较显著,30 mL和60 mL剂量组综合恢复明显,但认知功能改善并不显著,未出现严重不良反应。
孙颖[31]对脑蛋白水解物治疗老年痴呆症的临床疗效进行了观察。40例老年痴呆症患者随机分为治疗组(男12例,女8例,平均年龄78岁)和对照组(男11例,女9例,平均年龄77岁),2组一般资料无显著差异。治疗组应用脑蛋白水解物片(4片/次),对照组应用脑复康(0.8 g/次),2组服药均为3次/天(早、中、晚各1次空腹口服),服药时间均为1年以上。采用受试者的临床表现、简易智力评定量表、日常生活能力评定量表等指标评定疗效。结果显示:治疗组显效10例,有效8例,无效2例,总有效率为90%;对照组显效8例,有效7例,无效5例,总有效率为75%。2组临床疗效比较,治疗组疗效优于对照组,差异有统计学意义(P<0.01)。
3.2 联合用药治疗 表1为脑蛋白水解物治疗阿尔茨海默病(Alzheimer’s disease,AD)的部分临床研究,采用简易精神状态量表(minimum mental state examination,MMSE)、临床痴呆程度量表(clinicaldementiarating,CDR)、日常生活能力量表(activities of daily living,ADL)以及生活质量量表(quality of life)的评分对治疗效果进行评价。

表1 脑蛋白水解物治疗AD临床研究±s)Tab.1 Clinical study of cerebrolysin in the treatment of ±s)
治疗周期结束后,各实验组的MMSE、CDR、ADL和QOL评分均有明显改善,且与各对照组的相关表评分之间存在显著差异(P<0.05)。张媛媛[36]还通过蒙特利尔认知评估表(montrealcognitive assessment,MoCA)评价脑蛋白水解物的疗效,结果显示治疗后的研究组MoCA评分(25.23±4.72)显著优于对照组(19.85±2.73)(P<0.05)。见表1。
表2为脑蛋白水解物治疗AD的部分临床研究,参照MMSE评价治疗效果。MMSE评价标准:①基本控制(治疗后评分接近满分),②显效(治疗后评分提高≥30%),③有效(治疗后评分提高≥15%),④无效(治疗后评分提高<15%),⑤总有效率=(基本控制例数+显效例数+有效例数)/总例数×100%。
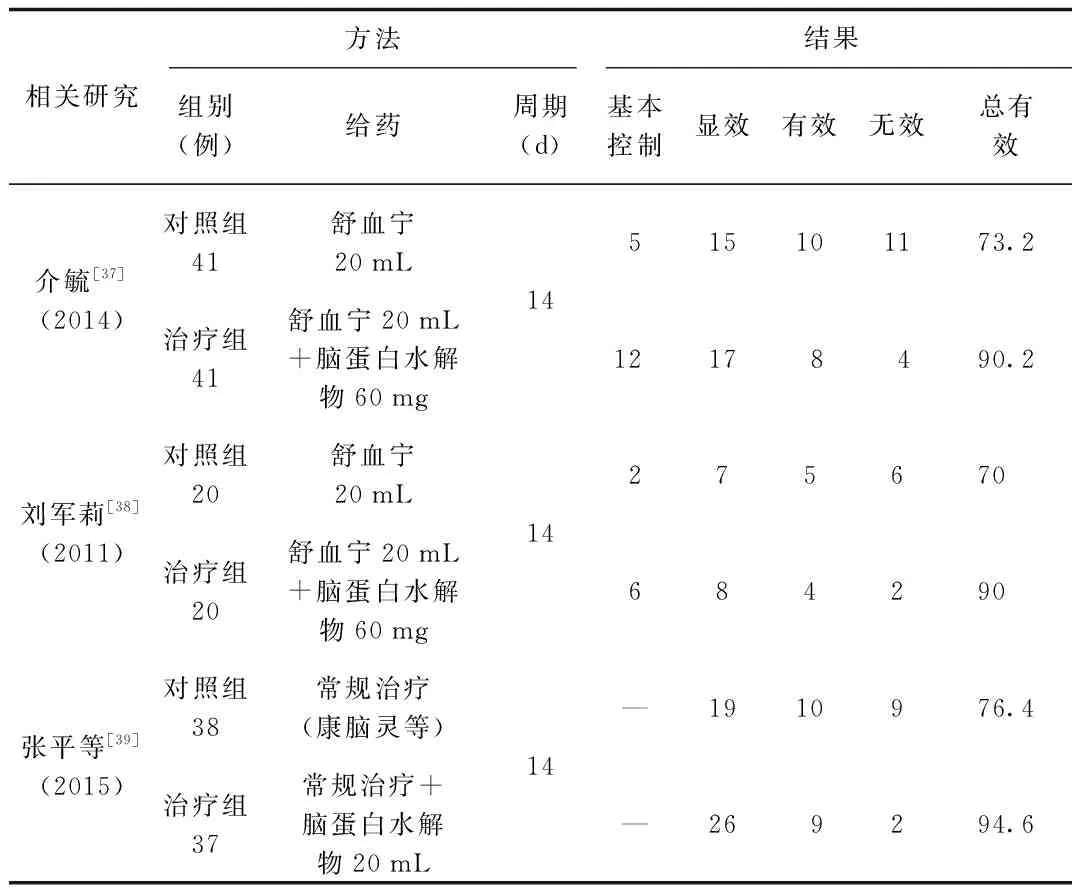
表2 脑蛋白水解物治疗AD临床研究(n,%)Tab.2 Clinical study of cerebrolysin in the treatment of AD(n,%)
治疗周期结束后,各治疗组的总有效率均显著优于各对照组(P<0.05)。见表2。
56例老年痴呆患者接受胞二磷胆碱联合脑蛋白水解物治疗(14 d)后的认知功能改善总有效率达94.6%[40],36例老年痴呆患者接受脑蛋白水解物合并马来酸桂派齐特注射液治疗(疗程14天/月,共5个疗程)后的认知和记忆改善总有效率达86.1%[41],治疗过程中及治疗后均未出现肝肾功能及胃肠道等的不良反应。
Alvarez等[42]对脑蛋白水解物和多奈哌齐各自单独及联合用药治疗轻、中度AD的疗效进行了研究,治疗28 w后的结果显示各治疗组之间在认知功能和行为领域的改善无显著性差异,但脑蛋白水解物治疗组和联合用药治疗组的CIBIC+评分(总体疗效评价)改善更明显,表明脑蛋白水解物与多奈哌齐对AD疗效一致且安全可靠,脑蛋白水解物与多奈哌齐联合用药可能存在的长期协同作用需要进一步的研究确证。
4 结语
阿尔茨海默病(Alzheimer’s disease,AD)为一种神经系统退行性疾病,迄今为止其发病机制尚未完全阐明。AD不仅严重影响患者个人生活质量,也给其家庭及社会造成巨大的精神和经济负担,随着社会老龄化的加快发展,AD发病形势愈加严峻。脑蛋白水解物是猪脑组织经标准化酶分解得到的活性水解物,含有多种游离氨基酸、低分子多肽及微量元素。多项研究表明,脑蛋白水解物可调节神经元代谢和改善神经细胞损害,能显著改善AD患者的认知功能、记忆力、生活能力,提高患者的生活质量[43-46]。脑蛋白水解物治疗AD疗效确切,安全可靠,具有较高的临床应用价值,值得进一步的综合开发与利用。
[1] 李修英,潘雨利,邵立平,等.离退休老干部老年痴呆症患病情况及相关影响因素[J].中国老年学杂志,2014,34(12):3413-3416.
[2] 程娟,徐娜娜,马英霞,等.北京地区阿尔茨海默病及认知障碍流行病学调查及相关危险因素分析[J].宁夏医科大学学报,2014,36(3):320-323.
[3] 李秋琴.2013年我地区老年痴呆流行病学调查分析[J].浙江中医药大学学报,2014,38(5):654-656.
[4] 陈一新,李继娥,王中衡,等.南昌地区老年痴呆流行病学调查[J].江西医药,2013,48(9):837-838.
[5] Hartbauer M,Hutter-Paier B,Skofitsch G,et al.Antiapoptotic effects of the peptidergic drug Cerebrolysin onprimary cultures of embryonic chick cortical neurons[J].J Neural Transm,2001,108(4):459-473.
[6] Liu W,Leng H,Zhu Z,et al.Analysis of the content of ten kinds of metal elements in cerebrolysin by atomic absorption spectrophotometry[J].Guang Pu Xue Yu Guang Pu Fen Xi,2001,21(3):397-399.
[7] Gromova OA,Kudrin AV,Kataev SI,et al.Effects of cerebrolysin on trace element homeostasis in the brain[J].Zh Nevrol Psikhiatr Im S S Korsakova,2003,103(11):59-61.
[8] 张道东,王秀英.脑蛋白水解物注射液治疗阿尔兹海默病的临床研究[J].中国药业,2006,15(15):27-28.
[9] Panisset M,Gauthier S,Moessler H,et al.Cerebrolysin in Alzheimer’s disease:a randomized,double-blind,placebo-controlled trial with a neurotrophic agent[J].J Neural Transm,2002,109(7-8):1089-1104.
[10] Alvarez XA,Alvarez I,Iglesias O,et al.Synergistic Increase of Serum BDNF in Alzheimer Patients Treated with Cerebrolysin and Donepezil:Association with Cognitive Improvement in ApoE4 Cases[J].Int J Neuropsychoph,2016,19(6):1-6.
[11] 宋昕,洪羽蓉,胡秋莹.阿尔兹海默病发病原因及机制的研究进展[J].临床和实验医学杂志,2015,14(10):871-873.
[12] 张若辰,许艳萍.阿尔兹海默病相关机制研究进展[J].中国医学工程,2014,22(7):191-193.
[13] 闫蓉,常翔,杨从,等.阿尔兹海默病β淀粉样蛋白形成和沉积的发病机制及中医药干预的可能途径[J].中药新药与临床药理,2013,24(6):629-632.
[14] 范月丹,张娴,曾乐平,等.Tau蛋白在阿尔兹海默病治疗中的研究进展[J].现代生物医学 进展,2015,15(33):6596-6600.[15] Livingston G,Barber J,Rapaport P,et al.START(STrAtegies forRelaTives) study:a pragmatic randomised controlled trial to determinethe clinical effectiveness and cost- effectiveness of a manual-basedcoping strategy programme in promoting the mental health of carers ofpeople with dementia[J].Health Technol Assess,2014,18(61):1-242.
[16] Kayyali A,Singh Joy SD.The Role of the Pesticide DDE in Alzheimer’s Disease[J].Am J Nurs,2014,114(7):56.
[17] Hoane MR,Swan AA,Heck SE.The Effects of a High-Fat Sucrose Diet on Functional Outcome Following Cortical Contusion Injury in the Rat[J].Behav Brain Res,2011,223(1):119-124.
[18] Sutcliffe JG,Hedlund PB,Thomas EA,et al.Peripheral reduction of β-amyloid is sufficient to reduce brain β-amyloid:implications for Alzheimer’s disease[J].J Neurosci Res,2011,89(6):808-814.
[19] 熊杰,白生华,徐万清,等.阿尔兹海默病患者血清C反应蛋白、载脂蛋白E和同型半胱氨酸检测的临床意义分析[J].中国卫生检验杂志,2011,21(8):1987-1989.
[20] Kuznetsov IA,Kuznetsov AV.What tau distribution maximizes fastaxonal transport toward the axonal synapse?[J].Math Biosci,2014,253:19-24.
[21] Medina M,Avila J.New perspectives on the role of tau in Alzheimer’s disease.Implications for therapy[J]. Biochem Pharmacol,2014,88(4):540-547.[22] Bloom GS.Amyloid-β and Tau:the trigger and bullet in Alzheimerdisease pathogenesis[J].JAMA Neurol,2014,71(4):505-508.
[23] Ramser EM,Gan KJ,Decker H,et al.Amyloid-β oligomers inducetau-independent disruption of BDNF axonal transport via calcineurinactivation in cultured hippocampal neurons[J].MolBiol Cell,2013,24(16):2494-2505.[24] Torrance M,Rockenstein E,Mante M,et al.Cerebrolysin Decreases Amyloid-βProduction by Regulating Amyloid ProteinPrecursor Maturation in a TransgenicModel of Alzheimer’s Disease[J].J Neurosci Res,2006,83(7):1252-1261.
[25] Rockenstein E,Mante M,Adame A,et al.Effects of Cerebrolysin? on neurogenesis in an APP transgenic model of Alzheimer’s disease[J].Acta Neuropathol,2007,113(3):265-275.
[26] Rockenstein E,Ubhi K,Pham E,et al.Beneficial effects of a neurotrophicpeptidergic mixture persistfor a prolonged period following treatment interruption in atransgenic model of Alzheimer’s disease[J].J Neurosci Res,2011,89(11):1812-1821.
[27] Ubhi K,Rockenstein E,Mante M,etal.Cerebrolysin Modulates Pronerve GrowthFactor/Nerve Growth Factor Ratio and Ameliorates the Cholinergic Deficit in a Transgenic Model of Alzheimer’s Disease[J].J Neurosci Res,2013,91(2):167-177.
[28] Rockenstein E,Desplats P,Ubhi K,et al.Neuro-peptide treatment with Cerebrolysinimproves the survival of neural stem cellgrafts in an APP transgenic model of Alzheimer disease[J].Stem Cell Res,2015,15(1):54-67.
[29] Gauthier S,Proao JV,Jia JP,et al.Cerebrolysin in Mild-to-Moderate Alzheimer’s Disease:A Meta-Analysis of Randomized Controlled Clinical Trials[J].Dement GeriatrCogn Disord,2015,39(5-6):332-347.
[30] Alvareza XA,Cacabelosa R,Laredo M,et al.A 24-week,double-blind,placebo-controlled study of three dosagesof Cerebrolysin in patients with mild to moderate Alzheimer’s disease[J].Eur J Neuro,2006,13(1):43-54.
[31] 孙颖.脑蛋白水解物治疗老年痴呆症[J].中国医学工程,2012,20(2):127.
[32] 李明秋,黄海华,牟鑫,等.脑蛋白水解物注射液治疗老年痴呆的疗效观察[J].中国老年学杂志,2011,31(7):1238-1239.
[33] 赖天赐.脑蛋白水解物注射液联合常规疗法治疗老年痴呆随机平行对照研究[J].实用中医内科杂志,2013,27(3):18-19.
[34] 李志云.脑蛋白水解物注射液治疗老年痴呆临床疗效观察[J].临床心身疾病杂志,2015,21(10):86-87.
[35] 李娜,李林文.脑蛋白水解物注射液治疗老年期痴呆的疗效观察[J].中国医药指南,2014,12(36):195-199.
[36] 张媛媛.脑蛋白水解物联合舒血宁治疗老年痴呆的疗效观察[J].当代医学,2015,21(21):140-141.
[37] 介毓.脑蛋白水解物联合舒血宁治疗老年痴呆疗效观察[J].中国实用医药,2014,9(2):178-179.
[38] 刘军莉.脑蛋白水解物联合舒血宁治疗老年痴呆疗效观察[J].药物与人,2014,27(7):61.
[39] 张平,王灵.脑蛋白水解物注射液治疗老年痴呆的疗效观察[J].吉林医学,2013,34(4):678-679.
[40] 潘均喜.胞二磷胆碱联合脑蛋白水解物治疗老年性痴呆56例[J].广西医学,2008,30(9):1404-1405.
[41] 余波.脑蛋白水解物合并马来酸桂派齐特注射液对老年痴呆的疗效观察[J].临床研究,2011,9(25):99-100.
[42] Alvarez XA,Cacabelos R,Sampedro C,et al.Combination Treatment in Alzheimer’s Disease:Results of a Randomized,Controlled Trial with Cerebrolysin and Donepezil[J].Current Alzheimer Res,2011,8(5):583-591.
[43] 于秀军,楯林義孝,郭力.脑蛋白水解物注射液改善阿尔兹海默病认知功能的机理探究[J].脑与神经疾病杂志,2010,18(2):89-92.
[44] 周贤刚,钟渠.脑蛋白水解物注射液治疗老年性痴呆疗效研究的系统评价[J].循证医学,2005,5(6):341- 345.
[45] 于明磊.脑蛋白水解物注射液治疗老年痴呆临床疗效观察[J].中外女性健康研究,2016,(14):20.
[46] Sharma HS,Muresanu DF,Sharma A.Alzheimer’s disease:cerebrolysin and nanotechnology as a therapeutic strategy[J].Neurodegener Dis Manag,2016,6(6):453-456.
(编校:薛雪)
Research progress of cerebrolysin in the treatment of Alzheimer’s disease
DENG Xiang-jun1,2, HUANG Xia-meng2, ZUO Chang-jing3, YU Peng1, WANG Ting1,2Δ
(1.Pharmaceutical College of Central South University, Changsha 410013, China; 2.Guangzhou Yipinhong Pharmaceutical CoLtd,Guangzhou 510760, China; 3.Department of Nuclear Medicine, Changhai Hospital Affiliated to Second Military Medical University, Shanghai 200433, China)
Alzheimer’s disease (AD) is a chronic degenerative disease of central nervous system.The disease onset slow,early typical performance for the decline in judgment,lack of initiative,moodiness,etc,clinical manifestations of memory loss, cognitive dysfunction based.Cerebrolysin is a akind ofneurotrophicpeptidegic mixture obtained by normalized enzymolysisof lipid-free porcine brain proteins,it is rich in various amino acids,small molecule polypeptide and various essential elements such as magnesium, phosphorus and selenium.Several studies have shown that cerebrolysin can significantly improve the memory,anxiety,fatigue,dizziness and other symptoms of AD patients.In this paper,the research progress of cerebrolysin in treatment of Alzheimer’s disease were reviewed to provide reference for the comprehensive development and clinical application of cerebrolysin.
Alzheimer’s disease; cerebrolysin; research progress
10.3969/j.issn.1005-1678.2016.11.060
邓湘俊,男,硕士在读,研究方向:药理学与临床药理学,E-mail:xiangjun5351@126.com;王霆,通信作者,男,博士,教授,研究方向:药理学研究及新药研发,E-mail:wt1965@qq.com。
R971
A
