不同浓度阿托品制剂治疗屈光不正患者的疗效及安全性
2016-07-24张晓瑾周磊
张晓瑾,周磊
(宁波市眼科医院 眼科,浙江 宁波 315040)
不同浓度阿托品制剂治疗屈光不正患者的疗效及安全性
张晓瑾,周磊Δ
(宁波市眼科医院 眼科,浙江 宁波 315040)
目的 探讨不同浓度阿托品制剂治疗屈光不正患者的疗效及安全性。方法 选取2014年4月~2015年8月宁波市眼科医院收治的近视性屈光不正患者123例,按随机数字表法分为3组,每组各41例,高浓度组予以0.1%硫酸阿托品滴眼液治疗,低浓度组予以0.01%硫酸阿托品滴眼液治疗,对照组给予人工泪液滴眼,观察1年后3组远视力、屈光度、眼压及眼轴长度变化状况。结果 治疗后,3组远视力差值比较,高浓度组>低浓度组>对照组(P<0.05);3组治疗前后屈光度、眼压、眼轴长度差值比较,对照组>低浓度组>高浓度组(P<0.05);低浓度组总有效率85.37%与高浓度组90.24%比较差异无统计学意义;高浓度组不良反应发生率21.95%与低浓度组4.88%比较,差异具有统计学意义(P<0.05)。结论 0.1%与0.01%浓度阿托品均有效控制近视性屈光不正屈光度、眼轴长度进展,进而提高远视力,前者效果更佳,后者安全性较高。
0.1%浓度阿托品制剂;0.01%浓度阿托品制剂;近视性屈光不正;安全性
近视是眼睛在调节放松状态下,目标物体发出的光线经眼球屈光系统屈光介质折射于视网膜之前成像的屈光状态。伴随科学技术发展及用眼压力的不断增加,近视逐渐呈现“低龄化”和“膨胀化”趋势,不仅使患者视觉质量降低,而且导致视网膜脱离、黄斑变性及青光眼等致盲性眼病发病率升高[1]。现阶段医学人员采用多种治疗方案,其中,非药物手段不能有效的控制屈光度、眼轴长度的进展,治疗效果具有极限性[2]。随着医学技术的发展,阿托品制剂成为公认的近视性屈光不正首选治疗药物,该制剂通过阻断眼内毒蕈碱受体控制近视进展及眼轴增长,疗效显著。据报道58%~96%青少年长期阿托品制剂局部应用能够降低近视度数的增长[3]。随着浓度增高,其作为毒蕈碱受体抑制剂抑制近视发展及眼轴增长的效果越明显,然而阿托品制剂应用后存在一定程度的不良反应,包括畏光、视近模糊等,限制其临床应用。阿托品制品所致不良反应的可能性与浓度呈一定相关性[4]。为探讨不同浓度阿托品制剂治疗近视性屈光不正患者的有效性和安全性,本研究选用浓度为0.1%与0.01%的阿托品制剂对123例近视性屈光不正患者进行研究,现报告如下。
1 资料与方法
1.1 一般资料 选取2014年4月~2015年8月宁波市眼科医院符合纳入标准且确诊为近视性屈光不正患者123例,按随机数字表法分为高浓度组、低浓度组和对照组,分别为41例。其中高浓度组男性23例,女性18例,年龄10~23岁,平均(17.13±3.72)岁,病程2~7年,平均(4.12±1.39)年;低浓度组男性24例,女性17例,年龄9~22岁,平均(16.87±3.89)岁,病程2~6年,平均(4.33±1.42)年;对照组男性22例,女性19例,年龄10~23岁,平均(17.22±3.21)岁,病程1~7年,平均(4.24±1.35)年;3组间性别、年龄及病程等基线资料比较差异无统计学意义。本研究经患者家长知情并签署知情同意书,经本院医学伦理委员会审核通过。
纳入标准:①符合《中华眼科学》[5]中近视性屈光不正的诊断及分类标准;②年龄9~23岁,性别不限;③积极配合此次研究;④具有正常思维和语言沟通交流能力,能够按要求治疗者;⑤无眼部急性炎症、干眼症、圆锥角膜、糖尿病等阿托品及角膜塑形镜治疗禁忌证。
排除标准:①年龄>23或<9岁;②合并心、肝、肾等全身系统疾病及遗传性近视者;③合并眼部外伤及显斜或手术眼、过敏性结膜炎等慢性眼病者;④既往存在内翻倒睫,严重的角、结膜感染等其他眼病者;⑤合并神经系统疾病及对阿托品药物或其他治疗药物存在过敏或禁忌症者;⑥癫痫,精神障碍不能正常交流者;⑦既往曾接受过其他控制近视发展或正参与其他研究者;⑧未遵医嘱用药,疗效判定不明确者。
1.2 方法
1.2.1 治疗方法:入组前停用其他原有治疗方案及对疗效有影响的药物,行常规生化、肾功离子检测,参照中华人民共和国国家卫生和计划生育委员会制定的《2013儿童眼及视力保健技术规范》[6],高浓度组予以0.1%硫酸阿托品滴眼液,低浓度组予以0.01%硫酸阿托品滴眼液。对照组仅给予人工泪液滴眼,缓解眼疲劳。晚睡前摇匀后滴双眼,滴药后双手压迫泪囊区5 min,1次/周,3组均治疗1年。对所有患儿家长强调按时用药的必要性,要求家长必须规范给患儿滴眼。禁食辛辣、刺激食物,注意治疗期间血压、呼吸、心率、尿量等状况。所有患儿均定期复诊,复诊中发现有外隐斜及融合功能不足者均终止试验。
1.2.2 阿托品配制方法:①0.1%阿托品配制方法:抽取1%阿托品眼液点眼液0.5 mL,注射入5 mL的人工泪液(思然ALCON,Alcon Laboratories,注册证号:H200110413)中,即为0.1%浓度的硫酸阿托品滴眼液;②0.01%阿托品配制方法:配制方法同上,抽取1%阿托品剂量为0.05 mL,注射入5 mL规格的人工泪液中,配制成0.01%浓度的阿托品滴眼液。
1.2.3 临床观测指标:观察并记录3组患者治疗前后远视力检查、屈光度、眼压、眼轴长度,主要采用IOLMaster光学生物测量仪[蔡司光学仪器(上海)国际贸易有限公司]、TopconRM8900电脑验光仪和TopconCV3000全自动综合验光仪(北京拓普康医疗器械有限公司)进行检查。①远视力检查:采用国际标准远视力表(5 m)检查,确保所用仪器、检查人员及光照条件不变,患者双眼须与视力表处于同一高度,对左、右2眼分别进行检查,遵循原则为先右后左,若患者无法辨别最大视标,医生可告知被测者向前移动位置,直至看清最大视标,此时视力=0.1×S(米)/5(米),S表示视力表与查验者的直线距离,左眼检测同右眼;②屈光度检查:应用0.5%阿托品膏睫状肌麻痹3 d后,采用视网膜检影验光,3 w后再用综合电脑验光仪(上海涵飞医疗器械有限公司)复验;③眼压测量:采用TopconCT80自动眼压仪(北京拓普康医疗器械有限公司)检测;④眼轴长度:采用眼科A超仪(南昌吾方医疗器械有限公司)测量眼轴,自动测量10次,取平均值并记录结果。
1.2.4 临床疗效:观察并记录2组患者临床治疗效果。疗效评价标准如下:显效为治疗后患者近视度数明显得到控制,屈光度变化值明显降低;进步为治疗后患者近视度数稍微得到控制,屈光度变化值稍有降低;无效为治疗后近视度数未得到控制或加重,屈光度变化值较大。有效率=(显效+进步)/本组总例数×100%。
1.2.5 安全性分析:治疗期间观察并记录用药2组患者不良反应状况,包括畏光、结膜炎等。

2 结果
2.1 3组患者远视力检查状况比较 与治疗前比较,低浓度组和高浓度组治疗后远视力显著升高(P<0.05);3组远视力差值比较,高浓度组>低浓度组>对照组(F=2.153,P<0.05)。见表1。

表1 3组患者治疗前后远视力比较±s)Tab.1 Comparison of distance vision among three groups before and after treatment ±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组比较,compared with control group;△P<0.05,与低浓度组比较,compared with low-concentration group
2.2 3组患者屈光度比较 与治疗前比较,对照组、低浓度组和高浓度组治疗后屈光度升高(P<0.05);3组治疗前后屈光度差值比较,对照组>低浓度组>高浓度组(F=2.321,P<0.05)。见表2。

表2 3组患者治疗前后屈光度比较±s)Tab.2 Comparison of diopter among three groups before and after treatment ±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组比较,compared with control group;△P<0.05,与低浓度组比较,compared with low-concentration group
2.3 3组患者眼压测量状况比较 与治疗前比较,对照组治疗后眼压升高(P<0.05);3组治疗前后眼压比较,对照组>低浓度组>高浓度组(F=2.418,P<0.05)。见表3。

表3 3组患者治疗前后眼压比较±s)Tab.3 Comparison of intraocular pressure among three groups before and after treatment ±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组比较,compared with control group;△P<0.05,与低浓度组比较,compared with low-concentration group
2.4 3组患者眼轴长度比较 与治疗前比较,对照组治疗后眼轴长度升高(P<0.05);3组治疗前后眼轴长度差值比较,对照组>低浓度组>高浓度(F=2.571,P<0.05)。见表4。

表4 3组治疗前后眼轴长度比较±s)Tab.4 Comparison of axial length among three groups before and after treatment ±s)
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组比较,compared with control group;△P<0.05,与低浓度组比较,compared with low-concentration group
2.5 2组用药组临床疗效比较 治疗后,低浓度组治疗总有效率85.37%与高浓度组90.24%比较无显著差异。见表5。
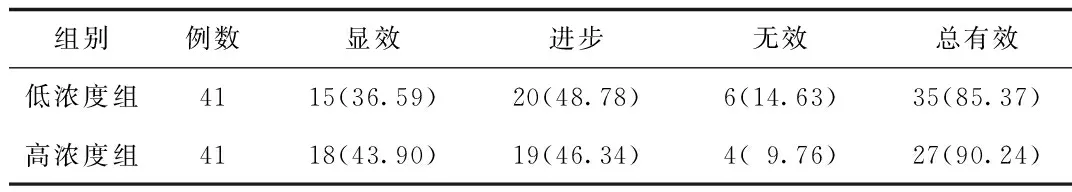
表5 2组临床疗效比较[n(%)]Tab.5 Comparison of clinical efficiency between two groups[n(%)]
2.6 安全性分析 所有患者均获得随访,无病例脱落现象,肝肾、离子等生化检查均正常,无严重不良事件出现,最佳矫正视力均未下降,学习均未受明显影响。高浓度组6例因瞳孔散大出现畏光,后减少或者停用阿托品,3例出现结膜炎,不良反应发生率21.95%(9/41);低浓度组有2例不能耐受,不良反应发生率4.88%(2/41),2组用药组不良反应发生率比较差异显著(χ2=5.145,P=0.023<0.05)。
3 讨论
现阶段,近视性屈光不正的治疗成为医学界关注的重点和眼科领域研究的热点,学龄期儿童的近视发病率将近50%~90%,随年龄增加患病率逐渐升高[7],严重影响青少年的正常生活,如果不及时控制甚至会增加眼病的风险。因此探讨近视性屈光不正的病变机制并及时进行控制对近视的治疗预后十分重要。近视的病因尚不明确,其中有一种学说为睫状肌过度调节学,长期近距离、高强度用眼者近视眼的发病率显著高于正常人,遗传、视觉环境和行为因素是儿童近视性屈光不正的危险因素[8-9]。随着对于近视性屈光不正机制研究进展,阿托品成为近视性屈光不正的首选药物,在近视性屈光不正的控制方面已经有几十年的临床经验,但是对于阿托品散瞳后导致的不良反应及阿托品使用浓度、频次和患者依从性之间的平衡尚未形成统一观点。胡延宁等[10]研究表明0.1%、0.01%不同浓度阿托品的长期作用时,高浓度的阿托品制剂对屈光度、眼轴长度的疗效较好,但不良反应及并发症随之增多,浓度降低时不良反应与并发症随之降低,疗效也有所不同。
眼睛具有自我调节作用,根据视物反应及功能等不同,调节的类型存在多种变化,可以针对不同刺激产生相应的外在表现,远视力、屈光度、眼压及眼轴长度均为眼睛调节能力的重要指标。研究表明正常眼视网膜和脉络膜上M受体十分丰富,对调控眼球的生长和眼轴的延长具有重要意义[11]。阿托品是非选择性的M受体阻断剂,通过拮抗睫状肌上的受体来麻痹睫状肌,使其放松调节,并解除调节张力从而起到治疗近视的作用[12]。叶凌颖等[13]动物实验发现在3%的浓度范围内,阿托品滴眼液能通过抑制玻璃体腔加深、眼轴延长从而部分抑制豚鼠形觉剥夺性近视的发生,其治疗青少年近视的疗效与阿托品的浓度有关,随着阿托品浓度升高,其治疗效果越显著。
由于阿托品对近视发生进展的控制机制也要求临床应用要谨慎,阿托品散瞳后所带来的不利影响(如畏光、视近模糊等)也较多[14],致使患者及家长难以坚持持久治疗,对本次研究结果进行分析,治疗1年后0.1%高浓度阿托品的不良反应远高于0.01%低浓度阿托品制品,总结原因有以下2点:一是阿托品本身具有一定的副作用;二是阿托品瞳孔散大后,光线进入眼内增,容易对视网膜和视神经产生中毒和光损伤。因此说明相对于0.1%高浓度阿托品,0.01%低浓度阿托品畏光、结膜炎发生率较低,对于近视性屈光不正安全性较高,患者耐受性及治疗依从性较高。
本次研究发现0.1%与0.01%浓度阿托品均有效控制近视性屈光不正屈光度、眼轴长度进展、提高远视力,前者效果更佳,后者安全性高,临床应用需要根据患者具体情况选择。关于阿托品制品长期用药浓度及用药方式等问题尚需要进一步研究证实。
[1] 何梦梅,杜亚茹,刘晴雨,等.角膜塑形镜治疗我国青少年低中度近视患者短期效果评价[J].国际眼科杂志,2016,16(2):237-241.
[2] 韩雯婷,徐蔚,荣翱.阿托品在儿童及青少年近视治疗中应用的研究进展[J].同济大学学报(医学版),2016,37(1):120-123.
[3] 孙远,刘泉.低浓度阿托品治疗近视的临床研究进展[J].国际眼科纵览,2014,38(4):241-244.
[4] 梁斗立,于雪冰,俞佳伟,等.不同浓度阿托品眼用凝胶间断使用延缓儿童近视发展的对比研究[J].中国斜视与小儿眼科杂志,2013,21(2):20-22.
[5] 李凤鸣,谢立信.中华眼科学[M].北京:人民卫生出版社,2014.
[6] 国家卫生和计划生育委员会网站.儿童眼及视力保健技术规范[J].中华眼科杂志,2013,49(7):85-87.
[7] Ametropia[J].Handbook of Disease Burdens & Quality of Life Measures,2010:4143.
[8] 叶燕,姚建生,王玉邦.学龄前儿童屈光不正及其危险因素探讨[J].南京医科大学学报(自然科学版),2011,31(1):119-122.
[9] 杨传武,袁作雄.青少年近视的防治对策分析[J].中国学校卫生,2013,34(11):1406-1408.
[10] Sankaridurg PR, Holden BA.Practical applications to modify and control the development of ametropia[J].Eye,2014,28(2):134-41.
[11] Binder PS, Lin L,Van dPC.Intracorneal Inlays for the correction of ametropias[J].Eye & Contact Lens,2015,41(4):197-203.
[12] 刘素江,吕建华.低浓度阿托品滴眼液和棱镜式组合透镜治疗青少年轻度近视的临床观察[J].河北医药,2013,35(18):2753-2755.
[13] 叶凌颖,张森,潘妙珍,等.不同浓度阿托品滴眼液对豚鼠形觉剥夺性近视的影响[J].中华眼视光学与视觉科学杂志,2015,17(12):730-735.
[14] Toyama E,Seki Y,Takahashi R,et al.Incidence and symptoms of atropine side effects in children[J].J of Japan Associa of Certif Orthop,2014,43:213-218.
(编校:苗加会)
Clinical effect and safety of different concentrations of atropine preparations in the treatment of ametropia
ZHANG Xiao-jin, ZHOU LeiΔ
(Department of Ophthalmology,Ophthalmic Hospital of Ningbo, Ningbo 315040, China)
ObjectiveTo investigate the effect and safety of Atropine preparations of 0.1%and 0.01%concentrations in the treatment of Ametropia.Methods123 cases of ametropia from April 2014 to August 2015 in ophthalmic hospital of ningbo were randomly selected and divided into three groups, 41 cases in each group.High concentration group
0.1%atropine sulfate eye drops treatment,low concentration group received 0.01%atropine sulfate eye drops treatment,and the control group received artificial tear mytear,and three groups were treated for one year.Changes in vision, refraction, intraocular pressure and axial length of the eye were compared after the treatment.ResultsHigh concentration group>low concentration group>control group in the the difference of distant visual acuity before and after the treatment (P<0.05),control group>low concentration group>high concentration group in the refractive index,intraocular pressure and ocular axis length difference before and after treatment(P<0.05),and the effective rate in the low concentration group 85.37%and high concentration group 90.24%had no significant difference.Adverse effects rate in high concentration group was 21.95%which was higher than low concentration group 4.88%(P<0.05).Conclusion0.1%and 0.01%concentrations of atropine were effective control of Ametropia in flexion and axial length spectrophotometry, and then improve the visual acuity, and the former is better,but the 0.01%concentrations had higher safety.
0.1%atropine sulfate eye drops; 0.01%atropine sulfate eye drops; ametropia; safety
10.3969/j.issn.1005-1678.2016.11.031
张晓瑾,女,本科,主治医师,研究方向:眼视光,E-mail:771004zxj@163.com;周磊,通信作者,男,本科,副主任医师,研究方向:近视、远视、散光、弱视、RGP等,E-mail:zhangxiaojin000@126.com。
R777.44
A
