鞘内注射阿片κ-受体激动剂U50,488H预处理对心肌缺血/再灌注损伤的保护作用
2016-07-24林家燕傅龙云陈明生王亚斌曹丰
林家燕,傅龙云,陈明生,王亚斌,曹丰Δ
(1.解放军第113医院 麻醉科,浙江 宁波 315040;2.舟山警备区医院 外科,浙江 舟山 316000;3.解放军第301医院 心内科,北京 271001)
鞘内注射阿片κ-受体激动剂U50,488H预处理对心肌缺血/再灌注损伤的保护作用
林家燕1,傅龙云2,陈明生1,王亚斌3,曹丰3Δ
(1.解放军第113医院 麻醉科,浙江 宁波 315040;2.舟山警备区医院 外科,浙江 舟山 316000;3.解放军第301医院 心内科,北京 271001)
目的 探讨鞘内注射阿片κ-受体激动剂U50,488H预处理对在体大鼠心肌缺血再灌注损伤的影响及相关机制。方法 选择健康成年雄性SD大鼠随机分为5组:假手术组(Sham),模型组(IR),静脉注射高剂量组(IV1),静脉注射低剂量组(IV2),鞘内注射组(IT),采用大鼠在体心肌缺血/再灌注模型,Sham组完成所有手术操作,但左冠状动脉结扎线不打结,不予静脉或鞘内药物注射;IR组完成模型后,予心脏缺血30 min后再灌注120 min处理,不予静脉或鞘内药物注射;IV1组、IV2组及IT组在建立模型前1 h分别给予U50,488H预处理,IV1及IV2组分别静脉注射U50,488H 0.1 mg/kg及0.01 mg/kg,IT组鞘内注射U50,488H 0.01 mg/kg,而后予心脏缺血30 min后再灌注120 min处理,术后观察大鼠心脏超声、心肌天狼猩红染色,血浆降钙素基因相关肽(calcitonin gene-related peptide,CGRP)及内皮素(endothelin,ET)含量等指标改变。结果 心脏超声结果显示:与IR组(EF%=35.4±1.1,FS%=21.1±1.1)比较,IT组(EF%=49.1±1.2,FS%=27.1±1.0)及IV1组(EF%=46.3±2.2,FS%=26.6±0.6)均可明显改善缺血/再灌注损伤后大鼠心脏收缩功能(P<0.05),而IV2组(EF%=34.8±1.4,FS%=21.4±1.6)心功能无明显变化。心肌天狼猩红染色结果提示:与IR组比较,IT组及IV1组心肌纤维化损伤明显减轻,而IV2组则无明显改善。ELISA结果显示:与IR组比较,IT组及IV1组血清CGRP浓度明显增加(P<0.05),ET浓度明显减少(P<0.05),而IV2组均无明显统计学差异。结论 鞘内注射阿片κ-受体激动剂U50,488H的预处理可明显改善大鼠心肌缺血/再灌注损伤后的心功能,并抑制心肌纤维化,其机制可能与调节CGRP、ET的释放有关。
鞘内注射;阿片κ-受体;心肌缺血/再灌注;降钙素
一直以来,心血管疾病都是危害人类健康的主要“杀手”之一,近年来对于心血管疾病的发病机制及防治方法的研究仍旧是科学家们关注的热点,亦是人类至今尚未攻克的难题。自阿片受体于1973年被发现以来,众多研究表明其参与了心血管活动的调节:δ受体主要与升压有关;通过中枢降低心血管交感神经张力主要是μ与κ受体,进一步研究表明,在以上三种阿片受体中,对心血管系统的中枢性调节作用最强的为κ受体[1-3]。但是,将阿片类药物用于缺血/再灌注预处理及后处理方面的研究多处于动物试验阶段,部分原因可能是实验时的用药剂量远远高于临床应用剂量,加之阿片类药物作为毒麻药品,应用受到严格管控,所以临床应用比较困难。本研究通过鞘内给药途径,小剂量注射选择性阿片κ-受体激动剂U50,488H于心肌缺血前预处理,探讨中枢κ-受体介导的心肌保护作用及其可能的作用机制,为阿片类药物临床应用提供参考。
1 材料与方法
1.1 材料 实验使用健康雄性SD(Sprague Dawley)大鼠,200 g±25 g[第四军医大学动物实验中心提供,合格证号:SCXK(陕)2012-0007]。U50,488H(美国Sigma-公司);CGRP试剂盒(上海碧云天生物技术有限公司),ET试剂盒(上海碧云天生物技术有限公司)。PowerLab生物信号采集处理系统(澳大利亚AD Instruments公司),Vevo 2100 超高分辨率小动物超声影像系统(加拿大Visual Sonics公司)Spectra Max 100酶标仪(美国Molecular Devices公司),倒置显微镜(日本Nikon公司)。
1.2 方法
1.2.1 动物选择及分组:50只SD大鼠随机分为5组:假手术组(Sham,n=10),模型组(IR,n=10),静脉注射高剂量组(IV1,n=10),静脉注射低剂量组(IV2,n=10),鞘内注射组(IT,n=10)。Sham组:大鼠给与心脏缺血/再灌注模型制备操作,但左冠状动脉结扎线不打结,不予静脉或鞘内药物注射;IR组:为模型对照组,大鼠制备心脏缺血/再灌注模型,予心脏缺血30 min后再灌注120 min处理,不予静脉或鞘内药物注射;IV1组及IV2组:为静脉药物注射组,模型制作同IR组,在心肌缺血前1 h分别予静脉注射U50,488H 0.1 mg/kg及0.01 mg/kg(生理盐水稀释至10 μL,后再给予生理盐水10 μL冲管);IT组:为鞘内药物注射组,模型制作同IR组,在心肌缺血前1 h予鞘内注射U50,488H 0.01 mg/kg(生理盐水稀释至10 μL,后再给予生理盐水10 μL冲管)。本研究中所有动物实验均遵循《实验动物保护条例》。
1.2.2 大鼠心肌缺血/再灌注模型制作[4]:大鼠禁食12 h,2%异氟烷麻醉后行气管插管,连接动物呼吸机,室内空气通气,潮气量20~30 mL/kg,呼吸频率70~80次/分。行右颈总动脉置管,连接Power Lab系统有创测压,并监测心电图(electrocardiogram,ECG)、平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR)。沿左锁骨中线,切开皮肤2cm,于第4、5肋间处打开胸腔,剪开心包并轻柔挤出心脏。在左冠状动脉处(动脉圆锥与左心耳之间)用6-0缝线缝一线结,放回心脏。稳定15 min,收紧线结后即形成左侧冠状动脉闭塞所致的心肌缺血模型:左侧冠状动脉支配的局部心肌发绀、血压下降,心电图呈心梗改变(ST段抬高或降低等)。术中平均动脉压低于30 mmHg或出现顽固性室性心律失常的大鼠弃去不用。
1.2.3 大鼠鞘内注射:采用Mestre法[5],参考文献操作,穿刺成功后予鞘内注射U50,488H 0.01 mg/kg(生理盐水稀释至10 μL),后再给予生理盐水10 μL冲管,出现肢体瘫痪的大鼠弃去不用。
1.2.4 超声心动图分析大鼠左心室功能:每组大鼠分别于术前及术后三天行超声心动图分析:2%异氟烷麻醉后,取仰卧位,应用Vevo 2100 超高分辨率小动物超声影像系统对大鼠进行心脏超声检查,分别记录二维及M型图像,测量大鼠左室收缩末期容积及左室舒张末期容积,计算左室射血分数EF(%)及短轴收缩率FS(%)。
1.2.5 大鼠心肌天狼猩红染色:每组取3只大鼠,术后一个月处死,取部分左心室心肌组织,经甲醛固定、脱水、石蜡包埋切片后,天狼猩红染液染色1 h,流水冲洗10 min,常规脱水、透明、树胶封固。染色结果中富含胶原蛋白的纤维化组织区域呈红色,正常心肌细胞组织呈黄绿色。每只大鼠随机选取10个显微镜视野(×200),应用Image J图像分析程序,分析计算心肌切片中天狼猩红染色的纤维组织面积占总面积的百分比,从而推断心肌的纤维化程度。
1.2.6 大鼠血浆CGRP及ET含量检测:术后3 d,每组取7只大鼠,经颈动脉抽取2~3 mL血液标本加入到100 g/L乙二胺四乙酸钠30 μL抑肽酶40 μL的试管中,混匀后3000 r/min离心10 min,分离血清,-20 ℃下保存待测定。采用ELISA法测定血清中 CGRP及ET含量。CGRP试剂盒及ET试剂盒的操作程序严格按照说明书进行。

2 结果
2.1 心脏超声 心脏超声结果显示见图2:与IR组(EF%=35.4±1.1,FS%=21.1±1.1)比较,IT组(EF%=49.1±1.2,FS%=27.1±1.0)及IV1组(EF%=46.3±2.2,FS%=26.6±0.6)均显著增加(P<0.05),而IV2组(EF%=34.8±1.4,FS%=21.4±1.6)则无明显变化。
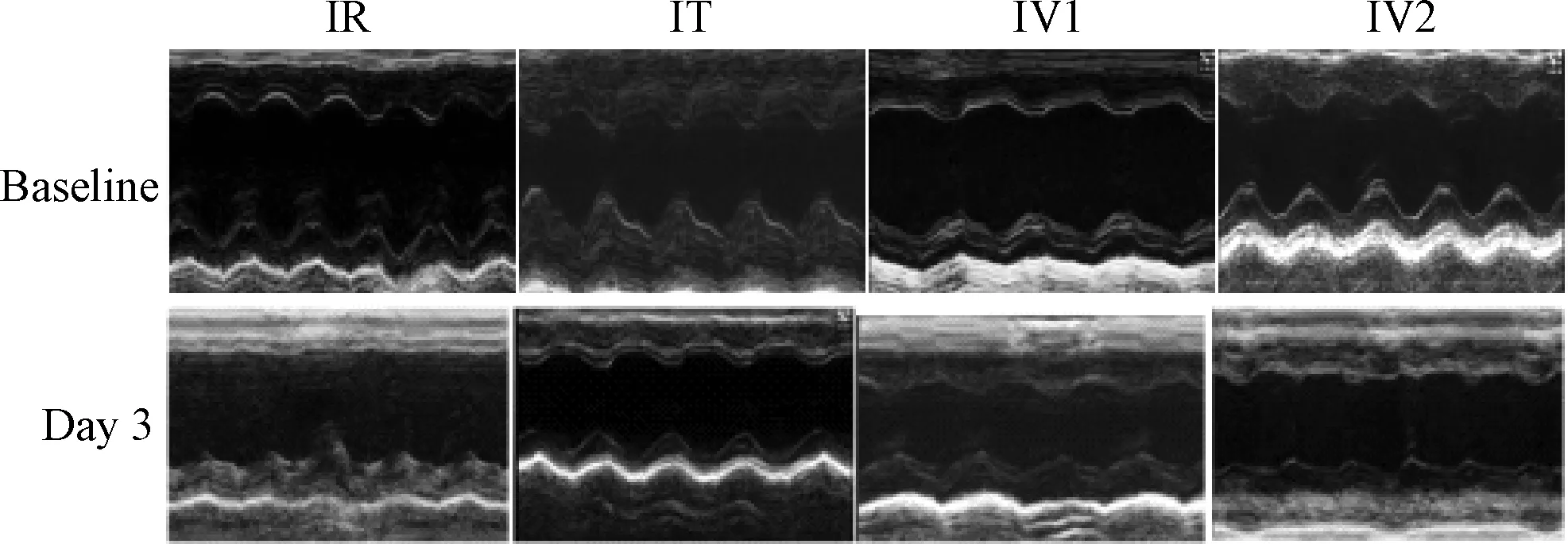
图1 各组大鼠超声心电图变化情况Fig.1 Changes of ECG in each group
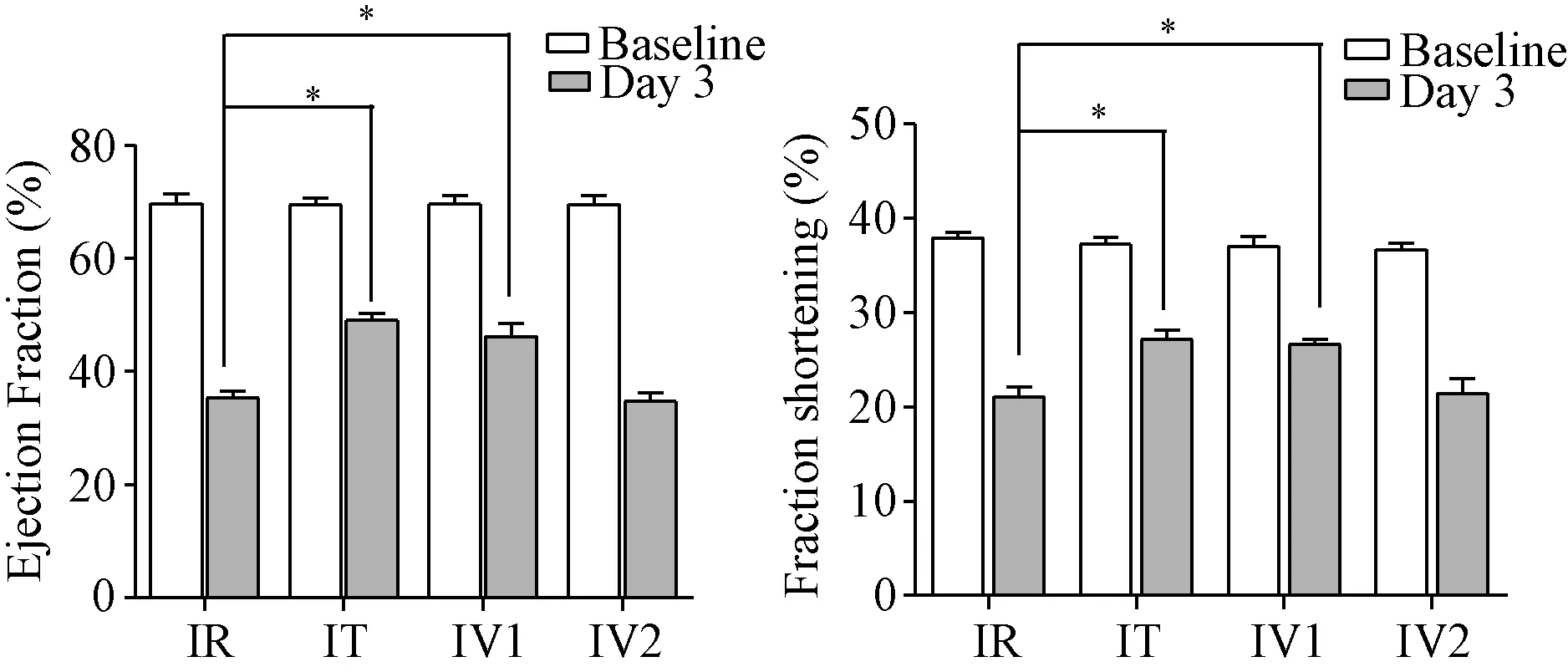
图2 各组大鼠EF%与FS%变化情况*P<0.05Fig.*P<0.05
2.2 心肌天狼猩红染色改变 见图3:红色区域为纤维化组织,心肌细胞组织呈黄绿色;各组心肌切片中天狼猩红染色的纤维组织面积占总面积的百分比见图4,结果显示:与IR组(53.5±3.02)%比较,IT组(27.1±3.57)%及IV1组(26.8±2.50)%心肌纤维化程度明显减轻,而IV2组(50.6±1.82)%则无明显改善。
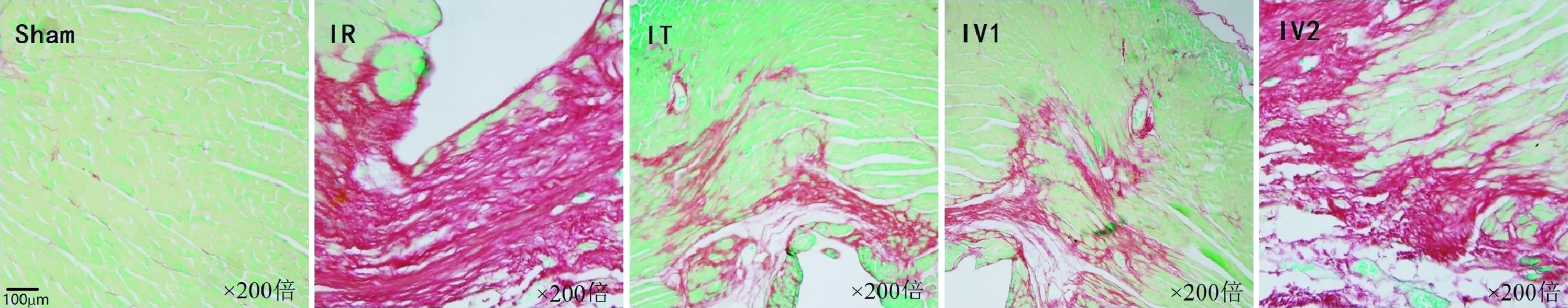
图3 各组大鼠心肌天狼猩红染色情况(×200)Fig.3 Histopathological changes of myocardium in each group (×200)
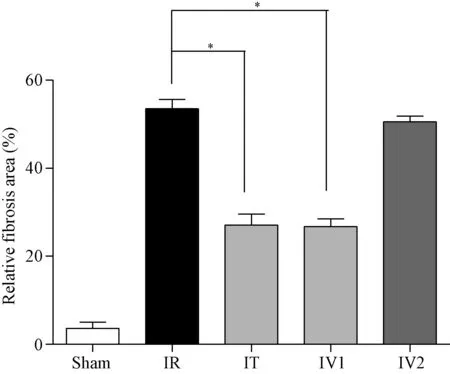
图4 各组大鼠心肌纤维化改变情况±s)*P<0.05Fig.4 Content change of myocardial fibers in each ±s)*P<0.05
2.3 大鼠血浆CGRP及ET含量变化 如图5:术后第3天,IT组(287.4±6.90)与IV1组(278.2±7.29)大鼠血清中CGRP含量明显高于IR组(234.3±8.38)pg/mL(P<0.05),而ET浓度[IT组:(176.5±8.15)pg/mL,IV1组:(177.67±9.73)pg/mL]明显低于IR组(233.07±7.30)pg/mL(P<0.05);IV2组[CGRP:(233.27±12.32)pg/mL,ET:(215.37±11.76)pg/mL]与IR组比较差异均无统计学意义。
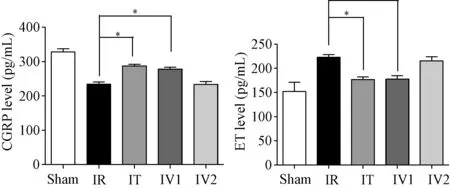
图5 各组大鼠血浆CGRP及ET含量变化情况*P<0.05Fig.5 Content change of plasma levels of CGRP and ET in each ±s)*P<0.05
3 讨论
心肌缺血预适应(ischemic preconditioning,IPC),是近年来研究心肌保护的一项重要发现,Schultz等[6]研究表明,阿片类受体在心肌缺血预适应中扮演了重要角色。除了分布于外周调节心血管功能的阿片受体外,中枢神经系统中亦有大量阿片受体分布于参与心血管调节的相关核团中。Groban等[7]研究发现,鞘内注射吗啡可减少大鼠心脏缺血/再灌注损伤所致的心肌梗死面积。进一步研究还发现鞘内注射吗啡预处理,可模拟心肌IPC或静脉注射吗啡预处理对缺血/再灌注心肌的保护作用,且μ、δ和κ三种阿片受体,均参与介导了这一作用[8-9]。
目前普遍认为,与阿片类药物成瘾性相关的可能为μ和δ受体[10],此外,成瘾性亦与药物使用剂量等相关。吗啡为非选择性阿片受体激动剂,对体内μ、δ和κ三种阿片受体可同时兴奋,因此在应用的同时存在药物成瘾性的风险。本研究中选择性阿片κ-受体激动剂U50,488H鞘内注射组(0.01 mg/kg)与静脉注射1组(0.1 mg/kg),均发现U50,488H可改善在体大鼠心肌缺血/再灌注损伤后的心脏收缩功能,并缓解心肌纤维化损伤,而静脉注射2组(0.01 mg/kg)却无明显保护作用,说明鞘内注射组的有效剂量远低于静脉注射组。因此,鞘内小剂量应用选择性阿片κ-受体激动剂预处理,既可达到心肌IPC的保护作用,又减少了药物成瘾性的风险,更加适合临床应用。
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是体内的一种非肾上腺素能、非胆碱能的强效扩张血管的神经递质,对调节血管的舒缩功能具有非常重要的作用,在一定范围内,CGRP可缓解因血管收缩因子的上调而带来的损伤[11]。在关于心肌IPC早期和延期的心肌保护研究中发现[12-14],缺血或药物预处理均可使内源性CGRP的释放增加,因此,CGRP可能在IPC这种保护作用中起重要作用。翁立军等[15]研究发现,侧脑室内注射吗啡预处理组和缺血预处理组,动物血清中的CGRP水平明显高于I/R组,而在侧脑室内注射吗啡预处理前,分别注射μ、δ和κ三种阿片受体拮抗剂于侧脑室,CGRP的释放也同时降低,进一步表明神经中枢中μ、δ和κ三种受体,均参与了侧脑室内注射吗啡预处理的心肌保护效应,且这种机制可能与影响内源性CGRP的释放相关[16]。本研究中,鞘内注射组与静脉注射1组大鼠血浆CGRP浓度明显高于模型组及静脉注射2组,说明鞘内小剂量注射选择性阿片κ-受体激动剂U50,488H所产生的心肌保护效应可能与影响大鼠内源性CGRP释放有关,而小剂量(0.01 mg/kg)静脉注射U50,488H则无法增加CGRP的释放。
内皮素(endothelin,ET)是一类具有强烈缩血管作用,并能刺激多种心血管细胞增殖、肥大及产生致炎症效应的多肽,它由血管内皮细胞等分泌释放,是缺血、缺氧及再灌注损伤时产生的一种致损伤因子,对心血管系统的病理生理功能有着重要的影响[17]。现已发现,内皮素的合成受到多种因素及其自身调节,血管内皮细胞、血管平滑肌细胞、心肌细胞、成纤维细胞、白细胞及巨噬细胞等都能够合成内皮素。本研究中,鞘内注射组与静脉注射1组大鼠血清ET浓度显著低于模型组,而静脉注射2组与模型组比较无明显差异,说明鞘内注射U50,488H还可能通过减少内源性ET释放,从而舒张冠脉、减轻心肌细胞异常增殖肥大及缓解心肌炎症反应,产生的心肌保护效应,而小剂量(0.01 mg/kg)静脉注射U50,488H则无明显影响,相关机制还有待进一步研究。
综上所述,鞘内小剂量(0.01 mg/kg)注射选择性阿片κ-受体激动剂U50,488H,可显著改善心脏收缩功能,缓解心肌损伤及心肌纤维化改变,其作用机制可能与影响内源性CGRP及ET释放有关,本研究选用鞘内注射的给药途径较静脉给药,可显著减少阿片类药物的有效剂量,减少药物成瘾风险,为阿片类药物临床应用提供了一定的参考。
[1] Pugsley MK.The diverse molecular mechanisms responsible for the actions of opioids on the cardiovascular system[J].Pharmacol Ther,2002,93(1):51-75.
[2] Wittert G,Hope P,Pyle D.Tissue distribution of opioid receptor gene expression in the rat[J].Biochem Biophys Res Commun,1996,218(3):877-881.
[3] Gross GJ.Role of opioids in acute and delayed preconditioning[J].J Mol Cell Cardiol,2003,35(7):709-718.
[4] Li R,Wong GT,Wong TM,et al.Intrathecal morphine preconditioning induces cardioprotection via activation of delta,kappa,and mu opioid receptors in rats[J].Anesth Analg,2009,108(1):23-29.
[5] Mestre C,Pélissier T,Fialip J,et al.A method to perform direct transcutaneous intrathecal injection in rats[J].J Pharmacol Toxicol,1994; 32(4):197-200.
[6] Schultz JE,Rose E,Yao Z,et al.Evidence for involvement of opioid receptors in ischemic preconditioning in rat hearts[J].Am J Physiol,1995,268(5):H2157-H2161.
[7] Groban L,Vernon JC,Butterworth J.Intrathecal morphine reduces infarct size in a rat model of ischemia-reperfusion injury[J].Anesth Analg,2004,98(4):903-909.
[8] Li R,Wong GT,Wong TM,et al.Intrathecal morphine preconditioning induces cardioprotection via activation of delta,kappa,and mu opioid receptors in rats[J].Anesth Analg,2009,108(1):23-29.
[9] 李锐,张野,张健,等.中枢阿片受体介导鞘内注射吗啡对大鼠缺血后心肌的保护作用[J].中国药理学通报,2008,24(5):676-680.
[10] 张力,李积胜.阿片类物质成瘾机制研究进展[J].国际精神病学杂志,2007,37(4):18-221.
[11] Vaage J,Valen G.Preconditioning and cardiac surgery[J].Ann Thorac Surg,2003,75(2):S709-S714.
[12] Song QJ,Li YJ,Deng HW.Early and delayed cardioprotection by heat stress is mediated by calcitonin gene-related peptide[J].Arch Pharmacol,1999,359(6):477-483.
[13] Peng J,Lu R,Deng HW,et al.Involvenment of alpha-calcitonin gene-related-peptide in monophosphoryl lipid A-induced delayed preconditioning in rat hearts[J].Eur J Pharmacol,2002,436(1):89-96.[14] Burgdrof C,Dendorfer A,Kurz T,et al.Calcitonin gene-related-peptide dose not interct with sympathetic activity in myocardial ischemia[J].Regul Pept,2005,125(1):99-102.
[15] 翁立军,张野,李锐,等.中枢吗啡预处理对在体大鼠心肌缺血/再灌注损伤的保护作用[J].安徽医科大学学报,2009,12(2):45-47.
[16] 陆姚,张野,李锐,等.阿片受体介导的中枢吗啡预处理对在体大鼠心肌缺血/再灌注损伤的保护作用[J].安徽医科大学学报,2009,44(1):49-52.
[17] 朱妙章,袁文俊,吴博威,等.心血管生理学与临床[M].北京:高等教育出版社,2004:271-280,445-450.
(编校:师维康)
Protective effect of κ-opioid receptor agonist U50, 488H pretreatment by intrathecal injection on myocardial ischemia/reperfusion injury
LIN Jia-yan1, FU Long-yun2, CHEN Ming-sheng1, WANG Ya-bin3, CAO Feng3Δ
(1.Department of Anesthesiology, 113 Hospital of People’s Liberation Army, Ningbo 315040 China; 2.Department of Surgery,Zhoushan Garrison Hospital, Zhoushan 316000 China; 3.Department of Cardiology, 301 Hospital of Peopl’s Liberation Army,Beijing 271001, China)
ObjectiveTo explore the effect and mechanism of intrathecal injecting κ- opioid receptor agonist U50, 488H on the rats with myocardial ischemia/reperfusion injury.Methods50 Sprague-Dawley rats were randomly divided into five groups (n=10): sham group (Sham), ischemia/reperfusion group (IR), high-dose intravenous injection group (IV1), low-dose intravenous injection group (IV2), and intrathecal injection group (IT).In sham group the rats were followed by the modeling step without ligation of the left coronary and no drug injection by intravenous or intrathecal; in IR group the rats were underwent 30 minutes of myocardial ischemia followed by 120 minutes of reperfusion, and were not treated with any drug.All the rats in IV1, IV2 and IT groups were intravenous injected with U50, 488H at 1 hour before they were underwent myocardial ischemia/reperfusion as in IR group.IV1 and IV2 groups were intravenous injected with U50, 488H respectively at the dose of 0.1 mg/kg and 0.01 mg/kg, while the IT group was intrathecal injected with U50, 488H at the dose of 0.01mg/kg.All the rats from 5 groups were observed with cardiac ultrasound, myocardial sirius staining, serum CGRP and ET level.ResultsCompared to IR group(EF%=35.4±1.1,FS%=21.1±1.1), the rats in IT group (EF%=49.1±1.2,FS%=27.1±1.0) and IV1 group (EF%=46.3±2.2,FS%=26.6±0.6) showed better myocardial contraction (P<0.05) and reduced myocardial fibrosis (P<0.05).IT group and IV1 group also showed reduced ET but increased CGRP in the serum (P<0.05).There were no difference between IV2 group and IR group in both observation.ConclusionPretreatment with intrathecal injection of opium κ-receptor stimulant U50, 488H not only protected the myocardial function from myocardial ischemia/reperfusion injury, but also repressed myocardial fibrosis.The protection may result from modulation of CGRP and ET.
intrathecal injection; κ-opioid receptor; myocardial ischemia/reperfusion; calcitonin
10.3969/j.issn.1005-1678.2016.11.009
宁波市自然科学基金(2012A610239)
林家燕,女,主治医师,研究方向:器官保护与麻醉药理,E-mail:ecaeme@163.com;曹丰,通信作者,女,教授,主任医师,研究方向:冠心病,E-mail:17807929@qq.com。
Q95.3,R543.3,R364.1
A
