α-环糊精葡萄糖基转移酶的高效表达及酶法制备AA-2G条件优化
2016-07-24邢琳张秀华钊倩倩刘飞颜震陈勉侯重文朱希强凌沛学
邢琳,张秀华,钊倩倩,刘飞,Δ,颜震,陈勉,侯重文,朱希强,,凌沛学
(1.济南市第四人民医院,山东 济南 250101;2.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;3.山东福瑞达医药集团公司,山东 济南 250101)
α-环糊精葡萄糖基转移酶的高效表达及酶法制备AA-2G条件优化
邢琳1,张秀华2,钊倩倩2,刘飞2,3Δ,颜震2,陈勉2,侯重文2,朱希强2,3,凌沛学3
(1.济南市第四人民医院,山东 济南 250101;2.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;3.山东福瑞达医药集团公司,山东 济南 250101)
目的 构建分泌表达α-环糊精葡萄糖基转移酶(α-Cyclodextrin Glycosyltransferase,α-CGTase)的重组菌株,并利用该酶液制备AA-2G。方法 经PCR扩增浸麻芽孢杆菌154基因组获得α-CGTase基因序列,将该基因序列和pET26b载体分别经Nco I、Xho I双酶切后用T4 DNA连接酶连接,并转化大肠杆菌BL21。利用发酵培养基分泌表达α-CGTase,利用该酶和淀粉糊精、维生素C反应制备AA-2G,并进行制备条件优化。结果 在大肠杆菌中实现了α-CGTase的胞外分泌表达,胞外环化酶活力达到120 U/mL,利用该酶的转糖基反应将淀粉糊精、维生素C转化为AA-2G,经HPLC检测正确。结论 利用自制α-CGTase得到了AA-2G,通过制备条件优化AA-2G产量为17.46 g/L,转化率达到58.2%(mg/mg)。
α-环糊精葡萄糖基转移酶;大肠杆菌;维生素C; AA-2G;酶法转化
维生素C(Vitamin C,VC)又叫L-抗坏血酸(L-ascorbic acid,L-AA),是一种水溶性维生素,在人体中发挥着重要的作用。VC是一种很好的抗氧化剂,对人体正常细胞有保护作用,近年来研究发现VC水平低下与肿瘤的发生密切相关[1],高浓度的VC可以抑制、杀伤肿瘤细胞[2-4],药理浓度的VC对卵巢癌、宫颈癌[5]、乳腺癌[6]、大肠癌、非霍奇金淋巴瘤、肾细胞癌、前列腺癌、膀胱癌等都具有一定的治疗作用[7-9]。此外,VC在氨基酸代谢、细胞间质合成、血液凝固、调节血脂等方面也发挥着重要作用[10]。但是VC本身不稳定,其分子中2位和3位碳原子上的烯醇式羟基极易被氧化解离,使VC丧失还原活性,从而限制了其应用。VC是目前世界上消耗量最大的药物原材料,因此开发性能稳定的VC衍生物成为了研究的热点。
VC衍生物主要有金属盐类衍生物、酯类衍生物、葡萄糖衍生物[11],其中2-O-α-D-吡喃葡萄糖基抗坏血酸(AA-2G)因其强稳定性、高安全性而备受关注。AA-2G进入人体后可被体内α-葡萄糖苷酶分解为VC与D-葡萄糖,使VC可以在体内保持有活性的烯醇式结构,是VC的最佳替代品,目前广泛应用于化妆品、食品、医疗保健及畜牧业和水产养殖等行业[12]。AA-2G的化学合成法非常困难且成本高,目前应用最广泛的是生物合成法,即利用α-环糊精葡萄糖基转移酶等糖基转移酶将供体上的D-吡喃葡萄糖基转移到VC的2-碳位羟基集团,脱水生成AA-2G。
α-环糊精葡萄糖基转移酶(α-Cyclodextrin Glycosy-ltransferase,α-CGTase)是糖基水解酶α-淀粉酶家族13成员,是一种微生物所产的胞外酶[13]。可以催化4种不同的反应,包括3种转糖基化反应(歧化反应、环化反应、偶合反应)和水解反应[14],其中环化反应是α-CGTase的特征反应,制备AA-2G也是利用此特征反应。本课题组前期利用大肠杆菌热激诱导成功表达α-CGTase,但是在胞内表达,并且表达量较低[15]。本研究旨在通过构建大肠杆菌分泌表达系统,制备可溶性α-CGTase,并利用该酶及淀粉制备AA-2G,以降低生产成本。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株:pET26b质粒,E.coliTop10,BL21(DE3),Bacillusmacerans154均为本实验室保藏。
1.1.2 培养基:液体LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠10;固体LB培养基含1.5%~2%琼脂粉。TB培养基(g/L):甘油 1,胰蛋白胨20,酵母粉10,葡萄糖20;发酵培养基(g/L):蛋白胨 1,酵母粉 2,磷酸氢二钾 13.5,磷酸氢二铵 4,柠檬酸 1.7,微量元素液10 mL/L;补料培养基(g/L):甘油500,硫酸镁 10,蛋白胨 10,酵母粉20。
1.1.3 试剂:限制性内切酶(NcoI,XhoI)、T4 DNA连接酶、Protein Marker、PfuDNA 聚合酶(Fermentas)、Kan;PCR引物、DNA Marker、质粒抽提试剂盒、PCR产物纯化试剂盒、DNA胶回收试剂盒(上海生工生物工程有限公司);糖化酶、α-环糊精(上海生工生物工程有限公司),其他试剂均为市售分析纯。
1.1.4 实验仪器:Bio-RAD Mini-PROTEAN Tetra Cell SDS-PAGE电泳槽,DYCP-40C型电泳仪(北京市六一仪器厂),三层摇床Ampere chart Mnltitron II(伊孚森生物技术中国有限公司),Eppendorf AG 22331 PCR仪,Thermo Micro7/21R离心机,TECAN Sunrise-Basic Tecan酶标仪。
1.2 方法
1.2.1 BL21-pET26-CGT表达菌株的构建:根据已知α-CGTase成熟肽编码序列设计上下游引物,从实验室保存的浸麻芽孢杆菌菌株Bacillusmacerans154中扩增α-CGTase基因序列。α-CGTase成熟肽编码序列全长2 064 bp,在其N端连接pET26b自身带有的pelB信号肽,上下游分别添加NcoI、XhoI酶切位点便于和载体相连,设计引物如下:
上游引物:5’-CATGCCATGGTCACCCGATACGAGCGTGG-3’
下游引物:5’-CCGCTCGAGTTAATTTTGCCAGTCCACC-3’
将PCR扩增得到的α-CGTase基因片段和pET26载体分别用限制性内切酶NcoI、XhoI进行双酶切,并切胶回收纯化。纯化后的载体和片段利用T4 DNA连接酶连接过夜,转化Top10感受态细胞,获得pET26-CGT重组质粒。经PCR和NcoI、XhoI双酶切验证正确的质粒送测序公司测序,测序正确的质粒转化BL21感受态细胞,获得表达载体BL21-pET26-CGT。
1.2.2 α-CGTase的分泌表达及酶活测定:将在摇瓶中筛选得到的酶活较高的菌株用1 L发酵罐发酵,所用种子培养基为LB培养基,待种子液生长至OD约为3.0时上罐,利用发酵培养基继续发酵表达,控制发酵液pH为6.7。待发酵培养基中营养成分消耗完全出现补料信号时加入补料培养基继续表达,并加入终浓度为1 mM IPTG诱导,加入甘氨酸促进蛋白向胞外分泌。每6 h取样,测定胞外酶活并进行SDS-PAGE电泳,检测胞外目的蛋白表达情况。
α-CGTase的酶活测定采用甲基橙法,测定酶活力为环化活力。配制10 μM α-环糊精作为标准溶液,取无菌EP管,分别加入0、20、40、60、80、100 μL标准溶液,加入50 mM(pH=6.0)磷酸缓冲液补足至每管100 μL,分别加入100 μL 0.1 M HCl溶液,100 μL甲基橙溶液,室温放置20 min显色,492 nm处测定吸光度,以α-环糊精含量为横坐标,吸光度值为纵坐标绘制标准曲线。另取10 μL适当稀释的酶液,加入90 μL 3%的可溶性淀粉,40 ℃反应10 min,反应结束后立即将样品置于冰上,冷却后加入100 μL HCl溶液、100 μL甲基橙溶液,室温放置20 min显色,测定492 nm吸光度。根据标准曲线方程计算出粗酶液酶活。
1.2.3 酶法转化制备AA-2G:在500 mL反应体系中加入2%VC、4%自制淀粉糊精及10%的自制粗酶液(4 500~5 500 U)混匀,加入0.1 M Ca2+,调整反应液pH为5.4,42 ℃下避光反应72 h,进行转糖基反应。反应结束后加入1 mg/mL糖化酶继续反应24 h,将AA-2Gn转化为AA-2G。反应结束后将样品离心,取上清液,0.45 μm超滤膜过滤后同AA-2G标准品、VC标准品一起进行HPLC检测。HPLC检测AA2G条件为:Agilent 1200 series HPLC色谱仪,Agilent自动进样器,紫外检测器,流动相为含1 mM四戊基溴化铵、10 mM H3PO4的10%甲醇溶液,流速0.5 mL/min,标准品浓度为1 mg/mL,柱温35 ℃,在238 nm处检测。
1.2.4 酶法转化制备AA-2G条件优化
① 转糖基反应温度对AA-2G产量的影响:按1.2.3中所述AA-2G制备方法,调整转糖基反应温度分别为37 ℃、40 ℃、42 ℃,其他条件不变,反应结束后HPLC检测溶液中AA-2G产量。
② α-CGTase浓度对AA-2G产量的影响:按1.2.3中所述AA-2G制备方法,调整自制α-CGTase粗酶液加入量分别为10%、20%、30%、40%,其他条件不变,反应结束后HPLC检测溶液中AA-2G产量。
③ 淀粉糊精加入量对AA-2G产量的影响:按1.2.3中所述AA-2G制备方法,调整淀粉糊精加入量(淀粉和VC加入比例为2:1)分别为4%、5%、6%,其他条件不变,反应结束后HPLC检测溶液中AA-2G产量。
④ 反应时间对AA-2G产量的影响:按1.2.3中所述AA-2G制备方法,调整转糖基时间分别为72、96、120 h,其他条件不变,反应结束后HPLC检测溶液中AA-2G产量。
2 结果
2.1 pET26-CGT重组菌的构建 pET26-CGT重组质粒与pET26b空质粒分别经酶切及PCR验证结果如图1所示。pET26b空质粒大小为5 360 bp,重组质粒大小约为7 424 bp,单酶切后对应条带位置与理论值相一致。目的基因片段大小为2 064 bp,经PCR扩增重组质粒得到片段大小与重组质粒双酶切所切下片段大小一致,均在2 000 bp附近,与理论值相符,而空质粒对照无此条带,说明目的基因片段成功插入载体中,pET26-CGT重组质粒构建成功。

图1 pET26-CGT重组质粒酶切及PCR验证结果Lane 1:DNA Marker;Lane 2:pET26-CGT重组质粒经Xho I单酶切;Lane 3:pET26b 空质粒经Xho I单酶切;Lane 4:pET26-CGT重组质粒经Nco I、Xho I双酶切;Lane 5:pET26b空质粒经Nco I、Xho I双酶切;Lane 6:pET26-CGT重组 质粒经PCR扩增;Lane 7:pET26b空质粒经PCR扩增Fig.1 Single and double-digested and PCR validation of recombinant pET26-CGTLane 1:DNA Marker;Lane 2:Single digested of pET26-CGT by Xho I;Lane 3:Single digested of pET26b by Xho I;Lane 4:Double digested of pET26-CGT by Xho I and Nco I;Lane5:Double digested of pET26b by Xho I and Nco I;Lane 6:PCR validation of recombinant pET26-CGT;Lane 7:PCR validation of pET26b
2.2 α-CGTase的分泌表达及酶活测定 α-CGTase 在发酵培养基中的表达情况如图2,发酵46 h胞外检测到α-CGTase条带,分子量约为74 kD,与理论分子量一致,随着发酵时间的延长胞外酶表达量也随之升高。通过甲基橙法测定酶环化活力结果如图3所示,同表达结果相对应,46 h样品中开始检测到酶活,随着表达时间的延长胞外酶活也随之升高,最高达到120 U/mL。
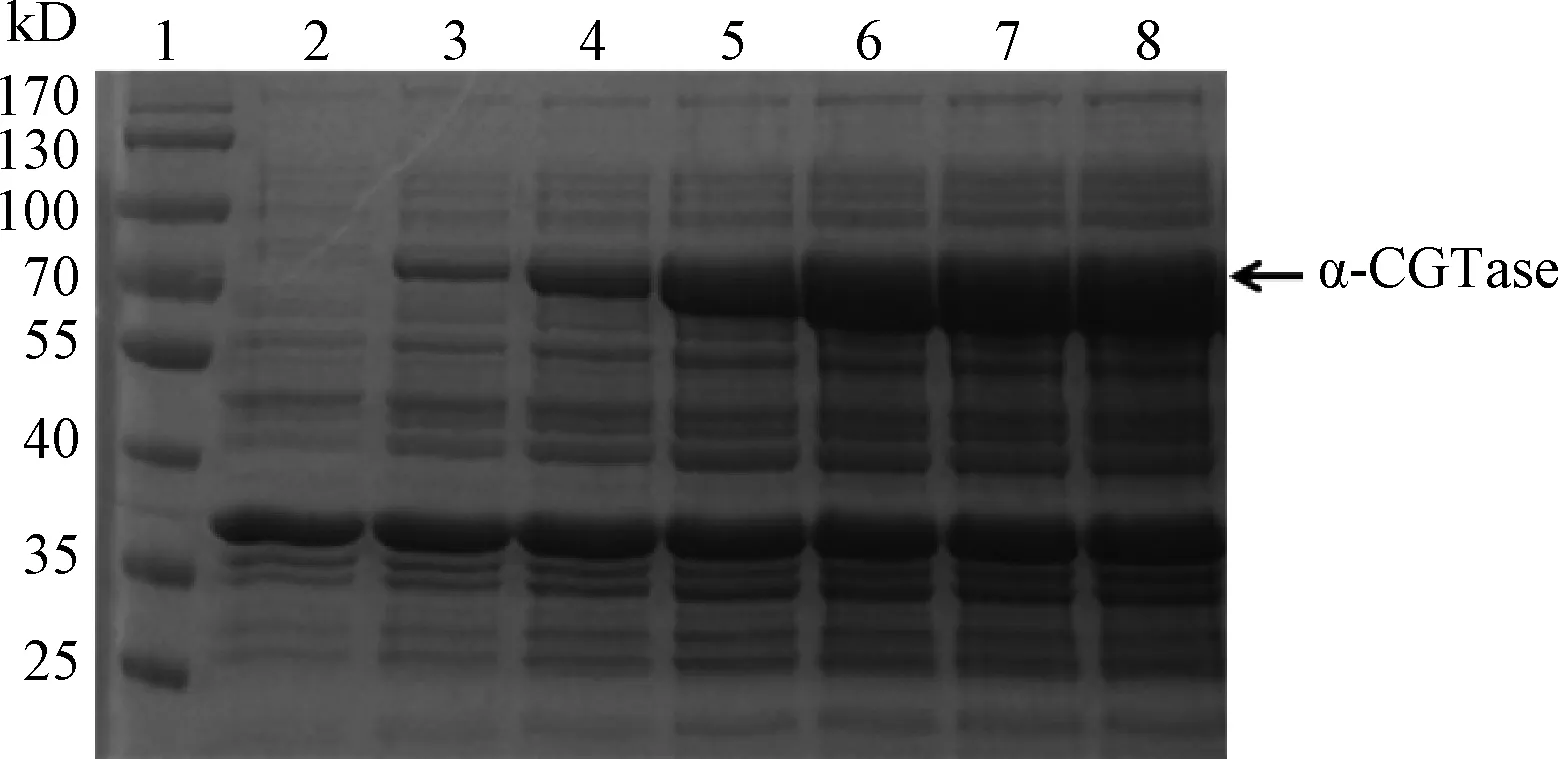
图2 α-CGTase胞外表达情况Lane 1:蛋白分子量Marker;Lane 2~8:表达40、46、52、64、 70、76、82 h发酵上清中目的蛋白Fig.2 SDS-PAGE analysis of the expression of α-CGTaseLane 1:Protein molecular weight Marker; Lane 2-8: Expression of α-CGTase in culture medium at 40, 46, 52, 64, 70, 76, 82 h
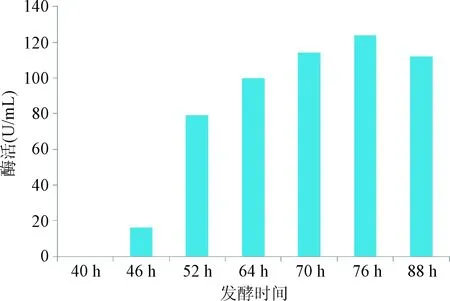
图3 α-CGTase胞外酶活Fig.3 Extracellular enzyme activity of α-CGTase
2.3 酶法转化制备AA-2G 利用自发酵酶液和自制淀粉糊精制备的样品和标准品一起经HPLC检测分析,结果如图4所示。结果显示AA-2G标准品在6.8 min出峰,VC标准品在6.37 min出峰,样品在两处均有峰出现。6.8 min处峰为AA-2G,说明用自制酶液和淀粉糊精制备得到了AA-2G;6.37 min处小峰,说明仍有少量VC没有完全转化,可在纯化时将其去除。
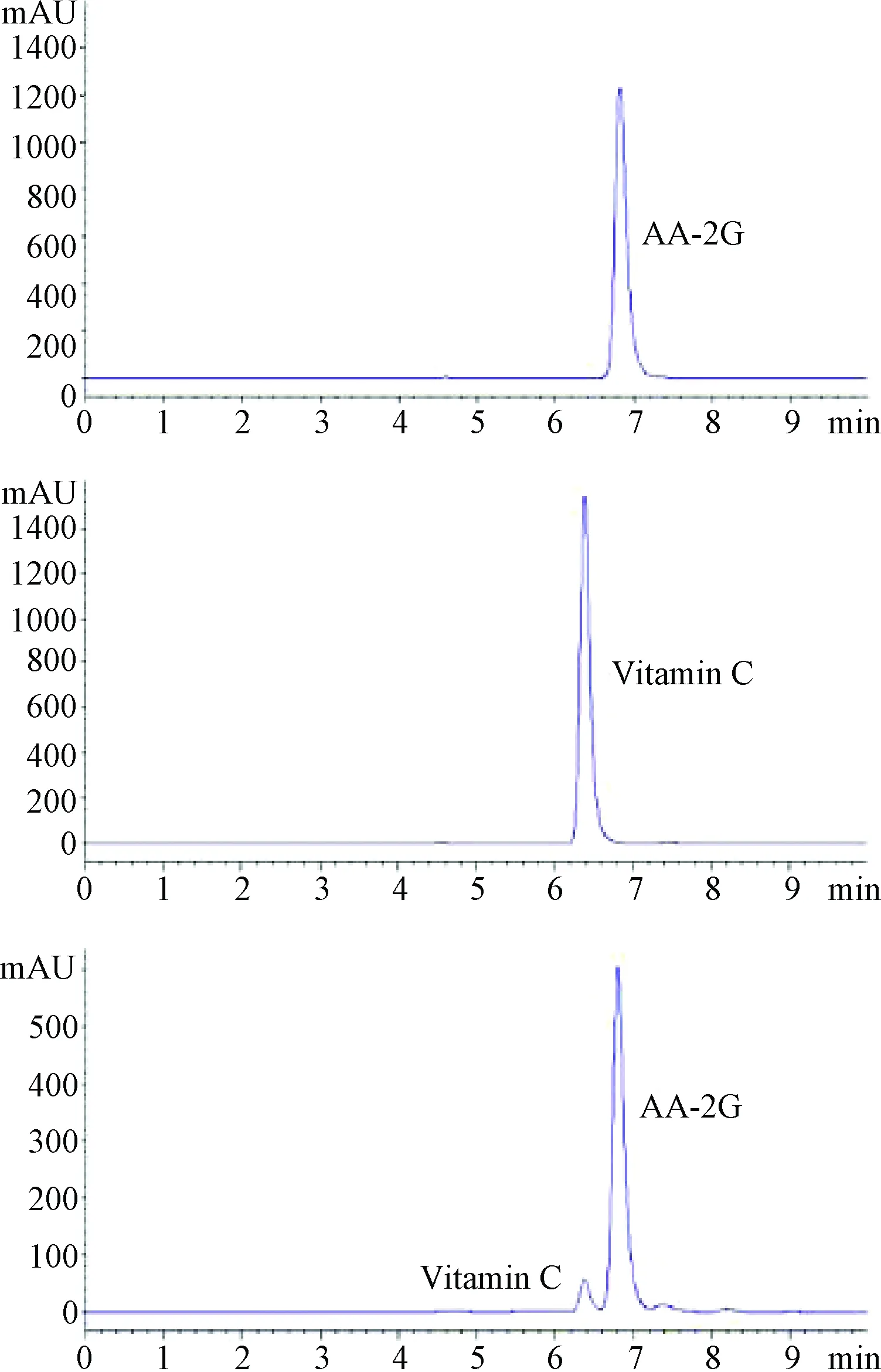
图4 AA-2G高效液相色谱图Fig.4 HPLC analysis of AA-2G
2.4 酶法转化制备AA-2G条件优化 酶法转化制备AA-2G条件优化结果如图5,α-CGTase的最适反应温度为40 ℃,温度过高或过低都会使酶活降低,影响AA-2G的转化。而随着α-CGTase浓度的增高,AA-2G的产量先增高后降低,本着利益最大化的原则,最后选择加入20%反应体系体积的自制酶液。随着淀粉加入量的增加,AA-2G产量也随之增加,但是随着淀粉量的增加,淀粉糊精制备更加困难,因此选定在最终反应体系中加入6%自制糊化淀粉、3%抗坏血酸。反应时间对AA-2G产量也有一定的影响,反应时间延长,AA-2G产量也相应增加,但到达96 h后产量增加不再明显,因此选定转糖基反应时间为96 h。
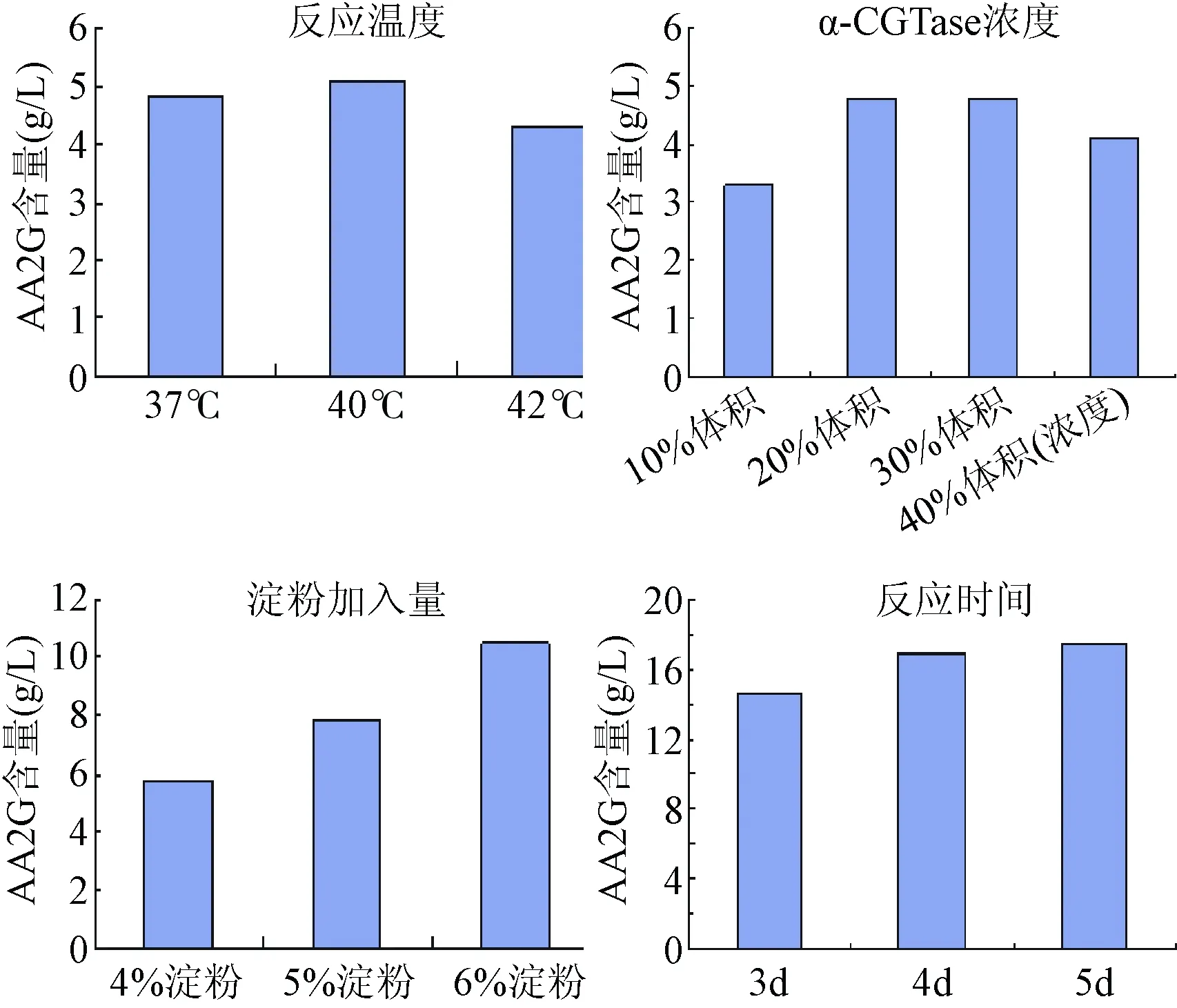
图5 酶法转化制备AA-2G条件优化Fig.5 Optimization of AA-2G condition by biotransformation
优化后的制备条件为使用3%抗坏血酸、6%自制糊化淀粉、20%反应体系体积的自制酶液、0.1 M Ca2+,在pH 5.4、40 ℃、避光隔氧、200 r/min震荡条件下反应120 h。转糖基反应结束后加入1 mg/mL的糖化酶,水解反应1 h。得到的最终反应液中AA-2G浓度为17.46 g/L,AA2G转化率为58.2%(mg/mg)。
3 讨论
本研究中利用pET26b质粒及其自身所带pelB信号肽,使α-CGTase在大肠杆菌中实现了分泌表达,发酵过程中诱导剂的加入及甘氨酸的添加促进了α-CGTase的胞外分泌[16],发酵结束时胞外粗酶液酶活达到120 U/mL。李彬[17]在大肠杆菌中表达α-CGTase,胞外粗酶液酶活为48 U/mL。张佳瑜[18]在枯草杆菌中表达α-CGTase,经发酵条件优化后胞外酶活为30 U/mL。李兆丰[16]在大肠杆菌中表达α-CGTase,并添加甘氨酸,胞外酶活仅为35.5 U/mL。本研究中利用pelB信号肽引导分泌的α-CGTase表达量达到了较高水平。
利用该酶和淀粉、维生素C经酶法转化制备AA-2G,经HPLC验证反应液中样品与标准品出峰时间一致,证实转化得到了AA-2G。韩瑞枝[19]利用α-CGTase转化生产AA-2G的产量为2.12 g/L。本研究中经条件优化后反应液中AA-2G浓度为17.46 g/L,AA2G转化率达到58.2%(mg/mg)。
α-CGTase是AA-2G制备中最关键的一种酶,但目前市场上该酶价格昂贵,本研究利用大肠杆菌分泌表达的α-CGTase粗酶液和淀粉糊精制备了AA-2G,该法可应用于大规模生产,不仅降低了生产成本,且转化效率高。后续研究将对AA-2G的纯化条件进行优化,以得到纯化成本低、纯度高的AA-2G样品。
[1] Konstantin S,Kazimierz SK.Ascorbate depletion:a critical step in nickel carcinogenesis[J].Environ Health Perspect,2005,113(5):577-584.
[2] 李能,周波,陈忠东.维生素C对Hela细胞系增殖及细胞周期的影响[J].南华大学学报(医学版),2004,32(2):161-163.
[3] 李媛,李晶晶,胡本容,等.三氧化二砷和维生素C 联合诱导肝癌细胞凋亡的作用研究[J].医药导报,2006,1(25):3-5.
[4] Verrax J,Cadrobbi J,Delvaux M,et al.The association of vitamins C and K3 kills cancer cells mainly by autoschizis ,a novel form of cell death Basis for their potential use as coadjuvants in anticancer therapy[J].Eur J Med Chem,2003,38(5):451-457.
[5] 曹娟,郑杰,卢航青.维生素C与宫颈癌Hela细胞凋亡关系的研究[J].现代肿瘤医学,2009,17(6):1017-1021.
[6] Vollbracht C,Schneider B,Leendert V,et al.Intravenous vitamin C administration improves quality of life in breast cancer patients during chemo-radiotherapy and aftercare:results of a retrospective,multicentre,epidemiological cohort study in Germany[J].In Vivo,2011,25(6):983-990.
[7] 刘祚仁,郭塨.维生素C抗癌作用的临床试验研究进展[J].医学综述,2014,20(13):2358-2360.
[8] Riordan HD,Riordan NH,Jackson JA,et al.Intravenous vitamin C as a chemotherapy agent:a report on clinical cases[J].P R Health Sci J,2004,23(2):115-118.
[9] Padayatty SJ,Riordan HD,Hewitt SM,et al.Intravenously administered vitamin C as cancer therapy:three cases[J].CMAJ,2006,174(7):937-942.
[10] 钱燕春,冯德云.维生素C防治肿瘤作用的研究进展[J].右江医学,2008,36(6):741-743.
[11] Dresser GK,Wacher V,Wong S,et al.Evaluation of peppermint oil and ascorbyl palmitate asinhibitors of cytochrome P4503A4 activity in vitro and in vivo[J].Clinical Pharmacology & Therapeutics,2002,72(3):247-255.
[12] Wang ZK,Qi QS,Wang PG.Engineering of cyclodextrin glucanotransferase on the cell surface of Saccharomyces cerevisiae for improved cyclodextrin production[J].Appli Environ Microb,2006,72 (3):1873-1877.
[13] Tonkova A.Bacterial cyclodextrin glucanotransferase[J].Enzyme and Microb Tech,1998,22:678-686.
[14] Vander Veen BA,Alebeek GJ,Uitdehaag JC,et al.The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans (strain 251) proceed via different kinetic mechanisms [J].Eur J Biochem/ FEBS,2000,267(3):658-665.
[15] 王晓玉,刘飞,颜震,等.浸麻芽孢杆菌环糊精葡糖基转移酶的克隆与表达[J].中国生化药物杂志,2012,33(1):46-48.
[16] 李兆丰.软化类芽孢肝菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D].无锡:江南大学,2009.
[17] 李彬.软化芽胞杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中胞外分泌的优化 [D].无锡:江南大学,2010.
[18] 张佳瑜.软化芽孢肝菌α-环糊精葡萄糖基转移酶在毕赤酵母和枯草杆菌中的表达[D].无锡:江南大学,2010.
[19] 韩瑞枝.环糊精葡萄糖基转移酶的分子改造及合成糖基化L-抗坏血酸 [D].无锡:江南大学,2013.
(编校:吴茜)
High level expression of α-CGTase and optimize biotransformation conditions of AA-2G
XING Lin1, ZHANG Xiu-hua2, ZHAO Qian-qian2, LIU Fei2Δ, YAN Zhen2, CHEN Mian2, HOU Zhong-wen2,ZHU Xi-qiang2,3, LING Pei-xue3
(1.The NO.4 People’ Hospital of Ji’nan City, Ji’nan 250101, China; 2.Shandong Academy of Pharmaceutical Science, Key Laboratory of Biopharmaceuticals, Engineering Laboratory of Polysaccharide Drugs, National-Local Joint Engineering Laboratory of Polysaccharide Drugs, Ji’nan 250101, China; 3.Shandong Freda Pharmaceutical Group Corporation, Ji’nan 250101, China)
ObjectiveTo construct a prokaryotic expression vector in BL21 to secretorily express α-Cyclodextrin Glycosyltransferase(α-CGTase).Methodsα-CGT gene was amplified fromBacillusmacerensgenome by PCR.pET26b and α-CGT gene were connected after digested withNcoI,XhoI respectivly, and then transformed intoEscherichiacoliBL21 strain.α-CGTase was expressed in fermentation culture medium and AA-2G was prepared by using α-CGTase, VC and starch.Resultsα-CGTase was expressed secretorily and the enzyme activity was up to 120 U/mL.AA-2G was prepared by the biotransformation of VC and starch using α-CGTase which proved to be correct by HPLC.ConclusionAA-2G was prepared by using self-made α-CGTase, after optimized the preparation conditions the yield of AA-2G was 17.46 g/L, and the conversion rate reached 58.2%(mg/mg).
α-CGTase;E.coli; Vitamin C; AA-2G; biotransformation
10.3969/j.issn.1005-1678.2016.11.002
国家高技术研究发展(863)计划(2014AA093603);山东省科技发展计划(2014GSF121043);山东省自主创新成果转化专项(2014CGZH1306);山东省重点研发计划(2015GSF121003);济南市重大专项(201403009)
邢琳,女,主治医师,研究方向:妇科肿瘤,E-mail:angela@126.com;刘飞,通信作者,男,助理研究员,研究方向:生物技术,E-mail:lfshwu@163.com。
Q786
A
