HPLC同时测定清火胶囊中5种成分的含量
2016-07-18伍国怡
伍国怡

【摘 要】 目的:建立HPLC法测定清火胶囊中靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚含量的方法。方法:采用Eclipse XDB(4.6×250 mm)色谱柱;流动相为甲醇-0.1%磷酸溶液,梯度洗脱;流速为0.80 ml/min;检测波长:289 nm。结果:靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚与其相邻质峰能完全分离。靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的线性范围分别为:0.050~5.00μg/ml(r=0.9999)、0.391~39.1μg/ml(r=0.9999)、0.696~69.6μg/ml(r=0.9997)、0.216~21.6μg/ml(r=1.0000)、0.212~21.2μg/ml(r=1.0000);方法回收率均不低于97%。结论:该方法灵敏度高、简便、准确,可用于清火胶囊的质量控制。
【关键词】 HPLC;靛玉红;芦荟大黄素;大黄酸;大黄素;大黄酚;清火胶囊
【中图分类号】R286.0 【文献标志码】 A【文章编号】1007-8517(2016)11-0019-03
Abstract:Objective HPLC method was established for the determination of Indirubin、Aloe-emodin、Rhein、Emodin and Chrysophanol in Qinghuo capsules.Methods Eclipse XDB(4.6×250mm) column was used with the mobile phase of methonal-0.1% phosphate acid solution by gradient elutio,The flow rate was 0.80ml/min. The detection wavelength was set at: 289nm.Results Indirubin、Aloe-emodin、Rhein、Emodin and Chrysophanol could be completely separated from interfacing impurity peaks. The HPLC method showed agood linear relationship in the range of 0.050~5.00μg/ml(r=0.9999)for Indirubin,0.391~39.1μg/ml(r=0.9999) for Aloe-emodin,0.696~69.6μg/ml(r=0.9997)for Rhein,0.216~21.6μg/ml(r=1.0000) for Emodin,0.212~21.2μg/ml(r=1.0000)for Chrysophanol. Recoveries for the three components were all above 97%. Condusion The method is sensitive, simple, accurate, and can be used for the quality control of Qinghuo capsules.
Keywords:HPLC;Indirubin;Aloe-emodin;Rhein;Emodin;Chrysophanol;Qinghuo Capsules
清火胶囊是由大青叶、大黄、石膏、薄荷脑等药物经适宜加工制成的中成药,收载于国家食品药品监督管理局标准[1],具有清热泄火,通便的功效。临床用于咽喉肿痛,牙痛,头目眩晕,口鼻生疮,大便不通等。原标准只有大黄素、大黄酚的含量测定项,文献也无同时测定清火胶囊中靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚5种成分的报道。研究参考有关文献[2-11],建立HPLC法测定清火胶囊中大青叶的主要成分靛玉红,大黄的主要成分芦荟大黄素、大黄酸、大黄素和大黄酚含量的方法。该方法灵敏度高、简便、准确,可用于清火胶囊的质量控制。
1 仪器与材料
1.1 仪器 Agilent 1200系列高效液相色谱仪(Agilent 1200 LC色谱工作站、G1322A DEGASSER 溶剂脱气机、G1311A 四元泵、G1329A(ALS)自动进样器、G1314B VWD 紫外检测器);德国赛多利斯 CP225D电子天平;西班牙COBOS AW-120自动电子天平;上海必能信SB3200WS 超声波清洗器。
1.2 材料 靛玉红(批号:717-200204)、芦荟大黄素(批号:110795-201007)、大黄酸(批号:0757-200206)、大黄素(批号:110756-200110)和大黄酚(批号:110796-201319)对照品均购自中国药品生物制品检定所。清火胶囊(批号:140111、141006,江西药都仁和制药有限公司;批号:140607,浙江泰康药业集团有限公司)。甲醇为色谱纯、水为超纯水,其余试剂为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent Eclipse XDB-C18(250×4.6mm,5μm);流动相:甲醇(A)-0.1%磷酸溶液(B),其梯度见表1;流速:0.8ml/min;检测波长:289 nm;柱温:30℃;进样量:10μl。理论板数按靛玉红计应不低于2500。
2.2 供试品溶液的制备 取本品10粒的内容物,精密稱定,研细,取约1粒的量,精密称定,精密加入甲醇25ml,称定重量,超声处理(功率250W,频率40KHz)30min,放冷,用甲醇补足减失的重量,摇匀,滤过,滤液用0.45μm 微孔滤膜滤过,取续滤液,即得。
2.3 阴性对照溶液的制备 按处方中药味的比例,分别自配不含大黄和不含大青叶的群药,按其工艺制成阴性对照样品,再按供试品溶液制备方法制备阴性对照溶液。
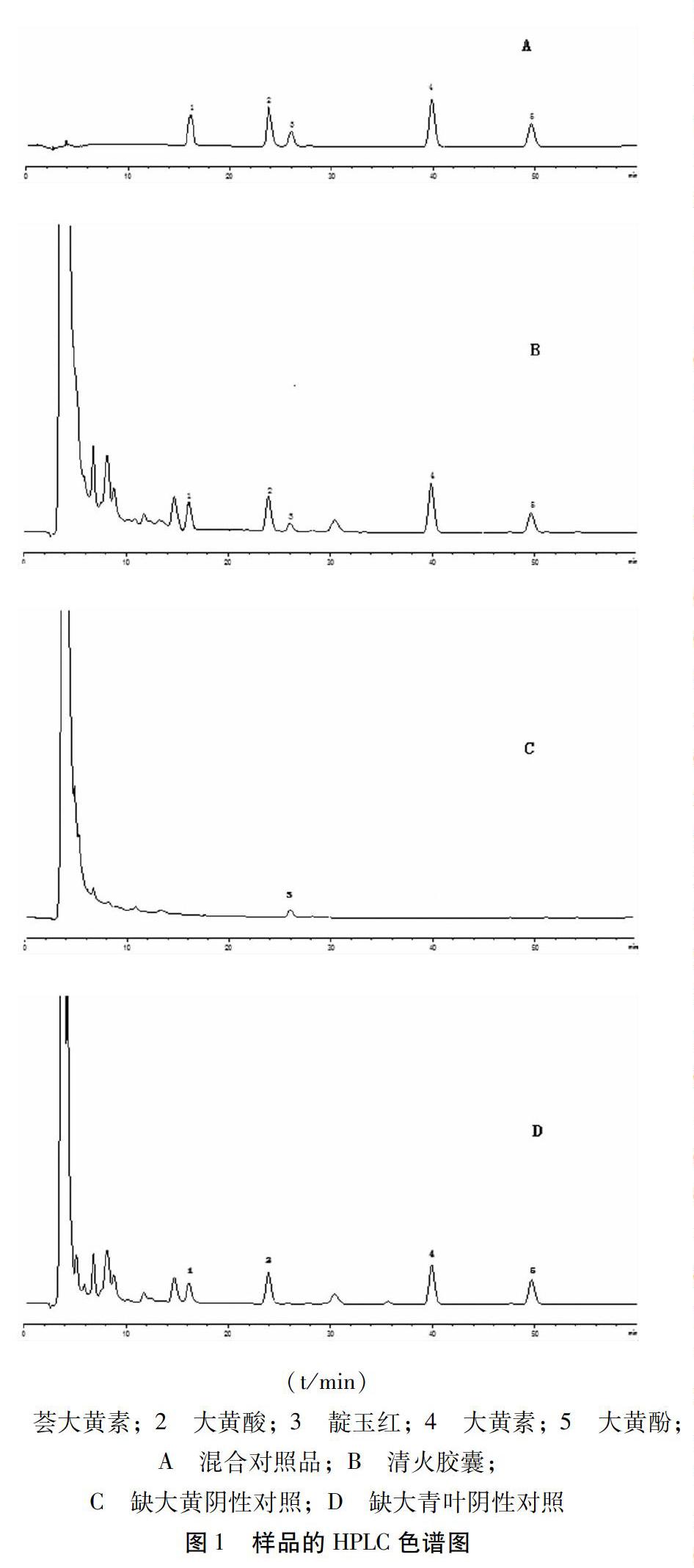
2.4 系统适用性试验 分别取混合对照品溶液、供试品溶液、阴性对照溶液注入色谱仪,色谱图见图1。在该色谱条件下,靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚与相邻组分峰的分离度均大于1.5,理论板数按靛玉红峰计不低于2500,阴性样品在与对照品色谱峰相应的位置上无吸收峰,表明处方中的其他成分对测定结果无影响。
2.5 线性关系的考察 精密称取靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚对照品适量,以甲醇为溶剂,分别配制成对照品贮备溶液(即含靛玉红0.4996mg/ml、芦荟大黄素0.3910mg/ml、大黄酸0.3480mg/ml、大黄素0.2156mg/ml、大黄酚0.2119mg/ml的溶液)倍比稀释法配置成系列质量浓度的溶液。进样10μl,测定各组分峰面积。以各组分浓度(C)横坐标,相应峰面积(A)为纵坐标,绘制标准曲线,得回归方程。靛玉红: A=91.267 C+9.9152,r=0.9999,线性范围:0.050~5.00μg/ml;芦荟大黄素:A=38.850C-6.6232,r=0.9999,线性范围:0.391~39.1μg/ml;大黄酸:A=121.823C-12.269,r=0.9997,线性范围:0.696~69.6μg/ml;大黄素:A=83.911C-3.6159,r=1.0000,线性范围:0.216~21.6μg/ml;大黄酚:A=46.881C-1.5005,r=1.0000,线性范围:0.212~21.2μg/ml。
2.6 精密度试验 精密吸取同一供试品(批号:140111)溶液10μl,按上述色谱条件进样,测定靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的峰面积,重复进样6次,其RSD分别为0.76%、1.04%、1.28%、0.91%、1.46%。
2.7 [JP3]重复性试验 取同一批样品(批号:140111)共6份,精密称定,分别制备供试品溶液,各进样10μl,测定靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的含量,分别为:0.0075、0.0073、0.0073、0.0077、0.0077、0.0074mg/粒,平均:0.0075mg/粒(RSD为2.45%);0.245、0.244、0.247、0.245、0.248、0.242mg/粒,平均:0.245mg/粒(RSD为0.87%);0.100、0.096、0.097、0.099、0.095、0.098mg/粒,平均:0.098mg/粒(RSD为1.92%);0.139、0.142、0.138、0.135、0.141、0.137mg/粒,平均:0.139mg/粒(RSD为1.86%);0.530、0.536、0.534、0.525、0.529、0.528mg/粒,平均:0.530mg/粒(RSD为0.76%)。
2.8 稳定性试验 取同一供试品(批号:140111)溶液,分别在0、1、2、4、6、8、10、12h时进样10μl,记录色谱峰面积,计算靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的峰面积的RSD分别为0.59%、1.53%、1.28%、0.94%、1.62%。
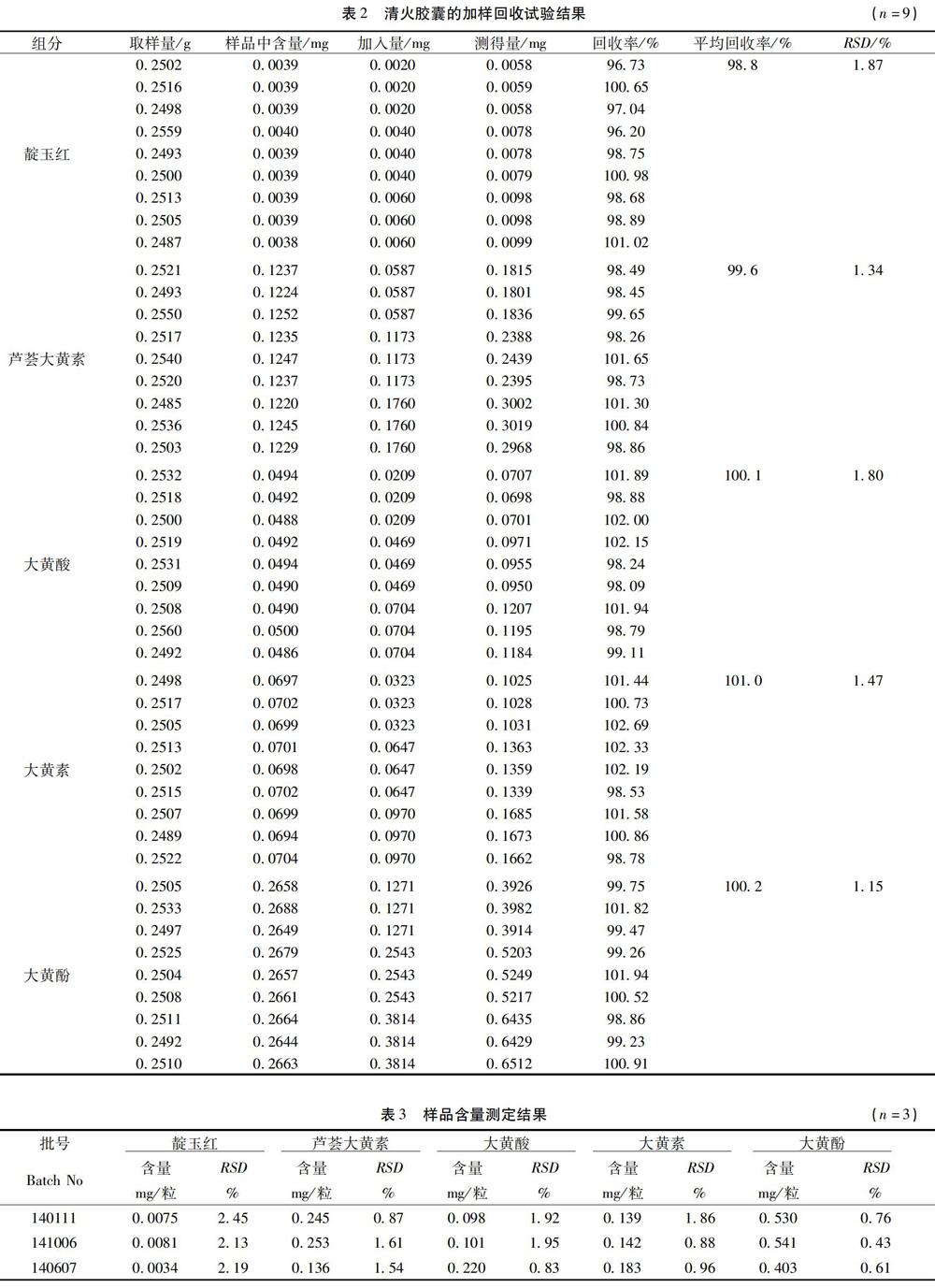
2.9 加样回收率试验 精密量取已测定靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的清火胶囊(批号:140111)样品9份(每份约0.5粒的量),精密称定,于①②③样品中分别精密加入靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚对照品贮备液4、150、60、150、600μl,于④⑤⑥样品中分别精密加入靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚对照品贮备液8、300、120、300、1200μl,于⑦⑧⑨样品中分别精密加入靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚对照品贮备液12、150、180、450、1800μl,制备供试品溶液,进样测定,计算加样回收率,结果见表2。
2.10 样品测定 取不同批号的清火胶囊,按供试品溶液制备方法处理,进行HPLC分析,以外标一点法计算靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的含量。结果见表3。
3 讨论
3.1 实验曾尝试用单一流动相甲醇-0.1%磷酸溶液(75∶[KG-*2]25)进行洗脱,部分组份分离效果不佳,加大水相组分的比例进行洗脱,结果发现分离效果大大提高,但出峰时间较长,影响工作效率;而选择现正文所用流动相,待测的5个成分分离较好且峰形较佳。
3.2 检测波长的选择:中国药典[2]收载大青叶中靛玉红检测波长为289nm,大黄中4个成分的检测波长为254nm,由于靛玉红含量较低,故选择289nm作为检测波长。
3.3 提取溶剂及时间的选择:分别用甲醇、乙醇、50%甲醇、50%乙醇作为提取溶剂超声提取,结果发现甲醇提取率最高。用甲醇超声提取30、40、50、60min等后进行对比考察,结果显示30min已经能够将目标组份提取完全。
3.4 由表3可知,不同厂家不同批号生产的清火胶囊中靛玉红、芦荟大黄素、大黄酸、大黄素和大黄酚的含量有差别,特别是靛玉红的含量,差别很大,提示不同的生产工艺制备出的清火胶囊内在质量有差异。现有的清火胶囊的质量控制方法较简单,不能有效地控制清火胶囊质量。该方法经方法学研究表明,实验所建立的方法简单、可靠,可作为评价清火胶囊的质量标准之一。
参考文献
[1]国家食品药品监督管理局标准.YBZO912208,清火胶囊[S].北京.
[2]国家药典委员会.中華人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:21-22.
[3]金阳.清火片质量标准研究[J].中成药,2008,30(4):533-536.
[4]张火旺.HPLC测定清火片中大黄素和大黄酚的含量[J].中国药师,2009,12(1):65-66.
[5]姚亮.HPLC测定清火片中大黄素和大黄酚的含量及含量均匀度[J].中国名族民间医药,2011,20(21):39-40.
[6]王金鹏,孙翠萍,林海霞,等.HPLC测定复方南板蓝根颗粒中靛蓝和靛玉红的含量[J].中国实验方剂学杂志,2012,18(21):128-130.
[7]方衡,邹韬博,刘海洋,等.HPLC测定温肾降浊散中大黄酸、大黄素及大黄酚的含量[J].中国实验方剂学杂志,2015,21(2):91-93.
[8]包明兰,巴根那,白梅荣.HPLC同时测定蒙药胃舒安胶囊中大黄素、大黄酸、大黄酚的含量[J].中国实验方剂学杂志,2013,19(6):96-98.
[9]肖英华,夏叶,程佩佩,等.反相高效液相色谱法同时测定大青叶中靛蓝与靛玉红含量[J].医药导报,2015,(11):1506-1508.
[10]郝乘仪,冯波,郭淑英,等.黄连上清片中9种成分的HPLC波长切换方法测定[J].中国医药工业杂志,2015,46(09):995-998.
[11]李莉,宋俊骊,王志梅,等.高效液相法同时测定九制大黄丸中5组份含量[J].中国药业,2015,(5):34-35.
(收稿日期:2016.04.07)
