不同低温条件保存的大鼠脂肪自体移植后成活率的探究
2016-07-18张广宇于冬梅郝立君
张广宇, 于冬梅, 罗 赛, 郝立君
不同低温条件保存的大鼠脂肪自体移植后成活率的探究
张广宇, 于冬梅, 罗 赛, 郝立君
目的 探讨在-80℃、-196℃低温条件下储存后的脂肪颗粒,在自体脂肪移植1、3个月后的移植成活率,并对移植物的组织学、活性等进行检测。方法 将实验动物分组,获取脂肪颗粒并处理,冻存3个月后,取出脂肪颗粒进行检测;然后制备动物模型,获取移植物,对脂肪颗粒和脂肪移植物进行组织学检测,检测脂肪颗粒及移植物颗粒的活性,并进行葡萄糖转移实验等。结果 移植1个月后,移植物成活率新鲜脂肪组>-196℃组>-80℃组(P<0.05)。移植3个月后,新鲜脂肪组、-196℃组、-80℃组移植成活率相比,差异无统计学意义(P=0.97)。-80℃组移植后1、3个月,脂肪颗粒活性无明显差别;新鲜脂肪组、-196℃ 组移植后3个月,颗粒活性均大于其移植后1个月。其中以一196℃ 组增加更明显。结论 -80℃、-196℃ 条件下,储存的脂肪移植后较好地保持了体积和活性。-196℃存储的脂肪在组织学和活性方面更接近于新鲜脂肪的移植效果。故短期内,-80℃、-196℃储存的脂肪满足临床脂肪重复注射的需求。
脂肪颗粒; 低温保存; 自体移植; 成活率; 移植物活性
自2013年11月至2014年12月,哈尔滨医科大学附属第一医院整形美容中心以新鲜的大鼠脂肪颗粒注射作为对照,旨在探讨两种低温保存方法对移植后移植物成活率的影响,以与传统的即抽即用的方法做对比,明确冻存的脂肪颗粒短期内在受区发生的变化,以便对未来临床上应用冻存脂肪颗粒移植时起到一定的借鉴作用。
1 实验动物与分组
选择雌性成年Waster大鼠36只(山东鲁抗医药有限公司动物实验中心提供),体质量为(240±10) g。将所有大鼠随机分为3组,A组注射新鲜脂肪颗粒;B组注射-80℃下冻存3个月的脂肪颗粒;C组注射-196℃下冻存3个月的脂肪颗粒,每组12只。所有动物均以单笼饲养。
2 操作方法
2.1 脂肪颗粒的获取与处理 实验动物称质量后,以0.4 ml/100 g的剂量腹腔注射10%水合氯醛,将大鼠双侧腹股沟区剃毛,碘伏消毒后,于双侧腹股沟内侧约0.5 cm处做长约1.0 cm的纵行切口,打开盆腔上肌层,抽出并切取腹股沟脂肪,止血后用3-0丝线分层缝合。将脂肪剪成大小约1.0 mm×1.0 mm×1.0 mm的颗粒,用20 ml注射器吸取脂肪颗粒和生理盐水,冲洗3次,每只大鼠获得纯净脂肪颗粒约1.5 ml,分成2份,1.0 ml用于脂肪注射,0.5 ml用于脂肪颗粒冻存后的检测。将脂肪颗粒分别导入已标记的3 ml冻存管中,每管中加入等体积的低温保护剂混合液。迅速置于0℃冰水混合物中浸浴15 min,再转入-80℃(深低温冰箱)和-196℃(液氮)中保存。
2.2 检测冻存3个月后的脂肪颗粒 将B、C组冻存的0.5 ml脂肪颗粒取出后迅速置于37℃水浴中快速晃动,约5 min完全解冻后,及时吸除低温保护剂,以20 ml注射器抽取生理盐水反复冲洗以避免低温保护剂在常温下对脂肪颗粒的毒害作用,待脂肪盐水混合液中无明显气味和油滴后,每组取出6份0.5 ml脂肪用于葡萄糖转移实验。另外,每组取出6份用做组织学检测。每组1.0 ml脂肪同法复苏处理后,测量其质量和体积后用于自体脂肪移植。
2.3 动物模型的制备 以相同方法获取并处理A组脂肪颗粒,每只大鼠获得约1.5 ml纯净脂肪颗粒,同样分做2份按上述用途分配。将大鼠背部皮肤备皮消毒后,于背部中线两侧分别做长约0.4 cm切口,以眼科剪分离皮下各形成大小约0.4 cm×0.4 cm空隙,两个空隙保持一定距离,分离时避免相通致脂肪融合,以1 ml注射器抽取0.5 ml脂肪接12号针头按标记分别注射于原脂肪来源大鼠皮下。以针尖蘸取亚甲蓝在受区形成的皮丘周围穿刺入皮下做标记,以便于其后脂肪移植物的获取。
2.4 移植物的获取 分别于脂肪颗粒移植后的1、3个月取出移植物,每组随机抽取6只大鼠,术区常规处理后,按术前标记切口完整剥离出背部两侧移植物,可见有明显的包膜包裹,有周围组织分界清楚,置于生理盐水中反复冲洗去除血液后以自制微刻度量筒测量体积并于电子天平称质量后,一侧移植物用于组织学检测,另一侧移植物用于移植物活性的检测。
2.5 脂肪颗粒和脂肪移植物的组织学检测 将每组6份0.5 ml脂肪颗粒经洗涤后,以滤纸包裹后放于包埋盒中,以4%中性甲醛固定24~48 h,脂肪移植物直接入甲醛固定。石蜡切片的制备:⑴脂肪从甲醛中取出后流水下冲洗约30 min。⑵脱水。⑶透明。⑷浸蜡。⑸包埋。⑹切片。⑺捞片。⑻烤片。苏木素-伊红染色:⑴石蜡切片常规脱蜡入水。⑵水洗。⑶苏木素染色10 min。⑷充分水洗。⑸盐酸乙醇分色。⑹水洗。⑺氨水蓝化2~3 min。⑻充分水洗。⑼0.5%~1.0%伊红染色0.5 min左右。⑽脱水透明。中性树胶封片。免疫组化步骤:⑴石蜡切片常规脱蜡入水。⑵滴加去离子水双氧水室温下孵育约10 min,阻断内源性过氧化物酶。⑶抗原修复。⑷滴加一抗,室温中孵育1 h,PBS漂洗3次,每次2 min。⑸滴加试剂1。⑹滴加试剂2。⑺DAB显色。⑻于苏木素中染色5 min,分化液中浸数秒后,自来水洗净,兰化液中浸数秒后自来水洗净。⑼于梯度乙醇中逐步脱水,擦干玻片后封片。
2.6 葡萄糖转移实验 将冲洗后的脂肪颗粒静置后去除底层的生理盐水和杂质沉淀后,将每份0.3 ml脂肪颗粒置于无菌培养皿中,每组6个标本,同时每组设置一个空白标本,以3个空白标本葡萄糖浓度的平均值作为基础浓度。于每个培养皿中加入4.0 ml含低糖无血清的DMEM,同时加入8 μl正规胰岛素,所有标本摇均后置于37℃、5%CO2恒温孵育箱中,孵育40 min后取出,抽取其中的澄清培养液体置于全自动生化分析仪中检测DMEM中葡萄糖浓度。基础浓度与每个样本中葡萄糖浓度的差值即为该脂肪颗粒样本的葡萄糖转移量。葡萄糖转移量的多少即代表脂肪颗粒活性的高低。移植物取出后,去除其中的结缔组织后,剪碎成大小为1.0 mm×1.0 mm×1.0 mm的颗粒,以600 r/min离心后,取上层颗粒组织0.3 ml,同法进行葡萄糖转移实验。
2.7 MTT法测定移植物颗粒的活性 将进行葡萄糖转移实验后的移植物颗粒,经PBS冲洗去除DMEM后,分别加入到离心管中,每管加入1 mg/ml Ⅰ型胶原酶0.6 ml孵育消化45 min后,250 r/min离心5 min,再加入PBS后震荡,终止消化,静置后每管中吸取出150 μl乳糜样悬液置于EP管中,每管加入40 μl浓度5 mg/ml的MTT,置于37℃温箱中反应3 h,反应完成后每管样本中加入异丙醇100 μl,震荡并低速离心30 s后加入葵花籽油,每管吸取50 μl上层蓝紫色液体,注入96孔板中,每组样本设置一空白孔,不添加脂肪颗粒而其他试剂及操作程序相同,同样取上层液体50 μl,将96孔板置于酶联免疫检测仪内,检测在492 nm下各样本的吸光度值(D492)。以3个空白孔的吸光度值平均值作为基础值,各个样本的吸光度值减去基础值即为该样本的活性值。
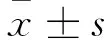
3 结果
3.1 肉眼观察 在-80℃、-196℃条件下储存的脂肪颗粒未见脂滴液化、细胞破碎后纤维状组织,与新鲜脂肪颗粒相比,除表面略暗缺少光泽外,并无其他差别。脂肪移植后1个月,A组移植物质地为中等硬度,成纽扣状弹性较好,表面可见到较多血管形成;B组、C组下脂肪移植物质地较软,表面也可见血管长如,外观上无明显差别(图1),脂肪移植后3个月,3组脂肪移植物均较软,表面可见蜂窝状结构,B组较A、C组移植物表面略显苍白。A、C组间外观上无明显不同(图2)。
3.2 体积分析 脂肪颗粒移植后3组体积在3个月内随时间延长体积逐渐缩小,各组数据经独立样本的t检验其正态性后,均服从近似正态分布(表1)。
3.3 葡萄糖转移实验结果分析 脂肪颗粒经冻存3个月后,与新鲜脂肪颗粒活性相比,B组、C组脂肪颗粒活性分别达到62.5%、68.7%。两组差异具有统计学意义(P<0.05,表2)。MTT实验结果见表3。
3.4 微血管密度分析 微血管经免疫组化处理后CD34附着于血管内皮细胞呈棕黄色,其微血管形态不规则,管腔由棕黄色的两个或更多的内皮细胞围成,其内可见渗出的颗粒状红细胞,有的血管呈条索状而无明显的管腔或只见成团的染色的内皮细胞。我们以每个样本3张切片在200倍显微镜下4个周边区和1个中央区的平均微血管数量为该样本的微血管密度值。3组在注射后3个月的微血管密度均大于同组注射后1个月的微血管,t检验分析,A组P=0.008,B组P=0.021,C组P=0.002,见表4。
3.5HE染色 注射前,3组脂肪颗粒在显微镜下观察无明显差异(图3)。注射后1个月,新鲜组移植物镜下可见少量完整的脂肪细胞多位于外周,大量脂肪坏死融合后形成的脂肪空泡位于中央区,多体积小,空泡间隔也较小,空泡周围大量中性粒细胞和淋巴细胞浸润,3个月后炎症细胞明显减少,可见大量增生的血管,管腔扩张充血。-80℃下存储的脂肪颗粒移植1个月后,大小不等的脂肪空泡满布视野,且脂肪空泡较大,可见密集的中性粒细胞、淋巴细胞及异物巨噬细胞增生。移植3个月后,可见大量边界清晰的形状不规则的脂肪大空泡。-196℃存储脂肪颗粒移植1个月后,小脂肪空泡较多且较密集,移植3个月后可见体积较大的脂肪空泡主要集中在中央区,外周区可见大量密集排列的具有细胞核的完整脂肪细胞,细胞膜清晰,炎症细胞罕见(图4,5)。各组CD34染色结果可见(图6,7)。
4 讨论
-80℃、-196℃ 条件下储存脂肪颗粒在移植后较好地维持了原注射脂肪的体积,均在40%以上。尤其是-196℃存储的脂肪在移植后1个月平均达到原体积的51%,且在移植物活性方面更优越于新鲜脂肪的注射效果。如果仅考虑注射的填充效果及体积因素,短期内,-80℃、-196℃ 条件下储存的脂肪颗粒满足临床脂肪重复注射的需求;-80℃、-196℃ 条件下冻存3个月后的脂肪颗粒较好地保持了脂肪颗粒的活性;-196℃ 组在脂肪移植3个月后,脂肪颗粒活性大于1个月的活性。表明-196℃下冻存的脂肪颗粒适应受区缺血、缺氧及炎症反应环境的能力强,长期注射后效果会较好;-80℃下存储的脂肪颗粒移植后随时间推移脂肪移植物成活率、活性变化较小,表明耐受受区环境的能力较差,可能由于其中促进脂肪颗粒成活的活性因子减少或活性降低明显,脂肪细胞增殖的能力下降。⑸脂肪移植后1个月,移植物在受区内的炎症反应较重,脂肪细胞此时也是耐受缺血适应受区环境的关键时期,脂肪细胞在这个时间内破坏融合严重,表现在该时期的血管在炎症作用血管扩张、管腔扩张、渗出较明显及大量吞噬细胞吞噬坏死的脂肪细胞。这可能也是导致移植物颗粒活性的下降在该时期内最明显的原因。⑹移植后脂肪颗粒存活的首要是建立血供,通过外周血管长入或与原脂肪颗粒中的毛细血管完成对接来建立,因此,移植后脂肪细胞的存活及脂肪颗粒的活性与微血管的形成存在密切的相关性,而脂肪颗粒活性好的血管也较密集说明活性越高越利于血管的形成,而血管的形成又可促进移植后脂肪移植物的存活。
表1 不同时期各组脂肪移植物的体积
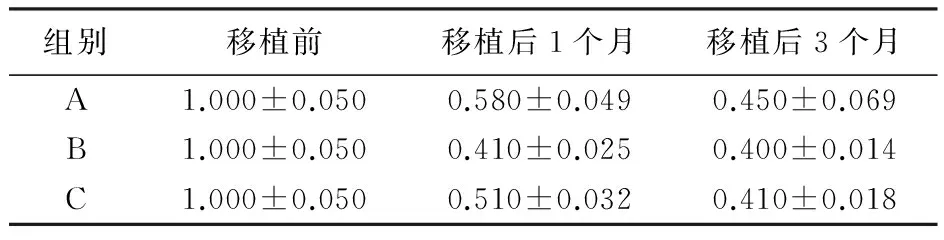
组别移植前移植后1个月移植后3个月A1.000±0.0500.580±0.0490.450±0.069B1.000±0.0500.410±0.0250.400±0.014C1.000±0.0500.510±0.0320.410±0.018
表2 各组在不同时期葡萄糖的转移量

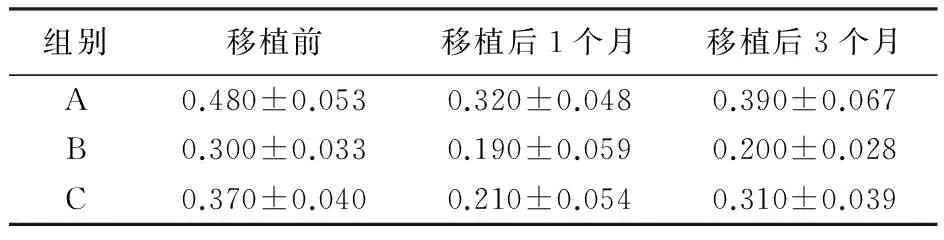
组别移植前移植后1个月移植后3个月A0.480±0.0530.320±0.0480.390±0.067B0.300±0.0330.190±0.0590.200±0.028C0.370±0.0400.210±0.0540.310±0.039

表3 不同时期各组的OD值
注:同组不同时间比较,P<0.05
表4 不同时期各组移植物微血管的密度
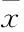

组别移植后1个月移植后3个月A5.22±0.776.74±0.66B2.31±0.443.15±0.47C4.10±0.565.68±0.69
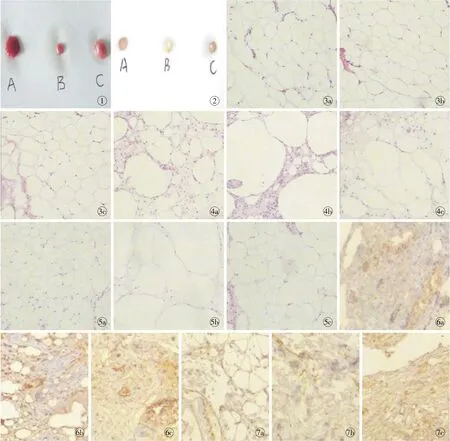
图1 移植后1个月各组脂肪移植物 图2 移植后3个月各组脂肪移植物 图3 注射前3组脂肪颗粒HE染色(×100)a.A组b.B组c.C组 图4 注射后1个月各组脂肪移植物HE染色(×100)a.A组b.B组c.C组 图5 注射后3个月各组脂肪移植物HE染色(×100)a.A组b.B组c.C组 图6 注射后1个月各组脂肪移植物CD34染色(×100)a.A组b.B组c.C组图7 注射后3个月各组脂肪移植物CD34染色(×100)a.A组b.B组c.C组
Fig 1 Fat transplants after transplantation at 1 month. Fig 2 Fat grafts after transplantation for 3 months. Fig 3 Fat granules before injection in the different groups (HE×100). a. A group. b. B group. c. C group. Fig 4 Fat transplants after injection at 1 month (HE ×100).a. A group. b. B group. c. C group. Fig 5 Fat transplants after injection at 3 months (HE ×100). a. A group. b. B group. c. C group. Fig 6 Fat transplants after injection at 1 month (CD34 ×200). a. A group. b. B group. c. C group. Fig 7 Fat transplants after injection at 3 months (CD34 ×200). a. A group. b. B group. c. C group.
-196℃及-80℃ 条件下短期内12周冻存脂肪颗粒具有可行性,适用于临床移植需求。移植的脂肪不具有永久性,其吸收率据报道可达30%~70%[1-2],由于其较高且不定的吸收率导致临床结果的不确定,注射后往往达不到预期效果,解决这种问题的方法主要有两种,过量注射和重复注射,而过量注射存在后期填充过度的可能会影响手术效果,而重复注射需要重复获取脂肪,其操作会增加手术花费和手术风险,增加了整形医师的工作量,同时给患者增加更多痛苦和不适,而且给患者的脂肪抽吸术术区带来重复创伤[3-4],增加了许多并发症的可能性[5]。而经脂肪抽吸术获得的脂肪颗粒在完成重复注射后,多余的脂肪颗粒往往被丢弃,使得在未来可能用于该患者2、3次脂肪移植的材料被浪费掉,因此,将第1次注射后的多余脂肪通过低温的方法保存起来以备注射,是避免重复抽取脂肪的好方法。许多脂肪获取和制备的技术被介绍,以获得更好更实用的脂肪细胞存活性和可预测的临床结果[6-7],但关于脂肪颗粒冻存移植后成活率的临床和实验报道所得出的结论往往不一致。2012年,BW Li通过吸脂术获取脂肪保存于生理盐水后经预冷后冻存在-20℃、-80℃、-196℃,2、7 d后,测定活性。冻存2、4周后注射于裸鼠,3个月后移植物取出后做组织学检测,结果体内、体外实验检测细胞活性在3种温度下无明显差异。Shoshani和Pu等[8-9]将保存在-80℃的脂肪颗粒注射于裸鼠,结果表明,脂肪可以通过冷冻保存,且其效果与直接注射新鲜脂肪相近。WL Murillo报道了1例以1260 ml冻存脂肪注射于臀部进行丰臀的患者,经6~48个月的随访,临床评估和MRI显示,脂肪成活率达到80%,并认为适宜的冻存脂肪可以补充被重吸收的部分而无须重复获取脂肪操作[10]。笔者阅读文献及结合实际认为,造成实验结果不一致的原因可能与脂肪来源、移植宿主、脂肪颗粒的获取方式、脂肪颗粒的纯化制备方法、冻存及复苏的方法、移植前脂肪颗粒中是否加入bFGF、Ang-1 、VEGF等促生长物质[11-12]、注射层面及手术无菌操作有关,因此,从以上等因素入手对整个操作程序进行优化,可达到提高冻存脂肪移植后成活率的目的,从而取得更好的临床效果。
[1] 李春明, 刘 毅. 体外培养的人脂肪间充质干细胞生物学特性的研究[J]. 中国美容医学, 2007,16(2):159-162.
[2] Guerrerosantos J. Long-term outcome of autologous fat transplantation in aesthetic-facial recontouring[J]. Clin Plast Surg, 2000,27(4):515-543.
[3] Kaufman MR, Miller TA, Huang C, et al. Autologous fat transfer for facial recontouring: Is there science behind the art?[J] . Plast Reconstr Surg, 2007,119(7):2287-2296.
[4] Shoshani O, Ullmann Y, Shupak A, et al. The role of frozen storage in preserving adipose tissue obtained by suction-assisted lipect-omy for repeated fat injection procedures[J]. Dermatol Surg, 2001,27(7):645-647.
[5] Tambasco D, Arena V, Finocchi V, et al. The impact of liposuction cannula size on adipocyte viability[J]. Ann Plast Surg, 2014,73(2):249-251.
[6] 王 昕, 陈小平, 林金德, 等. 自体富血小板纤维蛋白-颗粒脂肪行面部美容性注射的临床应用和评价[J]. 中国美容整形外科杂志, 2015,26(11):666-669.
[7] 刘 萍, 刘 毅, 李世龙, 等. 额部美学分区在颗粒脂肪移植隆额中的意义[J]. 中国美容整形外科杂志, 2015,26(11):685.
[8] Shoshani O, Ullmann Y, Shupak A, et al. The role of frozen storage in preserving adipose tissue obtained by suction-assisted lipect-omy for repeated fat injection procedures[J]. Dermatol Surg, 2001,27(7):645-647.
[9] Pu LL, Coleman SR, Cui X, et al. Autologons fat haversted and refined by the coleman technique:A comparative study[J]. Plast Reconstr Surg, 2008,122(3):932-937.
[10] Murillo WL. Buttock augmentation: case studies of fat injection monitore-d by magnetic resonance imaging[J]. Plast Reconstr Surg, 2004,114:1606-1616.
[11] 李发成, 程 琳. 自体脂肪颗粒注射隆乳术305例临床分析[J]. 中国美容整形外科杂志, 2015,26(8):463-465.
[12] Planat-Bénard V, Menard C, André M.Spontaneous cardiomyocyte,different from adipose tissue stroma cells[J].Circ Res,2004,94(2):223-229.
Study of survival rate of auto-transplanted rat fat stored in different low temperature conditions
ZHANGGuang-yu,YUDong-mei,LUOSai,HAOLi-jun.
(PlasticandCosmeticCenter,TheFirstAffiliatedHospitalofHarbinMedicalUniversity,Harbin150001,China)
HAOLi-jun,Email:lijunhao368@163.com
Objective To explore the survival rate of rat fat stored in -80℃ and -196℃ at 1~3 months after autotransplantation, further detecting the history and activity of transplanted fat. Methods Laboratory animals were grouped, fat particles were harvested and treated, and then the fat particles were taken out and detected at 3 months after cryopreservati; animal models were prepared to harvest fat transplants, and histological activity of fat particles and transplants was detected. Glucose transportation test was also performed. Results The survival ratio of transplants in the A group was greater than that in the C group, which was greater than that in the B group at one month after transplantation (P<0.05);therewasnosignificantdifferenceamongthethreegroupsat3months.SurvivalratiosofAgroupandCgroupat3monthswerefewerthanthatinonemonth,buttheBgroupremainedthesamevolumeoftransplantsatthetwoperiods. Conclusion Under -80℃, -196℃, the volume and activity of the stored fat were well-kept after transplantation. The histology and activity of the fat stored at -196℃ were almost the same as the fresh fat. Therefore, the fat tissues stored in -80℃, -196℃ container can meet the needs of the repeated clinical injection within a short period.
Fat granule; Cryopreservation; Auto transplantation; Survival rate; Graft viability
150001 黑龙江 哈尔滨,哈尔滨医科大学附属第一医院 整形美容中心 第一作者:张广宇(1989-),男,黑龙江双鸭山人,住院医师,硕士. 通信作者:郝立君,150001,哈尔滨医科大学附属第一医院 整形美容中心,电子信箱:lijunhao368@163.com
10.3969/j.issn.1673-7040.2016.03.020
R-332;R
A
1673-7040(2016)03-0181-05
2015-12-15)
