兔出血症病毒抗体的实验室检测能力验证结果评价
2016-07-15付瑞王洪王淑菁李晓波王吉卫礼岳秉飞
付瑞,王洪,王淑菁,李晓波,王吉,卫礼,岳秉飞
(中国食品药品检定研究院,北京 100050)
兔出血症病毒抗体的实验室检测能力验证结果评价
付瑞,王洪,王淑菁,李晓波,王吉,卫礼,岳秉飞*
(中国食品药品检定研究院,北京 100050)
【摘要】目的 通过兔出血症病毒抗体检测能力验证计划,了解实验动物检测机构检验能力,提高实验动物质量检测水平。方法 按照CNAS批准的能力验证方案,通过筛选血清制备样品,经过稳定性和均匀性检验合格,作为能力验证样品。采用随机编号,发样给参加单位,并附作业指导书。在规定时限提交检验报告和原始记录复印件,其结果与样品预检结果一致的判为满意结果,不一致或未能提交结果的判为不满意结果。结果 来自14个省市自治区的20个实验室报名参加本次比对实验,均在规定时间内反馈了检测结果,17个实验室检测结果为合格或优秀,占参加比对实验室的85%。在20个实验室中,14个实验室采用了酶联免疫吸附实验(ELISA)方法,6个实验室采用血凝抑制实验(HAI)方法。结论 全国各实验动物检测机构兔出血症病毒抗体总体检测能力较高,实施能力验证计划能够反映实验室的检测水平。
【关键词】兔出血症病毒;能力验证;酶联免疫吸附实验;血凝抑制实验
兔出血症(rabbit hemorrhagic disease,RHD)是由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起的一种急性、致死性传染病,对易感兔群的致病率达90%,病死率可高达100%,是对兔的一种毁灭性传染病[1]。兔出血症病毒是实验动物必须排除的病源微生物之一。
实验动物国家标准中规定采用血凝抑制(hemagglutination inhibition assay,HAI)的方法对实验用兔中兔出血症病毒抗体进行检测[2],基础级兔如果接种疫苗,HAI抗体效价应大于1∶10,同时免疫抗体合格率[(被检动物抗体阳性数/被检动物总数)×100%]大于等于70%判定该兔群免疫合格;清洁级和SPF兔HAI抗体效价应小于等于1∶10。该检测方法操作较为繁琐,对操作人员的能力要求较高。
为了提高国内实验动物质量检测实验室的整体水平,中国食品药品检定研究院组织实施了全国范围实验动物检测实验室间兔出血症病毒抗体检测能力比对,目的是要了解参加实验室在本检测项目上的技术水平和能力,分析考察实验室间差异,发现并解决检验中存在的问题,促进各实验室加强质量管理,提高检测水平。
1 材料与方法
1.1 样品来源
强阳性样品和弱阳性样品筛选自北京地区实验动物监督检验所收集的基础级兔血清;阴性样品采自中国食品药品检定研究院实验动物生产供应室提供的SPF级家兔。
1.2 组织及实施单位
本次能力验证代码为“NIFDC-PT-021”,由中国食品药品检定研究院组织并实施。
1.3 参加单位
本次比对面向全国从事实验动物检测工作的实验室,报名参加本次比对实验的共20个实验室,所有实验室均在截止日期前反馈结果。
1.4 样品的制备与分装
1)样品的筛选及检定:收集来自北京地区实验动物监督检验的基础级兔血清共210份,按照实验动物国家标准[3]进行检验,分别测定 HAI抗体效价;采用心脏采血的方法采集SPF家兔血,8000 r/ min离心10 min,收集SPF家兔血清共50 mL,按照上述方法进行检验,测定其HAI抗体效价。
2)强阳性样品的制备与分装:集中经检验HAI抗体效价≥1∶80的兔血清,混匀后进行分装,每支300 μL,共分装100支。
3)弱阳性样品的制备与分装:集中经检验HAI抗体效价为1∶20的兔血清样品,混匀后进行分装,每支300 μL,共分装100支。
4)阴性样品的制备与分装:集中经检验HAI抗体效价≤1∶10的SPF兔血清,混匀后进行分装,每支300 μL,共分装100支。
1.5 样品稳定性测试[4]
从分装的强阳性、弱阳性和阴性样品中各取5支,分别放置于37℃恒温培养箱中,分别于放置的0、24、48、72 h和 96 h分别各取一支,冻存于-20℃,作为稳定性样品,采用血凝抑制法分别测定各样品HAI抗体效价。
1.6 样品均一性测试
从分装的强阳性、弱阳性和阴性样品中各随机抽取8支,采用血凝抑制法分别测定各样品HAI效价,以确定分装各样品的均一性。
1.7 样品发放及结果反馈
采用随机编号的方法分别对各样品进行编号,编号规则为:CB-VIR-随机编号。每个参加实验室提供3份兔血清样品,每份1管,装量300 μL,性状为透明澄清液体。样品采用内外双层包装冷链运输,内层为封口膜密封,外层用透明塑料自封袋包装。
各实验室在收到样品时,首先确认样品是否完好,并填写《被测物品接收状态确认表》。检测实验室于15个工作日内完成检测工作,并填写《实验兔血清中兔出血症病毒抗体检测结果报告单》,同时将《被测物品接收状态确认表》、《实验兔血清中兔出血症病毒抗体检测结果报告单》、原始记录复印件和正式检测报告返回能力验证组织单位(中国食品药品检定研究院)。
1.8 结果评价原则[5]
本次检测为定性检测,结果以兔出血症病毒抗体阳性或阴性来表示,每个参加单位分发3个样本,样本经比对实施机构(中国食品食品药品检定研究院)检测已经确定阳性或阴性,参加比对的实验室对发放的样本按照国标进行定性检测,最后将检测结果与实施机构的结果进行比较确认是否相符。
本次计划以下列准则评价参加者的结果,即:实验室结果与标准结果完全一致,即判定为优秀;强阳性结果以及阴性结果与标准结果一致,弱阳性结果与标准结果不一致,即判定为合格;强阳性结果或者阴性结果与标准结果不一致,即判定为不合格;未按时限反馈结果,即判定为不合格。
2 结果
2.1 参加实验室分布
全国14个省市共20家实验室报名参加本次能力验证计划,实际参加20家,其中省级实验动物质检系统实验室15家(含国家质检中心),高校以及企业内部实验室3家,省级疾病预防控制中心实验室和省级药检院实验室各1家,20家实验室均反馈了结果。
2.2 样品稳定性检测结果
取强阳性样本、弱阳性样本和阴性样本各5份,于37℃下放置0、24、48、72 h和96 h,测定其HAI抗体效价,均应符合标准(见表1)。
2.3 样品均一性检测结果
将强阳性样本、弱阳性样本和阴性样本分别分装成100份,各取8份进行检测,强阳性样本RHDV抗体HAI效价应≥1∶80,弱阳性样本RHDV抗体HAI效价应≥1∶20并<1∶80,阴性样本RHDV抗体HAI效价应≤1∶10(见表2)。
2.4 各实验室结果分析
参加验证的20家实验室,全部反馈了实验结果,反馈实验结果的17家单位均符合预期,大部分实验室的原始记录比较详细明了,检测结果真实可信,效果比较满意。满意率为85%(见表3)。

表1 样品37℃稳定性试验结果Tab.1 Stability of the samples at 37℃

表2 样品均一性检测结果Tab.2 Detection of the uniformity of the samples
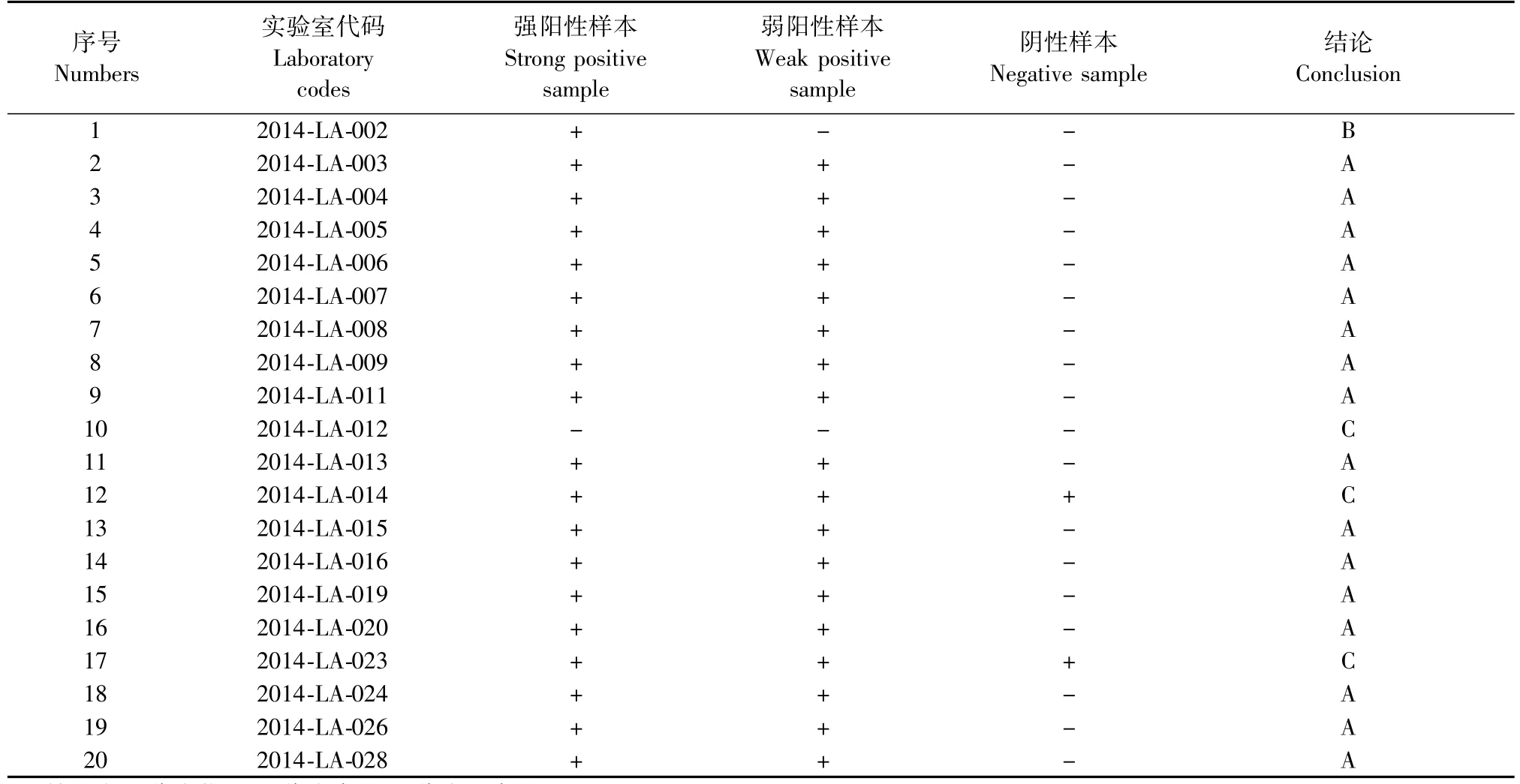
表3 实验室比对实验结果分析Tab.3 Comparative analysis of the results of different laboratories
3 讨论
由于至今还没有适于RHDV增殖的敏感细胞,使得RHDV的检测成为实验动物质量控制中的一个难点。RHDV只和人红血球发生凝集反应,与兔或其他哺乳动物红血球均无凝集反应。这是因为人红血球上存在ABH抗原,而其他哺乳动物均无此抗原[6]。用人“O”型血球和RHDV抗原进行的血凝抑制试验仍是目前经常采用的病毒抗体诊断方法,但是有些RHDV的病毒株在通常温度下没有血凝反应,而且血凝抑制实验操作较为繁杂,受实验人操作手法影响较大。而酶联免疫吸附试验(ELISA)在某种程度上比血凝抑制实验灵敏度更高,更易于标准化。
本次能力验证共有20个实验室参加,全部实验室均反馈结果,仅有3个实验室为不合格结果,合格率达到85%。其中12个实验室仅采用酶联免疫吸附试验(ELISA)方法,2个实验室同时采用了ELISA和血凝抑制(HAI)两种方法,在14个采用ELISA检测方法的实验室中,12个实验室采用进口试剂盒(XpressBio公司),结果均为优秀;1个实验室未注明试剂盒来源,结果为优秀;1个实验室采用国产试剂盒,结果为不合格。其余6个实验室均采用HAI方法,其中3个实验室为优秀结果。其中14个采用ELISA检测方法的实验室对于弱阳性样品检测结果均为阳性,8个采用了HAI检测方法的实验室对弱阳性样品检测结果5个为阳性。分析表明ELISA检测方法具有更好的灵敏度。
参考文献
[1] 田克恭,贺争鸣,刘群,等.实验动物疫病学[M].中国农业出版社,2015.
[2] GB/T14926.21-2008[S].2008.
[3] GB/T14926.54-2001[S].2001:15-18.
[4] 中国合格评定国家认可委员会.能力验证样品均匀性和稳定性评价指南[S].CNAS-GL03,2006.
[5] 中国合格评定国家认可委员会.能力验证结果的统计处理和能力评价指南[S].CNAS-GL02,2006.
[6] Ruvoen-Clouet N,Ganiere JP,André-Fontaine G,et al.Binding of rabbit hemorrhagic disease virus to antigens of the ABH histoblood group family[J].J Virol.2000,74(24):11950-11954.
Evaluation of the proficiency of laboratories for detection of rabbit hemorrhagic disease virus antibody
FU Rui,WANG Hong,WANG Shu-jing,LI Xiao-bo,WANG Ji,WEI Li,YUE Bing-fei*
(National Institutes for Food and Drug Control,Beijing 100050,China)
【Abstract】Objective Through the detection of rabbit hemorrhagic disease virus(RHDV)antibody,to investigate the capacity of experimental animal quality control laboratories,so as to improve their detection proficiency.Methods According to the program approved by CNAS,the screened samples were numbered randomly and tested for their stability and homogeneity.The random samples were issued to the participant laboratories with the Standard Operation Procedure (SOP).The participant laboratories must submit the test reports and original records in time.The feedback results were judged by the rate of concordance with the anticipated results.Results Twenty laboratories from 14 provinces were enrolled in the evaluation,and all of them submitted detection results on time.ELISA methods were used in 14 laboratories,and hemagglutination inhibition(HAI)assay was used in 6 laboratories.The results of 17 laboratories were marked as pass or excellent,with a rate of pass of 85%.Conclusions The ability for detection of RHDV antibody in animal test laboratories in China is high.The implementation of capacity testing can reflect the level of quality control laboratories.
【Key words】Rabbit hemorrhagic disease virus;Proficiency testing;ELISA;Hemagglutination inhibition assay,HAI
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0188-04
Doi:10.3969/j.issn.1005-4847.2016.02.014
[基金项目]国家科技支撑计划(2015BAI07B02):实验用动物病原分子生物学快速检测新技术研究与应用。
[作者简介]付瑞(1978-),男,副研究员,研究方向:实验动物病毒学。Email:furui78@126.com
[通讯作者]岳秉飞(1960-),研究员;研究方向:实验动物学;Email:y6784@126.com
Corresponding author:YUE Bing-fei,Email:y6784@126.com
[收稿日期]2016-01-13
