实验小鼠呼肠孤病毒Ⅲ型抗体的实验室检测能力验证结果评价
2016-07-15王吉付瑞李晓波王淑菁卫礼邢进冯育芳王洪岳秉飞
王吉,付瑞,李晓波,王淑菁,卫礼,邢进,冯育芳,王洪,岳秉飞
(中国食品药品检定研究院,北京 100050)
专题研究
实验小鼠呼肠孤病毒Ⅲ型抗体的实验室检测能力验证结果评价
王吉,付瑞,李晓波,王淑菁,卫礼,邢进,冯育芳,王洪,岳秉飞*
(中国食品药品检定研究院,北京 100050)
【编者按】实验动物质量检测作为质量控制的重要手段,其质量保证体系运行是否有效备受关注。如何检验一个检测室能力是否稳定?参加能力验证(Proficiency Testing,PT)是有效方式之一。能力验证是利用实验室间比对来确定实验室检测能力的质量评价活动。参加能力验证,不仅为实验室提供了一个评价和证明自身检测能力,出具科学结果的重要手段,而且提供了一种有效的外部质量监控方式。同时也为实验室提供了一个寻求改进和提高的契机。为政府和社会了解实验室检测能力的重要方式。近些年,国内实验动物检测实验室进行了多项能力验证计划,对强化质量管理、提高我国实验动物质量检测网络水平发挥了重要作用,为推动实验动物质量检测能力验证工作,专题组织者将近两年开展的能力验证项目进行总结,整理成文,供各位同仁一起研讨。
【摘要】目的 通过实验小鼠呼肠孤病毒Ⅲ型抗体检测能力验证计划,了解实验动物检测机构检验能力,提高实验动物质量检测水平。方法 按照CNAS批准的能力验证方案,血清经过标定后,经过稳定性和均匀性检验合格,作为能力验证样品。采用随机编号,发样给参加单位,并附作业指导书。在规定时限提交检验报告和原始记录复印件,其结果与样品预检结果一致的判为满意结果,不一致或未能提交结果的判为不满意结果。结果 共有17个省市的27个实验动物检测机构报名参加本次能力验证项目。27个检测机构均提交了满意结果,占总参加机构的100%。采用酶联免疫吸附实验(ELISA)方法的有26个检测机构,采用免疫荧光实验(IFA)方法的有1个检测机构。结论 实验动物质量检测机构实验小鼠呼肠孤病毒Ⅲ型抗体检测能力较高,实施能力验证计划能够反映实验室的检测水平。
【关键词】呼肠孤病毒Ⅲ型;检测能力验证;酶联免疫吸附实验;免疫荧光实验
为了进一步提高我国实验动物质量检测相关机构的整体检测水平,2015年由中国合格评定国家认可委员会(CNAS)组织,中国食品药品检定研究院计划实施了全国范围内实验动物检测机构实验小鼠呼肠孤病毒IⅡ型抗体检测能力验证计划。
呼肠孤病毒IⅡ型(mammalian orthoreovirus 3,Reo3)属呼肠孤病毒科的正呼肠孤病毒属。此种病毒可感染所有哺乳动物,包括小鼠、地鼠、豚鼠、猫和犬等[1-3]。并且能在猴、豚鼠、地鼠、猫、狗、猪和牛的原代肾细胞以及Hela、KB、FL和L细胞等传代细胞中增殖并引起细胞病变。Reo3也能感染人,能引起儿童腹泻、呼吸道感染及脑膜炎等疾病[1,2-5]。Reo3是SPF等级实验动物必须排除的病原微生物之一。实验动物国家标准中规定可以采用酶联免疫吸附实验(ELISA)、免疫荧光试验(IFA)和免疫酶试验(IEA)开展对SPF实验小鼠体内呼肠孤病毒Ⅲ型抗体的检测[6-9]。
其目的是要了解我国目前实验动物检测机构在实验小鼠呼肠孤病毒Ⅲ型抗体检测方面的技术水平和能力。通过比较各检测机构检测结果的不同,分析产生不同检测结果的原因,解决目前在我国实验动物检验中存在的问题,从而促进我国实验动物检测机构整体检测技术水平的提高。
1 材料与方法
1.1 能力验证计划开展
验证项目:实验小鼠呼肠孤病毒Ⅲ型抗体检测;开展时间:2015年10月;验证代码:NIFDC-PT-036;组织单位:中国合格评定国家认可委员会(CNAS);计划实施单位:中国食品药品检定研究院(以下简称中检院)。
1.2 能力验证计划的发布
本次能力验证计划实施前6个月在全国实验动物检测网络公开,面向全国实验动物检测机构。国内具备实验动物检测检测能力和资质的所有实验动物检测机构相关实验室均可报名参加。并规定了能力验证时间及检测结果反馈截至时间。
1.3 能力验证主要实验材料
实验小鼠呼肠孤病毒Ⅲ型(Reo3)抗体阳性血清、实验小鼠呼肠孤病毒Ⅲ型(Reo3)抗体阴性血清:本室冻存;呼肠孤病毒Ⅲ型(Reo3)抗原包被板和抗原片:本室制备;羊抗小鼠IgG-HRP、羊抗小鼠IgG-FITC:KPL公司;商品化实验小鼠呼肠孤病毒Ⅲ型抗体ELISA试剂盒:国外某公司产品。
1.4 比对样本的检测及标定
此次比对实验需要3个样本(编号分别为样本1、样本2、样本3),3个样本肉眼观察性状均应为澄清、透明、无絮状物的淡黄色液体。3个样本按国标ELISA方法测定后,分别用 IFA方法和商品化ELISA检测试剂盒进行标定[7,9,10]。ELISA和 IFA均按国标要求进行操作[7,9],商品化试剂盒按说明书进行操作。
1.5 比对样本的分装及编号
取3个经过标定的样本各分装100支,每支150 μL。外包装均一致,样本性状颜色均一致。由实施单位将所有样本进行随机编号,并记录每支样本编号和相对应的结果。
1.6 样本均一性测定
3个比对样本随机各取15支用ELISA法测定其A值。通过计算这15支样本的A值的变异系数来评价样本的均一性[10]。
1.7 样本稳定性测定
3个比对样本各15支,分别于37℃下放置1、2、3、4、5、6、7、8、9、10、11、12、13、14、15 d,每天分别各取一支,冻存于-70℃,作为稳定性样品。采用ELISA方法分别测定各样本A值,计算3个样本放置15 d的相对偏差以评价样本的稳定性[10]。
1.8 样本的分发
将经过均一性和稳定性试验均符合要求的比对样本,分发给各报名参加比对单位。每个单位分发3个样本。并由实施单位记录不同单位相对应的样本编号,通过冷链保持低温运输。
1.9 方法的采用
本次能力验证在检测方法方面没有限定,各参加实验室既可以采用实验动物国家标准中规定的检测方法[6],也可以采用非标方法。
1.10 比对结果评价标准
此次比对实验为定性检测,样本检测结果以阴性(-)或阳性(+)来表示。比对单位在规定截至日期内反馈结果,并且3个样本的检测结果与实施单位分发样本的预期结果均相符,判为满意;比对单位未在截至日期内反馈结果,或者比对样本中有一个结果与预期结果不相符,则判为不满意[10-12]。
2 结果
2.1 参加此次能力验证计划检测机构及其编号规则
报名参加此次能力验证计划的共有国内27个实验动物检测机构。由中检院赋予每个检测机构一个代码,以“NIFDC-PT-036-编号”表示。凡说明参加机构反馈的检测结果及其评价,均以相应代码替代。
2.2 样本标定
经ELISA检测样本1和样本2为阳性,样本3为阴性。3个样本经IFA法和商品化ELISA试剂进行标定,检测结果完全相符,结果见表1。
2.3 样本均一性测定
3个样本A值的变异系数分别为4.5%、3.4% 和14.0%,结果见表2。
2.4 样本的稳定性测定
稳定性测定结果显示3个样本在37℃放置1~15 d相对偏差分别为2.7%、4.8%和13.9%,结果见表2。
2.5 参加能力验证实验室行业分布
经过统计,除15家实验动物检测机构参加此次能力验证外,还有各省市疾病预防控制中心4家、药品检定研究院1家、生物医药生产企业及科研院所等7家也参加了此次能力验证。
2.6 参加能力验证实验室地区分布
本次能力验证的27个国内检测机构,分别来自国内17个省/市/自治区。其中北京最多为4家,其次是江苏为3家,上海、广东、山东、四川、湖北分别为2家,天津、河北、辽宁、黑龙江、新疆、陕西、河南、浙江、江西、湖南各1家。涵盖了我国西北、西南、华北、华南、华东、东北及江浙、湖南及湖北等地区。
2.7 比对样本检测结果分析
参加比对的27个实验室均在规定时间内反馈了3个样本的检测结果。表3为27个实验室代码及其相对应的样本编号及其检测结果。
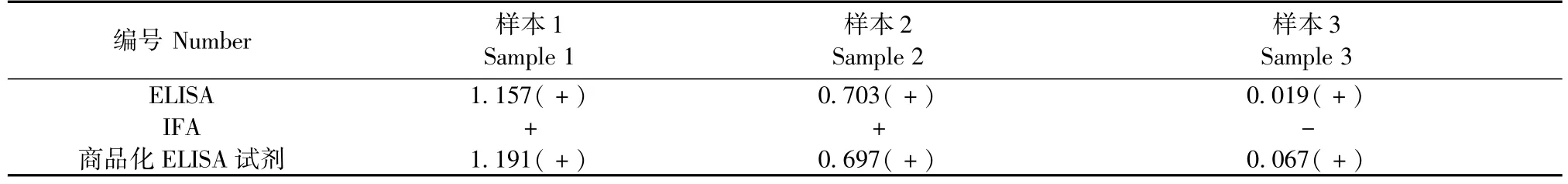
表1 比对样本标定结果(A值)Tab.1 Results of the sample calibration(A value)
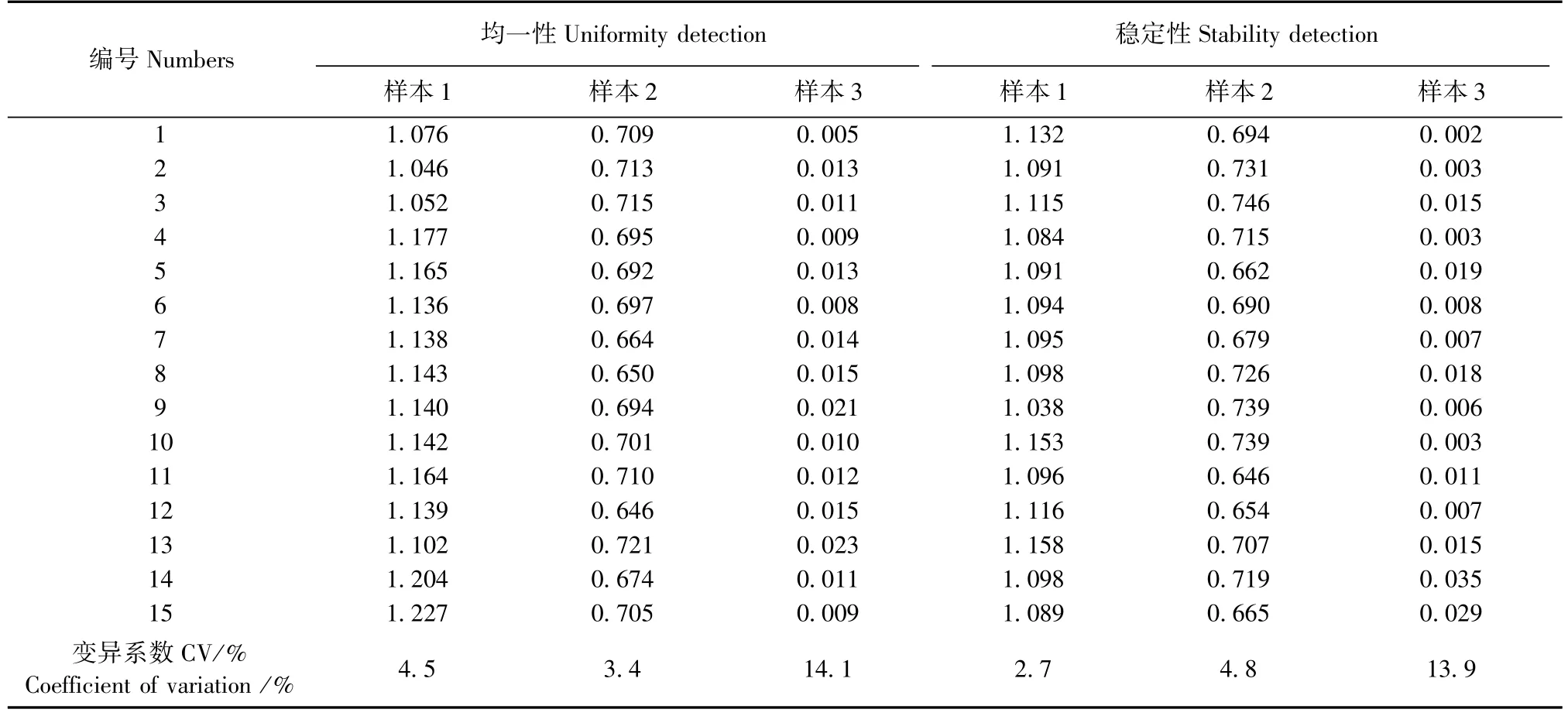
表2 样本均一性及稳定性测定结果(A值)Tab.2 Results of detection uniformity and detection stability of the samples(A value)
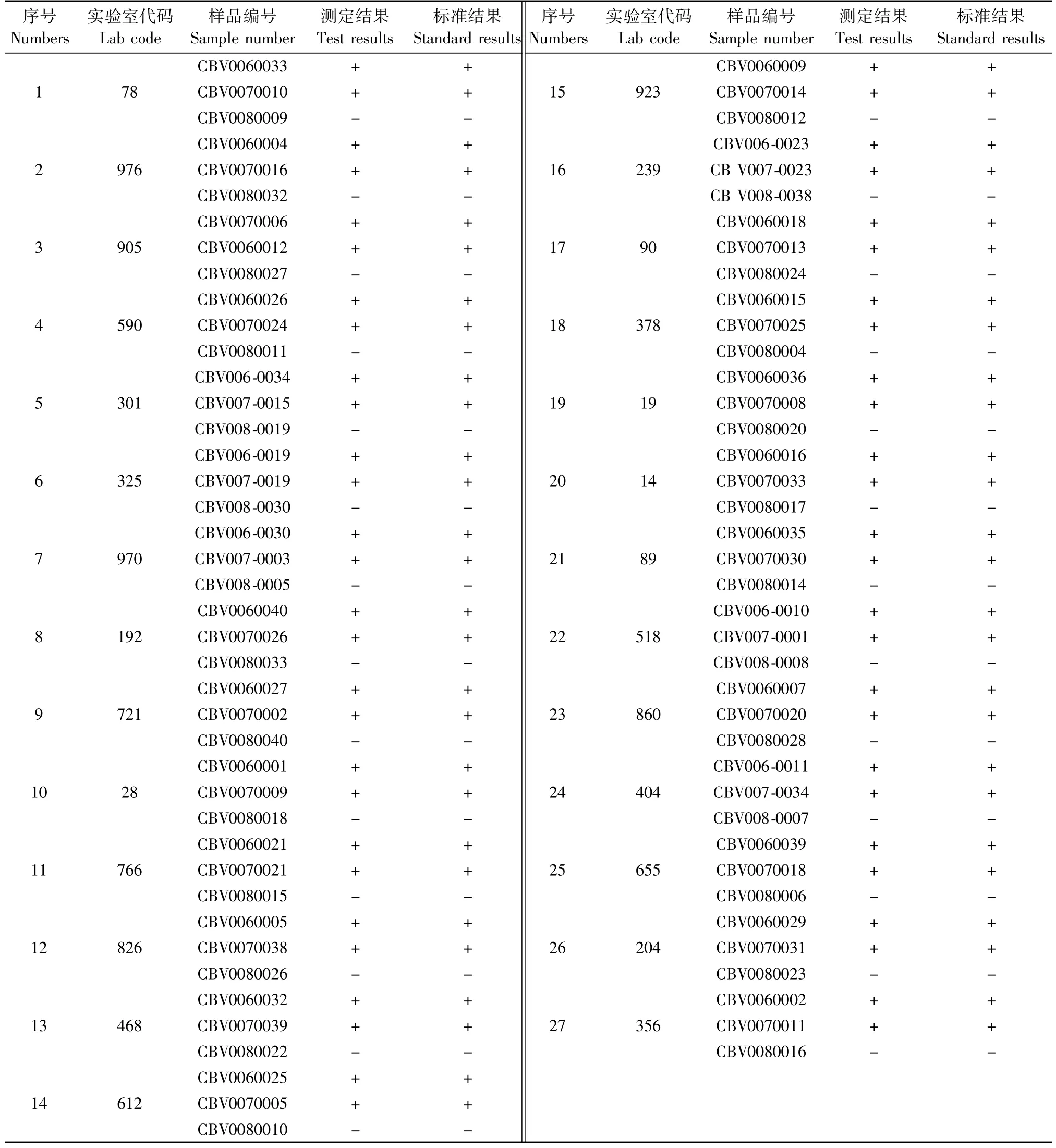
表3 实验室比对实验结果分析Tab.3 Comparison of the test results with standard results
从表3统计结果看,27个实验室在规定时间内反馈的各自的3个样本检测结果均与预期结果相符,此次比对实验27个实验室评价结果均为满意。
3 讨论
此次能力验证的比对样本应中国合格评定国家认可委员会(CNAS)要求,均做了标定和均一性、稳定性试验。标定结果显示2种方法(ELISA和IFA)检测结果完全一致;均一性实验结果显示3个样本的变异系数均小于15%;稳定性实验结果显示3个样本的相对偏差均小于25%。说明提供的3个样本均符合比对样本的要求[10-12]。
参加本次能力验证的27家实验室均在规定时间内反馈结果。有26家采用ELISA进行检测,有1家采用IFA进行检测,检测结果均与预期结果相符,满意率为100%。27家实验室的原始记录均清晰完整,检测结果真实可信。表明参加比对的27家实验室均具备检测实验小鼠呼肠孤病毒Ⅲ型抗体的能力。与本实验室2013年(2013年参加单位有13个省市17个单位,检测结果满意率为87.5%)开展的实验动物病毒项目能力验证计划比[10],此次能力比对实验参加的单位数量增多,检测结果满意率有所增加。由此可见我国具有实验动物质量检测能力的机构在增加,且检测能力和水平也在提高。
实验小鼠呼肠孤病毒Ⅲ检测现行国标推荐方法有酶联免疫吸附试验(ELISA)、免疫酶试验(IEA)和免疫荧光试验(IFA)[6]。27家实验室中有26家采用ELISA方法,且26家实验室检测结果符合率均为100%。由此可见酶联免疫吸附试验(ELISA)由于其具有微量、特异、高效、经济、方便、安全和结果客观等特点,仍被实验动物检测机构广泛应用[13]。26家采用ELISA方法检测实验室,有11家采用国内检测试剂盒进行检测,有10家采用国外检测试剂盒进行检测,说明国内和国外小鼠Reo3抗体ELISA检测试剂盒均可以用于实验小鼠呼肠孤病毒Ⅲ型的检测。有5家报告中没有提供试剂盒来源,建议在以后的比对实验报告中将试剂盒来源说明,以便对检测结果及检测试剂进行评价和分析,将更加有利于我国实验小鼠呼肠孤病毒Ⅲ型检测的开展及能力的提高。
实验动物国家标准中规定阳性检测结果需要复检,复检结果与初检结果一致,方可判为阳性[6]。从本次比对实验看,有部分实验室对阳性结果进行了复检,符合实验动物国家标准中实验小鼠呼肠孤病毒Ⅲ型检测结果的判定。建议其他实验室对阳性检测结果进行复检方可对检测样本进行结果判定,既符合国标检测要求,又使结果更加真实可靠。
参考文献
[1] 田克恭.实验动物病毒性疾病[M].北京:中国农业出版社,1992,83-88.
[2] 王吉,卫礼,岳秉飞,等.呼肠孤病毒Ⅲ型免疫荧光检测方法的建立及初步应用[J].中国医学比较杂志,2011,21(8):1 -4.
[3] 王吉,卫礼,贺争鸣,等.呼肠孤病毒Ⅲ型(Reo3)RT-PCR检测方法的建立[J].中国医学比较杂志,2012,22(9):46-50.
[4] Roner MR,Steele BG.Features of the mammalian orthoreovirus 3 Dearingl 1 single-stranded RNA that direct packaging and serotype restriction[J].J Gen Virol.2007,88(12):3401-3412.
[5] Tyler KL,Barton ES,Ibach ML,et al.Isolation and molecular characterization of a novel type 3 reovirus from a child with meningitis[J].J Infect Dis.2004,189(9):1664-1675.
[6] 中华人民共和国国家标准GB/T 14926.25-2001《实验动物呼肠孤病毒Ⅲ型检测方法》[S].23-244.
[7] 中华人民共和国国家标准GB/T 14926.50-2001《实验动物微生物学检测方法》[S].酶联免疫吸附试验:1-4.
[8] 中华人民共和国国家标准GB/T 14926.51-2001《实验动物微生物学检测方法》[S].免疫酶试验:5-7.
[9] 中华人民共和国国家标准GB/T 14926.52-2001《实验动物微生物学检测方法》[S].免疫荧光试验:10-12.
[10] 李晓波,王洪,付瑞,等.实验大鼠细小病毒H-1株抗体检测能力验证结果评价[J].中国药事,2014,28(9):990-994.
[11] 中国合格评定国家认可委员会.能力验证样品均匀性和稳定性评价指南[S].CNAS-GL03,2006.
[12] 中国合格评定国家认可委员会.能力验证结果的统计处理和能力评价指南[S].CNAS-GL02,2006.
[13] 王吉,卫礼,巩薇,等.乙型脑炎病毒(JEV)ELISA检测方法的建立[J].中国比较医学杂志,2010,20(8):56-59.
Evaluation of the detection proficiency of laboratories testing of mammalian orthoreovirus 3 antibody in laboratory mice
WANG Ji,FU Rui,LI Xiao-bo,WANG Shu-jing,WEI Li,XING Jin,FENG Yu-fang,WANG Hong,YUE Bing-fei*
(National Institutes for Food and Drug Control,Beijing 100050,China)
【Abstract】Objective Through the proficiency validation of testing of mammalian orthoreovirus 3(Reo3)antibody in laboratory mice,to investigate the capacity of experimental animal quality control laboratories,so as to improve the detection capacity.Methods According to the program approved by CNAS,serum samples after calibration were tested for stability and homogeneity,and numbered randomly.The random samples were issued to the participant laboratories with the Standard Operation Procedure(SOP).The participants must submit the test reports and original records in time.The feed-back results were judged by the concordance rate with the anticipated results.Results 27 laboratories from 17 provinces were enrolled in this evaluation project,all of them submitted detection results on time.Results All the 27 laboratories were marked as pass or excellent,with a pass rate of 100%.ELISA was used in 26 laboratories,and immunofluorescence assay was used in one laboratory.Conclusions The ability for detection of Reo3 antibody in laboratory mice in animal test laboratories is high.The implementation of proficiency testing can reflect the inspection level of quality control laboratories.
【Key words】Mammalian orthoreovirus 3(Reo3);Detection capacity evaluation;ELISA;Immunofluorescence assay
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0183-05
Doi:10.3969/j.issn.1005-4847.2016.02.013
[基金项目]国家科技支撑计划(2015BAI09B02)。
[作者简介]王吉(1974-),女,副研究员,从事微生物学和免疫学研究副研究员。Email:wj-nd-jds@sina.com
[通讯作者]岳秉飞(1960-),研究员;研究方向:实验动物学;电话:010-67095401;Email:y6784@126.com
Corresponding author:YUE Bing-fei,Email:y6784@126.com
[收稿日期]2016-01-13
