重组腺病毒介导脂联素基因对ApoE-/-小鼠动脉粥样硬化的作用机制
2016-07-15王雪梅魏琴张春姜涛段明军杨毅宁
王雪梅,魏琴,张春,姜涛,段明军,杨毅宁
(新疆医学动物模型研究重点实验室,新疆医科大学第一附属医院临床医学研究院,乌鲁木齐830011)
重组腺病毒介导脂联素基因对ApoE-/-小鼠动脉粥样硬化的作用机制
王雪梅,魏琴,张春,姜涛,段明军,杨毅宁*
(新疆医学动物模型研究重点实验室,新疆医科大学第一附属医院临床医学研究院,乌鲁木齐830011)
【摘要】目的 研究腺病毒介导的脂联素(APN)过表达对ApoE-/-小鼠动脉粥样硬化(AS)的抑制作用和对NF-κB信号通路的影响。方法 将12周龄雄性ApoE-/-小鼠120只分为空载腺病毒对照组和脂联素干预组,每组60只。在3个不同时间点(0天、4周、8周)处死小鼠收集组织。全自动生化仪检测血脂指标;ELISA法测定血清APN浓度;油红O染色法检测小鼠主动脉血管组织的病理学变化;Masson染色法检测进展性斑块区的胶原含量和纤维帽厚度变化;免疫荧光法测定小鼠主动脉血管APN和NF-κB p65蛋白的表达;免疫印迹法检测主动脉血管APN、NF-κB p65核蛋白和炎症因子的表达。结果 APN过表达抑制了ApoE-/-小鼠动脉粥样硬化斑块形成。与对照组相比,脂联素干预组的动脉粥样硬化病理损伤面积减少(P<0.01),动脉粥样硬化损伤程度降低(P<0.001),总体油红O染色测定血管表面损伤百分比,4周时为(27.78±8.64)vs(33.02±5.18)%;8周时为(31.58 ±5.87)vs(52.16±5.79)%。脂联素减缓了高脂饮食导致的小鼠血清中TC(P<0.001)、TG(P<0.001)、LDL-C(P <0.001)的浓度增加,使血脂水平趋向正常化。随着血清脂联素浓度增加,可以阻遏NF-κB通路的激活,抑制NF-κB p65核蛋白和炎症因子的表达。结论 脂联素通过抑制NF-κB通路激活来减轻AS的炎症反应。
【关键词】脂联素;动脉粥样硬化;ApoE-/-小鼠;炎症;NF-κB信号通路
目前普遍认可的炎症学说,认为动脉粥样硬化(atherosclerosis,AS)的发生和发展是一个慢性炎症过程,而AS性疾病是一种全身系统性的血管病变,也是多种心血管疾病发生发展的病理生理基础[1]。炎症是AS发生的关键诱因,有多种炎性因子和黏附分子参与AS的病理过程,例如炎症因子CRP、IL-6、IL-8、TNF-a、黏附分子ICAM-1、VCAM-1、基质金属蛋白酶MMP-9[2]。核转录因子-κB(NF-κB)信号通路广泛存在于机体各种细胞内,通过自身的激活和核易位,由转录活性区调节相关基因的转录,参与机体免疫应答、炎症反应、细胞增殖与凋亡及细胞内信号传递等,调控多种基因的表达和相互作用[3,4]。短暂而快速的NF-κB激活对机体的正常生理功能很重要,但当各种病理因素持续刺激诱导NF-κB持久活化时则会导致内环境的紊乱,其中发现NF-κB的异常激活与AS的发生关系密切[5]。AS是一种多种因素作用的慢性炎症过程,而炎症作为介导来研究NF-κB和AS之间关系的研究报道较少。
脂联素(adiponectin,APN)是脂肪组织分泌的一种有益细胞因子。脂联素在人体内的血清浓度是3~30 μg/mL。脂联素在体内是以三聚体、六聚体和多聚体的形式存在[6]。APN有改善胰岛素抵抗、糖脂代谢,抗炎及抑制动脉粥样硬化的作用[7]。但是脂联素发挥保护作用的途径还不完全清楚。本研究应用重组腺病毒载体使目的基因脂联素在ApoE-/-小鼠体内过表达,建立 ApoE-/-小鼠动脉粥样硬化模型,研究脂联素过表达,对小鼠AS病理发展的影响,以及对血脂调节、炎症因子和NF-κB信号通路的影响。
1 材料与方法
1.1 实验动物
实验选择SPF级ApoE-/-小鼠,12周龄,雄性,体重20~22 g。由上海南方模式生物研究中心[SCXK(沪)2009-0023]赠予10只,雌雄各5只,在新疆医科大学第一附属医院实验动物部保种繁殖[SYXK(新)2010-0003],在SPF级饲养室饲养。所有涉及动物实验操作程序均经过新疆医科大学第一附属医院的动物伦理委员会批准(批准号为IACUC-20130709010)。12 h∶12 h昼夜循环饲养。
1.2 实验试剂
小鼠的高脂饲料(饲料配方是35%的脂肪,45%的碳水化合物,1.25% 胆固醇。中国江苏美迪森生物公司);pDC316-mCMV-EGFP-mAdipoq和pDC316-mCMV-EGFP腺病毒载体(中国深圳百恩维生物科技有限公司);血脂测定试剂(美国罗氏诊断产品有限公司);APN酶联免疫反应试剂盒(美国Biomerica公司);油红O染色液(美国Amresco公司);苏木素染色液(中国北京中杉金桥);NF-κB p65,APN一抗(美国Thermo fisher公司);荧光二抗DylightTM488和DylightTM594(美国Thermo Fisher公司);GAPDH一抗(美国CST公司);VCAM-1,IL-6,TNF-a,Lamin A(美国Abcam公司);Western blot二抗试剂盒(Invitrogen公司)。
1.3 动脉粥样硬化模型的建立
随机将小鼠分为对照组60只和脂联素干预组60只,小鼠自由采食,高脂饲料饲养加速ApoE-/-小鼠动脉粥样硬化模型建立。实验期间分别在0周、2周、4周、6周,尾静脉注射脂联素腺病毒或空载腺病毒3×108pfu/100 μL。两组ApoE-/-小鼠分别喂养0、4、8周后,处死收集标本。
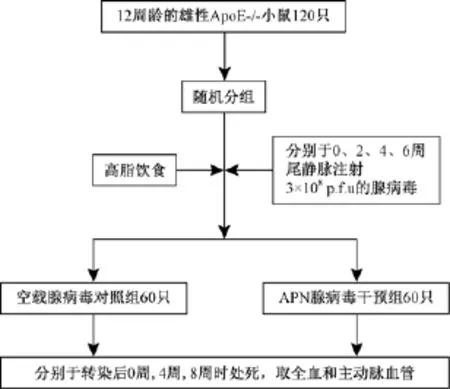
图1 实验方案示意图Fig.1 Schematic diagram of the experimental protocol
1.4 小鼠主动脉血管组织的病理学检测
1.4.1 主动脉血管总体油红O染色检测斑块损伤
手术显微镜下小心分离小鼠主动脉,从主动脉弓根部开始向下分离直至髂动脉分叉处,全部离段取出,将主动脉用剪刀纵向剪开,将整根主动脉浸于油红O染色液中15 min,取出主动脉放到70%乙醇中分化5 min,换一次乙醇,直到正常组织变为乳白色,PBS清洗2遍后拍照。使用Image J软件分析计算主动脉斑块面积和斑块损伤区域占管腔的比率。
1.4.2 主动脉弓根部血管Masson三色染色
4%多聚甲醛固定主动脉;清水下冲洗;梯度酒精脱水、二甲苯透明;组织石蜡包埋;切片;切片脱蜡,水化;Masson三色染色(参见说明书)。应用Image J图像分析软件,测量血管动脉粥样硬化进展性斑块中胶原纤维的比例和纤维帽的面积。
1.5 血脂指标检测
心脏采血静置析出血清,4000 r/min离心10 min,收集血清在-80℃超低温冰箱保存。全自动生化仪检测小鼠血清TC、TG、HDL-C、LDL-C的水平。
1.6 血清脂联素水平检测
采用酶联免疫法,检测血清APN浓度(按照试剂盒说明书进行操作)。
1.7 免疫荧光法测定主动脉血管APN、vWF、p65蛋白的表达
NF-κB p65(Thermo,USA)1∶50倍比稀释,APN (Thermo,USA)1∶200倍比稀释。二抗second antibody(Thermo,USA)1∶200倍比稀释。石蜡切片烤片60℃,1 h;脱蜡,浸水,3%H2O2室温下静置10 min,微波修复10 min,滴加一抗,4℃过夜,滴加浓度为1∶50的二抗,DAPI核染色。在200倍光镜下,随机选取5个不同视野分别采集图像,应用Image J图像分析软件测量荧光表达区域的面积,算出阳性细胞百分比。
1.8 WB法检测血管组织中炎症因子和抗炎因子蛋白的表达
总蛋白内参GAPDH和核蛋白内参LAMIN A的表达量用来校正上样可能带来的误差。从组织中提取实验所需的总蛋白和核蛋白;BCA法蛋白定量;SDS-聚丙烯酸胺凝胶电泳(SDS-PAGE)。
1.9 统计分析
采用SPSS 22.0统计软件进行统计分析。计量资料用均数±标准差(±s)表示,多组均数的比较采用两因素方差分析(general linear model-univariate)或单因素方差分析(One-Way ANOVA),选择LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 脂联素抑制了ApoE-/-小鼠动脉粥样硬化的发生
总体血管油红O染色后,与对照组相比,脂联素干预组在4周和8周时的血管动脉粥样硬化表层的损伤比率降低,差异具有显著性(P<0.001),4周时为(27.78±8.64)%vs(33.02±5.18)%;8周时为(31.58±5.87)%vs(52.16±5.79)%,见图2。
2.2 脂联素减缓了ApoE-/-小鼠动脉粥样硬化斑块的进程
在动脉粥样硬化进展性斑块中,随着斑块的发展,弹力纤维占斑块的比率是逐渐下降的,纤维帽趋向变薄,面积下降,由稳定斑块变成不稳定斑块,增加血栓形成的危险。与对照组相比,脂联素干预组在4周和8周时的胶原纤维占不稳定斑块面积的比率增加,纤维帽面积增加,差异均具有显著性。见表1,图3。
2.3 血清脂联素过表达降低血脂水平升高
和对照组相比,脂联素干预组的血清脂联素水平升高,TC、TG和 LDL-C水平降低,差异均具有显著性;HDL-C水平差异无显著性。提示脂联素过表达能够减缓血脂异常的发展进程,
脂联素具有纠正异常血脂水平的生物学功能,减缓了脂质代谢紊乱。(见表2)。
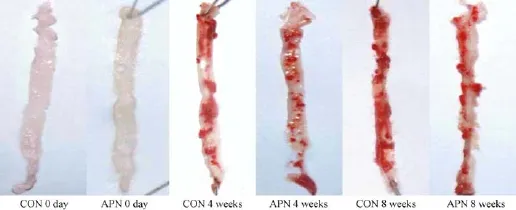
图2 小鼠主动脉总体斑块损伤总体油红O染色(n=6,±s)Fig.2 The gross appearance of the surface of whole aorta lesions.Oil red staining(n=6,±s)
表1 4周、8周对照组和脂联素干预组血管损伤面积检测结果(n=6,±s)Tab.1 Mean lesion area and mean lesion rate at 4 weeks and 8 weeks in the control and APN group(n=6,±s)
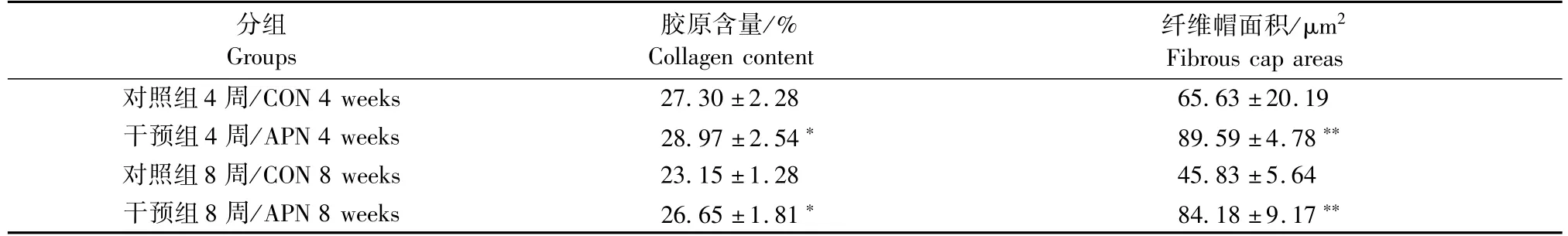
表1 4周、8周对照组和脂联素干预组血管损伤面积检测结果(n=6,±s)Tab.1 Mean lesion area and mean lesion rate at 4 weeks and 8 weeks in the control and APN group(n=6,±s)
注:与对照组相比,*P<0.01;**P<0.001。Note.Compared with the control group,*P<0.01;**P<0.001.
分组Groups胶原含量/% Collagen content纤维帽面积/μm2Fibrous cap areas对照组4周/CON 4 weeks 27.30±2.28 65.63±20.19干预组4周/APN 4 weeks 28.97±2.54* 89.59±4.78**对照组8周/CON 8 weeks 23.15±1.28 45.83±5.64干预组8周/APN 8 weeks 26.65±1.81* 84.18±9.17**
表2 血清脂联素和血脂水平比较(n=12,±s)Tab.2 Comparison of the serum APN and TC,TG,LDL-C,HDL-C levels(n=12,±s)
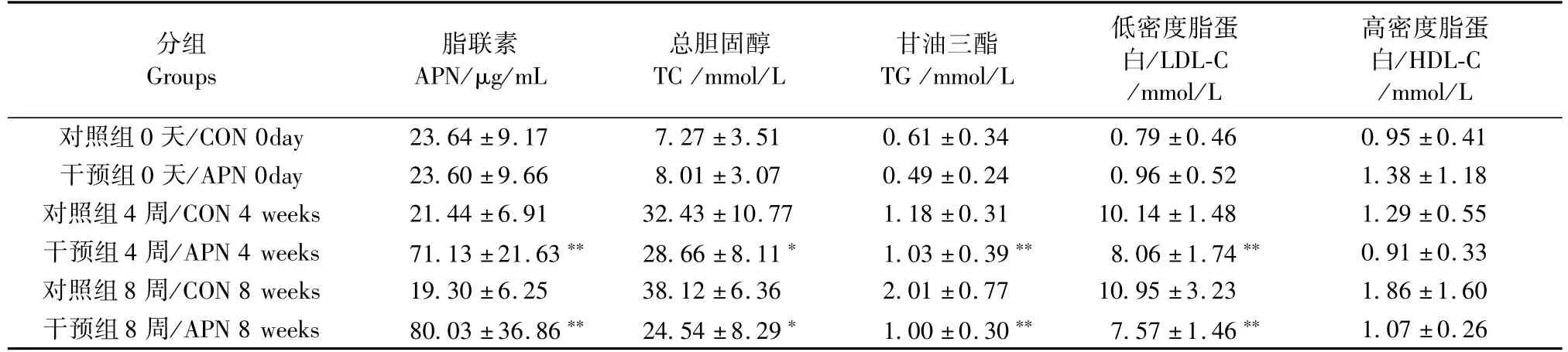
表2 血清脂联素和血脂水平比较(n=12,±s)Tab.2 Comparison of the serum APN and TC,TG,LDL-C,HDL-C levels(n=12,±s)
注:与对照组相比,#P<0.05;*P<0.01;**P<0.001。Note.Compared with the control group,#P<0.05;*P<0.01;**P<0.001.
高密度脂蛋白/HDL-C /mmol/L对照组0天/CON 0day 23.64±9.17 7.27±3.51 0.61±0.34 0.79±0.46 0.95±0.41干预组0天/APN 0day 23.60±9.66 8.01±3.07 0.49±0.24 0.96±0.52 1.38±1.18对照组4周/CON 4 weeks 21.44±6.91 32.43±10.77 1.18±0.31 10.14±1.48 1.29±0.55干预组4周/APN 4 weeks 71.13±21.63** 28.66±8.11* 1.03±0.39** 8.06±1.74** 0.91±0.33对照组8周/CON 8 weeks 19.30±6.25 38.12±6.36 2.01±0.77 10.95±3.23 1.86±1.60干预组8周/APN 8 weeks 80.03±36.86** 24.54±8.29* 1.00±0.30** 7.57±1.46** 1.07±0.26分组Groups脂联素APN/μg/mL总胆固醇TC/mmol/L甘油三酯TG/mmol/L低密度脂蛋白/LDL-C /mmol/L
2.4 主动脉血管APN过表达抑制NF-κB p65和炎症因子的蛋白表达
2.4.1 免疫荧光检测APN和NF-κB p65在主动脉血管的表达
和对照组相比,脂联素干预组APN蛋白表达区域占血管内膜和中膜面积的百分比表达增加,NF-κB p65核蛋白表达占内膜和中膜的面积百分比减少,差异均具有显著性。提示随着脂联素在血管内膜和中膜中的表达增加,NF-κB p65核蛋白表达降低,脂联素抑制了NF-κB的激活。见表3,图4,5。2.4.2 APN降低了NF-κB p65蛋白和炎症因子的表达
和对照组相比,脂联素干预组的APN蛋白表达增加,NF-κB p65核蛋白表达降低,差异均具有显著性。提示随着脂联素在血管中的表达增加,NF-κB p65核蛋白表达降低,脂联素抑制了NF-κB的激活(表4、5及图6)。
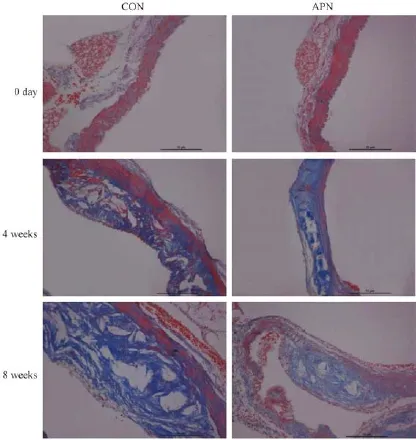
图3 小鼠主动脉弓根部的Masson染色(苯胺蓝、酸性品红和丽春红三色,×200,n=6,±s)Fig.3 Histology of the aortic arch root.(Masson staining,×200,n=6,±s)
表3 脂联素和NF-κB p65在血管中的表达(n=6,±s)Tab.3 Expression of adiponectin and NF-κB p65 in the aortas(n=6,±s)

表3 脂联素和NF-κB p65在血管中的表达(n=6,±s)Tab.3 Expression of adiponectin and NF-κB p65 in the aortas(n=6,±s)
注:与对照组相比,*P<0.01;**P<0.001。Note.Compared with the control group,*P<0.01;**P<0.001.
p65阳性表达占血管内膜和中膜的比率p65+(intimal+medial)area/%对照组0天/CON 0day 9.84±1.97 4.73±1.20干预组0天/APN 0day 10.81±2.12 4.44±1.58对照组4周/CON 4 weeks 18.10±5.17 7.95±1.46干预组4周/APN 4 weeks 41.51±12.67** 6.05±1.23*对照组8周/CON 8 weeks 23.46±3.05 11.92±2.18干预组8周/APN 8 weeks 64.79±7.21** 7.94±1.53*分组Groups脂联素阳性表达占血管内膜的比率APN/intimal area/%
表4 血管APN蛋白和NF-κB p65核蛋白的表达(n=3,±s)Tab.4 Expression of APN andNF-κB p65 proteins in the aortic wall(n=3,±s)
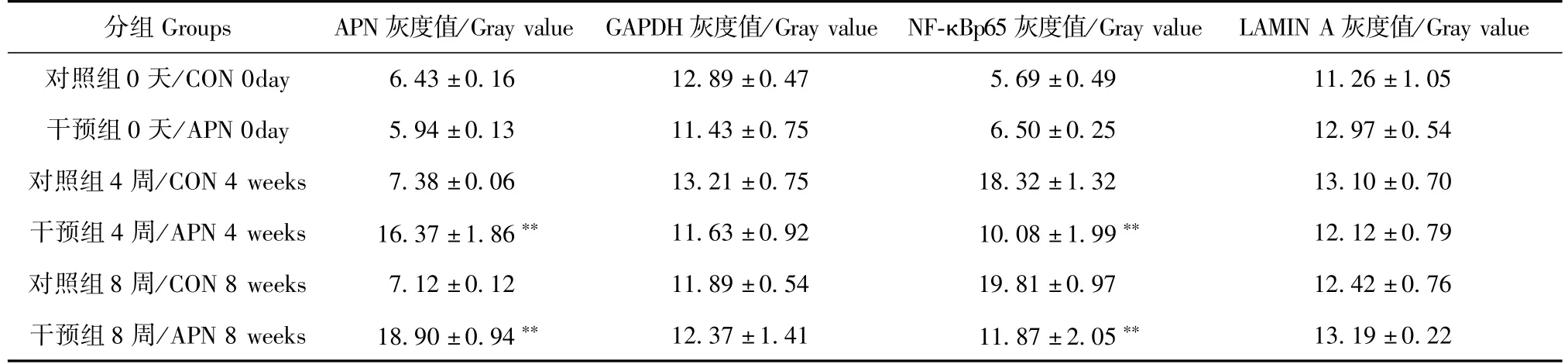
表4 血管APN蛋白和NF-κB p65核蛋白的表达(n=3,±s)Tab.4 Expression of APN andNF-κB p65 proteins in the aortic wall(n=3,±s)
注:与对照组相比,**P<0.001。Note.Compared with the control group,**P<0.001.
分组Groups APN灰度值/Gray value GAPDH灰度值/Gray value NF-κBp65灰度值/Gray value LAMIN A灰度值/Gray value对照组0天/CON 0day 6.43±0.16 12.89±0.47 5.69±0.49 11.26±1.05干预组0天/APN 0day 5.94±0.13 11.43±0.75 6.50±0.25 12.97±0.54对照组4周/CON 4 weeks 7.38±0.06 13.21±0.75 18.32±1.32 13.10±0.70干预组4周/APN 4 weeks 16.37±1.86** 11.63±0.92 10.08±1.99** 12.12±0.79对照组8周/CON 8 weeks 7.12±0.12 11.89±0.54 19.81±0.97 12.42±0.76干预组8周/APN 8 weeks 18.90±0.94** 12.37±1.41 11.87±2.05** 13.19±0.22
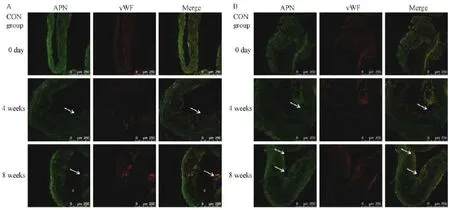
图4 APN和vWF在主动脉血管的表达Fig.4 Expression of APN and vWF in the aortic wall
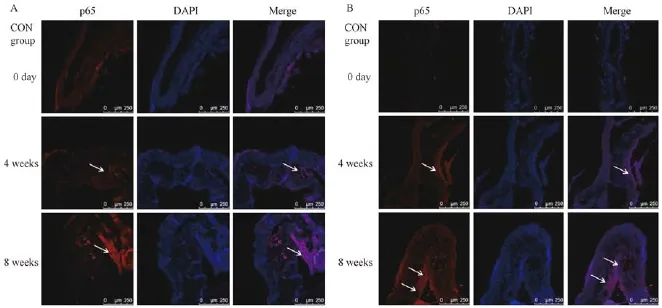
图5 NF-κB p65核蛋白在主动脉血管的表达Fig.5 Nuclear NF-κB p65 expression in the aortic wall
表5 动脉血管VCAM-1、TNF-a、IL-6蛋白表达(n=3,±s)Tab.5 Expression of the VCAM-1,TNF-a and IL-6 proteins in the aortic wall(n=3,±s)
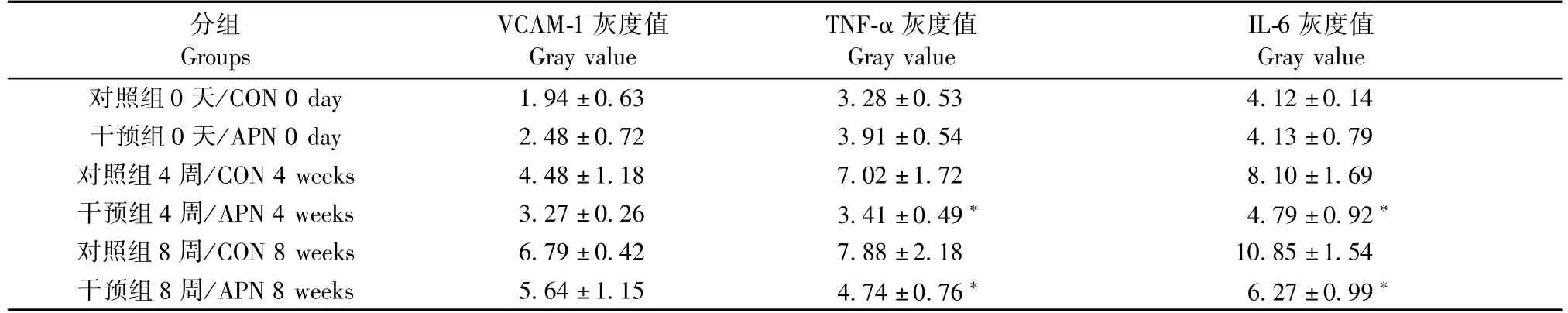
表5 动脉血管VCAM-1、TNF-a、IL-6蛋白表达(n=3,±s)Tab.5 Expression of the VCAM-1,TNF-a and IL-6 proteins in the aortic wall(n=3,±s)
注:与对照组相比,**P<0.001。Note.Compared with the control group,**P<0.001.
IL-6灰度值Gray value对照组0天/CON 0 day 1.94±0.63 3.28±0.53 4.12±0.14干预组0天/APN 0 day 2.48±0.72 3.91±0.54 4.13±0.79对照组4周/CON 4 weeks 4.48±1.18 7.02±1.72 8.10±1.69干预组4周/APN 4 weeks 3.27±0.26 3.41±0.49* 4.79±0.92*对照组8周/CON 8 weeks 6.79±0.42 7.88±2.18 10.85±1.54干预组8周/APN 8 weeks 5.64±1.15 4.74±0.76* 6.27±0.99*分组Groups VCAM-1灰度值Gray value TNF-a灰度值Gray value

图6 血管APN、核NF-κB p65蛋白和炎症因子的表达Fig.6 Expression of APN and NF-κB p65 proteins and inflammatory factors in the aortic wall
3 讨论
脂联素(APN)是脂肪组织分泌的一种起正向调节作用的细胞因子[8]。研究表明APN增加脂质分解作用,使得游离脂肪酸(FFA)释放量显著下降,诱导血液中的FFA进入骨骼肌细胞中氧化分解,进而降低血脂水平[9]。这和本研究中APN显著降低TC、TG、LDL使血脂趋于正常化的作用是一致的。APN加强脂肪代谢过程中各种转运体及酶的基因表达,增加转运体和酶的活性,最终调节血脂趋向正常化[10]。脂联素没有显著增加HDL-C的水平,可能原因是本研究选用的是ApoE-/-小鼠,而载脂蛋白E主要调节的是LDL,对于HDL没有显著的作用。
核转录因子-κB(NF-κB)信号通路是一个和炎症密切相关的信号通路。在细胞中,NF-κB以二聚体的形式存在,主要有经典途径的异源二聚体p65/ p50和同源二聚体p50/p50,以及非经典途径中的RelB/p50或RelB/p52[11]。NF-κB与IκB结合的三聚体复合物在静息状况下存在于细胞质中,当细胞受到应激、细胞因子等的作用时,IκB激酶(IKK)的构象发生改变,被相关信号通路控件识别并降解,NF-κB游离,随后移入核内,启动相关基因的转录,也就是NF-κB信号通路的激活[12]。本研究中,随着APN在血管中的过表达,NF-κB p65的核蛋白表达降低,也就是脂联素能够抑制NF-κB的激活,阻滞炎症反应对AS的促进作用。动物实验研究发现,尾静脉注射腺病毒载脂联素,造成脂联素的过表达,脂联素的血浆浓度达到对照组的48倍,14 d后病理切片显示动脉斑块被抑制了30%,实时荧光定量反应表明血管细胞粘附分子被抑制了29%,A类清道夫受体(class A scavenger receptor,SR-A)的蛋白表达减少了34%,显著降低了TNF-a的水平,而主动脉组织巨噬细胞表面的B类清道夫受体CD36不受影响,说明 APN缓解改善了 AS的炎性状态[13]。有研究证实,APN能显著抑制由脂多糖诱导的巨噬细胞里TNF-a mRNA的表达,TLR(toll-like receptor,TLR)介导的NF-κB的激活;这种抑制TLR介导的NF-κB的激活作用由补体Clq受体介导达成[14]。APN促进NF-κB抑制蛋白(IκB)在巨噬细胞中的磷酸化,使得NF-κB处于阻遏状态,降低炎性反应水平[15]。这与本研究结果是一致的,脂联素干预组 ApoE-/-小鼠主动脉血管中的炎症因子TNF-a、IL-6、黏附分子VCAM-1的蛋白表达显著降低。综上所述,APN通过抑制NF-κB信号通路介导的炎症反应,减缓AS的发展。开展进一步的研究,就APN对NF-κB上游激酶IKKβ、NIK的作用研究,或者可能的旁路激酶PKA、PKC的作用研究,能够更加全面的认识APN对于炎症和AS的作用机制。
参考文献
[1] Pateras I,Giaginis C,Tsigris C,et al.NF-κB signaling at the crossroads of inflammation and atherogenesis:searching for new therapeutic links[J].Expert Opin Ther Targets,2014,18(9):1089-1101.
[2] Si Y,Zhang Y,Zhao J,et al.Niacin inhibits vascular inflammation via downregulating nuclear transcription factor-κB signaling pathway[J].Mediators Inflamm,2014,2014:263786.
[3] Shi J,Sun X,Lin Y,et al.Endothelial cell injury and dysfunction induced by silver nanoparticles through oxidative stress via IKK/NF-κB pathways[J].Biomaterials,2014,35(24):6657 -6666.
[4] Sui Y,Park SH,Xu J,et al.IKKβ links vascular inflammation to obesity and atherosclerosis[J].J Exp Med,2014,211(5):869-886.
[5] Ren S,Fan X,Peng L,et al.Expression of NF-κB,CD68 and CD105 in carotid atherosclerotic plaque[J].J Thorac Dis,2013,5(6):771-776.
[6] 王园园,龙民慧,邹民吉,等.大鼠动脉粥样硬化动物模型的建立和评价[J].中国实验动物学报,2008,16(6):421-423,489.
[7] 赵宏宇,郑强,张锦.球状脂联素在波动性高血糖诱导人脐静脉内皮细胞凋亡中的作用[J].中国组织化学与细胞化学杂志,2010,9(5):448-452.
[8] Lee,SW,Zhang HR,Zhang CH,et al.Adiponectin abates diabetes-induced endothelial dysfunction by suppressing oxidative stress,adhesion molecules,and inflammation in type 2 diabetic mice[J].Heart Circ Physiol,2012,303:H106-H115.
[9] Lee SW,Park YJ,Zhang CH,et al.Exercise training improves endothelial function via adiponectin-dependent and independent pathways in type 2 diabetic mice[J].Heart Circ Physiol,2011,301:H306-H314.
[10] Yang CH,Miyahara H,Katayama M,et al.Pollock oil supplementation modulates hyperlipidemia and ameliorates hepatic steatosis in mice fed a high-fat diet[J].Lipid Health Dis,2011,10:189-198.
[11] 刘瑞,李伶,朱伟,等.RNAi介导的脂联素基因沉默对ApoE基因敲除小鼠糖脂代谢的影响[J].中华内分泌代谢杂志,2010,26(2):143-145.
[12] Nawrocki AR,Hofmann SM,Scherer PE,et al.Lack of association between adiponectin levels and atherosclerosis in mice[J]. Arteriosc Thromb Vasc Biol.2010,30:1159-1165.
[13] Dagli N,Ozturk U,Balin M,et al.Adiponectin levels in coronary artery ectasia[J].Heart Vessels,2009,24(2):84-89.
[14] Ekmekci H,Ekmekci OB.The role of adiponectin in atherosclerosis and thrombosis[J].Clin Appl Thromb Hemost,2006,12(2):163-168.
[15] Okamoto Y,Kihara S,Ouchi N,et al.Adiponectin reduces atherosclerosis in apolipoprotein E-deficient mice[J].Circulation,2002,106(22):2767-2770.
Mechanism of the effect of rAd-APN gene on atherosclerosis in ApoE-/-mice
WANG Xue-mei,WEI Qin,ZHANG Chun,JIANG Tao,DUAN Ming-jun,YANG Yi-ning*
(Xinjiang Key Laboratory of Medical animal Model Research,Clinical Medical Research Institute of the First Affiliated Hospital of Xinjiang Medical University,Urumqi 830011,China)
【Abstract】Objective Atherosclerosis(AS)is a common pathological basis of cardiovascular diseases.Adiponectin(APN)has been shown to have an anti-AS effect,and the underlying mechanisms,however,are largely unknown.Nuclear transcription factor κB(NF-κB)has also been regarded as a proatherogenic factor,mainly because of its regulation of a variety of the proinflammatory genes linked to AS.It is hypothesized that the inhibitory effects of APN on AS is through the inhibition of NF-κB signaling pathway.The aim of this study was to test the hypothesis via investigation and validation of the inhibitory effect of APN on AS in ApoE-/-mice,and to delineate the roles of NF-κB signaling pathway in modulating the APN effect on AS in vivo.Methods APN overexpression in ApoE-/-mice were mediated by transfecting adenovirus bearing a vector encoding for APN and enhanced green fluorescent protein(Ad-APN-eGFP).The AS in ApoE-/-mice was induced by feeding a high-fat diet.To validate the inhibitory effect of the adenovirus mediated APN overexpression on AS inthe ApoE-/-mice.120 male ApoE-/-mice aged 12 weeks were randomly and evenly assigned into two groups(60 mice per group),and were fed with a high-fat diet to induce AS.At 0 day,2,4,and 6 weeks of high-fat diet feeding.The 2 groups of mice were injected intravenously in the tail with either 100 μL(3.0×108p.f.u)of Ad-eGFP virus(control group)or the same amount of Ad-APN-eGFP virus(APN group).Blood samples and aortic tissues were taken at 0 day,4,and 8 weeks of high-fat diet feeding.For the blood samples,FABA was used to analyze the concentrations of blood lipids and ELIZA was used to test the concentrations of serum APN.For the aortic tissues,oil red O staining was used to detect the surface lesion percentage.Masson staining was used to evaluate the collagen content and fibrous cap thickness of the plaque area.Immunofluorescence method was used to detect APN and NF-κB p65 expression.Western blot was used to detect the expressions of APN,nuclear NF-κB p65 and the downstream factors of NF-κB pathway.Results APN inhibited the formation of atherosclerotic plaque in ApoE-/-mice.The lesion formation in aortic sinus was significantly inhibited(P <0.01).Compared with the control group,the oil red O staining showed that the surface area ratio of atherosclerotic lesions was decreased significantly in the Ad-APN group(P<0.001):the percentage of surface lesions in the 4 weeks groups was 27.78±8.64 vs.33.02±5.18(%);the 8 weeks groups was 31.58±5.87 vs.52.16±5.79(%).As the serum APN was increased,the concentration of TC,TG and LDL-C were significantly decreased(P<0.001 for all),and the growth of body weight was slowed down(P<0.05).APN effectively inhibited the expression of NF-κB nuclear protein p65 and inflammatory factors.Conclusions Adiponectin reduces the inflammatory reactions in atherosclerosis through inhibiting the NF-κB pathway.
【Key words】Adiponectin;Atherosclerosis;ApoE-/-mice;Inflammation;NF-κB signaling pathways
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0175-08
Doi:10.3969/j.issn.1005-4847.2016.02.012
[基金项目]新疆维吾尔自治区自然科学基金青年基金项目(2015211C095);新疆重大疾病医学重点实验室-省部共建国家重点实验室培育基地(2010DS890294)开放课题(SKLIB-XJMDR-2014-16)。
[作者简介]王雪梅(1983-),女,助理研究员,研究方向:心血管病学动物疾病模型制作和发病机制。E-mail:wxuemei1983@sina.com
[通讯作者]杨毅宁(1973-),教授,主任医师,研究方向:心血管病学诊疗。E-mail:65242155@qq.com
Corresponding author:YANG Yi-ning,Email:65242155@qq.com
[收稿日期]2015-11-23
