小鼠冷冻胚胎和精子SNP遗传鉴定方法的建立
2016-07-15徐伟晁天柱刘丽均李凯肖君华
徐伟,晁天柱,刘丽均,李凯,肖君华*
(1.东华大学生物科学与技术研究所,上海 201620;2.上海斯莱克实验动物有限责任公司,上海 201615)
研究报告
小鼠冷冻胚胎和精子SNP遗传鉴定方法的建立
徐伟1,晁天柱1,刘丽均2,李凯1,肖君华1*
(1.东华大学生物科学与技术研究所,上海 201620;2.上海斯莱克实验动物有限责任公司,上海 201615)
【摘要】目的 建立小鼠冷冻胚胎和精子SNP(single nucleotide polymorphism)分型方法,用于冷冻胚胎和精子快速遗传鉴定方案。方法 以中科院上海实验动物中心(国家啮齿类实验动物种子中心上海分中心)提供的小鼠冷冻胚胎和精子为样本,采用全基因组扩增技术和PCR-LDR分型技术建立小鼠冷冻物SNP遗传鉴定方法。结果 全基因组扩增技术能大幅度增加冷冻胚胎样本的DNA总量;PCR-LDR分型方法适用于小鼠全基因组45个SNPs的分型;分型确定C57BL/6,BALB/c,FVB/NJ等胚胎和精子各10种近交系,SNP位点信息与测序结果一致;小鼠冷冻胚胎个数与SNPs检出个数成正比,当胚胎数达到12以上时SNP检出率100%。结论 实现近交系小鼠冷冻胚胎和精子快速SNP基因分型及遗传质量鉴定。
【关键词】小鼠;冷冻胚胎和精子;全基因组扩增;PCR-LDR分型;SNP遗传鉴定
模式动物小鼠已建立超过32 000个品系[1],美国[2]、欧洲[3]和日本[4]先后建立冷冻胚胎和精子保存库代替传统的连续繁殖方式,以保护、保存小鼠这一重要遗传资源,并预防小鼠资源流失和重复性工作[5]。美国杰克逊实验室具有世界上最丰富的小鼠资源和最大的冷冻胚胎保存库[6],我国也先后成立国家啮齿类实验动物种子中心和国家遗传工程小鼠资源库[7],并建立了大型低温冷冻库。低温保存过程中,冷冻物遗传特征的稳定性是影响小鼠遗传质量的重要影响因素之一,但国内尚缺乏小鼠冷冻胚胎和精子的遗传鉴定方法。主要是因为样本有限且十分珍贵,相应的DNA量又远低于常规的个体,因此就需要对少量的DNA进行全基因组的扩增以实现SNP遗传鉴定。
遗传质量鉴定旨在保持实验小鼠的遗传稳定性,检测小鼠品系是否发生随机的遗传漂变、遗传突变和基因污染等现象,以确保被检测的品系符合其本身的要求[8]。迄今,针对实验小鼠个体的遗传检测方法主要包括传统的形态学、细胞学以及同功酶和DNA分子标记检测方法[9],其中DNA分子标记检测法已成为趋势[10-13]。DNA分子标记检测法包括长度多态性、随机遗传扩增多态性、STR、SB-ASA、SNP等。虽然STR具有杂合度高、多态性好、易于检测和利于实现分型标准化、自动化等优点,并应用于遗传连锁图谱的构建、有关疾病基因的定位、法医学亲子鉴定等领域,但是STR在分型中侧翼序列易发生变异,且不适用于大规模基因组研究[11]。因此,具有高通量、可自动操作、费用相对低廉的第三代遗传标记SNP被广泛应用于小鼠的遗传检测[14]。
基于高温连接酶的连接检测反应 (ligase detection reaction,LDR),是一种高通量灵敏度与特异性的SNP分型方法[15-18]。本研究以上海实验动物研究中心提供的近交系小鼠冷冻胚胎和精子为样本,采用直接裂解法、全基因组扩增技术和 PCRLDR技术,实现近交系小鼠冷冻物基因组上45个SNPs的基因分型和遗传质量鉴定。
1 材料与方法
1.1 DNA抽提及全扩
SPF级C57BL/6、BALB/c、SJL/J、NOD、DBA1、Scid、EG、KKTA、FVB/NJ、ACA小鼠冷冻胚胎和C57BL/6、NOD、129S3、C3H-Scid、C3H/ORL、MRL/ MPJ、NOD-Scid、Tuskuba、B10A、Scid-BG精子由中科院上海实验动物中心(国家啮齿类实验动物种子中心上海分中心)【SCXK(沪)2012-0002】提供,每个品系各取两只,雌鼠周龄4周、雄鼠周龄10周,体重20~30 g,冷冻胚胎和精子均来自以上小鼠,且其冷冻时间为一、二周或一、二月。冷冻精子的DNA提取采用动物基因组DNA快速抽提试剂盒(上海生工生物工程有限公司),操作步骤依说明书进行。冷冻胚胎的细胞裂解和DNA扩增,显微镜下挑出二细胞期冷冻胚胎(19~40个),清洗后加入1.5 μL裂解液 (200 mmol/L KOH,50 mmol/L二硫苏糖醇)65℃ 10 min,添加1.5 μL中和液(900 mmol/L Tris-HCl,pH 8.3,300 mmol/L KCl,200 mmol/L HCl)[19]4℃静置1 h后,DNA扩增采用 illustraTMReady-To-GoTMGenomiPhiTMV3(GE Healthcare)全基因组扩增试剂盒,操作步骤依说明书进行。以1%的琼脂糖凝胶电泳确定DNA质量和浓度,-20℃保存备用。
1.2 引物和探针设计
根据MGI数据库中C57BL/6、FVB、BALB/c、DBA1、NOD等10个近交系品系中已知的SNP遗传标记,挑选各品系间存在差异的45个SNPs位点,建立PCR-LDR分型方案。针对各SNP位点,设计引物和探针。用Primer3在线软件设计引物 (http:// frodo.wi.mit.edu/primer3/)[20],并由上海生工生物工程技术服务有限公司合成。设计的探针[21]由上海英骏生物技术有限公司合成。
1.3 测序反应
PCR产物纯化后均用双脱氧终止法进行测序(美国ABI 3730XL测序仪),测序引物与PCR扩增引物相同。所有测序反应由上海生工生物工程技术有限公司完成。
1.4 PCR-LDR
PCR反应终浓度体系为 (15 μL)包括10× PCR buffer 1.5 μL,dNTPs 1.5 μL,45对引物分为4组,每组分别为12、11、10、12对1.5 μL,BSA 0.2 μL,HotStarTaq DNA polymerase 1 μL,DEPC水7.8 μL,DNA模版1.5 μL,同时设阴性对照。PCR反应程序为:94℃变性2 min;94℃变性30 s,58℃退火1 min 30 s,72℃延伸30s,35个循环;72℃ 10 min。反应产物经琼脂糖凝胶电泳检测特异性。
LDR反应体系终浓度 (5 L)包括10×ligase buffer(NEB)0.5 L,探针各0.05 mol/L,TaqDNAigase 1 unit,PCR产物10 ng/L,同时设阴性对照LDR反应程序为:95℃变性2 min;94℃变性30 s,50℃复性延伸2 min,30个循环。
LDR连接产物用标准5%变性PAGE胶进行电泳通过ABI 377A测序仪进行(Applied Biosystems)数据采集与分析使用GeneScanTM 672和GeneMapper软件(Applied Biosystems)。
2 结果
2.1 小鼠冷冻精子、胚胎全基因组扩增DNA电泳
图1表示10种近交系小鼠冷冻精子抽提DNA在1%的琼脂糖凝胶中电泳检测结果,10个泳道对应着不同的品系,从电泳图谱可以看出,DNA条带清晰明亮、无降解现象,可保证后续实验顺利进行。图2表示胚胎全基因组扩增DNA在1%的琼脂糖凝胶中电泳检测结果。图中DNA的条带大小范围在2027~21 226 bp,且条带清晰。
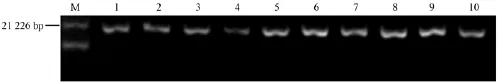
图1 10种小鼠冷冻精子全基因组扩增DNA电泳结果Note.Lane 1,2,3,4,5,6,7,8,9 and 10 represent the electrophoresis of samples of frozen sperm whole genome DNA amplification of C57BL/6,NOD,129S3,C3H-Scid,C3H/ORL,MRL/MPJ,NOD-Scid,Tuskuba,B10A and Scid-BG mice.M:MarkerFig.1 The electrophoresis results of whole genome DNA amplification of 10 kinds of mouse sperms.

图2 10种小鼠冷冻胚胎全基因组扩增DNA电泳结果Note.Lane 1,2,3,4,5,6,7,8,9 and 10 represent the electrophoresis of samples of frozen embryo whole genome DNA amplification of C57BL/6,BALB/c,SJL/J,NOD,DBA1,Scid,EG,KKTA,FVB/NJ and ACA mice.M:MarkerFig.2 The electrophoresis results of whole genome DNA amplification of 10 kinds of mouse frozen embryos
2.2 SNP位点验证
测序结果表明,NCBI和MGI数据库中近交系小鼠 C57BL/6、BALB/c、SJL/J、NOD、DBA1、Scid、EG、KKTA、FVB/NJ、ACA、129S3、C3H-Scid、C3H/ ORL、MRL/MPJ、NOD-Scid、Tuskuba、B10A和 Scid-BG 45个SNPs遗传标记的基因型与PCR-LDR分型结果一致,未出现杂峰和双峰,说明小鼠的来源都是纯系。以品系C57BL/6、FVB冷冻胚胎第Ⅱ组 rs 13477094位点为例,该处对应的PCR-LDR分型结果基因型分别是G、C,经过测序验证后(图3)箭头处标出,测序结果与分型结果一致。
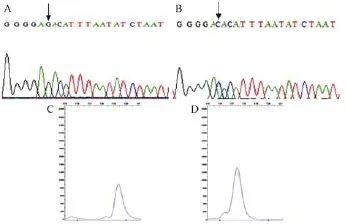
图3 rs 13477094位点测序和PCR-LDR Note.A represents the sequencing chart of frozen embryos of C57BL/6 mouse strain in rs13477094 point.B represents the sequencing chart of VB mouse strain frozen embryos in rs13477094 point.C represents 377 electrophoretogram of G homozygosis C57BL/6 mouse strain frozen embryos in rs13477094 point.D represents 377 electrophoretogram of C homozygosis FVB mouse strain frozen embryos in rs13477094 point.Fig.3 The sequencing and PCR-LDR results of rs 13477094 points
2.3 四组标准PCR-LDR方案
图4是以FVB为模版的四组多重PCR-LDR结果。第Ⅰ组和第Ⅳ组出12个峰,第Ⅱ组出11个峰,第Ⅲ组出10个峰。LDR连接产物长度与设定探针长度一致。如I-1峰 (图4)的大小为79,与 rs 4177540的纯合子的连接探针长度一致,因此该SNP位点为G,并与MGI上的数据相同。
表1表示的 BALB/c、FVB/NJ、NOD胚胎和129S3、C3H/ORL、Scid-BG10精子近交系小鼠的PCR-LDR检测结果,10种胚胎和精子的检测结果(见表2),胚胎和精子45个位点的基因型与MGI 和NCBI数据库中的信息完全一致。

图4 FVB小鼠胚胎四组PCR-LDR分型方案的377聚丙烯酰胺凝胶电泳Note.The templatesre present FVB.Each I-IV peak(I-1 to IV-12)represents SNPs 377 electrophoretogram. Fig.4 Polyacrylamide gel 377 electrophoresis of frozen embryos of FVB mice in the four panels
2.4 SNP位点在同一冷冻胚胎细胞中的梯度差异分析
为了探索SNP的检出率与胚胎细胞个数的关系,本研究以C57BL/6小鼠的2细胞期冷冻胚胎作为实验对象,检测在不同个数胚胎细胞下SNPs的分型情况。从图5可以看出随着细胞个数的增多,SNPs位点被检出的点是逐渐递增的,其中当小鼠冷冻胚胎小于等于2个2细胞期时,未鉴定出SNPs;当2细胞期细胞个数为4时,SNPs为5;当2细胞期细胞个数为6时,SNPs为18;当2细胞期细胞个数为8时,SNPs为27;当2细胞期细胞个数为10时,SNPs为38;当大于等于12个2细胞期时,SNPs为45,检出率100%。
3 讨论
随着国内各地大型低温冷冻库的建立,其中小鼠的冷冻胚胎和精子在长期低温的状态下,是否能一直有效的保证其遗传特性完整值得关注。然而,一直以来因冷冻样本十分珍贵、DNA含量又远低于常规个体样本,导致小鼠的冷冻胚胎和精子的遗传鉴定方案仍旧缺乏。本实验建立的冷冻物遗传鉴定方案,能快速实现样本的基因分型和品系鉴定。
在遗传鉴定检测中,分子生物学标记检测技术具有对各发育时期的个体、组织甚至细胞进行检测,不仅不受环境、基因表达等的限制,而且数量丰富、遗传稳定、操作简单快捷,同时能检测基因组上多个位点,有丰富的多态性[22]。
本研究建立了针对特定区段、极微量样本的前处理和扩增方案,以及进一步的PCR-LDR的DNA分子分型检测,能准确判断出样本的遗传背景和品系。其中因冷冻胚胎(2细胞期)样本仅含有19~40个细胞,为此本研究采用全基因组扩增的方法直接对冷冻胚胎获得的微量DNA进行扩增,DNA条带大小在2027~21 226 bp,出现该现象的原因可能是由于胚胎冷冻保存使DNA部分降解,但仍旧不影响分型结果。
本研究中建立的PCR-LDR对于10种近交系小鼠胚胎和精子的45个SNPs分型方案,能够快速、准确的鉴别出该SNP位点的基因型,并且测出的部分数据与MGI和NCBI上的数据库SNP信息一致,另外,部分品系的SNP信息数据库中没有与之相对应,这需要我们补充。因此,在建立标准化的SNP分型方案前,应有准确而且完整的SNP数据可供查阅。

表1 PCR-LDR对近交系小鼠胚胎和精子的分型结果Tab.1 Genotyping results of frozen embryos and sperms of inbred mouse strains by PCR-LDR
本研究建立的多重PCR-LDR每组分布的位点多达10组以上,四组总共含有45个SNPs位点,表1中C57BL/6分别与胚胎和精子中两两比对差异位点数中值为20,冷冻胚胎3个品系间两两比对差异位点中值为19,精子3个品系间两两比对差异位点中值为21,由此可见45个SNP位点在检测的冷冻胚胎和精子近交系小鼠品系中的鉴定效果较高,可以避免只通过几个SNP区分品系的情况。
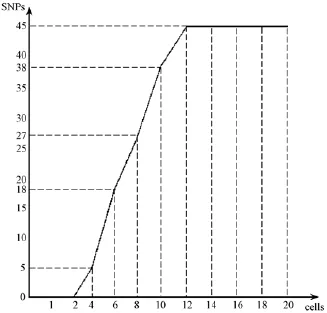
图5 C57BL/6小鼠胚胎2细胞期不同数目相对应的SNPs数目Note.The numbers of cells in the 2-cell stage embryos is represented by the horizontal coordinates,and the longitudinal coordinates represent the number of expressed SNPs.Fig.5 SNPs number corresponding to different number of 2-cell stage embryos of C57BL/6 mice
本研究以C57BL/6小鼠的2细胞期冷冻胚胎来探索SNPs的检出率与胚胎细胞个数的关系,从结果中可以看出随着冷冻胚胎个数的增加SNPs检出个数也增加,当胚胎数大于等于12时,检出率达到峰值100%。虽然全基因组扩试剂盒能扩增冷冻胚胎DNA的量,但是由于PCR-LDR分型系统对于DNA的量需求比较大,因此有可能才会出现冷冻胚胎个数≤2或≤10时,SNP分型检测不出或者检测率不到100%的现象。
PCR-LDR方案在本实验室作为一种常规的SNP高通量分型方案已经进展多年,该方案技术成熟、易操作、费用低,相信该方案在冷冻胚胎、精子遗传鉴定,能确保大型冷冻库的可靠、稳定运行,并为实现实验动物行业长期稳定的繁荣发展提供保证。
参考文献
[1] Mouse Genome Informatics[EB/OL].http://www.informatics,jax.org.
[2] The Jackson Laboratory(USA):http://www.jax.org/resources/ index.html.
[3] MRC,Mammalian Genetics Unit,Harwell(UK):http://www. mgu.har.mrc.ac.uk/stock/stock.html.
[4] CARD,Kumamoto University:http://cardb.cc.kumamotou.ac. jp/transgenic.
[5] 徐平.实验动物资源开发、保存和共享利用[J].中国比较医学杂志,2011,10:48-56.
[6] 柯贤福.浙江省实验动物发展现状及对策研究[D].浙江大学,2012年(万方数据,2013,10:Q95-33.)
[7] 黄韧,薛成,王晓明,等.中国实验动物生物学特性数据库的建设与共享[J].实验动物科学,2008,25(2):27-32.
[8] 方喜业,邢瑞昌,贺争鸣.实验动物质量控制[M].北京:中国标准出版社,2007:154.
[9] 刘先菊,王艳蓉,魏强.常用实验动物遗传质量检测方法概述[J].医学动物防制,2013,29(8):864-869.
[10] 谢建云,邵伟娟,高诚.多重PCR在几个近交系小鼠遗传检测中的应用初探[J].中国实验动物学报,2003,11:93-95.
[11] 胡培丽,范昌发,岳秉飞,等.4个近交系小鼠SNP位点的测定[J].中国比较医学杂志,2006,5:278-280.
[12] Sherry ST,Ward MH,Kholodov M,et al.dbSNP:the NCBI database of genetic variation[J].Nucl Acid Res,2001,29:308-311.
[13] Peters LL,Robledo RF,Bult CJ,et al.The mouse as a model for human biology:A resource guide for complex trait analysis[J]. Nat Rev Genet,2007,8:58-69.
[14] Petkov PM,Cassell MA,Sargent EE,et al.Development of a SNP genotyping panel for genetic monitoring of the laboratory mouse[J].Genomics,2004,83:902-911.
[15] Xiao Z,Xiao J,Jiang Y,et al.A novel method based on ligase detection reaction for low abundant YIDD mutants detection in hepatitis B virus[J].Hepatol Res,2006,34:150-155.
[16] Xiao Z,Cao H,Luan X,et al.Effects of additives on efficiency and specificity of ligase detection reaction[J].Mol Biotechnol,2007,35:129-133.
[17] 晁天柱,陈国强,赵莹,等.用于野生小家鼠来源一号染色体替换系构建的PCR-LDR分型系统[J].中国实验动物学报,2011,19:372-376.
[18] 谢雯,鲍世民,谢建云,等.基于PCR-LDR平台的近交系小鼠遗传质量快速检测方法[J].中国实验动物学报,2012,20:1 -8.
[19] Cui X,Li H,Goradia JM,et al.Single-sperm typing:determination of genetic distance between the Gγ-globin and parathyroid hormone loci by using polymerase chain reaction and allele-specificoligomers[J].Proc Natl Acad Sci U S A.1989,86:9389 -9393.
[20] Rozen S,Skaletsky H.Primer3 on the WWW for general users and for biologist programmers[M].In:Krawetz S,Misener S (eds).Bioinformatics Methods and Protocols.Methods Mol Biol,2000,132:365-386.
[21] 王刚,李凯,周宇荀,等.新型通用探针LDR分型技术的开发及细胞色素P450基因多位点分型[J].华东理工大学学报,2008,34:503-508.
[22] 周光兴,杨斐,杨萍.医学实验动物学[M].复旦大学出版社,2012:23-24.
Establishment of a SNP genetic identification method for frozen embryos and sperm of inbred mice
XU Wei1,CHAO Tian-zhu1,LIU Li-jun2,LI Kai1,XIAO Jun-hua1*
(1.Institute of Biological Sciences and Biotechnology,Donghua University,Shanghai 201620,China;2.SLAC Laboratory Animal Co.Lit.Shanghai 201615)
【Abstract】Objective To establish a rapid SNP(single-nucleotide polymorphism)genetic identification method for the frozen samples,such as frozen embryos and sperm of inbred mice.Methods In this study,the frozen embryos and sperm of inbred mice were provided by Shanghai Lab.Animal Research Center.Whole genome amplification and PCR-LDR genotyping system were used to get the rich DNA sample.Forty-five SNP were genotyped by multiple polymerase chain reaction and ligase detection reaction(PCR-LDR).Results The electrophoresis results showed that the whole genome amplification technique could highly increase the total DNA of frozen embryos.PCR-LDR typing method was suitable for the mouse genome typing of 45 SNPs.Ten strains of inbred frozen embryos and sperms of C57BL/6,BALB/c,FVB/NJ mice were genotyping identified,and their SNP loci data obtained by PCR-LDR were as the same as those of database.The number of frozen mouse embryos was proportional to the number of SNPs detected,and when the embryo number reached more than 12,the detection rate of SNP was 100%.Conclusions This method can be used to the genetic quality identification,and rapidly identify the inbreed frozen mouse embryos and sperms.
【Key words】Mouse;Frozen embryos and sperms;Genetic identification;Polymerase chain reaction and ligase detection reaction(PCR-LDR);Single-nucleotide polymorphism(SNP)
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0169-06
Doi:10.3969/j.issn.1005-4847.2016.02.011
[基金项目]上海市科学技术委员会科研计划项目(编号:14140900502,15140900500)。
[作者简介]徐伟(1990-),男,硕士研究生,研究方向:小鼠遗传学。Tel:021-67792650;E-mail:xuweidhu@163.com
[通讯作者]肖君华(1968-),男,教授,研究方向:小鼠遗传学。Tel:021-67792652;E-mail:xiaojunhua@dhu.edu.cn
Corresponding author:XIAO Jun-hua,Email:xiaojunhua@dhu.edu.cn
[收稿日期]2015-11-16
