橙皮苷对小鼠抗氧化作用及抗氧化酶基因表达的影响
2016-07-15田美杰孙英健官佳懿沈红
田美杰,孙英健,官佳懿,沈红
(北京农学院动科学院/兽医学(中兽医)北京市重点实验室,北京 102206)
橙皮苷对小鼠抗氧化作用及抗氧化酶基因表达的影响
田美杰,孙英健*,官佳懿,沈红*
(北京农学院动科学院/兽医学(中兽医)北京市重点实验室,北京 102206)
【摘要】目的 探讨橙皮苷(HDN)对机体抗氧化作用的影响。方法 采用分光光度法、邻苯三酚自氧化法和Fe2+-邻二氮菲法检测HDN体外清除自由基、抑制线粒体肿胀和红细胞氧化溶血;实验小鼠灌服不同浓度HDN (0、80、160、320 mg/kg)连续12 d,ELISA和分光光度法检测小鼠组织中MDA含量,抗氧化酶(SOD、CAT、GSH-PX)活力,RT-PCR技术分析抗氧化物酶mRNA表达水平。结果 与对照组比较,HDN组自由基(·OH、O2-·、DPPH·)清除率明显提高,小鼠红细胞体外氧化溶血和线粒体肿胀显著降低;小鼠组织及血清中MDA含量降低,抗氧化酶SOD、CAT、GSH-PX活力明显高于对照组,组织中抗氧化酶mRNA(SOD、CAT、GSH-PX)表达上调。结论 HDN能够清除自由基,降低自由基引起的细胞氧化损伤,抑制过氧化物生成,上调抗氧化酶基因表达及提高酶活力,呈现良好的抗氧化作用。
【关键词】橙皮苷;抗氧化酶;基因表达
动物体的正常生理活动有赖于机体内环境的稳态,自由基对于维持内环境的稳态十分重要,当机体受到如外源性异物、辐射等刺激时,易诱发产生大量自由基,从而对机体内DNA和组织细胞造成一定程度损伤,引起机体氧化应激反应。自由基是指未经配对的电子基团,易与机体细胞膜上的磷脂结合,攻击细胞膜而造成一定损伤[1]。红细胞膜含有丰富的不饱和脂肪酸,自由基可作用于膜上的蛋白分子,易造成红细胞膜氧化损伤、通透性增大、细胞变脆,严重时发生红细胞溶血[2]。细胞内的线粒体同样也是自由基攻击的对象,自由基通过影响线粒体膜呼吸链的电子传递,导致细胞氧化损伤[3]。
橙皮苷(HDN)是一种天然黄酮类化合物,生物来源广泛,可由豆科、芸香科、柑橘属等植物中提取[4]。研究发现,橙皮苷及其衍生物对体外多种自由基具有良好的清除作用,如对二苯代苦味酰基自由基(DPPH·)、超氧阴离子自由基(·O2-)和羟自由基(·OH)自由基的清除[5~7]。Naveen Tirkey等[8]研究发现,四氯化碳可致大鼠肝急性损伤,引起大鼠肝匀浆中谷胱甘肽(GSH)、超氧化物歧化酶(SOD)以及过氧化氢酶(CAT)水平下降,而橙皮苷可以明显的抑制这些变化,发挥明显的抗氧化作用。本实验通过体内外实验,检测HDN对自由基清除、抗氧化物酶(SOD、CAT、GSH-PX)活力及其基因表达,探讨HDN的抗氧化作用。
1 材料与方法
1.1 材料
橙皮苷(HDN)、DPPH、二硫苏糖醇(DTT)、硫代巴比妥酸(TBA)购自美国 Sigma公司,丙二醛(MDA)、SOD、CAT、GSH-PX检测试剂盒购自南京建成生物工程研究所,邻苯三酚、硫酸亚铁、邻二氮菲购自国药化学试剂厂,TUREscript 1st Strand cDNA Synthesis Kit购自北京艾德莱生物科技有限公司,SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(RR420A)购自日本TaKaRa公司,所用引物由华大科技公司合成,PCR仪购自美国Applied Biosystems公司。
6~8周龄KM小鼠40只,体重20~22 g,清洁级,购于军事医学科学院实验动物中心【SCXK-(军)2012-0004】。无菌手术在北京农学院实验动物示范中心屏障动物实验室进行【SYXK(京)2010 -0003】,并按实验动物使用的3R原则给予人道的关怀。
1.2 方法
1.2.1 动物处理
取小鼠40只随机分四组,每组10只,空白对照组小鼠每天灌服生理盐水,HDN组小鼠每天灌服不同剂量HDN(80、160、320 mg/kg),连续灌服12 d。
1.2.2 自由基的清除分析
(1)Fe2+-邻二氮菲氧化法测定·OH自由基的清除
试剂参比管(A3)中加入1 mL邻二氮菲溶液(0.75 mmol/L)、0.2 mol/L磷酸盐缓冲液(pH 7.4)2 mL、蒸馏水1 mL、1 mL FeSO4溶液(7.5 mmol/L)和1 mL 0.1%H2O2,混匀后37℃反应90 min,取适量反应液于比色皿,紫外分光光度计测536 nm吸光度值(A);取不同浓度HDN(10、20、40、80、160 μg/ mL)1 mL加入已盛有4 mL蒸馏水的离心管内制备样品参比管(A0);5 mL反应体系溶液得到反应体系参比管(A2);样品反应管(A1)则将试剂参比管体系中的H2O2换为不同浓度HDN,根据公式计算羟自由基清除率[5],·OH清除率(%)=(A1-A0-A2)/ (A3-A2)×100%,其中A1—样品反应管的吸光度值;A0—样品参比管的吸光度值;A2—反应体系管的吸光度值;A3—试剂管的吸光度值。
(2)邻苯三酚自氧化法测定O2-·自由基清除
样品反应管(A2)中加入PBS缓冲液(pH 8.3)5 mL,50 μL不同浓度HDN,25℃恒温水浴中温育20 min,然后加入25 mmol/L邻苯三酚40 μL,混匀后继续25℃恒温水浴中,准确反应3 min,快速滴加50 μL二硫苏糖醇溶液(50 mg/mL DTT)终止反应,立即混匀,室温放置5 min,上清液在322 nm波长A值;空白参比管(A0)将上述体系中不同浓度HDN和邻苯三酚换为等体积PBS缓冲液,试剂参比管(A1)则将邻苯三酚换为等体积PBS缓冲液,根据公式计算超氧阴离子清除率[6],O2-·清除率(%)= (A2-A1+A0)/A0×100%,A0—空白参比管吸光度值;A1—样品参比管吸光度值;A2—样品反应管吸光度值。
(3)分光光度法测定DPPH·自由基的清除
样品反应管中加入0.2 mmol/L DPPH-乙醇溶液1.2 mL、不同浓度HDN 0.5 mL,加入2.3 mL双蒸水将反应体系体积补足为4 mL,充分混匀;样品参比管中加入不同浓度HDN 0.5 mL与3.5 mL双蒸水;试剂参比管中加入1.2 mL DPPH-乙醇溶液和2.8 mL双蒸水;室温下静置,避光反应30 min,紫外分光光度计517 nm处测定上清液A值,根据公式计算自由基清除率[5],DPPH·清除率(%)=(A0-A1+A2)/A0×100%,其中A1—样品反应管的吸光度值;A2—样品管的吸光度值;A0—反应体系管的吸光度值。
1.2.3 TBA检测脂质过氧物丙二醛(MDA)生成抑制率
首先制备小鼠不同组织(肝、肾、脾、心脏)匀浆液,用生理盐水稀释,分别取1 mL组织匀浆液置于样品反应管,然后向管内加入1 mL不同浓度HDN;分别取1 mL组织匀浆液置于对照管,然后向管内加1 mL生理盐水;向上述各管中加入100 μL硫酸亚铁溶液(6 mmol/L)和40 μL H2O2(60 mmol/L),置于37℃水浴锅内反应1 h,然后冷却,加入1 mL 15%三氯乙酸和1 mL 0.6%TBA,混匀后在沸水中煮沸显色15 min,冷却后3000 r/min离心10 min,取上清液加入比色管,紫外分光光度计测定532 nm A值,按公式计算MDA生成抑制率,MDA抑制率(%)=(1-A1/A0)×100%,其中A1—样品反应的吸光度值;A0—对照管的吸光度值。
1.2.4 肝线粒体肿胀检测
线粒体悬液制备:制备小鼠肝匀浆液,4℃ 3000 r/min离心15 min,向沉淀中加入预冷匀浆介质蔗糖(0.25 mol/L)洗涤3次,收集离心上清液合并于4℃10 000 r/min离心20 min,肝线粒体沉淀用预冷Tris-HCl缓冲液(10 mol/L)制成线粒体悬液[4]。
样品反应管(A1)加入3 mL肝线粒体悬液、50 μL FeSO4(0.1 mmol/L)、50 μL H2O2(0.1 mmol/ L)、1 mL不同浓度HDN;空白对照管(A2)加入3 mL肝线粒体悬液、1 mL Tris-HCl缓冲液;阳性对照管(A0)加入3 mL肝线粒体悬液、50 μL FeSO4、50 μL H2O2、1 mL Tris-HCl缓冲液;混匀反应,紫外分光光度计测定520 nm A值,按公式计算抑制率(%)=[A0-(A1-A2)]/A0×100%。
1.2.5 红细胞氧化溶血检测
红细胞悬液制备:取小鼠血液于4℃ 2500 r/min离心10 min,弃上清然后加入等渗生理盐水洗涤红细胞3次,最后制成1%红细胞悬浮液。取1 mL红细胞悬液和4 mL生理盐水加入空白对照管(A2);阳性对照管(A0)为1 mL红细胞悬液和4 mL生理盐水以及50 μL 100 mmol/L H2O2(100 mmol/L);样品反应管(A1)加入1 mL红细胞悬液和50 μL不同浓度HDN及3.950 mL生理盐水;向上述各管加入50 μL H2O2混匀,置于37℃水浴锅内温育1 h,冷却后2000 r/min离心5 min,紫外分光光度计测415 nm处A值;按公式计算红细胞溶血率(%)=A1/A0×100%[4],阳性对照组A值为100%红细胞溶血率,A1A2分别为样品反应管和空白对照管A值。
1.2.6 小鼠组织和血清中MDA含量的检测
于末次给药24 h后处死小鼠,眼眶采血,取小鼠肝和肾,用预冷PBS中洗去浮血,滤纸拭干,称取1 g组织和9倍组织重量体积预冷生理盐水置于匀浆机匀浆,4℃3000 r/min离心10 min,收集上清液备用。血液于离心管2000 r/min离心15 min,分离血清。
分别取0.1 mL血清和上清液按试剂盒的说明操作,紫外分光光度计检测532 nm MDA含量。
1.2.7 小鼠组织中抗氧化酶检测
取已制备的组织匀浆液按试剂盒说明操作,根据公式计算SOD、CAT、GSH-PX活力。
1.2.8 荧光定量PCR检测抗氧化物酶基因表达
(1)总RNA提取:取100 mg小鼠肝、肾组织剪碎,加入1 mL Trizol研磨,研磨液置入EP管静置5 min,然后4℃12 000 r/min离心10 min,取上清液于EP管中再加入0.2 mL氯仿,振荡15 s静置2 min,4℃12 000 r/min离心15 min,吸出上清液并加入等体积异丙醇轻轻混匀,放置10 min后4℃12 000 r/ min离心10 min,弃上清加1 mL 75%乙醇,4℃12000 r/min离心3 min,重复2次,室温静置晾干RNA后加入DEPC水20 μL混匀,检测A260和A280值,确定RNA纯度,-80℃保存备用。
(2)cDNA的合成:采用反转录试剂盒TURE-script 1st Strand cDNA Synthesis Kit,反应体系20 μL,为总RNA 3 μL、Oligo(dT)1 μL、5×RT Reaction Mix 4 μL、TUREscript H-RTase 0.8 μL、RNase free H2O 10.2 μL,混匀置于PCR仪,42℃孵育1 h,65℃孵育15 min,反转录即得cDNA,-20℃保存备用。
(3)PCR检测与分析:在0.2 mL的PCR薄壁管中建立PCR反应。反应体系20 μL,为cDNA 2 μL、上下引物各1 μL、SYBR Premix Ex Taq(2×)10 μL、ROX Reference Dye(50×)0.4 μL、灭菌蒸馏水5.6μL;PCR反应条件为95℃30 s,95℃5 s,55~59℃(引物最适温度)30 s,95℃15 s,60℃1 min,95℃15 s,共40个循环;最后采用与荧光定量PCR仪配套的Step One Software v2.1分析PCR数据。实验所用引物序列见表1。

表1 SYBR real-time PCR反应引物序列Tab.1 Sequences of the primers in SYBR real-time PCR
1.2.9 统计分析
数据以平均数±标准差表示,采用t检验比较差异。
2 结果
2.1 HDN体外抗氧化作用
2.1.1 HDN对自由基清除
HDN体外清除自由基的结果见图1,与对照组比较,HDN在0~160 μg/mL剂量范围内对·OH自由基清除显著提高,且表现量效关系(图1A);HDN组有较好的清除作用,HDN在0~80 μg/mL剂量范围内对O2-·自由基清除明显提高,80 μg/mL时清除率达到最大值,160 μg/mL组清除率有所下降(图1B);HDN对DPPH·自由基清除随着HDN剂量增加清除率大幅提高(图1C)。
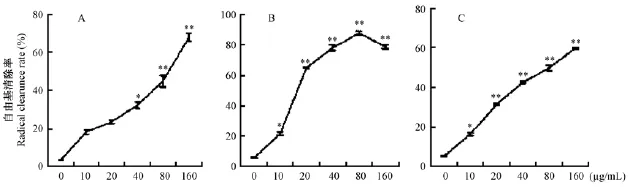
图1 HDN对自由基清除的影响(ABC分别为·OH、O2-·、DPPH·自由基)Fig.1 Effect of HDN on free radical scavenging(ABC indicate OH,O2-,DPPH free radical,respectively)
2.1.2 HDN对线粒体肿胀和红细胞氧化溶血的抑制作用
与阳性对照组比较,HDN组红细胞氧化溶血显著降低,且随HDN剂量增加红细胞溶血逐渐降低,表现明显量效关系(图2)。随HDN剂量增加,HDN组肝线粒体肿胀抑制率明显增加,即线粒体肿胀程度明显降低;且随着肝线粒体与HDN作用时间延长,肝线粒体肿胀抑制率明显提高(图3)。
2.1.3 HDN对脂质过氧化的抑制作用
HDN组不同组织MDA抑制率均低于阳性对照组,但随着HDN剂量增加抑制率呈升高趋势,表明组织中MDA生成降低,其中肝组织MDA抑制率提高最明显,HDN为80 μg/mL时肝组织MDA抑制率最大,HDN在40和80 μg/mL时肝线粒体MDA抑制率也较高;HDN为20~80 μg/mL时肾MDA抑制率逐渐提高,40 μg/mL时MDA抑制率最高;HDN在10~80 μg/mL范围心脏MDA抑制率逐渐升高,80 μg/mL组心脏MDA抑制率最大,160 μg/mL时MDA抑制率有所降低(图4)。
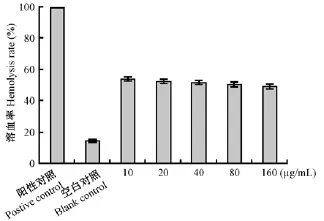
图2 HDN对红细胞氧化溶血的影响Fig.2 Effects of HDN on hemolysis of erythrocytes
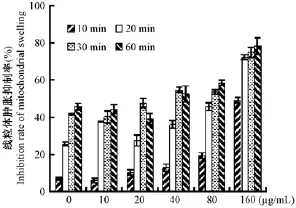
图3 HDN对肝线粒体肿胀的影响Fig.3 Effects of HDN on hepatocyte mitochondria swelling
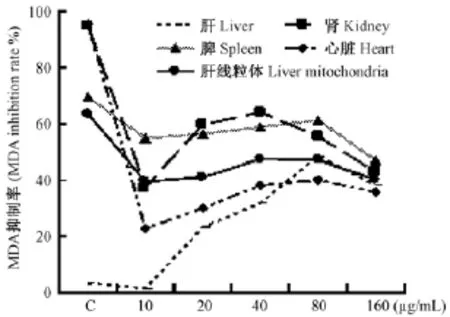
图4 HDN对不同组织和线粒体脂质过氧化物(MDA)形成的影响Fig.4 Effects of HDN on the MDA production in different tissues and hepatocyte mitochondria
2.2 HDN对小鼠抗氧化作用的分析
2.2.1 HDN对小鼠组织中MDA含量的影响
与对照组比较,HDN组小鼠肝、肾组织和血清中MDA含量明显低于对照组,随HDN量增加组织和血清中MDA含量明显减少,其中以肝最明显,其次肾(图5)。
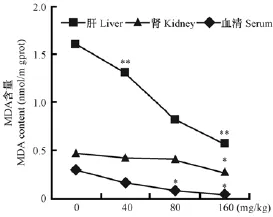
图5 HDN对不同组织和血清中MDA生成的影响Fig.5 Effects of HDN on the MDA production in the liver,kidney and serum
2.2.2 HDN对小鼠肾抗氧化酶活力及基因表达的影响
小鼠的肾组织中抗氧化酶(SOD、CAT、GSHPX)活力及基因表达结果见图6-8。由图6知,HDN组小鼠肾SOD活力随HDN剂量提高逐渐增强,高剂量组最明显极显著高于对照组(图6A);PTPCR检测 SOD(SOD1、SOD2)基因表达,结果随着HDN剂量提高SOD1和SOD2基因mRNA相对表达量增加,SOD2表达量高于SOD1(图6B)。与对照组比较,HDN三个剂量组小鼠肾组织CAT活力均显著高于对照组,中剂量组CAT活力最高(图7A);CAT基因mRNA表达水平与蛋白表达一致,不同剂量HDN组CAT mRNA相对表达量均高于对照组,以中剂量组表达量最高(图7B)。HDN组小鼠肾GSH-PX活力均高于对照组,且中剂量组GSH-PX活力最高(图8A);中高剂量组CAT基因相对表达量极显著高于对照组(图8B)。
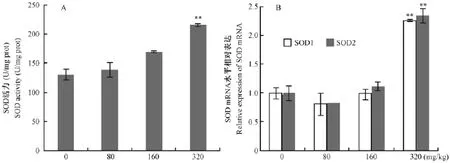
图6 HDN对肾组织SOD活力及基因mRNA表达的影响(A表示S0D活力,B表示S0D基因表达)Fig.6 Effects of HDN on the SOD activity and its gene mRNA expression in the kidneys (A.SOD activity;B.SOD mRNA expression)
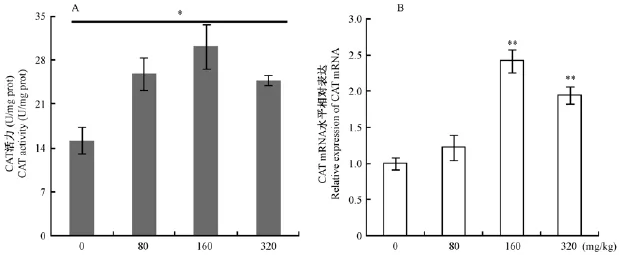
图7 HDN对肾组织CAT活力和基因mRNA表达的影响Fig.7 Effects of HDN on the CAT activity and its gene mRNA expression in the kidneys

图8 HDN对肾组织GSH-PX活力及基因mRNA表达的影响Fig.8 Effects of HDN on the GSH-PX activity and its gene mRNA expression in the kidneys
2.2.3 HDN对小鼠肝抗氧化酶活力及基因表达的影响
小鼠肝抗氧化酶(CAT、GSH-PX、SOD)活力结果见图9,与对照组比较,不同剂量HDN组肝CAT活力均明显高于对照组,其中低剂量组最高,且极显著高于对照组(图9A);HDN组肝GSH-PX活力均极显著高于对照组,且中剂量组最高(图9B);随着HDN剂量提高肝SOD活力逐渐增强,高剂量组最强极显著高于对照组(图9C)。抗氧化酶基因表达与蛋白一致,三种抗氧化酶(CAT、GSHPX)基因mRNA表达相对量均显著高于对照组(图10)。
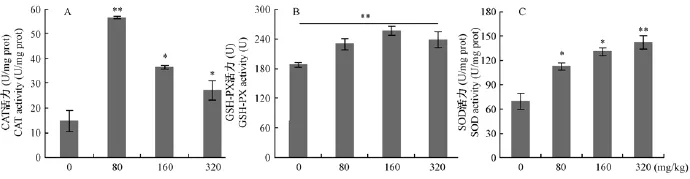
图9 HDN对肝组织抗氧化物酶活力的影响(ABC分别为CAT、GSH-PX、SOD)Fig.9 Effects of HDN on the activity of antioxidant enzymes in the livers.A:GSH-PX.B:SOD.C:CAT.
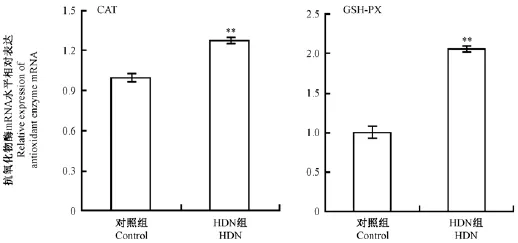
图10 HDN对肝组织抗氧化物酶基因mRNA表达的影响Fig.10 Effects of HDN on the antioxidant enzyme gene mRNA expression in the livers
3 讨论
机体正常生理状态下,红细胞膜上蛋白酶分子易受自由基攻击,造成红细胞膜氧化损伤,膜结构发生变化,蛋白酶活性下降,红细胞膜完整性被破坏,从而导致红细胞溶血[9]。王垣芳等[10]研究樱桃叶黄酮体外抗氧化活性时发现,随着黄酮浓度的升高,抑制红细胞氧化溶血的作用越强,其抑制率达到79%,而姜云云等[11]研究也得到一致结论,芦笋中分离出的黄酮苷单体有很强的抑制红细胞氧化溶血的活性。本实验结果表明,HDN能明显降低小鼠红细胞溶血率,缓解红细胞氧化溶血,随HDN剂量提高抑制细胞溶血作用增强,结果表明HDN对细胞氧化应激有一定保护作用。
线粒体是氧化磷酸化作用的主要场所,机体正常情况下只有小部分的氧被还原成为超氧阴离子自由基(O2-·),但在异常或病理状态下线粒体受到损伤,可产生大量的O2-·和·OH等物质,引起细胞功能变化,诱发多种疾病[12]。研究认为,线粒体通透性转换孔道的异常开放可引起线粒体肿胀,表现线粒体吸光度降低,通过检测其吸光度值可分析评价线粒体肿胀度[13]。吕静[14]对荷叶黄酮抗氧化的研究表明,荷叶黄酮对VC-FeSO4系统诱导的肝线粒体肿胀有很好的抑制作用,并存在量效关系,最小吸光度值在0.2左右。本实验结果HDN能较好清除三种自由基(O2-·、·OH和DPPH·),随HDN剂量提高和与线粒体作用时间延长,HDN显著抑制线粒体肿胀,保护其免受自由基攻击。
脂质过氧化代谢产物丙二醛(MDA)含量可直接反应机体受自由基攻击的程度,是一种可用于衡量自由基代谢程度的重要指标。娄桂予等[15]报道采用家兔高脂饮食构建动脉粥样硬化模型,结果发现HDN可抑制家兔血清中MDA和NO生成。EISayed等[16]通过给成年雄性大鼠口服丙烯腈(CAN)构建氧化损伤模型,检测发现HDN处理组的大鼠组织中MDA含量明显降低,GSH-PX和SOD活力明显提高。有研究发现HDN能明显缓解和恢复由角叉莱胶引发的大鼠脂质过氧化物(LPO)增多、抗氧化因子谷胱甘肽(GSH)减少和SOD活力降低等[17]。2010年Chen等[18]研究发现HDN能显著降低人肝细胞氧化应激后的脂质过氧化产物水平。
过氧化氢酶(CAT)主要功能是参与活性氧代谢过程,它与SOD、POD组成了一个清除自由基的级联反应体系,在清除自由基和保护机体免受损伤方面具有重要的作用[19]。超氧化物歧化酶(SOD)是一类金属酶,根据活性中心结合的金属离子不同,SOD主要分为Cu/Zn-SOD和Mn-SOD两类,它能催化超氧阴离子自由基发生歧化反应,再经过CAT作用转化为水和氧气,从而达到清除超氧阴离子自由基的目的[20-21]。谷胱甘肽过氧化物酶(GSH-PX)能够催化谷胱甘肽清除生物体内有害自由基(主要是氧自由基)或脂质过氧化物,从而抑制自由基的生成[22]。本实验结果HDN能明显降低组织中MDA水平,提高肝肾及血液中三种抗氧化物酶(SOD、CAT、GSH-PX)活力。蒋守群[23]研究大豆异黄酮(GEN)对岭南黄羽肉鸡骨骼肌细胞GSH-PX影响,结果发现鸡骨骼肌细胞培养液中添加GEN后,细胞抗氧化能力增强,细胞中GSH-PX mRNA表达上调。阳坦[24]研究发现,葡萄籽提取物能够提高山羊肌细胞中抗氧化酶(GSH-PX、CAT和SOD)基因表达,而本实验结果发现,肝肾组织抗氧化物酶基因表达水平上调,结果与前人报道一致。
综上所述,本研究结果表明HDN能显著清除自由基,抑制红细胞溶血和线粒体肿胀,降低组织脂质过氧化,提高抗氧化物酶活力和基因水平表达,提示HDN具有良好的抗氧化作用,其作用机制可能是通过提高抗氧化酶基因表达调控抗氧化作用。
参考文献
[1] Sumida Y,Niki E,Naito Y,et al.Involvement of free radicals and oxidative stress in NAFLD/NASH[J].Free Radical Res,2013,47(11):869-880.
[2] 杜冠魁,肖曼,钟国柄,等.葡萄糖-6-磷酸脱氢酶缺乏对红细胞溶血率的影响 [J].广东医学,2013,34(13):2081-2083.
[3] O'Connell KM,Littleton-Kearney MT.The role of free radicals in traumatic brain injury[J].Biol Res Nursing,2013,15(3):253-263.
[4] 刘学仁,张莹,林志群.橙皮苷和橙皮素生物活性的研究进展[J].中国新药杂志,2011,,20(4):329-381.
[5] 陈平,樊瑞胜,聂芊,等.橙皮苷磺酸钠对自由基清除能力的研究[J].食品工业科技,2007,28(9):64-69.
[6] 任志秋,陈平.橙皮苷锌配合物合成及清除自由基能力的研究[J].哈尔滨商业大学学报(自然科学版),2009,25(6):688-693.
[7] 邹淑君,于子惠,许树军,等.橙皮苷及橙皮素清除自由基活性的研究[J].中医药学报,2013,41(1):65-66.
[8] Hasegawa S,Rodgers GP,et al.Impaired deformability of Heinz body-forming red cells[J].Biorheology,1993,30(3-4):275 -286.
[9] Tirkey N,Pilkhwal S,Kuhad A,et al.Hesperidin,a citrus bioflavonoid,decreases the oxidative stress produced by carbon tetrachloride in rat liver and kidney J].BMC Pharmacol,2005,5 (1):2.
[10] 王垣芳,修金霞,赵峰,等.樱桃叶黄酮的体外抗氧化活性[J].食品与生物技术学报,2014,33(9):966-970.
[11] 姜云云,叶光明,范国荣,等.芦笋总黄酮及5种黄酮苷成分的体外抗氧化活性研究 [J].中成药,2012,34(10):2009-2011.
[12] 陈永红,杜冠华.线粒体与衰老[J].中国药理学通报,2000,16(5):485-488.
[13] Martinou JC,Green DR.Breaking the mitochondrial barrier [J].Nature Rev Mol Cell Biol,2001,2(1):63-67.
[14] 吕静.荷叶黄酮的体外抗氧化活性研究 [J].西藏科技,2010,4:12-15.
[15] 娄桂予,张勇,钱民章.果柚对家兔试验性高脂血症的降血脂[J].遵义医学院学报,2001,24(5):383-385.
[16] El-Sayed ESM,Abo-Salem OM,,Abd-Ellah MF,et al.Hesperidin,an antioxidant flavonoid,prevents acrylonitrile-induced oxidative stress in rat brain[J].J Biochem Mol Toxicol,2008,22 (4):268-273.
[17] Jain M,Parmacr HS.Evaluation of antioxidative and anti-inflammatory potential of hesperidin and naringin on the rat air pouch model of inflammation[J].Inflammat Res,2011,60(5):483 -491.
[18] Chen M,Gu H,Ye Y,et al.Protective effects of hesperidin against oxidative stress of tert-butyl hydroperoxide in human hepatocytes[J].Food Chem Toxicol,2010,48(10):2980-2987.
[19] 丁道远,胡皆汉,朴勇旭.荧光光谱法研究某些药物与 DNA的相互作用[J].光谱学与光谱分析,1990,10:24.
[20] 陈鸿鹏,谭晓风.超氧化物歧化酶 SOD研究综述[J].经济林研究,2007,25(1):59-61.
[21] 时沁峰,曹威荣.超氧化物歧化酶(SOD)的研究概况 [J].畜禽业,2009,(4):66-68.
[22] Forman HJ,Zhang H,Rinna A.Glutathione:overview of its protective roles,measurement,and biosynthesis[J].Mol Aspects Med,2009,30:1-12.
[23] 蒋守群.大豆异黄酮对岭南黄羽肉鸡生产性能、肉品质的影响和抗氧化作用机制研究[D].浙江大学,2007:11.
[24] 阳坦.葡萄籽提取物对山羊肌肉细胞抗氧化酶基因表达和酶活力的影响[D].西南大学,2014:7.
Effect of hesperidin on the antioxidant activity and antioxidant enzyme gene expression in mice
TIAN Mei-jie,SUN Ying-jian*,GUAN Jia-yi,SHEN Hong*
(College of Animal Science and Technology,Beijing University of Agriculture/ Beijing Key Laboratory of Traditional Chinese Veterinary Medicine,Beijing 102206,China)
【Abstract】Objective The aim of this study was to investigate the effects of hesperidin(HDN)on antioxidant activity in mice.Methods HDN scavenging free radicals was detected by spectrophotometry,inhibition of mitochondrial swelling was detected by pyrogallol autoxidation,and erythrocyte hemolysis was detected by Fe2+phenanthroline.The mice were fed with HDN at different concentrations(0,80,160,320 mg/kg)by gastric gavage for 12 days.ELISA and spectrophotometric methods were used to assay the amount of MDA in mouse liver and kidney tissues and the activity of antioxidant enzymes(SOD,CAT,GSH-PX),and the antioxidant enzyme gene mRNA expression was analyzed by RT-PCR.Results Compared with the control group,the radical(·OH,O2-·,DPPH·)clearance rate was significantly increased in the HDN groups.There was a significant decrease of oxidative hemolysis of erythrocytes and mitochondrial swelling in vitro. MDA content in the mouse liver and kidney tissues and serum showed a decrease,and the activity of antioxidant enzymes (SOD,CAT,GSH-PX)in the HDN group was significantly higher than that in the control group.There was an up-regulation of mRNA expression of antioxidant enzyme in mouse liver and kidney tissues.Conclusions The results showed that HDN can eliminate free radicals,reduce cell oxidative damage caused by free radicals,inhibit superoxide production,upregulate antioxidant enzyme gene expression and enhance their enzyme activity,thus showing a good antioxidant effect.
【Key words】Hesperidin;Antioxidant enzymes;Gene expression
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0150-08
Doi:10.3969/j.issn.1005-4847.2016.02.008
[基金项目]北京市教委项目(PXM2013014207000067和 KM201410020005),北京农学院科技创新团队科研能力提升工程项目(KCT2014012)。
[作者简介]田美杰(1990-),女,硕士研究生,专业:兽医药理,Email:763746834@qq.com。
[通讯作者]沈红(1961-),女,研究方向:免疫药理。Email:shenhong921@sina.com。孙英健(1970-),女,研究方向:中兽药药理与毒理。Email:yjsun51@sina.com
Corresponding author:SHEN Hong,E-mail:shenhong921@sina.com;SUN Ying-jian,Email:yjsun@sina.com
[收稿日期]2015-09-11
