马铃薯早疫病菌Alternaria alternata交配型异型体MAT1-1和MAT1-2不同的致病力研究
2016-07-13蒙静雯谢业焜沈林林李冬亮詹家绥
蒙静雯,谢业焜,沈林林,李冬亮,祝 雯,詹家绥
(1.福建农林大学植物病毒研究所,福建 福州 350002;2.湖北医药学院,湖北 十堰 442000)
马铃薯早疫病菌Alternaria alternata交配型异型体MAT1-1和MAT1-2不同的致病力研究
蒙静雯1,2,谢业焜1,沈林林1,李冬亮1,祝 雯1,詹家绥1
(1.福建农林大学植物病毒研究所,福建 福州 350002;2.湖北医药学院,湖北 十堰 442000)
摘 要:从全国7个省份(黑龙江、内蒙古、山东、河南、湖北、福建和云南)收集Alternaria alternata,采用SSR中性分子标记和交配型特异性引物测定菌株并选出234株不同基因型的菌株,再用离体叶片法测量菌株的致病力(病斑面积)。结果表明,7个群体中来自南方群体比来自北方群体致病力强,其中福建群体比山东群体的致病力高98.29%。MAT1-1交配型菌株和MAT1-2交配型菌株之间致病力存在显著差异,MAT1-2交配型菌株致病力比MAT1-1交配型菌株平均高15.34%。
关键词:Alternaria alternata;马铃薯早疫病;致病力;交配型;离体鉴定
在自然条件下,真菌可以通过无性、有性、准性和异核等一系列生殖模式在世代间传递遗传物质[1],这些不同生殖模式对真菌本身种群结构、进化方向以及病害流行有着不同的影响[2]。真菌的生殖模式由交配型基因(MAT)调控,该基因由基因组保守区的基因簇组成编码与性发育相关的多种蛋白[3-4]。对于许多异宗配合的真菌来说,有性生殖是由一个MAT1基因调控的,该基因编码两种不同的异型体(idiomorphs)MAT1-1 和MAT1-2,异型体间核酸序列缺乏相似性,编码不同的结构蛋白[4-6]。
动植物的性别由性染色体决定,虽然真菌的性识别机理还不清楚,但其交配型基因区域中存在类似于动物性染色体上发生的基因异位或者重排的现象,说明真菌和动物在性别识别上可能具有相似的进化特点[7]。动物的雌性和雄性受到性染色体直接或者间接的影响,在形态和生理上存在差异,但真菌不同交配型是否存在形态、生理和生态特征的差异有待进一步探讨。部分研究表明有的真菌不同交配型的菌株在致病力、细胞生长和维持细胞壁完整性的特征上存在一定差异[3,8-9]。例如在农业上,小麦叶枯病菌(Zymoseptoria tritici)MAT1-1交配型菌株致病力比MAT1-2交配型菌株致病力高[10],烟曲霉(Aspergillus fumigatus)MAT1-1交配型比MAT1-2交配型有更强的侵染力[11];在临床医学,新型隐球菌(Cryptococcus neoformans)α交配型菌株比a交配型菌株致病力更高[12]。
Alternaria alternata属链格孢属菌,在世界各地都可以引起早疫病害[13-16]。在自然条件下尚未发现早疫病菌有性生殖过程,因此一直被划分为无性生殖真菌,但这种真菌仍然携带有两个不同异型体MAT1-1 和MAT1-2的MAT1基因,控制有性生殖行为和有性孢子的产生[5-6]。Arie等[5]用PCR方法从A. alternata中克隆交配型MAT1基因序列,利用侧翼区域将MAT1-2异型体全长测序,发现MAT1-2蛋白中保守的high mobility group (HMG)区域,同时利用侧翼区域设计引物扩增相反MAT1-1异型体。发现MAT1-1异型体至少包含1个假定alpha box区域蛋白基因的编码区,MAT1-2异型体至少包含1个假定HMG box区域蛋白基因的编码区。通过异源表达,在A. alternata的近缘种Cochliobolus heterostrophus 中证明MAT1基因有功能。
在自然条件下我国A. alternata 群体两种不同交配型异型体的时空频率分布呈等比例分布[17],与之前报道的结果一致[18-19],说明该病原在自然条件下可能存在隐性有性生殖,两种交配型菌株有同样的机会侵染寄主。本试验分析比较A. alternata的致病力,研究交配型基因除了决定真菌的性行为外,是否还具有其他生理生化作用。
1 材料与方法
1.1 试验材料
1.1.1 病叶收集 2011—2013年在我国7个省份(黑龙江、内蒙古、山东、河南、湖北、福建和云南)收集有黑褐色同心圆坏死斑症状的马铃薯早疫病病叶[15],间隔1~2 m随机采样,每株植株上摘取1片病叶。
1.1.2 病原菌分离纯化 收集的病叶用流动的自来水冲洗后晾干,用75%酒精表面消毒2 min,再用无菌水反复洗3次,除去叶片表面水分,置于1%的水琼脂(琼脂粉10 g/L)培养基中保湿培养。在25℃培养24 h后挑取病斑长出的菌丝,置于马铃薯葡萄糖琼脂培养基(PDA:土豆200 g/L,葡萄糖20 g/L和琼脂18 g/L)上培养,25℃条件下培养5 d左右。对培养出来的菌丝做单孢分离,置于PDA培养基上培养,完成纯化。
1.1.3 病原菌鉴定和培养 使用光学显微镜进行真菌形态学观察[16,20]和采用真菌通用引物ITS1 和ITS4进行PCR扩增并测序。引物序列:ITS1 (5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)。收集纯化后的菌丝提取DNA。经过形态学和分子生物学方法,检测鉴定为A. alternata。
1.1.4 主要试剂 Taq DNA 聚合酶、2×Taq PCR Master Mix、DNAMarker100bp均购于北京全式金公司,2×EasyTaq PCR SuperMix(-dye)购自北京Transgen 生物科技有限公司。琼脂糖凝胶DNA回收试剂盒、Plant gDNA Kit 购于Promage公司。PCR引物合成和测序由北京睿博兴科生物技术有限公司和南京金斯瑞技术有限公司完成。其他常规试剂购自上海生工生物工程公司。
1.1.5 主要仪器 台式高速冷冻离心机、PCR扩增仪(Applied Biosystems公司2720 thermal cycler仪器)、微量移液器(Eppendorf公司)、电泳仪、水平电泳槽、紫外反射投射仪、凝胶成像系统G:BOX F3(Syngene公司)、低温冰箱。
1.2 试验方法
1.2.1 提取病原菌总DNA 收集菌丝,按照植物总DNA提取试剂盒的使用说明来提取菌株总DNA,置于-20℃保存备用。
1.2.2 SSR标记扩增病原菌 使用8对微卫星标记(SSR标记)[21-22]扩增病原菌总DNA,扩增体系(25 μL):12.5 μL反应混合液2×EasyTaq PCR SuperMix(-dye),正反向引物(10 μmol/L)各1 μL,DNA模板1 μL,无菌水9.5 μL。SSR标记的正向引物5′端用不同的荧光FAM、ROX、TAMRA标记(北京睿博兴科生物技术有限公司合成)。PCR程序:95℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸30 s,35个循环;72℃终延伸5 min。PCR产物由北京睿博兴科生物技术有限公司完成测序。
根据每对SSR引物扩增PCR 产物大小,使用GeneMaker软件(SoftGenetics,Pennsylvania State University,America)进行等位基因分配。相同引物扩增相同大小条带被作为1个等位基因。每个菌株多位点单倍型结合8对SSR位点等位基因一起组成。如果不同菌株间多位点单倍型都一致则认为是同一个无性系中的个体,即无性生殖的后代。
1.2.3 交配型基因MAT1特异性引物扩增病原菌 交配型特异性引物依据GenBank下载A. alternata交配型全序列GU735423.1 和GU735413.1设计(表1)。 引物A扩增携带MAT1-1交配型异型体的病原菌,条带大小为661 bp;引物B 扩增携带MAT1-2交配型异型体的病原菌,条带大小为494 bp。将两种引物混合进行PCR扩增即双重PCR。扩增体系(20 μL):10×PCR 反应缓冲液2 μL,dNTP(2.5 mmol/L)2 μL,DNA 聚合酶(5 U/μL)1 μL,A正反向引物(10 μmol/L)各1 μL,B正反向引物(10 μmol/L)各1 μL,DNA模板2 μL和无菌水9 μL。PCR程序:95℃预变性5 min;94℃变性60 s,53℃退火30 s,72℃延伸30 s,33个循环;72℃终延伸10 min。用含有G8140 Golden ViewⅠ(北京Solarbio 科技有限公司)的1.2%琼脂糖凝胶电泳检测PCR产物,100 V电泳1 h。在凝胶成像系统观察结果并记录。

表1 扩增链格孢属真菌A. alternata交配型异型体的特异性引物序列信息
1.2.4 致病力试验 菌株按照采样地点分成7个群体(黑龙江、内蒙古、山东、河南、湖北、福建和云南群体)。每个群体挑选出约30种不同基因型A. alternata菌株置于PDA培养基,25℃条件下培养5 d。采用离体叶片法:摘取生长周期4 周大小的Favorita品种健康叶片,用无菌水冲洗表面后晾干,置于1%的水琼脂 (琼脂粉10 g/L)培养基中保湿培养。在试供菌株的菌落边缘打直径为5 mm的菌饼,接在健康的马铃薯叶片背面(生长4周大小Favorita品种叶片),每片叶子接1个菌饼,每株菌重复4次,对照接没有菌的菌饼,置于22℃条件下16 h光照,8 h黑暗保湿培养。每天拍照记录发病情况,用Assess软件[23]测量第5天的病斑面积。
2 结果与分析
2.1 不同交配型病原菌致病力分布
根据SSR数据,从7个群体选出234株不同基因型的株菌,进行交配型和致病力鉴定。在这些菌株中,119株为MAT1-1,115株为MAT1-2,两者的比例为1.03∶1,卡方检测符合1∶1分布(χ2=0.04,df =1,P=0.84)。不同交配型菌株致病力分布趋势相似(图1)。病斑面积在0.5~2 cm2范围内,MAT1-1交配型菌株数量大于MAT1-2交配型菌株数量,所占比例为75%、67%;病斑面积在3~5 cm2范围以及7~11 cm2范围内,MAT1-2交配型菌株数量大于MAT1-1交配型菌株数量,所占比例分别为13%与8%、5%与2% (图1)。234株菌中不同交配型之间的病原菌致病力显著不同,其中MAT1-1交配型菌株的病斑面积为0~9.31 cm2,平均病斑面积是1.72 cm2;MAT1-2交配型菌株的病斑面积为0~10.09 cm2,平均病斑面积是1.96 cm2。
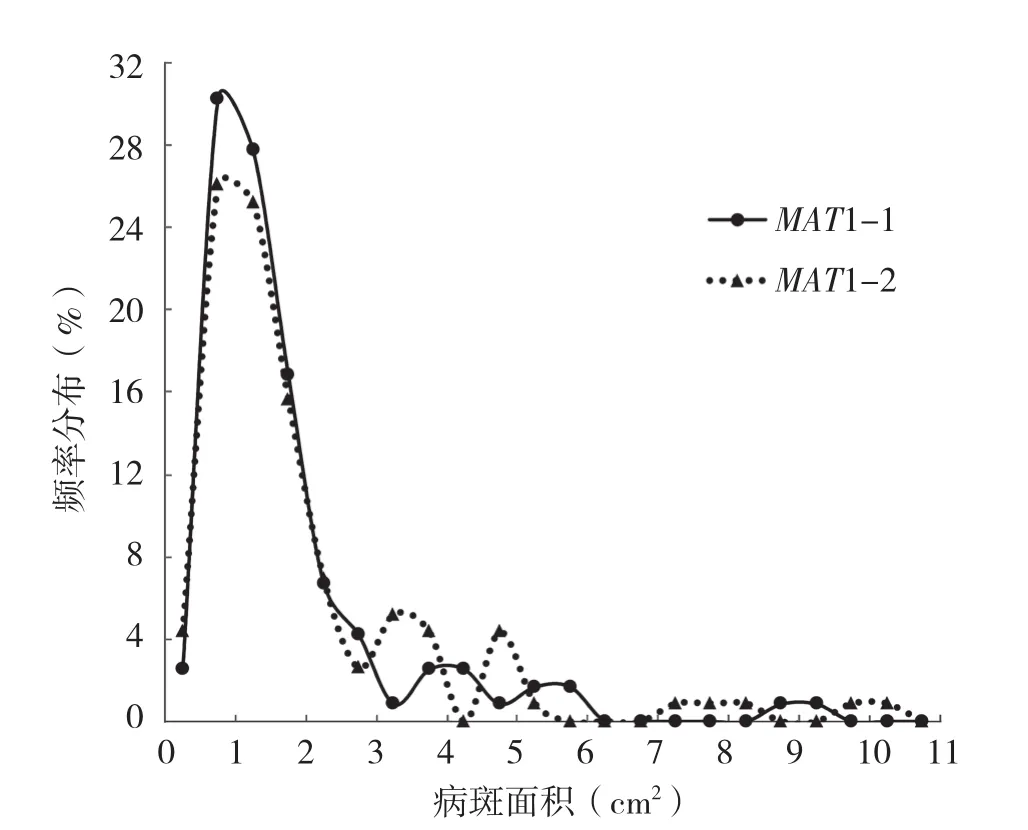
图1 不同交配型A. alternata致病力差异频率分布
2.2 不同交配型病原菌致病力差异分析

表2 不同交配型和群体的A. alternata菌株致病力差异分析
方差分析结果表明不同群体、不同交配型的A. alternata在致病力上存在显著差异(表2~表4)。由表3可知,在被分析的7个群体中,来自南方的群体比来自北方的群体致病力强,福建的群体致病力最强,山东的群体致病力最弱,两者之间相差约1倍(2.32/1.17)。7个群体中除了河南和黑龙江群体外,MAT1-2交配型菌株致病力均显著高于MAT1-1交配型菌株。7个群体中MAT1-2菌株致病力最强的是福建群体,最弱的是黑龙江群体;MAT1-1菌株致病力最强的是云南群体,最弱的是山东群体。总体来说,MAT1-2菌株的平均致病力为1.88,MAT1-1菌株的平均致病力为1.63,前者高于后者15.34%(表4)。

表3 最小显著性差异法(LSD)比较7个A. alternata群体致病力差异
注:同列数据后大写英文字母不同者表示差异极显著,表4同。
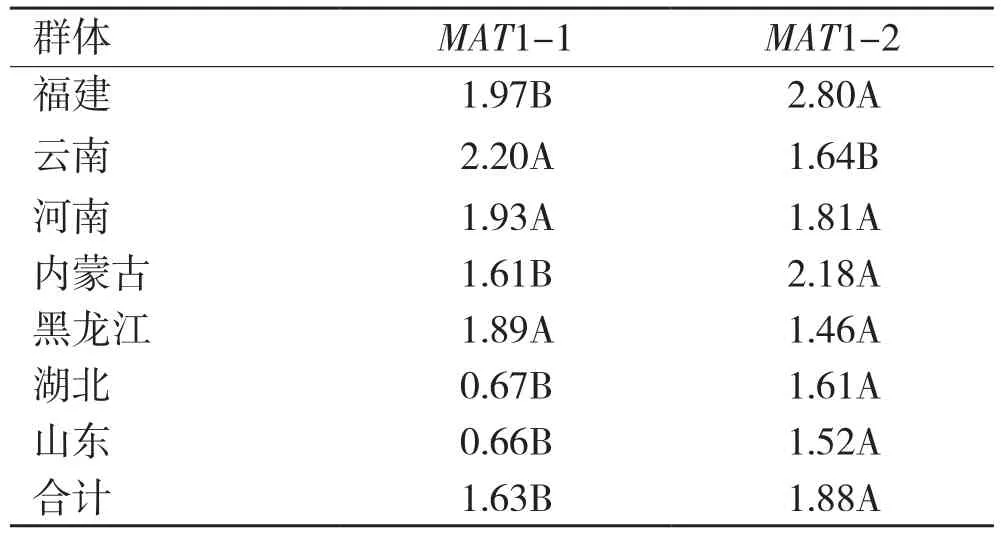
表4 最小显著性差异法(LSD)比较7个A. alternata群体内不同交配型菌株致病力差异
3 讨论
本研究采用群体遗传学的方法研究来自全国7个省份的A. alternata不同群体不同交配型的菌株致病力差异性。方差分析表明,导致菌株间致病力差异的原因由多因素决定,如菌株生长环境、交配型和菌株遗传背景等,进而说明病原菌能否成功侵染寄主不仅与携带的毒性基因有关[24-25],还与基因组中微效多基因有关[10,26],这些基因对菌株致病力有加性遗传效应[27]。
7个群体中南北方群体的菌株致病力有显著差异,其中来自南方的福建群体比来自北方的山东群体致病力高98.29%,5/7群体中不同交配型菌株致病力有显著差异。两种不同的交配型致病力最强的群体分别是福建和云南,均属于南方群体,平均而言7个群体中MAT1-2交配型菌株致病力比MAT1-1交配型菌株的高15.34%。同时在两种交配型菌株致病力差异频率分布图中当病斑面积< 3 cm2时MAT1-1交配型菌株数量大于MAT1-2交配型菌株;当病斑面积> 3 cm2时,MAT1-2交配型菌株数量大于MAT1-1交配型菌株。MAT1-2交配型菌株的病斑面比MAT1-1交配型菌株的大13.95%。
自然条件下在25~28℃、相对湿度70% 以上的环境里容易发生马铃薯早疫病病害[28]。本研究的7个群体中福建省地理环境(纬度最低、热带季风气候)更适合早疫病的发生,病原菌致病力相对较高。同时7个群体中MAT1-2菌株致病力最强的是福建群体,MAT1-1菌株致病力最强的是云南群体。总体来说,MAT1-2交配型菌株致病力比MAT1-1交配型菌株的强。 然而之前的研究发现,在全国A. alternata 两种不同交配型菌株空间分布频率呈1∶1等比例分布特点,高致病力的交配型菌株并没有影响交配型菌株的频率,这可能是由于其他生态特征与交配型的频率依赖选择导致[10]。对于有性和无性生殖交替循环的真菌来说,群体中暂时会出现更多致病力高的交配型菌株,但不同交配型菌株的分布频率很快恢复到等比例分布的情况[29]。虽然与病原菌A. alternata致病力相关的生物因素和遗传机制尚不清楚,试验结果表明在马铃薯叶片上A. alternata侵染、传播过程中MAT1交配型基因有一定作用。
参考文献:
[1] Anderson J B,Kohn L M,Leslie J F. Genetic mechanisms in fungal adaptation[A]. The fungal community:its organization and role in the ecosystem [M]. New York:Marcel Dekker,1992:73-98.
[2] Barrett L G,Thrall P H,Burdon J J,et al. Life history determines genetic structure and evolutionary potential of host-parasite interactions[J]. Trends in Ecol Evol,2008,23(12):678-685.
[3] Lengeler K B,Fox D S,Fraser J A,et al. Matingtype locus of Cryptococcus neoformans:a step in the evolution of sex chromosomes[J]. Eukaryotic Cell,2002(5):704-718.
[4] Li W,Metin B,White T C,et al. Organization and evolutionary trajectory of the mating type (MAT)locus in dermatophyte and dimorphic fungal pathogens [J]. Eukaryotic Cell,2010,9(1):46-58.
[5] Arie T,Kaneko I,Yoshida T,et al. Mating-type genes from asexual phytopathogenic ascomycetes Fusariumoxysporum and Alternaria alternata[J]. Mol Plant Microbe Interact,2000,13(12):1330-1339.
[6] Stewart J E,Kawabe M,Abdo Z,et al. Contrasting codon usage patterns and purifying selection at the mating locus in putatively asexual Alternaria fungal species[J]. PLoS One,2011,6(5):e20083.
[7] Fraser J A,Diezmann S,Subaran R L,et al. Convergent evolution of chromosomal sex-determining regions in the animal and fungal kingdoms[J]. PLoS Biol,2004,2(12):e384.
[8] Lockhart S R,Wu W,Radke J B,et al. Increased virulence and competitive advantage of a/α over a/a or α/α offspring conserves the mating system of Candida albicans[J]. Genetics,2005,169(4):1883-1890.
[9] Barbour L,Xiao W. Mating type regulation of cellular tolerance to DNA damage is specific to the DNA postreplication repair and mutagenesis pathway[J]. Mol Microbiol,2006,59(2):637-650.
[10] Zhan J,Torriani S F,Mcdonald B A. Significant difference in pathogenicity between MAT1-1 and MAT1-2 isolates in the wheat pathogen Mycosphaerella graminicola[J]. Fungal Genet Biol,2007,44(5):339-346.
[11] Alvarez-Perez S,Blanco J L,Alba P,et al. Mating type and invasiveness are significantly associated in Aspergillus fumigatus[J]. Med Mycol,2010,48(2):273-277.
[12] Barchiesi F,Cogliati M,Esposto M,et al. Comparative analysis of pathogenicity of Cryptococcus neoformans serotypes A,D and AD in murine cryptococcosis[J]. J Infection,2005,51(1):10-16.
[13] Hausladen H,Bässler E,Asensio N. Early blight of potato[J]. PPO-Special Report,2004(10):173.
[14] Mmbaga M T,Kim M S. Identification of Alternaria alternata as a causal agent for leaf blight in Syringa species[J]. Plant Pathol J,2011,27(2):120-127.
[15] 范子耀,王文桥,孟润杰,等. 马铃薯早疫病病原菌鉴定及其对不同药剂的敏感性[J]. 植物病理学报,2013,43(1):69-74.
[16] Zheng H,Zhao J,Wang T,et al. Characterization of Alternaria species associated with potato foliar diseases in China[J]. Plant Pathol,2014,64(2):425-433.
[17] 蒙静雯. 中国马铃薯早疫病病原菌的群体遗传结构[D]. 福州:福建农林大学,2015.
[18] Stewart J E,Thomas K A,Lawrence C B,et al. Signatures of recombination in clonal lineages of the citrus brown spot pathogen,Alternaria alternata sensu lato[J]. Phytopathology ,2013,103(7):741-749.
[19] Stewart J E,Timmer L W,Lawrence C B,et al. Discord between morphological and phylogenetic species boundaries: incomplete lineage sorting and recombination results in fuzzy species boundaries in an asexual fungal pathogen[J]. BMC Evol Biol,2014,14 (1):38.
[20] 何凯,杨水英,黄振霖,等. 马铃薯早疫病菌的分离鉴定和生物学特性研究[J]. 中国蔬菜,2012(12):72-77.
[21] Benichou S,Dongo A,Henni D E,et al. Isolation and characterization of microsatellite markers from the phytopathogenic fungus Alternaria dauci[J]. Mol Ecol Resour,2009,9(1):390-392.
[22] Meng J,Zhu W,He M,et al. High genotype diversity and lack of isolation by distance in the Alternaria solani populations from China[J]. Plant Pathol,2015,64(2):434-441.
[23] Lamari L. Assess:image analysis software for plant disease quantification[M]. American:Phytopatological Society,2002.
[24] 耿锐梅,曹长代,董世峰,等. 植物寄主与病原真菌互作研究进展[J]. 中国果菜,2011(4):23-26.
[25] Zhan J,Thrall P H,Burdon J J. Achieving sustainable plant disease management through evolutionary principles[J]. Trends Plant Sci,2014,19(9):570-575.
[26] Makhdoomi A,Mehrabi R,Khodarahmi M,et al. Efficacy of wheat genotypes and Stb resistance genes against Iranian isolates of Zymoseptoria tritici[J]. J Gen Plant Pathol,2015,81(1):5-14.
[27] Zhan J,Mcdonald B A. Experimental measures of pathogen competition and relative fitness[J]. Annu Rev Phytopathol,2013,51:131-153.
[28] 台莲梅,郑寰宇,左豫虎,等. 黑龙江省马铃薯早疫病菌生物学特性研究[J]. 植物保护,2012,38 (1):85-89.
[29] Sommerhalder R J,Mcdonald B A,Zhan J. The frequencies and spatial Distribution of mating types in Stagonospora nodorum are consistent with recurring sexual reproduction[J]. Phytopathology,2006,96 (3):234-9.
(责任编辑 崔建勋)
Significant difference in pathogenicity of MAT1-1 and MAT1-2 isolates in potato pathogen Alternaria alternata
MENG Jing-wen1,2,XIE Ye-kun1,SHEN Lin-lin1,LI Dong-liang1,ZHU Wen1,ZHAN Jia-sui1
(1. Institute of Plant Virology,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2. Hubei University of Medicine,Shiyan 442000,China)
Abstract:Alternaria alternata collected from seven provinces (Heilongjiang,Inner Mongolia,Shandong,Henan,Hubei,Fujian and Yunnan)in China were molecularly characterized using neutral SSR markers and mating typespecific primers. Among them,234 distinct genotypes were selected for pathogenicity analysis by detached leaf assay. The result indicated that,on average,the pathogen from South displayed higher pathogenicity than that from North. For example,the pathogenicity of pathogen from Fujian was 98.29% higher than that from Shandong. The result also showed a significant difference in pathogenicity between MAT1-1 and MAT1-2 isolates. On average,MAT1-2 isolate displayed 15.34% higher pathogenicity than MAT1-1 isolate.
Key words:Alternaria alternata;potato early blight;pathogenicity;mating types;detached leaf inoculation
中图分类号:S432.1
文献标识码:A
文章编号:1004-874X(2016)02-0089-05
收稿日期:2015-10-13
基金项目:国家现代农业(马铃薯)产业技术体系(CARS-10)
作者简介:蒙静雯(1985-),女,在读博士生,E-mail:mjw175860836@163.com
通讯作者:詹家绥(1963-),男,博士,教授,E-mail:jiasui.zhan@fafu.edu.cn
