脏污程度对奶牛乳区温度分布规律的研究
2016-07-11彭丹丹杨春合顾宪红
彭丹丹,陈 健,赵 越,韩 丽,李 淦,杨春合,顾宪红
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
脏污程度对奶牛乳区温度分布规律的研究
彭丹丹,陈健,赵越,韩丽,李淦,杨春合,顾宪红*
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
摘要:为提高红外热成像技术检测奶牛隐性乳房炎的准确性,按脏污程度对奶牛乳区温度分布的影响进行研究。选取乳房外观正常,SCC<5×105·mL-1的泌乳牛325头,对其后乳区进行分区:乳头池、乳腺池和乳腺,并对不同分区采取3分制的评分制进行评分,根据评分将后乳区不同分区各分为4组。结果显示,在干净状态下,奶牛后乳区左右不同分区的皮肤温度差异均不显著(P>0.05);从乳腺、乳腺池到乳头池,其皮肤平均温度、最低温度、最高温度有显著降低或降低的趋势,降低幅度相应为1.90、6.90和1.62 ℃;随着脏污程度的增加,乳头池、乳腺池、乳腺皮肤的最低温度呈现极显著降低(P<0.01),平均温度有降低的趋势,温度变异程度极显著增加(P<0.01)。综上表明,脏污程度对奶牛乳区温度分布有重要影响,且乳腺部分最高温度受到的影响较小,是温度法检测奶牛隐性乳房炎的较适部分和较适检测指标。
关键词:脏污程度;温度分布;红外热成像技术;乳头池;乳腺池;乳腺
奶牛乳房炎是奶牛生产中最为严重的疾病之一,可以引起产奶量下降,牛奶质量降低,奶牛淘汰率增加,奶牛利用年限减少等经济损失[1-4]。目前常用的检测奶牛隐性乳房炎的方法有体细胞计数法(SCC)、加州乳腺炎测试法(CMT)、乳汁微生物培养鉴定法、乳汁pH法、乳汁电导法和乳汁酶学法,这些方法都需要以牛奶作为样品,不能进行大规模牛群现场连续测试,限制了其在生产实际中的应用[5]。红外热成像技术 (Infrared thermograph technology,IRT) 是近年来用于检测奶牛隐性乳房炎的新方法[6],此方法通过测定乳腺健康部位与炎症部位的皮肤表面温度差异来判断乳腺炎症区域及炎症反应程度,不需要牛奶作为样品进行检测,具有检测方便快速、非接触、对奶牛无应激的优点。众多研究表明,IRT可以检测出人工感染乳区皮肤表面温度的升高[7-8],最近研究表明,若奶牛左右乳区温度差值超过1.5 ℃,可以初步判断温度升高一侧乳腺发生隐性乳房炎[9]。然而,前人对应用IRT检测奶牛隐性乳房炎的研究中多局限于干净干燥的乳区,而在实际应用中,有些牛的乳区表面有脏污,有时还很严重,脏污程度对乳区皮肤温度指标的影响还未见报道。因此,本试验旨在探究不同脏污程度引起乳区表面温度的变化规律,为应用乳区温度差值检测奶牛隐性乳房炎的可靠性和敏感性提供理论依据。
1材料与方法
1.1试验地点、时间
2015年3月-5月在北京中地畜牧奶牛良种科技园进行试验。
1.2试验动物选择
选择泌乳牛舍为试验牛舍,对全群泌乳牛进行乳房外观检查。首先,对待选牛进行乳房外观检查,将乳房外形变形和患有临床乳房炎(乳房外观具有明显的红、肿、热特征)的奶牛剔除。其次,结合牛场当月DHI数据测定结果,将SCC>5×105·mL-1的奶牛进行剔除。然后,对剩余奶牛的采食量情况、精神状态和健康状况进行观察。最终选出325头采食正常、精神状态良好的奶牛,平均胎次为(1.6±0.9)胎,平均泌乳天数为(194±95)d,平均产奶量为(26.95±8.64)kg。
1.3奶牛乳区脏污程度的评分及试验动物分组
1分=乳区干净,无污染;2分=中度污染,乳区有2%~50%面积污染;3分=重度污染,有脏污结块,>50%面积污染。根据后乳区左右两侧的脏污程度,对乳头池、乳腺池、乳腺分别按照脏污评分分为4组:左右两侧评分都为1,表示为1-1;左右两侧评分分别为1和2,表示为1-2;左右两侧评分分别为1和3,表示为1-3;左右两侧评分分别为2和3,表示为2-3。各个分组的奶牛头数分布见表1。
表1各个分组的奶牛头数
Table 1The cow numbers of each group

后乳区分区Differentpartsofrearudder脏污评分分组Classificationofsmudgyscoren乳头池Teatcistern1-1581-2301-3312-332乳腺池Mammarycistern1-1581-2311-3312-330乳腺Mammarygland1-1581-2311-3312-332
1.4主要测试仪器设备
Testo-625手持式温湿度表,温度传感器精度为±0.5 ℃,湿度传感器精度为±2.5% RH;EOS 5D Mark Ⅲ佳能单反相机(佳能中国),有效像素2 230万;VarioCAM®high resolution便携式红外热像仪(德国英福泰克),显示分辨率640×480像素,测温为-32~400 ℃,测温精度为±1%(23 ℃),热灵敏度为±0.03 ℃;IRBIS 3 Standard红外热图像处理软件标准版(北京雅世恒源),具有从热像仪下载红外图像文件、自动显示热图像中和测量区域内的最高和最低温度、在状态栏查看不同的测量参数等功能。
1.5奶牛乳区红外热图像采集
按照对试验奶牛的选择标准,在牛舍采集奶牛后乳区的红外热图像,时间为上午8:00-10:00,每次均在挤奶之前采集乳区红外热图像。采集乳区红外热图像时,使用牛颈夹保定奶牛,使奶牛保持站立姿势,并处于安静状态,采集时将奶牛尾巴卷起使乳区充分暴露,用红外热像仪镜头垂直对准乳区拍摄,镜头距离乳区1.5 m。在拍摄红外热图像之后,立即拍摄每头奶牛乳区对应的普通可见光照片[10-14]。进行乳区红外图像分析之前,在软件中将奶牛皮肤发射率设置为0.98。
1.6牛舍环境温湿度测定
采集奶牛后乳区红外热图像期间,使用Testo-625手持式温湿度表记录牛舍的环境温湿度。试验采样期间,牛舍的平均温度为(16.51±2.23) ℃,变化为12.00~19.30 ℃;平均湿度为(46.68±14.93)%,变化为25.10%~65.10%。
1.7奶牛后乳区的分区以及皮肤温度的测定方法
1.7.1奶牛后乳区分区方法按照奶牛乳区的解剖结构(图1)将奶牛左后乳区、右后乳区分别分为乳头池、乳腺池以及其上部的乳腺组织3部分,则奶牛后乳区总共分为6个部分(图2)。

图1 奶牛乳区的解剖结构Fig.1 The anatomical structure of dairy udder

1.右乳头池,2.左乳头池,3.右乳腺池,4.左乳腺池,5.右乳腺,6.左乳腺1.Right teat cistern,2.Left teat cistern,3.Right mammary cistern,4.Left mammary cistern,5.Right mammary gland,6.Left mammary gland图2 奶牛后乳区的各个分区(左图为奶牛乳区可见光照片;右图为奶牛乳区红外图像)Fig.2 Each part of dairy rear udder(the left is visible light photo of dairy rear udder,the right is infrared image dairy rear udder)
1.7.2奶牛后乳区皮肤温度的测定方法使用红外热图像处理软件对得到的奶牛乳区红外热图像进行温度分析。应用软件的测量区域功能,乳头池部分使用矩形画图工具,找出一个乳头池范围内的最大矩形;乳腺池部分使用圆形画图工具,选取乳头池基部正上方5 cm的位置为圆心画圆;其余上部的乳腺组织使用矩形画图工具,找出一个上部乳腺组织范围内的最大矩形(图2)。记录划定区域内的平均温度、最低温度、最高温度、温度极差和标准差等数据。全后乳区皮肤的平均温度、最低温度、最高温度、温度极差、标准差是后乳区各个分区皮肤的平均温度、最低温度、最高温度、温度极差、标准差以及各个分区所占面积的加权值。
1.8数据统计分析
使用Spss Statistics 17.0软件对试验数据进行分析。使用配对t检验比较奶牛后乳区左右两侧之间干净以及不同脏污评分条件下相应分区皮肤温度的差异。使用ANOVA单因素方差分析(One-way ANOVA)和Duncan氏多重比较(Duncan’s multiple range test)检验干净后乳区不同分区皮肤温度差异、后乳区相应分区在不同脏污评分下皮肤温度的差异。以P>0.05为差异不显著,以P<0.05为差异显著,以P<0.01为差异极显著。
2结果
2.1干净后乳区皮肤温度分布规律
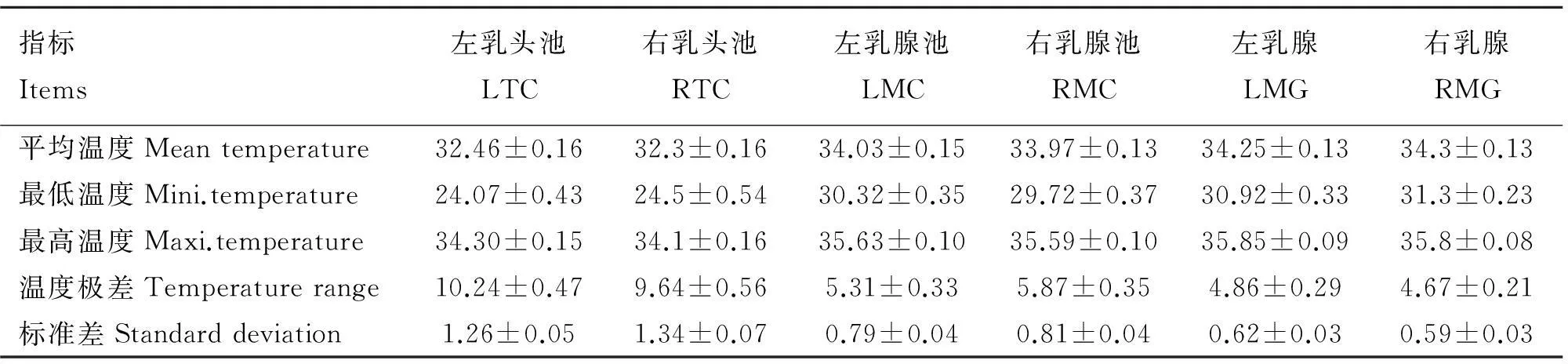
2.1.1干净后乳区左右两侧不同分区皮肤温度分布规律干净乳区不同分区左右两侧皮肤温度差异比较结果见表2。由表2可以看出,不论是乳头池、乳腺池还是乳腺,左右两侧皮肤平均温度、最高温度、最低温度、温度极差和标准差差异均不显著(P>0.05)。 2.1.2干净全后乳区不同分区皮肤温度分布规律干净全后乳区不同分区皮肤温度差异比较结果见表3。从乳头池、乳腺池到乳腺,皮肤平均温度、最低温度、最高温度均呈现由低到高的变化:乳头池皮肤平均温度、最低温度、最高温度分别极显著低于全后乳区、乳腺池、乳腺的皮肤平均温度、最低温度、最高温度(P<0.01),降低温度平均相应为1.77、6.38和1.51 ℃,而全后乳区、乳腺池、乳腺之间皮肤平均温度、最高温度差异均不显著(P>0.05),而乳腺池皮肤最低温度极显著低于乳腺皮肤最低温度(P<0.01)。乳头池皮肤温度极差、温度标准差分别极显著高于全后乳区、乳腺池、乳腺的皮肤温度极差、温度标准差(P<0.01),而全后乳区的皮肤温度极差、温度标准差与乳腺的皮肤温度极差、温度标准差接近,差异不显著(P>0.05)。
表2干净后乳区左右两侧不同分区皮肤温度配对分析结果(n=58)
Table 2The paired analysis results of skin temperature of left and right sides at different parts of clean rear udder(n=58)
℃
表3干净全后乳区不同分区皮肤温度分布(n=58)
Table 3Skin temperature distribution of different parts of whole clean rear udder(n=58)

℃
同列数据肩标不同小写字母表示差异显著 (P<0.05),不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著 (P>0.05)。表5同
In the same column,values with different small letter superscripts mean significant difference (P<0.05),values with different capital letter superscripts mean extremely significant difference (P<0.01),while the same letter superscripts mean no significant difference (P>0.05).The same as table 5
2.2不同脏污评分下乳区温度分布规律
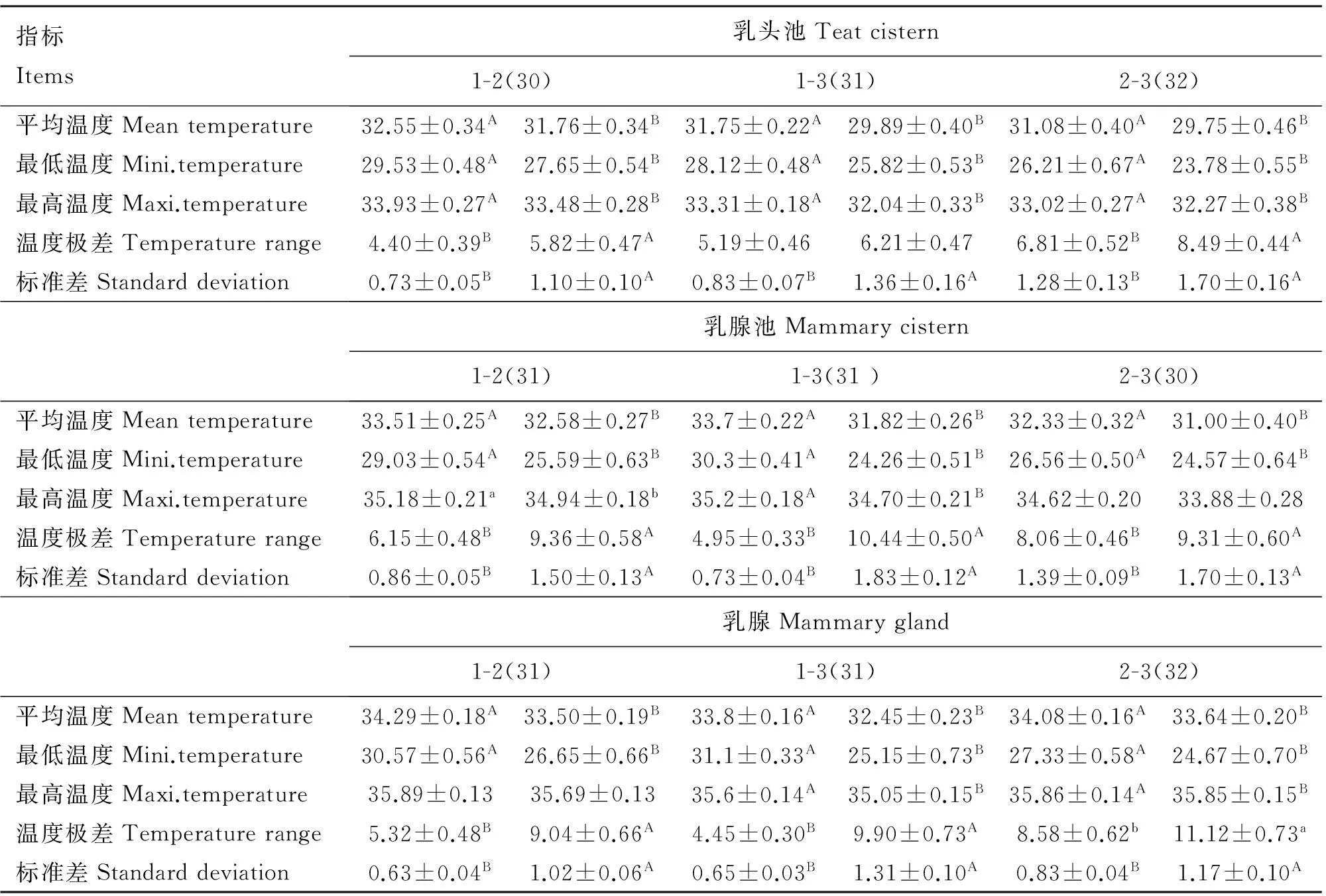
2.2.1不同脏污评分下左右乳头池皮肤温度分布规律不同脏污评分下左右乳头池皮肤温度差异比较结果见表4。除了1-3组皮肤的温度极差差异不显著(P>0.05)外,不同脏污评分的乳头池之间皮肤平均温度、最低温度、最高温度、温度极差、标准差差异极显著(P<0.01)。
2.2.2不同脏污评分下左右乳腺池皮肤温度分布规律不同脏污评分下左右乳腺池皮肤温度差异比较结果见表4。除2-3组乳腺池之间皮肤的最高温度差异不显著(P>0.05)外,各脏污程度之间乳腺池皮肤的平均温度、最低温度、最高温度、温度极差、标准差均呈现差异极显著或显著的变化(P<0.01或P=0.05)。
2.2.3不同脏污评分下左右乳腺皮肤温度分布规律不同脏污评分下左右乳腺皮肤温度差异比较结果见表4。除1-2组乳腺皮肤的最高温度差异不显著(P>0.05)之外,1-2组、1-3组、2-3组乳腺之间皮肤的平均温度、最低温度、最高温度、温度极差、标准差呈现的差异均显著或极显著(P<0.05或P<0.01)。
2.2.4不同脏污评分下乳头池皮肤温度分布规律不同脏污评分下乳头池皮肤温度差异比较结果见表5。随着乳头池脏污评分从1分到3分,乳头池皮肤的平均温度、最低温度、最高温度均呈现由高到低的极显著变化(P<0.01),对应的变化幅度分别为2.32、4.04和1.46 ℃,除了1分、2分乳头池皮肤最高温度之间差异不显著(P>0.05)之外。而乳头池皮肤的温度极差、标准差随着脏污程度的增加则逐渐呈现由低到高的极显著变化(P<0.01)。
2.2.5不同脏污评分下乳腺池皮肤温度分布规律不同脏污评分下乳腺池皮肤温度差异比较结果见表5。随着乳腺池脏污评分从1分到3分,乳腺池皮肤的平均温度、最低温度、最高温度逐级呈现极显著地降低(P<0.01),对应的变化幅度分别为2.20、5.27和0.93 ℃,而乳腺池皮肤的温度极差、标准差逐级呈现极显著升高(P<0.01)。
表4不同脏污评分下左右乳区皮肤温度配对分析结果
Table 4The paired analysis results of skin temperature of left and right sides of different parts at different smudge scores
℃
不同脏污评分下不同乳区左右两侧的同行数据肩标不同小写字母表示差异显著 (P<0.05);不同大写字母表示差异极显著(P<0.01);相同字母表示差异不显著 (P>0.05)
The same row of left and right sides of different parts at different smudge scores, values with different small letter superscripts mean significant difference (P<0.05); values with different capital letter superscripts mean extremely significant difference (P<0.01);while the same letter superscripts mean no significant difference (P>0.05)
表5不同脏污评分下各乳区皮肤温度分布
Table 5Skin temperature distribution of different parts at different smudge scores

℃
2.2.6不同脏污评分下乳腺皮肤温度分布规律不同脏污评分下乳腺皮肤温度差异比较结果见表5。随着乳腺脏污评分从1分到3分,乳腺皮肤的最低温度极显著下降(P<0.01),下降幅度达5.97 ℃,而温度极差、标准差极显著增大(P<0.01)。乳腺皮肤的平均温度、最高温度则随着脏污程度达到3分时极显著或显著下降(P<0.01或P<0.05),而脏污评分为1分、2分乳腺皮肤的平均温度和最高温度差异不显著(P>0.05)。
3讨论
3.1干净后乳区皮肤温度分布规律
3.1.1干净后乳区左右两侧不同分区皮肤温度差异比较人体医学研究表明,左右对称部位的皮肤温度具有对称分布的特征[15-17]。研究分析正常青年的体表温度分布,发现正常青年体表的温度对称性很好[18],健康女性左右乳腺的皮肤温度基本呈对称分布,且具有高度的正相关(r>0.9)[19]。
本研究结果表明,奶牛干净后乳区不同分区同样呈现左右对称的特征:无论乳头池、乳腺池、还是乳腺,左右两侧皮肤平均温度、最高温度、最低温度、温度极差和标准差差异均不显著。本试验结果与前人研究结果一致。曾有研究发现,奶牛右前乳区、左前乳区、右后乳区和左后乳区的皮肤温度分别为33.99、33.97、34.13和34.05 ℃,而且左右乳区皮肤温度之间差异不显著[20]。有研究报道,绵羊左右两个乳区的皮肤温度分别为37.01和37.08 ℃,二者之间差异不显著[21]。奶牛左后乳区和右后乳区皮肤温度的对称分布特征与奶牛乳房解剖结构和血液循环系统分布有关。反刍动物乳房由具有独立功能的乳腺组成(奶牛有4个乳房,羊有2个乳房)。每个乳房有自己独立的泌乳组织和乳池结构,且具有独立的分泌导管[22]。奶牛乳房除了解剖结构具有对称性,左右乳区的血液循环系统也呈对称分布的特征。
3.1.2干净全后乳区不同分区皮肤温度差异比较研究发现,人体从头至脚的皮肤温度呈降低趋势。有研究发现,乳腺、乳腺池、乳头池的皮肤平均温度、最低温度、最高温度显著降低[23],呈现从躯体近端到远端逐渐下降的规律。正常女性乳腺组织的温度分布是以乳头为中心的对称分布,乳头温度最低[24]。本试验研究结果表明,奶牛后乳区左右乳头池皮肤平均温度、最低温度、最高温度都显著低于后乳区其他分区。
3.2不同脏污评分下乳区温度分布规律
本试验均选择正常健康泌乳奶牛是为了避开患有乳房炎的奶牛所引起的乳房表面温度变化,从而单一考虑由于脏污程度引起的乳房表面温度变化,进一步探究不同脏污程度下乳房表面的温度分布规律。脏污程度对乳区皮肤温度有影响,并且随着脏污程度的增加,乳区皮肤的最低温度显著降低。相比最高温度,不同脏污程度对乳区皮肤的最低温度影响更大。这是因为只要出现脏污,不管脏污程度如何,该脏污部位的温度就会因脏污的遮挡而使测到的表面温度降低,从而拉低了该区域的最低温度;只要存在干净区域,该区域的真实温度就能通过红外热图像呈现出来。1-2组乳腺皮肤的最高温度无显著差异,推测是因为乳腺占后乳区的面积较大,轻度脏污对皮肤有所遮挡,仅会导致遮挡部位局部皮肤温度降低,但对裸露出来的干净皮肤的温度没有影响,所以导致1-2组乳腺皮肤的最高温度无显著差异。可见,脏污程度对乳区皮肤最高温度的影响比对其平均温度、最低温度的影响更不敏感,所以使用最高温度作为检测奶牛隐性乳房炎的温度指标较为合适。随着脏污程度的增加,乳头池、乳腺池、乳腺皮肤的温度极差和标准差也逐渐增加,结果表明,脏污程度越严重,乳房相应部位的温度变异程度越大。
随着脏污程度的增加,除了1-2组乳腺皮肤表面的最高温度差异不显著外,乳头池、乳腺池、乳腺皮肤表面的平均温度、最小温度、最大温度都呈现显著或极显著的降低,表明在利用红外热像仪检测奶牛隐性乳房炎时必须保证奶牛乳房表面干净无脏污。脏污对奶牛乳房表面温度的影响可以通过清洁乳房得以校正,清洁后的乳房需要等到完全干净、干燥后才能继续进行红外热图像的采集。在试验过程中,此奶牛场采用的卧床是橡胶垫上面增添稻壳,而奶牛除了采食,一般都是躺在卧床上反刍休息,奶牛乳房表面容易沾上稻壳,测试发现卧床上的稻壳对乳房表面温度影响不大。奶牛乳房表面的脏污还有干的粪污和湿的粪污,由于湿的粪污对乳房表面温度影响较大,且乳房沾上湿粪污的情况较少,所以拍摄过程中,一般挑选的牛是脏污为干燥粪污的牛,对脏污为湿粪污的牛进行排除。
试验分别探究了不同脏污程度对3个部位乳头池、乳腺池和乳腺的影响,因为乳腺占后乳区面积较大,其皮肤最高温度受轻度脏污的影响不大,而且相比乳房其它较远端的部位受环境条件影响较小,因此对于利用红外热成像技术检测奶牛隐性乳房炎有较大的适用性。前人利用红外热成像技术检测奶牛隐性乳房炎的大量试验研究中,通常选用乳腺池作为检测部位,根据奶牛左右乳腺池温度温差判断温度升高一侧乳腺发生隐性乳房炎[9]。
4结论
本研究结果表明:奶牛干净后乳区不同分区的皮肤温度呈现左右对称的特征;奶牛后乳区左右乳头池皮肤平均温度、最低温度、最高温度都显著低于后乳区其他分区,呈现从躯体近端到远端逐渐下降的规律,且乳腺部分代表性强,对检测奶牛隐性乳房炎有较大的适用性;随着脏污程度的增加,乳区皮肤的最低温度显著降低,不同脏污程度对乳区皮肤的最低温度影响较大,对乳区皮肤的最高温度影响较小,所以利用最高温度作为检测奶牛隐性乳房炎的温度指标较为合适;随着脏污程度的增加,温度极差和标准差也显著增加。
参考文献(References):
[1]KORHONEN H J T,KAARTINEN L.Changes in the composition of milk induced by mastitis[D].Helsinki:University of Helsinki,1995.
[2]HALASA T,HUIJPS K,ØSTERÅS O,et al.Economic effects of bovine mastitis and mastitis management:A review[J].VetQ,2007,29(1):18-31.
[3]HORTET P,SEEGERS H.Loss in milk yield and related composition changes resulting from clinical mastitis in dairy cows[J].PrevVetMed,1998,37(1-4):1-20.
[4]SINGH D,KUMAR S.A study on evaluation of economic losses due to mastitis in bovine in Purvanchal Region of UP[J].IndianJFieldVet,2013,8(4):68-70.
[5]VIGUIER C,ARORA S,GILMARTIN N,et al.Mastitis detection:current trends and future perspectives[J].TrendsBiotechnol,2009,27(8):486-493.
[6]REDAELLI V,BERGERO D,ZUCCA E,et al.Use of thermography techniques in equines:Principles and applications[J].JEquineVetSci,2014,34(3):345-350.
[7]WILLARD S,DRAY S,FARRAR R,et al.Use of infrared thermal imaging to quantify dynamic changes in body temperature following lipopolysaccharide (LPS) administration in dairy cattle[J].JAnimSci,2007,85(Suppl 2):26.
[8]HOVINEN M,SIIVONEN J,TAPONEN S,et al.Detection of clinical mastitis with the help of a thermal camera[J].JDairySci,2008,91(12):4592-4598.
[9]杨春合,顾宪红,曹正辉,等.奶牛左右乳区温度温差作为隐性乳房炎检测指标的可行性研究[J].畜牧兽医学报,2015,46(9):1663-1670.
YANG C H,GU X H,CAO Z H,et al.Study on possibility of left and right quarter skin temperature difference as a detecting indicator of subclinical mastitis in dairy cows[J].ActaVeterinariaetZootechnicaSinica,2015,46(9):1663-1670.(in Chinese)
[10]陈丙瑞.红外热像仪在医学中的应用与测量误差的研究[D].秦皇岛:燕山大学,2009.
CHEN B R.The applications of infrared thermography in medicine and research of measurement error[D].Qinhuangdao:Yanshan University,2009.(in Chinese)
[11]李云红.基于红外热像仪的温度测量技术及其应用研究[D].哈尔滨:哈尔滨工业大学,2010.
LI Y H.Research on temperature measurement technology and application based on infrared thermal imager[D].Harbin:Harbin Institute of Technology,2010.(in Chinese)
[12]陈斌,田桂华.红外热成像技术在植物病害检测中的应用研究进展[J].江苏农业科学,2014,42(9):1-4.CHEN B,TIAN G H.Research progress of application of infrared thermal imaging technology in plant disease detection[J].JiangsuAgriculturalSciences,2014,42(9):1-4.(in Chinese)
[13]河生德,拉毛鹏措,才项加,等.使用红外测温仪对环湖藏系绵羊和牦牛正常皮肤温度值的测定[J].黑龙江畜牧兽医,2010(4):77.
HE S D,LA M P C,CAI X J,et al.Determination of infrared thermometer on the tibetan sheep and yak skin temperature[J].HeilongjiangAnimalHusbandryandVeterinary,2010(4):77.(in Chinese)
[14]张文征,窦艳仙,安容姝,等.应用红外热成像技术辨析疼痛性质和发病机制[J].北京中医药大学学报,2012,35(5):355-357.
ZHANG W Z,DOU Y X,AN R S,et al.Infrared thermal imaging technology used in analysis on nature and mechanism of pain[J].JournalofBeijingUniversityofTraditionalChineseMedicine,2012,35(5):355-357.(in Chinese)
[15]SHERMAN R A,KARSTETTER K W,DAMIANO M,et al.Stability of temperature asymmetries in reflex sympathetic dystrophy over time and changes in pain[J].ClinJPain,1994,10(1):71-77.
[16]NIU H H,LUI P W,HU J S,et al.Thermal symmetry of skin temperature:normative data of normal subjects in Taiwan[J].NationalMedicalJournalofChina(Taipei), 2001,64(8):459-468.
[17]王红星,孟殿怀,励建安.健康青年男性脊柱区红外热像特征分析[J].中华物理医学与康复杂志,2006,28(10):687-689.
WANG H X,MENG D H,LI J A.Infrared thermography of the spine of a healthy young man[J].ChineseJournalofPhysicalMedicineandRehabilitation,2006,28(10):687-689.(in Chinese)
[18]炉庆洪,杨洪钦,陈丽,等.正常青年体表温度分布的红外热像分析[J].中国生物医学工程学报,2007,26(4):528-531,536.LU Q H,YANG H Q,CHEN L,et al.Analysis of the skin temperature distribution of infrared thermography of normal youth[J].ChineseJournalofBiomedicalEngineering,2007,26(4):528-531,536.(in Chinese)[19]王瑜华,叶真,包中涛,等.健康女性乳腺体表温度分布红外热成像与特征分析[J].福建师范大学学报(自然科学版),2012,28(5):58-61.
WANG Y H,YE Z,BAO Z T,et al.Breast surface temperature distribution of the normal females by infrared thermal imaging and feature analysis[J].JournalofFujianNormalUniversity(NaturalScienceEdition),2012,28(5):58-61.(in Chinese)
[20]COLAK A,POLAT B,OKUMUS Z,et al.Short communication:Early detection of mastitis using infrared thermography in dairy cows[J].JDairySci,2008,91(11):4244-4248.
[21]MARTINS R F,DO PRADO PAIM T,DE ABREU CARDOSO C,et al.Mastitis detection in sheep by infrared thermography[J].ResVetSci,2013,94(3):722-724.
[22]BRUCKMAIER R M,BLUM J W.Oxytocin release and milk removal in ruminants[J].JDairySci,1998,81(4):939-949.
[23]刘艳峰,周翔,王丽娟.人体皮肤温度适应性变化特性及垂直分布规律初步研究[J].环境与健康杂志,2014,31(1):68-70.
LIU Y F,ZHOU X,WANG L J.A preliminary study on the characteristics of temperature adaptability and vertical distribution of human skin[J].JournalofEnvironmentandHealth,2014,31(1):68-70.(in Chinese)
[24]苏毅明,叶真,许啊清,等.女性乳腺红外热图像特征分析及其与超声影像的对比[J].福建师范大学学报(自然科学版),2009,25(4):53-56,66.
SU Y M,YE Z,XU A Q,et al.Feature analysis of female breast thermal imaging and its comparison with ultrasound imaging[J].JournalofFujianNormalUniversity(NaturalScienceEdition),2009,25(4):53-56,66.(in Chinese)
(编辑程金华)
Effect of Smudgy Degree on Temperature Distribution of the Udder Surface in Dairy Cow
PENG Dan-dan,CHEN Jian,ZHAO Yue,HAN Li,LI Gan,YANG Chun-he,GU Xian-hong*
(StateKeyLaboratoryofAnimalNutrition,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
Abstract:In order to improve the accuracy of detecting dairy cow subclinical mastitis by infrared thermography,the effect of smudgy degree on temperature distribution of the udder surface in dairy cow was studied.325 dairy cows with normal udder appearance and SCC<5×105·mL-1were selected.Their rear udders were partitioned into teat cistern,mammary cistern and mammary gland,and the smudgy degree was graded according to a 3-point scoring system.Then different parts of rear udder were divided into 4 groups.The results showed that the difference of skin temperature of left and right sides at the different parts was not significant(P>0.05) in the clean rear udder.It was also found that the mean skin temperature,minimum temperature and maximum temperature from mammary gland,mammary cistern to teat cistern significantly reduced or had a tendency to be lower,and that the decreased amplitude was 1.90,6.90 and 1.62 ℃,respectively.However,with the increase of degree of the smudge,at teat cistern,mammary cistern and mammary gland,the minimum skin temperature,was sharply decreased(P<0.01),mean temperature had a tendency to reduce,and the variational degree of temperature was significantly increased(P<0.01).These results indicated that smudgy degree of udder surface had an important effect on its temperature distribution,the highest temperature of mammary gland had a smaller effect of smudge,which is optimum to determine subclinical mastitis of dairy cow by IRT method.
Key words:smudgy degree;temperature distribution;infrared thermography;teat cistern;mammary cistern;mammary gland
doi:10.11843/j.issn.0366-6964.2016.04.026
收稿日期:2015-08-04
基金项目:奶牛产业技术体系北京市创新团队项目(bjcystx-ny-3);国家科技支撑计划课题(2012BAD39B02);中国农业科学院科技创新工程(ASTIP-IAS07)
作者简介:彭丹丹(1993-),女,河南平顶山人,硕士生,主要从事畜禽应激、健康养殖与环境控制研究,E-mail:2511103871@qq.com *通信作者:顾宪红,研究员,博导,主要从事畜禽应激、福利与健康养殖研究,E-mail:guxianhong@vip.sina.com
中图分类号:S858.23
文献标志码:A
文章编号:0366-6964(2016)04-0844-08
