文昌鸡性成熟启动前后下丘脑c-Myc/LIN28B/let-7a通路表达规律分析
2016-07-11苏一军朱云芬李国辉张会永殷建玫王克华邹剑敏
韩 威,苏一军,朱云芬,李国辉,张会永,殷建玫,王克华,邹剑敏
(中国农业科学院家禽研究所 国家级地方鸡种基因库,扬州 225125)
文昌鸡性成熟启动前后下丘脑c-Myc/LIN28B/let-7a通路表达规律分析
韩威,苏一军,朱云芬,李国辉,张会永,殷建玫,王克华,邹剑敏*
(中国农业科学院家禽研究所 国家级地方鸡种基因库,扬州 225125)
摘要:本研究旨在分析c-Myc/LIN28B/let-7a调节通路与鸡性成熟启动的关联。测定5~17周龄文昌鸡母鸡卵巢重量、最大卵泡直径、输卵管长度及冠大小的发育性变化,并采用qRT-PCR检测c-Myc/LIN28B/let-7a基因在性成熟启动前后下丘脑中的表达。结果表明,在发育早期,文昌鸡性腺组织发育缓慢,卵泡保持原始状态。12周龄后,性腺组织进入快速发育期,13周龄母鸡的卵巢重量(1.35 g)和输卵管长度(15.68 cm)与12周龄测量值(0.60 g,7.16 cm)相比分别增加了125%和120%,同时出现等级前小白卵泡(SWF,直径1.0~2.0 mm)或大白卵泡(LWF,直径3.0~5.0 mm),由此确定,12~13周龄为文昌鸡母鸡的性成熟启动关键时机。qRT-PCR检测表明,c-Myc、LIN28B基因在文昌鸡性成熟启动时,下丘脑组织中的表达水平显著降低(P<0.05,P<0.01),且c-Myc基因的低表达能够持续到开产,而LIN28B基因表达水平在开产前(15周龄)又恢复至较高水平;性成熟启动后let-7a表达水平显著升高(P<0.01),并持续至开产。综上表明,c-Myc→LIN28B┤let-7a通路参与鸡性成熟启动调节。
关键词:文昌鸡;性成熟启动;下丘脑;基因表达
性早熟(Precocious puberty)在人类表现为病理状态,而在家禽生产上则是一个具有重要经济价值的性状[1]。中国地方鸡品种资源的早熟特性十分明显,如蛋用型的白耳黄鸡、仙居鸡,肉用型的文昌鸡、广西三黄鸡等开产日龄大都在110~120 d,比国外品种提前20 d以上。开展鸡性成熟调控机制研究,对于高产蛋鸡和优质肉鸡育种具有重要意义。性成熟启动(Puberty onset)是个复杂的生物学过程,受遗传、环境、营养等因素的共同调节,哺乳动物和人类遗传学研究为肯定遗传因素的调控作用提供了有力证据[2-3]。通过全基因组关联分析(Genome-wide association analysis,GWAS),研究者发现多个性早熟调节候选基因系统,包括KISS1/GPR54[4-5]、LIN28[6]、NKB[7]及MKRN3印记基因等[8-9],大大加深人们对性成熟启动的神经内分泌调控和遗传决定机制理解。性成熟启动受多基因网络调控,没有孤立的基因或通路独立地负责性成熟启动过程[10-11]。越来越多的证据表明,性成熟启动可能不会提早发生,性成熟启动基因的转录抑制可能起重要作用。近年来,研究者基于高通量基因组学数据,借助生物信息学分析初步构建性成熟启动的多层次等级转录调控网络[12-13],为理解性成熟启动的调控机制注入新见解。而构成该网络核心的c-Myc/LIN28/let-7通路还缺乏足够的试验支持,尤其是缺乏禽类研究证据,相关同源基因在禽类性成熟启动进程中的表达规律尚未被清晰阐述。下丘脑是调节性成熟进程的关键组织,本研究利用qRT-PCR方法检测该通路基因在性成熟启动前、后文昌鸡下丘脑中的表达变化规律,为解析多层次等级基因转录抑制在性成熟启动中的调控作用提供依据。
1材料与方法
1.1材料
文昌鸡来源于国家级地方鸡种基因库保种群,上笼母鸡人工授精后,连续收集10~12 d种蛋孵化,人工鉴定雏鸡性别,随机选留母鸡个体。在常规标准化饲养管理条件下,饲喂至17周龄,分育雏、育成和产蛋3个阶段,全程饲喂全价配合饲料(嘉吉饲料(镇江)有限公司),自由采食和饮水。
1.2不同周龄鸡冠和性腺组织发育度量
5~17周龄,每周选取母鸡个体10个,屠宰后测定鸡冠大小、卵泡大小、卵巢重量和输卵管长度。冠和卵泡大小测量使用游标卡尺,卵巢重量测量使用电子称,输卵管长度测量采用皮尺。冠高:指第2齿尖至基部的垂直距离。冠长:指冠基部最前端~最后端的直线距离。输卵管长度:指漏斗管部~泄殖腔部的直线(自然伸展)距离。
1.3下丘脑组织样采集
选择用于性腺组织发育度量的11~15、17周龄母鸡个体(每组6个/10个),屠宰后按照鸟类脑部组织结构分离下丘脑组织,液氮保存。
1.4组织RNA提取和质量检测
mRNA定量分析的总RNA,按照Trizol试剂盒(SK1311,上海生工生物工程有限公司)说明进行提取,用于miRNA定量分析的小RNA,采用miScript II RT kit(QIAGEN,USA)试剂盒提取。分光光度计检测OD260 nm/OD280 nm值,琼脂糖电泳检测RNA的完整性。
1.5qRT-PCR定量分析
c-Myc和LIN28B基因相对定量:反转录第一链cDNA合成采用AMV First Strand cDNA Synthesis Kit(SK2445)试剂盒。PCR扩增引物序列见表1,GAPDH基因做内参。20 μL反应体系:SybrGreen qPCR Master Mix(2×)10 μL,引物F (10 μmol·L-1) 1 μL,引物R (10 μmol·L-1) 1 μL,ddH2O 6 μL,Template (cDNA) 2 μL。反应程序:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 40 s,40个循环 。
let-7a相对定量:snRNAU6做内参,U6逆转录引物、let-7a茎环特异性引物及PCR扩增引物见表2。反转录体系(5 μL):变性总 RNA和RT primer (2 μmol·L-1) 3.0 μL,5×PrimeScript®Buffer 1.0 μL,RNase Free dH2O 0.6 μL,PrimeScript®RT Enzyme Mix I 0.4 μL。反应程序:42 ℃ 15 min,85 ℃ 5 s,4 ℃保存。PCR扩增体系(20 μL):2×SYBR Green Mix With ROX 10.0 μL,ddH2O 8.2 μL,Primer mix (10 μmol·L-1) 0.8 μL,RT product 1 μL。反应程序为50 ℃ 2 min,95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,39个循环。每个样品3次重复。
表1qRT-PCR检测基因引物序列
Table 1Primer sequences for qRT-PCR

基因Gene登录号Accessionnumber引物序列(5'-3')Primersequence产物长度/bpLengthLIN28BGalluslin-28homologB(C.elegans)NM_001034818.1F:GCCTAAAAGAAGGAGAACCAGTGR:TTGGGTCGTCTTTCACTTCCT117c-MycGallusmyelocytomatosisviraloncogenehomologNM_001030952.1F:AAGAGGCTAAAGTTGGACAGTGGR:CGCAGGGCAAAGAAACTCA166GAPDHGallusglyceraldehyde-3-phosphatedehydrogenaseNM_204305.1F:ACTGTCAAGGCTGAGAACGGR:GGTCACGCTCCTGGAAGATA269
表2miRNA qRT-PCR检测引物信息
Table 2Primer sequences forlet-7 miRNA qRT-PCR
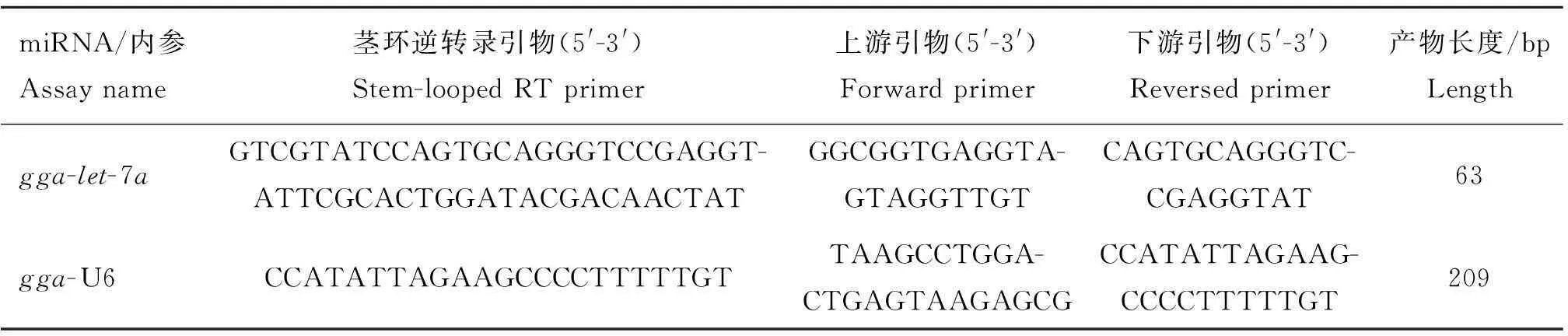
miRNA/内参Assayname茎环逆转录引物(5'-3')Stem-loopedRTprimer上游引物(5'-3')Forwardprimer下游引物(5'-3')Reversedprimer产物长度/bpLengthgga-let-7aGTCGTATCCAGTGCAGGGTCCGAGGT-ATTCGCACTGGATACGACAACTATGGCGGTGAGGTA-GTAGGTTGTCAGTGCAGGGTC-CGAGGTAT63gga-U6CCATATTAGAAGCCCCTTTTTGTTAAGCCTGGA-CTGAGTAAGAGCGCCATATTAGAAG-CCCCTTTTTGT209
1.6数据处理
根据2-△△CT方法计算基因相对表达水平。性状和表达水平比较分析,采用SPSS20.0单因素方差分析one-way AVOVA LSD进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2结果
2.1不同周龄性腺组织发育性变化
5~17周龄文昌鸡母鸡鸡冠、卵泡和性腺组织的发育性变化见表3。结果表明,早期性腺组织发育缓慢,卵泡保持原始状态,这一过程约持续12周。12周龄后,性腺组织进入快速发育期,13周龄母鸡的卵巢重量(1.35 g)和输卵管长度(15.68 cm)与12周龄测量值(0.60 g,7.16 cm)相比,分别增加了125%和120%(P<0.01),同时出现等级前小白卵泡(SWF,直径1.0~2.0 mm)或大白卵泡(LWF,直径3.0~5.0 mm)。另一个显著的外在表型变化,就是母鸡眼睑周围的皮肤颜色由黄色或淡红色转变成深红色。约20~30 d后,母鸡即可达到性成熟并产下第1个蛋(开产)。基于上述指标,判定文昌鸡性成熟启动时期为12~13周龄。
2.2扩增片段检测和克隆测序
提取的组织总RNA经分光光度计检测,OD260nm/OD280nm为1.8~2.0,表明总RNA保持完整。LIN28B、c-Myc和let-7aPCR扩增产物凝胶电泳检测(图略),结果表明,扩增片段长度大小与引物设计相一致。LIN28B和c-Myc基因PCR产物克隆测序见图1,通过序列比对,测定序列与GenBank中鸡相应基因的核苷酸序列相一致。
2.3基因表达水平分析
LIN28B、c-Myc基因和let-7a在性成熟启动前后下丘脑中的相对表达水平见图2。结果表明,性成熟启动转变时(12~13周龄),c-Myc和LIN28B基因的表达水平显著降低(P<0.05,P<0.01),且c-Myc基因的低表达能够持续到开产,而LIN28B基因表达水平在开产前(15周龄)又恢复至较高水平。与之相反,let-7a的表达水平显著升高(P<0.01),并持续至开产。
表3不同发育时期鸡冠和性腺组织度量(n=10)
Table 3Measurement of comb size and gonad tissues during different development stages(n=10)
A.LIN28B基因;B.c-Myc基因A.LIN28B gene;B.c-Myc gene图1 检测基因PCR扩增片段序列Fig.1 Sequences of gene PCR products
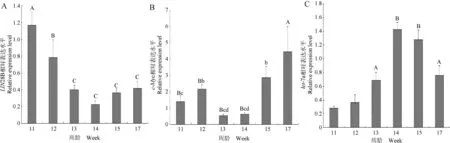
小写字母表示P<0.05;大写字母表示P<0.01Lowercase letters indicated P<0.05;Capital letters indicated P<0.01图2 不同发育阶段LIN28B、c-Myc基因和let-7a的相对表达水平Fig.2 Relative expression levels of LIN28B,c-Myc genes and let-7a in different development phases
3讨论
3.1文昌鸡性成熟启动度量
性成熟调控机制研究中,一个重要的前提条件是能够准确地度量性成熟启动时期及其进程。在过去的十年里,还没有出现新的性成熟度量方法[14]。人类上,“Tanner分期”(按青春期性发育的特征将生殖系统的发育分为5期,用于临床评估)仍是最经典的性成熟分级方法,TannerⅡ期的阴毛出现(Pubarche)和乳房初发育(Thelarche)为青春期启动的标志,初潮期(Age at menarche)是青春期最显著标志。阴门开启(Vaginal opening,VO)被视为雌性哺乳类动物性成熟启动的标志[15-16]。生殖激素水平测定也常被用于度量性成熟阶段[17-18]。
与哺乳动物和人类相比,禽类的生殖活动具有不同的特点。母鸡在4~5月龄达到性成熟,并开始产蛋,开产是青春期完成和性成熟的标志[19]。母鸡没有初情期和发情周期。尽管研究者针对禽类性成熟过程的生理学特征开展了广泛的研究[20],然而迄今为止,还没有系统的方法能够用于度量鸡的性成熟阶段。母鸡在性发育过程中能被直接观测到的外在特征主要有冠的大小和颜色、体重变化,但是这些指标难以精确度量性成熟启动及进程。性腺的发育状态是机体性成熟发育进程的最直接体现,在本研究首先测定母鸡性腺组织5~17周龄持续发育性变化,结果表明进入13周龄后,文昌鸡母鸡的卵巢、输卵管、卵泡呈现“迸发式”快速发育,代表了生殖状态改变的一个重要转折时期。另外,本研究也测定了性成熟前后不同发育阶段母鸡血清LH水平,结果与已有的报道相类似,LH水平的增加与性腺组织的快速发育相一致。虽然基于不同发育阶段LH平均水平可以度量鸡性成熟启动及其进程,但是难以精确区别单个个体的性发育状态,因为测定值在不同发育阶段、同一发育阶段不同个体间存在重叠和较大变异,这也是未使用LH水平作为度量指标的主要原因。在以后研究中寻找新的更精确的标记,如循环miRNA[21]用于性成熟度量是非常必要的。
因此,基于性腺发育指标确定了12~13周龄为文昌鸡母鸡的性成熟启动关键时期,这为开展性成熟启动相关研究提供了前提基础。
3.2c-Myc/LIN28B/let-7a通路与鸡性成熟启动
LIN28和let-7是线虫幼虫发育的异时性调节因子,LIN28基因编码一种RNA结合蛋白,抑制let-7 miRNA前体向成熟miRNA的转变。LIN28/let-7通路调节功能多样化,与癌症、胚胎发育、老化、糖代谢等过程密切相关[22-23]。此外,越来越多的研究表明,LIN28/let-7通路参与性成熟启动时期的决定。渐增的LIN28表达会导致线虫发育延迟,人类LIN28B基因与初潮期提前相关[24-25],LIN28a过表达小鼠初情期启动延迟[26]。研究还发现,LIN28/let-7通路的调节性成熟启动时期作用存在性别差异,LIN28b对雄性小鼠的调节作用可能强于雌性小鼠,而且这种调节可能部分地独立于let-7。提示LIN28/let-7通路可能还包括其他功能组分。
已知的MYC家族成员至少有3个:C-Myc、N-Myc和L-Myc。C-Myc基因是禽类髓细胞病毒MC-29的V-Myc同源基因,其肿瘤发生作用是三者中最强的。C-Myc蛋白在结构上包含转录激活区和DNA结合区,能作为转录因子激活或抑制下游靶基因的转录,是哺乳动物体尺和代谢作用的重要调节因子[26]。研究已证实MYC作用于LIN28基因的上游,是LIN28基因的正向调节因子,同时let-7也能靶向MYC基因[26],形成了一个反馈环。S.Alvarellos等[27]研究发现,在幼年期~青年期发育转变大鼠的下丘脑中,LIN28、LIN28B和c-Myc的表达水平显著降低,至青春期前期达到最低水平;而let-7a、let-7b(还包括miR-132、miR-145)表达则显著增加,c-Myc/LIN28B/let-7通路的表达变化在青春期延迟模型中也被发现。
本研究qRT-PCR检测发现,c-Myc、LIN28B基因在文昌鸡性成熟启动关键转变时期(12~13周龄)下丘脑组织中的表达水平显著降低(P<0.05,P<0.01),且c-Myc基因的低表达能够持续到开产,而LIN28B基因表达水平在开产前(15周龄)又恢复至较高水平;与之相对应的是,性成熟启动后let-7a表达水平显著升高,研究结果与哺乳动物中发现的c-Myc→LIN28┤let-7(→表示促进作用,┤表示抑制作用)表达变化模式相一致,初步表明,该调控通路与性成熟启动调节相关。
4结论
c-Myc/LIN28B/let-7a通路参与文昌鸡性成熟启动调节。
参考文献(References):
[1]储明星,冯涛,狄冉,等.哺乳动物性早熟相关基因的研究进展[J].遗传,2009,31(1):13-28.
CHU M X,FENG T,DI R,et al.Advances on related genes with sexual precocity in mammals[J].Hereditas,2009,31(1):13-28.(in Chinese)
[2]PALMERT M R,HIRSCHHORN J N.Genetic approaches to stature,pubertal timing,and other complex traits[J].MolGenetMetab,2003,80(1-2):1-10.
[3]PARENT A S,TEILMANN G,JUUL A,et al.The timing of normal puberty and the age limits of sexual precocity:variations around the world,secular trends,and changes after migration[J].EndocrRev,2003,24(5):668-693.
[4]SEMINARA S B,MESSAGER S,CHATZIDAKI E E,et al.The GPR54 gene as a regulator of puberty[J].NEnglJMed,2003,349(17):1614-1627.
[5]DE ROUX N,GENIN E,CAREL J C,et al.Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54[J].ProcNatlAcadSciUAS,2003,100(19):10972-10976.
[6]PERRY J R,STOLK L,FRANCESCHINI N,et al.Meta-analysis of genome-wide association data identifies two loci influencing age at menarche[J].NatGenet,2009,41(6):648-650.
[7]TOPALOGLU A K,REIMANN F,GUCLU M,et al.TAC3 and TACR3 mutations in familial hypogonadotropic hypogonadism reveal a key role for Neurokinin B in the central control of reproduction[J].NatGenet,2009,41(3):354-358.
[8]DE VRIES L,GAT-YABLONSKI G,DROR N,et al.A novel MKRN3 missense mutation causing familial precocious puberty[J].HumReprod,2014,29(12):2838-2843.
[9]MACEDO D B,ABREU A P,REIS A C,et al.Central precocious puberty that appears to be sporadic caused by paternally inherited mutations in the imprinted gene makorin ring finger 3[J].JClinEndocrinolMetab,2014,99 (6):1097-1103.
[10]GAJDOS Z K,BUTLER J L,HENDERSON K D,et al.Association studies of common variants in 10 hypogonadotropic hypogonadism genes with age at menarche[J].JClinEndocrinolMetab,2008,93(11):4290-4298.
[11]ELKS C E,PERRY J R,SULEM P,et al.Thirty new loci for age at menarche identified by a meta-analysis of genome-wide association studies[J].NatGenet,2010,42(12):1077-1085.
[12]OJEDA S R,DUBAY C,LOMNICZI A,et al.Gene networks and the neuroendocrine regulation of puberty[J].MolCellEndocrinol,2010,324(1-2):3-11.
[13]LOMNICZI A,WRIGHT H,CASTELLANO J M,et al.A system biology approach to identify regulatory pathways underlying the neuroendocrine control of female puberty in rats and nonhuman primates[J].HormBehav,2013,64(2):175-186.
[14]DORN L D,BIRO F M.Puberty and its measurement:a decade in review[J].JResAdolescen,2011,21(1):180-195.
[15]YINGLING V R,KHANEJA A.Short-term delay of puberty causes a transient reduction in bone strength in growing female rats[J].Bone,2006,38(1):67-73.
[16]DORN L D,DAHL R E,WOODWARD H R,et al.Defining the boundaries of early adolescence:a user’s guide to assessing pubertal status and pubertal timing in research with adolescents[J].ApplDevSci,2006,10(1):30-56.
[17]SHIRTCLIFF E A,DAHL R E,POLLAK S D.Pubertal development:Correspondence between hormonal and physical development[J].ChildDev,2009,80(2):327-337.
[18]PACZOSKA-ELIASIEWICZ H E,PROSZKOWIEC-WEGLARZ M,PROUDMAN J,et al.Exogenous leptin advances puberty in domestic hen[J].DomestAnimEndocrinol,2006,31(3):211-226.
[19]DUNN I C,LEWIS P D,WILSON P W,et al.Acceleration of maturation of FSH and LH responses to photostimulation in prepubertal domestic hens by oestrogen[J].Reproduction,2003,126(2):217-225.
[20]ONAGBESAN O M,METAYER S,TONA K,et al.Effects of genotype and feed allowance on plasma luteinizing hormones,follicle-stimulating hormones,progesterone,estradiol levels,follicle differentiation,and egg production rates of broiler breeder hens[J].PoultSci,2006,85(7):1245-1258.
[21]CORTEZ M A,BUESO-RAMOS C,FERDIN J,et al.MicroRNAs in body fluids--the mix of hormones and biomarkers[J].NatRevClinOncol,2011,8(8):467-477.
[22]THORNTON J E,GREGORY R I.How does Lin28 let-7 control development and disease?[J].TrendsCellBiol,2012,22(9):474-482.
[23]ZHU H,SHYH-CHANG N,SEGRA V,et al.The Lin28/let-7 axis regulates glucose metabolism[J].Cell,2011,147(1):81-94.
[24]HE C,KRAFT P,CHEN C,et al.Genome-wide association studies identify loci associated with age at menarche and age at natural menopause[J].NatGenet,2009,41(6):724-728.
[25]ONG K K,ELKS C E,LI S,et al.Genetic variation in LIN28B is associated with the timing of puberty[J].NatGenet,2009,41(6):729-733.
[26]ZHU H,SHAH S,SHYH-CHANG N,et al.Lin28a transgenic mice manifest size and puberty phenotypes identified in human genetic association studies[J].NatGenet,2010,42(7):626-630.
[27]SANGIAO-ALVARELLOS S,MANFREDI-LOZANO M,RUIZ-PINO F,et al.Changes in hypothalamic expression of the Lin28/let-7 system and related microRNAs during postnatal maturation and after experimental manipulations of puberty[J].Endocrinology,2013,154(2):942-955.
(编辑程金华)
Analysis on Changes of Hypothalamic c-Myc/LIN28B/let-7a Pathway Transcription during Puberty Onset in Wenchang Chicken
HAN Wei,SU Yi-jun,ZHU Yun-fen,LI Guo-hui,ZHANG Hui-yong,YIN Jian-mei,WANG Ke-hua,ZOU Jian-min*
(NationalChickensGeneticResources,PoultryInstitute,ChineseAcademyofAgriculturalSciences,Yangzhou225125,China)
Abstract:This experiment was conducted to investigate the role ofc-Myc/LIN28B/let-7apathway in chicken puberty onset.The Wenchang chicken breed was used as the material.The comb size,ovary weight,oviduct length and follicle size for hens were measured from 5 to 17 weeks.qRT-PCR was performed to analyze the hypothalalmic expression changes ofc-Myc/LIN28B/let-7apathways.The results showed that:1) The ovary and oviduct developed slowly and the follicles kept primitive in early period of development in Wenchang chicken.This period would last about 12 weeks.Then,the gonad tissues developed explosively,the ovary weight and oviduct length of 13 weeks increased 125% and 120% respectively compared to that of 12 weeks,and accompanied by emergence of pre-hierarchical follicles.Based on these,the crucial “timing” for transition from juvenile to puberty onset for Wenchang hens was determined as age of 13 weeks.2) qRT-PCR test revealed the relative expression levels ofc-MycandLIN28Bgenes in hypothalamus decreased significantly (P<0.05,P<0.01) at the transition timing of puberty onset in Wenchang chicken.The lower level ofc-Myccould last to the age of first laying,but that ofLIN28Brecovered to higher level before the age of first laying.Accompanied with these changes was the significant increase oflet-7a(P<0.01),which could kept higher until the age of first laying.These results indicated thatc-Myc→LIN28B┤let-7aregulating pathway was involved in chicken puberty onset.
Key words:Wenchang chicken;puberty onset;hypothalamus;gene expression
doi:10.11843/j.issn.0366-6964.2016.04.010
收稿日期:2015-10-14
基金项目:国家自然科学基金项目(31201799);江苏省农业三新工程项目(SXGC[2015]300);江苏省农业科技创新项目(CX[15])1009)
作者简介:韩威(1980-),男,徐州睢宁人,副研究员,博士,主要从事家禽资源保护与评价研究,E-mail:hanwei830@163.com,Tel:0514-86587763 *通信作者:邹剑敏,研究员,E-mail:jqszjm@163.com
中图分类号:S831.2
文献标志码:A
文章编号:0366-6964(2016)04-0709-07
