鹅乙酰辅酶A酰基转移酶2基因的克隆及其在鹅肥肝形成过程中的表达变化
2016-07-11王倩倩夏丽丽孙晓先耿拓宇龚道清
王倩倩,杨 彪,夏丽丽,孙晓先,耿拓宇,龚道清
(扬州大学动物科学与技术学院,扬州 225009)
鹅乙酰辅酶A酰基转移酶2基因的克隆及其在鹅肥肝形成过程中的表达变化
王倩倩,杨彪,夏丽丽,孙晓先,耿拓宇,龚道清*
(扬州大学动物科学与技术学院,扬州 225009)
摘要:为了探讨ACAA2基因与鹅(Anseranser)肝脂肪代谢的关系,本试验选取35只朗德鹅分为填饲组(15只)和对照组(20只),填饲组包括填饲7、14和19天3个阶段。运用RT-PCR方法克隆出朗德鹅ACAA2基因的完整编码序列并进行生物信息学分析,采用实时定量PCR技术测定了朗德鹅填饲不同阶段该基因在肝中的表达水平,并用葡萄糖、脂肪酸和胰岛素分别处理鹅原代肝细胞,观察这些因子对基因表达的影响。朗德鹅ACAA2基因完整CDS区长1 194 bp,编码 397个氨基酸;各阶段填饲组肝中该基因的表达量显著高于对照组(P<0.05),但随填饲时间的延长,表达水平呈下降趋势。另外,在培养的鹅原代肝细胞中,相较于对照组,0.5 mmol·L-1的油酸能使ACAA2的表达量显著上调,而0.25 mmol·L-1的棕榈酸和不同浓度的胰岛素能显著下调ACAA2的表达(P<0.05)。结果表明,ACAA2基因的表达与鹅肥肝的形成密切相关,为深入研究ACAA2基因在鹅肥肝形成过程中的作用奠定了基础。
关键词:鹅;乙酰辅酶A酰基转移酶2;脂肪肝;基因克隆
鹅肥肝是一种高级营养品,富含不饱和脂肪酸,易被人体吸收和利用,且可降低人体血液中胆固醇的含量。因其营养丰富、质地细嫩、味道鲜美,鹅肥肝被公认为是三大美味佳肴之一[1-2]。有关鹅肥肝形成机理一直受到人们的关注,近年来国内外学者从分子水平上开展了相关研究,筛选出一些与鹅肥肝形成相关的基因,并对基因功能进行了研究,使得人们对鹅肥肝形成的分子机理有了初步的了解[3-5]。乙酰辅酶A酰基转移酶2(Acetyl-coenzyme A acyltransferase 2,ACAA2)又称线粒体3-羰基辅酶A硫解酶(Mitochondrial 3-Oxoacy-l Coenzyme A Thiolase),作为酰基转移酶主要分布于线粒体,参与脂肪酸的β氧化和胆固醇的生物合成过程等,被认为是非常重要的脂类代谢基因[6-7]。李文娟[8]利用基因芯片技术发现ACAA2 是鸡肌肉组织间脂质代谢差异基因路径上起枢纽作用的节点基因。V.C.De Boer 等[9]采用基因组芯片对不同小鼠脂质代谢组织进行了表达谱分析,同样检测到ACAA2基因的差异表达。A.Sidrah等[10]研究发现ACAA2基因的表达量在饮食诱发的肥胖小鼠中显著降低。上述研究结果提示,ACAA2在维持肝脂肪酸代谢的过程中可能发挥重要作用。鹅是肝脂肪沉积能力最强的动物,经过20 d填饲其肝可以增加8~10倍,且有研究表明填饲能使与脂代谢相关基因的表达量显著上调[11-12],但有关鹅ACAA2基因的研究未见报道。
本试验以肥肝专门化品种朗德鹅为素材,克隆出鹅ACAA2基因的完整编码区序列(CDS),利用荧光定量PCR技术分析该基因在填饲期不同阶段肝中的表达情况,并用不同的与脂肪合成相关因子(葡萄糖、胰岛素和脂肪酸)处理鹅原代肝细胞,研究这些因子对其表达的影响,为深入研究ACAA2基因在鹅肥肝形成过程中的作用奠定基础。
1材料与方法
1.1试验动物
本研究所用素材为扬州瑞农股份有限公司提供的朗德鹅。选取35只朗德鹅公鹅分为填饲组(15只)和对照组(20只)。对照组分别于70、77、84和89日龄各屠宰5只;填饲组从71日龄开始填饲,70日龄为填饲0天,分别于77日龄(填饲7天)、84日龄(填饲14天)和89日龄(填饲19天)各屠宰5只,试验组和对照组均取肝右叶组织,经液氮速冻后在-70 ℃保存备用。填饲用的饲料处理方法:称取适量的玉米,入锅煮沸5 min后取出沥干,趁热加入1%食盐、1%鹅油,充分搅拌冷却后即可填饲。填饲量:其中1~7 d,每天填饲3次,每次填饲的玉米用量约为100 g;8~13 d,每天填饲4次,玉米用量约为200 g;最后5 d每天填饲5次,每次玉米用量约为280 g。填饲组人工强制填饲,对照组鹅自由饮水和采食玉米饲料。试验鹅在填饲期单独笼养,自由饮水。
1.2试验材料
Trizol、琼脂糖凝胶DNA回收试剂盒、DH5α感受态细胞购自天根生化科技(北京)有限公司;Pmd19-T Vector购于宝生物(大连)工程有限公司;HiScriptTMQ RT SuperMix for qPCR(+gDNA wiper) 反转录试剂盒,荧光定量试剂盒SYBR Green Master Mix购自南京诺唯赞生物科技有限公司;10×PCR Buffer,25 mmol·L-1MgCl2,dNTP Mixture(Each 10 mmol·L-1),rTaq DNA聚合酶,琼脂糖(Agarose)购自上海生工生物工程技术服务有限公司。高糖培养基、胎牛血清(FBS)购自GIBCO公司,Ⅳ 胶原酶购自Worthington公司,葡萄糖、DMSO、红细胞裂解液购自北京索莱宝科技有限公司,油酸钠、棕榈酸钾、胰岛素购自Sigma公司,EGF购自peprotech(派普泰克)公司中国代表处,青霉素/链霉素混合液购自上海碧云天生物技术研究所 。
1.3试验方法1.3.1全长CDS克隆根据鸡(Gallus)ACAA2基因序列(GenBank登录号:NM_001006571 )设计引物,PCR扩增朗德鹅ACAA2基因全长编码区序列(CDS)。上下游引物:F:5′-ATGGCGCTGCTCAGGGGTGT-3′,R:5′-CTCAGGCGGTGTTCTCAATG-3′。
PCR反应总体系为20 μL:其中模板DNA 1 μL (约150 ng),10×PCR Buffer 2 μL,Mg2+2.2 μL,dNTPs 0.8 μL,rTaqDNA聚合酶0.2 μL,ddH2O 11.8 μL,上下游引物(10 μmol·L-1)各1 μL。PCR反应条件:9 5℃预变性5 min;95 ℃变性30 s,62.9 ℃退火30 s,72 ℃延伸2 min,共33个循环;72 ℃延伸10 min;产物于4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳进行检测,用琼脂糖凝胶DNA回收试剂盒进行目的片段的回收,并将回收后的PCR产物连接到pMD-19T Vector,转化至DH5α感受态细胞,培养后挑单菌落并接种于液体培养基中进行摇菌培养,进行菌液PCR鉴定后,挑选3个阳性克隆送南京金斯瑞生物科技有限公司进行测序。
1.3.2生物信息学分析通过DNAMAN软件将测序结果与GenBank上发表的各个物种的相应序列进行比对;用MEGA软件将ACAA2基因氨基酸序列与鸡、人、鼠等物种进行同源性比对,构建系统发生树;在ExPASy服务器上使用ProtParam和ProtScale程序进行蛋白质亲疏水性、理化性质分析;用HNN (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_hnn.html)分析朗德鹅ACAA2氨基酸序列的二级结构;利用NetPhos2.0预测ACAA2氨基酸序列存在的磷酸化位点;使用SWISS-MODEL在线预测其蛋白3D结构;利用PSOTⅡProtein Sorting Prediction在线软件对ACAA2蛋白进行亚细胞定位预测。
1.3.3荧光定量PCR分析用Trizol法提取肝样品总RNA,按照HiScriptTMQ RT SuperMix for qPCR(+gDNA wiper)反转录试剂盒说明书进行反转录,得到的cDNA置于-20℃保存。根据扩增的朗德鹅ACAA2基因的CDS序列设计引物,以磷酸甘油醛脱氢酶基因(GAPDH)为内参,采用SYBR-Green法对ACAA2基因在朗德鹅填饲不同阶段肝中的表达量进行定量分析。定量引物信息如表1所示。反应体系为20 μL:SYBR Green Master Mix为10 μL,上下游引物(10 μmol·L-1)分别为0.4 μL,模板cDNA为2 μL,Rox Reforence Dye 2为0.4 μL,余下的用水补齐。PCR反应条件:95℃预变性5 min;95℃变性10 s,60℃退火/延伸34 s,共40个循环。所有样本进行3个重复测定,qRT-PCR 结果采用2-ΔΔCt方法计算。
表1实时荧光定量引物
Table 1The primers for qRT-PCR

基因Gene引物序列(5'-3')Primersequence退火温度/℃Annealingtemperature产物长度/bpProductsizeACAA2F:ACACCTTGTGGGAAGGTCTGR:CGTTAAAATGGCCAGCATCT60165GAPDHF:GCCATCAATGATCCCTTCATR:CTGGGGTCACGCTCCTG60155
1.3.4鹅原代肝细胞的分离与培养孵化第22~23天正常发育的朗德鹅胚蛋用于鹅原代细胞分离。鹅原代肝细胞的分离主要采用“胶原酶消化法”[13],而分离后鹅肝细胞的培养参照小鼠、大鼠原代肝细胞的培养方法进行[14-15]。细胞培养所需的完全培养基配制体系:90%高糖DMEM、10%FBS、1%青/链霉素混合液、0.02 ml·L-1EGF。用12孔板按7×105个·孔-1进行细胞铺板培养,培养26 h后进行处理。
1.3.5鹅原代肝细胞的葡萄糖、脂肪酸或胰岛素处理葡萄糖对肝细胞的处理:试验组分别用100、200 mmol·L-1葡萄糖的完全培养基进行细胞培养,对照组用正常完全培养基;胰岛素对肝细胞的处理:试验组分别用100和200 nmol·L-1胰岛素的完全培养基培养细胞,对照组用正常的完全培养基;油酸对肝细胞的处理:试验组分别用0.25和0.5 mmol·L-1油酸且含2%BSA的完全培养基培养细胞,对照组用含2%BSA的完全培养基;棕榈酸对肝细胞的处理:试验组分别用0.25和0.5 mmol·L-1棕榈酸且含2% BSA的完全培养基培养细胞,对照组用含2% BSA的完全培养基。各试验组和对照组处理细胞时间为14 h。
2结果
2.1朗德鹅ACAA2基因的克隆
扩增产物经1.2%琼脂糖凝胶电泳检测,在1 000bp上方可见一条清晰的特异性条带(图1)。测序结果表明,鹅ACAA2基因的完整CDS区包含1 194bp,编码397个氨基酸 (图2)。

M.DNA相对分子质量标准M.DNA marker图1 鹅ACAA2基因编码区序列的PCR产物凝胶电泳图Fig.1 The electrophoresis of PCR products of goose ACAA2 CDS
2.2ACAA2基因序列的分析
对ACAA2序列进行同源性分析(表2),所获得的鹅ACAA2的CDS与鸡(Gallus,NM_001006571.2)、斑胸草雀(Taeniopygiaguttata,XM_002194733.3)、小鼠(Musmusculus,NM_177470.3)、猪(Susscrofa,NM_001167638.1)、牛(Bostaurus,NM_001035342.2)、绵羊(Ovisaries,XM_012120952.1)、人(Homosapiens,NM_006111.2)和斑马鱼(Daniorerio,NM_213052.1)的同源性分别为88.11%、85.71%、73.37%、72.28%、71.44%、71.36%、71.02%和70.27%。利用MEGA软件使用Neighbour-joining法对ACAA2基因的氨基酸序列进行聚类分析(图3),结果显示,绵羊与牛聚为一类,人与猪聚为一类,这两类最后与小鼠汇于一支,这些哺乳动物最后均汇聚一支,而本次试验克隆出鹅ACAA2基因编码的氨基酸序列与原鸡聚为一类,之后与斑胸草雀聚为一类,这些鸟类最后汇聚为一支,进一步证实克隆出的序列为鹅的ACAA2基因。
用ExPASy网站上的ProtParam程序对其进行蛋白理化性质分析,预测其分子量为41 674.9,等电点为8.02,分子式为C1831H2981N519O554S17。ACAA2基因可编码397个氨基酸,其中40个强酸性氨基酸(E和D),42个强碱性氨基酸(K和R),154个疏水氨基酸(A、I、L、F、W和V),85个极性氨基酸(N、C、Q、S、T和Y),其中丙氨酸(Ala)含量最高,有54个,占13.6%。使用ProtScale程序进行亲水性分析,预测鹅ACAA2蛋白疏水性最高为2.244,最低为-3.133,且疏水性低分值区域(score<0)比高分值区(score>1.5)多,由此推测,鹅ACAA2蛋白是一种亲水性蛋白(图4);用 HNN(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_hnn.html)对其氨基酸序列进行二级结构分析,预测序列具有α螺旋(Alpha helix:43.83%)、延长片段(Extended strand:12.34%)和无规卷曲(Random coil:43.83%)3种二级结构(图5)。同时,预测鹅ACAA2存在 16 个磷酸化位点,分别在 Ser(5)、Thr(8)和Tyr(3),表明鹅ACAA2存在磷酸化调控。用SWISS-MODEL在线预测其蛋白3D结构(图6)。经PSOTⅡProtein Sorting Prediction软件对ACAA2蛋白进行亚细胞定位预测显示,该蛋白位于细胞质中的概率最高。
表2朗德鹅ACAA2基因与其他物种在核苷酸和氨基酸水平上的同源性
Table 2Homology of gooseACAA2 nucleotide and amino acid sequences to other species

物种Species核苷酸水平一致度/%Identityofnucleotidesequence氨基酸水平一致度/%IdentityofaminoacidsequenceGenBank登录号GenBankaccessionnumber鸡Gallusgallus88.1194.71NM_001006571.2斑胸草雀Taeniopygiaguttata85.7192.21XM_002194733.3小鼠Musmusculus73.3779.85NM_177470.3猪Susscrofa72.2880.60NM_001167638.1牛Bostaurus71.4479.60NM_001035342.2绵羊Ovisaries71.3678.84XM_012120952.1人Homosapiens71.0278.09NM_006111.2斑马鱼Daniorerio70.2779.60NM_213052.1

双划线为磷酸化位点;方框为起始密码子和终止密码子The double lines are phosphorylation sites;the boxes are the initiation codon and the termination codon图2 鹅ACAA2基因CDS核酸和氨基酸序列Fig.2 The coding sequence and the predicted amino acid sequence of goose ACAA2 gene
2.3ACAA2基因在填饲鹅肝中的表达规律
70日龄朗德鹅肝平均重量为124 g,用玉米强制填饲7、14和19 d后,其肝平均重量分别达183、416和827 g,表明填饲后鹅肝脂肪沉积逐步增加。使用荧光定量PCR技术,检测对照组和填饲组的ACAA2基因mRNA在不同填饲阶段(填饲第7天、第14天、第19天)的表达水平。如图7所示,各阶段填饲组肝中ACAA2基因的表达量显著高于对照组(P<0.05),但随着填饲时间的延长,其表达水平呈下降趋势,表明填饲可以诱导肝中ACAA2基因的表达。
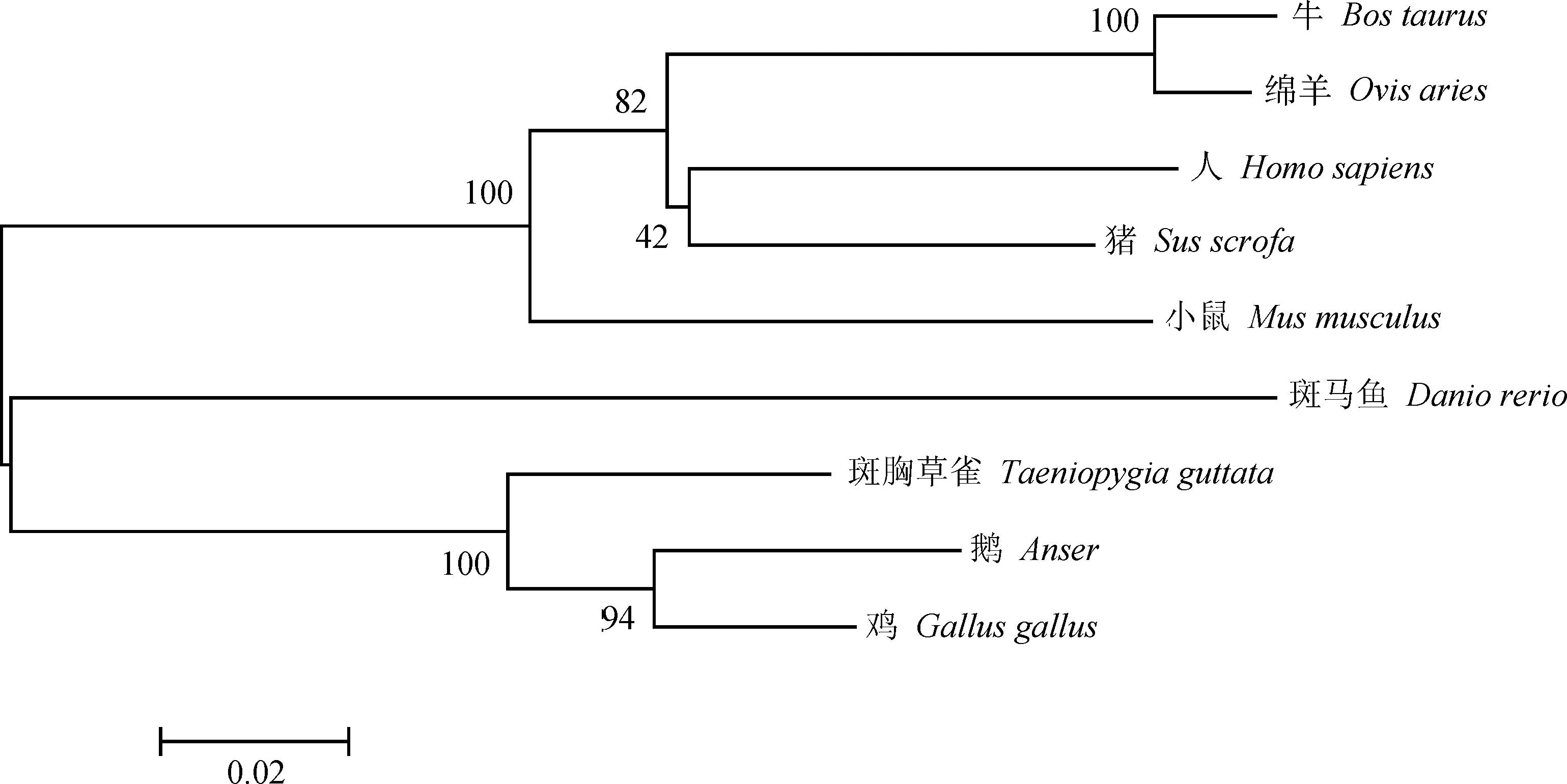
图3 基于氨基酸序列分析的ACAA2基因系统发生树Fig.3 The phylogenetic tree of ACAA2 gene drawn with its amino acid sequence

图4 ProtScale预测的鹅ACAA2蛋白疏水性分布图Fig.4 The putative hydrophobicity of ACAA2 protein predicted by ProtScale

图5 HNN对鹅ACAA2蛋白的二级结构预测示意图Fig.5 The secondary structure of goose ACAA2 protein predicted by HNN
图6 鹅ACAA2蛋白三级结构模型Fig.6 The putative tertiary structure of goose ACAA2 protein

*.P<0.05;GAPDH为内参基因;数据以“平均数±标准误”表示;n=5*.P<0.05;GAPDH was used as internal reference gene;all data are presented as “means ± SEM”;n=5图7 填饲不同阶段朗德鹅肝中ACAA2的mRNA水平Fig.7 The mRNA abundance of ACAA2 gene in the livers in Landes geese at different overfeeding stages
2.4葡萄糖、脂肪酸和胰岛素对鹅ACAA2基因表达的调控
为了检测ACAA2基因是否受脂肪代谢相关因子的调控,分别用不同浓度葡萄糖、脂肪酸(油酸和亚油酸)和胰岛素处理鹅原代肝细胞。结果显示,葡萄糖(100和200 mmol·L-1)对ACAA2基因的表达没有显著影响(图8),0.5 mmol·L-1的油酸能使ACAA2的表达量显著上调(P<0.05)(图9),0.25 mmol·L-1的棕榈酸能显著下调ACAA2基因的表达 (P<0.05)(图10),而胰岛素(100和200 nmol·L-1)都能使ACAA2的表达量降低,且差异显著(P<0.05),尤其是100 nmol·L-1胰岛素处理的肝细胞,ACAA2的下调幅度较大(图11)。
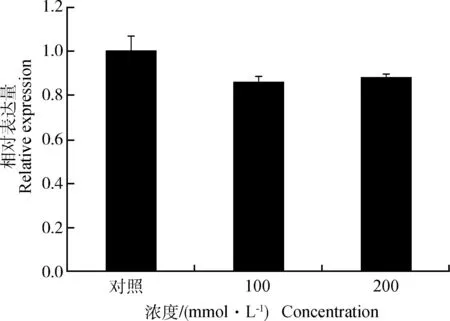
GAPDH为内参基因;数据以“平均数±标准误”表示;n=3。下同GAPDH was used as internal reference gene;all data are presented as” means ± SEM”;n=3.The same as below图8 葡萄糖对鹅原代肝细胞中ACAA2基因表达的影响Fig.8 The influence of glucose on the mRNA abundance of ACAA2 in goose primary hepatocytes

*.P<0.05 。下同P<0.05.The same as below图9 油酸对鹅原代肝细胞中ACAA2基因表达的影响Fig.9 The influence of oleate on the mRNA abundance of ACAA2 in goose primary hepatocytes

图10 棕榈酸对鹅原代肝细胞中ACAA2基因表达的影响Fig.10 The influence of palmitate on the mRNA abundance of ACAA2 in goose primary hepatocytes

图11 胰岛素对鹅原代肝细胞中ACAA2基因表达的影响Fig.11 The influence of insulin on the mRNA abundance of ACAA2 in goose primary hepatocytes
3讨论
乙酰辅酶A酰基转移酶2(ACAA2)在脂肪代谢中起着重要的作用。多种与脂肪代谢有关的药物通过影响ACAA2 mRNA的合成调节脂类代谢[16-17]。此外,M.Doi 等研究表明,LPL受体基因可以激活ACAA2 基因的表达,从而降低动物的肥胖症状[17]。然而,有关鹅ACAA2基因的研究至今未见报道。鉴于此,本研究利用ACAA2基因在物种间的保守性,设计了能特异扩增鹅ACAA2的引物,扩增所获得的产物经克隆测序,获得了鹅ACAA2基因全长编码序列,共1 194 bp,编码397个氨基酸。经氨基酸比对分析,证实了所获得的序列为鹅ACAA2的完整编码序列。
关于鹅肥肝形成机理人们已有了初步的认识,一般认为是肝中脂肪合成和脂蛋白运输脂肪及脂肪酸β-氧化平衡的破坏,使得肝中脂肪异常沉积,继而形成肥肝。通过对不同填饲阶段肝中ACAA2的表达情况研究,发现填饲可显著诱导ACAA2的表达,填饲初期其表达水平显著升高,但随着填饲时间的延长,其表达水平显著下降。已知ACAA2分布于线粒体,参与脂肪酸的β-氧化和胆固醇的生物合成过程,填饲后肝合成甘油三脂(Triglyceride,TG)的速度会急剧增加,也使得肝中脂肪酸β氧化代偿性增加,因而ACAA2基因的表达显著升高,当TG合成超过其输出时,便会沉积在肝。随着填饲时间的延长,TG在肝中聚集增多,游离脂肪酸也增加,大量的游离脂肪酸在线粒体内被氧化,产生过多的活性自由氧(ROS),从而导致线粒体损伤,位于线粒体上的ACAA2基因表达下降,这意味着肝脂肪酸的β氧化减少,进而导致脂肪在肝中沉积增多,促进肥肝的形成。
肝脂肪合成受多种因子调节,胰岛素是脂肪生成的主要调节因素,葡萄糖也是一个重要的调节因子,胰岛素可以促进肝细胞内葡萄糖合成糖原,加快糖原转变成脂肪,过量葡萄糖会在肝中转化为以甘油三脂为主的脂肪,而脂肪酸能影响脂肪合成基因的表达。有研究表明填饲可使鹅血浆中葡萄糖、胰岛素和脂肪酸的水平增加[18-19]。为了进一步了解ACAA2与脂肪肝形成的关系,本研究用高葡萄糖、脂肪酸和胰岛素处理鹅原代肝细胞,确定这些因子对该基因表达的影响。结果显示,脂肪酸和胰岛素均可显著影响ACAA2的表达,但葡萄糖对该基因表达的影响甚少。有趣的是,不饱和脂肪酸(即油酸)和饱和脂肪酸(即棕榈酸)对ACAA2的表达存在差别调控,这与以往报道的研究结果一致,即不饱和脂肪酸与饱和脂肪酸具有不同的生物学效应[20]。而添加油酸可使ACAA2基因的表达量上调说明在油酸诱导的脂肪变性模型中,脂肪酸线粒体氧化功能没有受损,进一步促进了脂肪在肝中沉积。这些细胞试验结果进一步说明ACAA2的表达调控与鹅脂肪肝的形成密切相关。
综上所述,本研究克隆并测定了鹅ACAA2基因全长CDS区,填饲可显著诱导该基因的表达,而且脂肪肝相关因子如高血脂和高胰岛素血症可调节其表达水平。这些结果表明,ACAA2基因在鹅肥肝形成中发挥重要作用,然而,其作用机制以及脂肪肝相关因子对该基因的表达调控机制还有待深入研究。
参考文献(References):
[1]卢素芳,何瑞国.鹅肥肝饲料技术的研究近况[J].饲料广角,2003(3):34-36.
LU S F,HE R G.The research status of goose fat liver feed technology[J].FeedAngle,2003(3):34-36.(in Chinese)
[2]周敏,潘健存,王士长.鹅肥肝的营养作用及其生产技术[J].广西农学报,2004(5):40-43.
ZHOU M,PAN J C,WANG S C.The utrition function and production technology of geese fatty liver[J].ChineseJournalofGuangxiAgriculture,2004(5):40-43.(in Chinese)
[3]MOUROT J,GUY G,LAGARRIGUE S,et al.Role of hepatic lipogenesis in the susceptibility to fatty liver in the goose (Anser anser)[J].ComBiochemPhysiolB:BiochemMolBiol,2000,126(1):81-87.
[4]ZHU L H,MENG H,DUAN X J,et al.Gene expression profile in the liver tissue of goose after overfeeding[J].PoultSci,2011,90(1):107-117.
[5]邵丹,王来娣,张蕊,等.鹅肥肝形成相关基因的研究进展[J].中国畜牧兽医,2012,39(9):42-46.
SHAO D,WANG L D,ZHANG R,et al.The research progress of related genes in goose fatty liver formation[J]ChinaAnimalHusbandry&VeterinaryMedicine,2012,39(9):42-46.(in Chinese)
[6]WANDERS R J,VREKEN P,FERDINANDUSSE S,et al.Peroxisomal fatty acid alpha-and beta-oxidation in humans:enzymology,peroxisomal metabolite transporters and peroxisomal diseases[J].BiochemSocTrans,2001,29 (Pt 2):250-267.
[7]EASTON S,BARTLETT K,POURFARZAM M.Mammalian mitochondrial β-oxidation[J].Biochem,1996,320:345-357.
[8]李文娟.鸡肉品质相关脂肪代谢功能基因的筛选及营养调控研究[D].北京:中国农业科学院,2008.
LI W J.The genes select of lipid metabolism about chicken quality and its ntrition research[D].Beijing:Chinese Academy of Agricultural Sciences,2008.(in Chinese)
[9]DE BOER V C,VAN SCHOTHORST E M,DIHAL A A.Chronic quercetin exposure affects fatty acid catabolism in rat lung.[J].CellMolLifeSci,2006,63(23):2847-2858.
[10]SIDRAH A,ATTYA B,ASMA G.In-silico approaches to sequence and structure based scrutiny of nonsynonymous SNPs and synteny of ACAA2 for its implicated role in metabolomics[J]ProceedingsIWBBIO,2014:7-9.
[11]何桦,潘志雄,刘贺贺,等.鹅DHRS7基因克隆、序列分析及其在鹅肥肝形成过程中的表达特点[J].畜牧兽医学报,2012,43(9):1385-1391.
HE H,PAN Z X,LIU H H,et al.Cloning of gooseDHRS7 gene,sequence analysis and its expression characteristic in the development of fatty liver[J].ActaVeterinariaetZootechincaSinica,2012,43(9):1385-1391.(in Chinese)
[12]潘志雄,王继文,唐慧,等.鹅Perilipin基因部分片段的克隆、不同品种及填饲对组织mRNA表达水平的影响[J].畜牧兽医学报,2010,41(8):939-943.
DAN Z X,WANG J W,TANG H,et al.Cloning of goosePerilipingene,tissues expression and the effect of overfeeding on its mRNA level of mRNA in tissues[J].ActaVeterinariaetZootechincaSinica,2010,41(8):939-943.(in Chinese)
[13]潘志雄.油酸诱导鹅肝细胞脂肪变性对细胞内脂质代谢平衡相关基因表达的影响[D].雅安:四川农业大学,2009.
PAN Z X.Effects of oleic oil on expression of gene related to lipid metabolic homeostasis in goose primary hepatocytes[D].Ya’an:Sichuan Agricultural University,2009.(in Chinese)
[14]张兴元,宋向芹,张芳,等.介绍一种简易高效的大鼠原代肝细胞分离方法[J].滨州医学院学报,2011,34(1):29-32.
ZHANG X Y,SONG X Q,ZHANG F,et al.The introduce of a simple and effective separation method for rat primary hepatocytes[J].ChineseJournalofBinzhouMedicalUniversity,2011,34(1):29-32.(in Chinese)
[15]WAN C L,KATE L,DAVID T.Isolation and culture of adult mouse hepatocytes[J].MethodsMolBiol,2010,633:185-196.
[16]HU T,FOXWORTHY P,SIESKY A,et al.Hepatic peroxisomal fatty acid beta-oxidation is regulated by liver X receptor alpha[J].Endocrinology,2005,146(12):5380-5387.
[17]DOI M,KONDO Y,TSUTSUMI K.Lipoprotein lipase activator NO-1886 (ibrolipim) accelerates the mRNA expression of fatty acid oxidation-related enzymes in rat liver[J].Metabolism,2003,52(12):1547-1550.
[18]HAN C C,WANG J W,XU H Y,et al.Effect of overfeeding on plasma parametes and mRNA expression of genes associated with hepatic lipogenesis in geese[J].Asian-AustraliaJAnimSci,2008,21(4):590.[19]王宝维,舒常平,葛文华,等.填饲期肥肝鹅脂肪沉积、血脂成分和脂类代谢酶的变化规律[J].中国农业科学,2014,47(8):1600-1610.
WANG B W,SHU C P,GE W H,et al.The change rule of fat deposition,lipid composition and lipid metabolism enzymes in goose fatty liver[J].ScientiaAgriculturaSinica,2014,47(8):1600-1610.(in Chinese)
[20]GENG T,HU W,BROADWATER M H,et al.Fatty acids differentially regulate insulin resistance through endoplasm reticulum stress-mediated induction of tribbles homologue 3:a potential link between dietary fat composition and the pathophysiological outcomes of obesity[J].Diabetologia,2013,56(9):2078-2087.
(编辑郭云雁)
Cloning of Goose Acetyl-Coenzyme A Acyltransferase 2 and Its Expression Pattern in the Development of Fatty Liver
WANG Qian-qian,YANG Biao,XIA Li-li,SUN Xiao-xian,GENG Tuo-yu,GONG Dao-qing*
(CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China)
Abstract:To explore the relationship betweenACAA2 gene and liver fatty metabolism in goose,35 Landes geese were divided into overfeeding group(15) and control group(20),the overfeeding group included 3 periods:overfeeding 7,14 and 19 days.The full coding sequence (CDS) ofACAA2 was cloned by RT-PCR and analyzed,its expression levels at different stages of overfeeding were determined in both normal and fatty liver by qRT-PCR in Landes geese.In addition,goose primary hepatocytes were treated with glucose,fatty acids or insulin to determine how its expression was regulated during fatty liver formation.Data indicated that the complete CDS of gooseACAA2 was 1 194 bp and encoded 397 amino acids.TheACAA2 expression level in the livers of the overfed geese was significantly higher (P<0.05) than the control at every stage,and presented a declining trend with the extension of overfeeding time.Moreover,compared to the control,the expression ofACAA2 gene was significantly increased in the goose primary hepatocytes treated with 0.5 mmol·L-1oleate,but was decreased in the primary hepatocytes treated with 0.25 mmol·L-1palmitate and insulin with different concentrations (P<0.05).The results suggeste thatACAA2 expression is closely related to the development of goose fatty liver,which will provide a basis for further study the role ofACAA2 gene in the formation of goose fatty liver.
Key words:goose;Acetyl-coenzyme A acyltransferase 2;fatty liver;gene cloning
doi:10.11843/j.issn.0366-6964.2016.04.009
收稿日期:2015-08-24
基金项目:国家自然科学基金项目(31372298;31472086);江苏省农业自主创新项目(CX(12)2033)
作者简介:王倩倩(1988-),女,山东栖霞人,硕士生,主要从事家禽分子营养研究,E-mail:xiaoxiaoqian_qian@126.com *通信作者:龚道清,博士,教授,博士生导师, E-mail:yzgong@163.com
中图分类号:S835;S813.3
文献标志码:A
文章编号:0366-6964(2016)04-0700-09
