细粒棘球绦虫铜锌超氧化物歧化酶基因的表达与特征分析
2016-07-11宋星桔胡丹丹钟秀琴阳爱国毛光琼古小彬杨光友
宋星桔,胡丹丹,钟秀琴,阳爱国,郭 莉,毛光琼,王 凝,闫 敏,汪 涛,古小彬,杨光友*
(1.四川农业大学动物医学院,成都 611130;2.四川省动物疫病预防控制中心,成都 610041)
细粒棘球绦虫铜锌超氧化物歧化酶基因的表达与特征分析
宋星桔1,胡丹丹1,钟秀琴1,阳爱国2,郭莉2,毛光琼2,王凝1,闫敏1,汪涛1,古小彬1,杨光友1*
(1.四川农业大学动物医学院,成都 611130;2.四川省动物疫病预防控制中心,成都 610041)
摘要:旨在探讨Eg-SOD基因的特征及其在细粒棘球绦虫上的抗氧化作用。通过原核表达得到重组Eg-SOD,对其进行酶活性测定、免疫印迹、ELISA以及免疫荧光定位分析。经原核表达出的重组Eg-SOD蛋白为可溶性蛋白,以羟胺法测定其酶学活性,可达(464.55±19.99)U·mg-1。免疫印迹结果显示,该蛋白质能够被实验室人工感染细粒棘球蚴的小鼠阳性血清所识别,具有较强的反应原性;ELISA分析显示,重组Eg-SOD对人工感染细粒棘球蚴的小鼠血清和自然感染包虫病的绵羊血清检出率均为100%,而对细颈囊尾蚴的交叉反应为37.5%,提示该蛋白质可以作为潜在的诊断候选分子。免疫荧光定位显示该蛋白质广泛分布于成虫和原头蚴的组织间隙,以及少量分布于表皮。本研究对Eg-SOD的特点进行了初步的探讨,并揭示该蛋白质与虫体的抗氧化损伤有着密切的联系。
关键词:细粒棘球绦虫;铜锌超氧化物歧化酶;荧光定位
细粒棘球绦虫(Echinococcusgranulosus)的中绦期幼虫(细粒棘球蚴)寄生于人和动物的肝和肺等器官内,引起人和动物的细粒棘球蚴病(又称为囊型包虫病)。在中国,有25个省、市、自治区有包虫病病例的报道,其中以西部牧区发病最为严重[1-2]。该病给我国畜牧业造成了严重的经济损失,同时也为人类带来了诸多公共卫生安全问题。

目前已有多种寄生虫的Cu/Zn SOD已被深入研究。研究者以曼氏血吸虫(Schistosomamansoni)Cu/Zn SOD DNA疫苗免疫小鼠,发现该疫苗对曼氏血吸虫感染有显著的抵抗作用[11]。此外,在大片吸虫(Fasciolagigantica)、猪带绦虫(Taeniasolium)和盘尾丝虫(Onchocercavolvulus)等虫种的研究表明,Cu/Zn SOD具有较强的免疫原性[12-15]。在Cu/Zn SOD酶活性的研究上,发现多种抗寄生虫药物,如苯并咪唑类药物,能够对其产生特异性的抑制作用,而不伤害宿主Cu/Zn SOD的活性[16-17]。然而,在细粒棘球绦虫上,对Cu/Zn SOD的研究还非常有限[18]。因此,本研究拟对细粒棘球绦虫Cu/Zn SOD(Eg-SOD)的抗氧化作用,免疫原性以及它在各时期虫体中的分布情况进行研究,期望通过了解Eg-SOD的这些基本特征,为该蛋白质的进一步深入研究奠定基础,并为包虫病的防控提供基础参考资料。
1材料与方法
1.1虫体
细粒棘球蚴包囊采自青海省西宁市屠宰场的绵羊肝或肺,在实验室无菌条件下进行手术分离。用一次性注射器对囊液进行反复抽送后吸出囊液,并分离生发层。囊液经3 000 r ·min-1离心5 min,取沉淀用灭菌生理盐水洗涤3次即得细粒棘球蚴原头蚴。
为了获取细粒棘球绦虫成虫,对两只来自非棘球蚴病疫区的犬(约5月龄,雌性)提前1周投喂吡喹酮(praziquantel)和阿苯达唑(albendazole)。在四川农业大学生物安全二级实验室条件下,分别将约20 000个原头蚴饲喂犬,35 d后剖杀犬只,取其小肠部分,置于37 ℃温热的生理盐水中,并用木片轻轻刮取其黏膜表面,自然沉降得到残渣,用放大镜从中挑取成虫。
1.2血清
对12只6~8周龄雌性ICR小鼠进行腹腔接种,每只接种200 μL含有约2 000个原头蚴的PBS混悬液(含100 U·mL-1青霉素和 100 μg·mL-1链霉素)。9个月后,对小鼠进行断尾采血,并剖杀小鼠,在其腹腔中发现了棘球蚴包囊的小鼠血清视为阳性血清;阴性血清为未接种原头蚴的小鼠血清。14份自然感染细粒棘球蚴的绵羊血清以及健康绵羊血清采自新疆某屠宰场;8份感染细颈囊尾蚴的绵羊血清来自四川某屠宰场。
1.3生物信息学分析
从细粒棘球绦虫基因组数据库中下载得到细粒棘球绦虫Eg-SOD基因全序列,以DNAStar软件推测其对应的氨基酸序列。以在线软件SignalP(http://www.cbs.dtu.dk/services/SignalP/)、Transmembrane Prediction server(http://www.sbc.su.se/~miklos/DAS/)和TargetP(http://www.cbs.dtu.dk/services/TargetP/)分别对其信号肽、跨膜区以及亚细胞定位进行分析。以推导出的氨基酸序列找出同源基因,并以Clustal W2在线软件(http://www.ebi.ac.uk/Tools/msa/clustalw2/)对氨基酸序列进行比对分析。以DNAMAN比较同源基因之间的相似性。最后用MEGA 5.05软件以邻接法构进行系统进化分析,并构建进化树。
1.4Eg-SOD的表达、纯化与酶活性测定
取约2 000个原头蚴,以动物组织总RNA提取试剂盒(Tiangen,China)提取总RNA,并以反转录试剂盒(Invitrogen,Carlsbad,CA,USA)将其反转录为cDNA。设计一对特异性的PCR引物(上游:5′-CGGGGTACCATGAAGGCTGTCTGTGTTA-TGC-3′,下划线为KpnⅠ酶切位点;下游:5′-CCG-CTCGAGGCTTTTAGCGATTCCGATGA-3′,下划线为XhoⅠ酶切位点),从cDNA中扩增出Eg-SOD基因全长CDs区域。经TA克隆后,将扩增产物以酶切链接的方式导入pET32a载体中;经测序验证连接正确后,将质粒转入大肠杆菌BL21中,以IPTG诱导重组蛋白质的表达。超声裂解重组菌后,取裂解产物上清,以Ni2+亲和层析的方法进行纯化。按超氧化物歧化酶分型测试试剂盒(羟胺法)(南京建成生物工程研究所)的操作步骤对重组Eg-SOD蛋白的酶活性进行测定。
1.5重组蛋白质多克隆抗体的制备
以重组蛋白质对2只约15周龄的雄性新西兰大白兔进行3次皮下免疫,每次免疫间隔2周。首次免疫为50 μg·mL-1重组蛋白质与等体积弗氏完全佐剂混合,加强免疫为50 μg·mL-1重组蛋白质与等体积弗氏不完全佐剂混合。免疫结束后第2周,对大白兔进行采血,并分离血清。将分离后的血清在Protein A亲和层析柱(Bio-Rad,USA)中进行纯化,得到血清中的多克隆抗体。对照组大白兔即把重组蛋白质替换为等体积的PBS,抗体制备过程与试验组相同。
1.6免疫印迹
将重组蛋白质和原头蚴裂解液分别进行SDS-PAGE凝胶电泳,再将凝胶分别转移到硝酸纤维素膜上。经5%脱脂牛奶封闭后,分别以绵羊和小鼠棘球蚴阳性、阴性血清(均为1∶200稀释)对重组蛋白质进行孵育;以重组蛋白质高免血清和对照血清(均为1∶1 000稀释)对原头蚴裂解液进行孵育。经洗涤后,以HRP标记的山羊抗小鼠或兔抗绵羊二抗对重组蛋白质进行孵育;再以HRP标记的山羊抗兔二抗对原头蚴裂解产物进行孵育。最后在显色底物作用下进行显色观察。
1.7ELISA
向96孔板中加入100 μL含有2 μg·mL-1重组蛋白质的包被液(0.1 mol·L-1碳酸钠溶液pH 9.6),4 ℃包被过夜。经5%脱脂牛奶包被后,向孔中分别加入12份小鼠棘球蚴阳性血清和阴性血清(1∶200稀释)进行孵育;然后加入HRP标记的山羊抗小鼠二抗进行孵育;洗涤后以可溶性TMB显色底物进行显色,并以2 mol·L-1H2SO4终止显色。在酶标仪紫外波长450 nm处测定吸光度值。以相同的抗原和血清反应浓度分别对14份细粒棘球蚴绵羊阳性和阴性血清以及8份细颈囊尾蚴绵羊血清进行孵育,再以HRP标记的兔抗绵羊二抗孵育,并进行显色,测定OD值。
1.8免疫荧光定位
取新鲜虫体样品(包括原头蚴、生发层和成虫)于4%多聚甲醛溶液中固定36 h;样本经一系列的脱水、透明处理后包埋入石蜡内,并以切片机切片备用。经脱蜡和水化处理后,将切片用3% H2O2处理10 min,然后置于约95 ℃的0.01 mol·L-1枸橼酸缓冲液中5~10 min,进行热修复抗原;经洗涤后,分别以多克隆抗体和健康兔IgG对切片进行4 ℃孵育过夜;随后,反复洗涤切片,以FITC标记的山羊抗兔荧光二抗(Bethyl Laboratories)对虫体进行显色,并在荧光显微镜下进行观察。
2结果
2.1Eg-SOD基因的生物信息学分析
细粒棘球绦虫基因组中Cu/ZnSOD基因全长2 356 bp,含两个较长的内含子和三个外显子,与其他带科绦虫或蠕虫的基因结构相似。该基因CDs序列含459个碱基,编码152个氨基酸,与其他物种SOD氨基酸序列之间的保守性较高,与带科绦虫之间的相似性达到92.76%~98.68%,与其寄生宿主(哺乳动物)之间的相似性为57.89%~59.21%(图1)。经氨基酸序列预测,SOD蛋白没有信号肽和跨膜区,其相对分子质量约为15.6 ku,等电点为5.95,分布于细胞周质之中。Eg-SOD二级结构具有典型的Cu/Zn SOD酶活性区域,八个折叠区以及两个二硫键形成位点可供形成二聚体。基于动物界Cu/ZnSOD基因氨基酸序列的进化分析显示,所有序列主要归为四大分支,即蠕虫分支、昆虫分支、线虫分支以及脊椎动物分支,Eg-SOD归为蠕虫分支(图2)。
2.2重组Eg-SOD的表达及其识别
经凝胶电泳显示,由特异性引物PCR扩增的产物为一条459 bp左右的条带,与基因组数据中的Eg-SOD基因大小一致。经测序得到的序列与基因组中的序列相似性达到100%,即表明该片段为Eg-SOD基因CDs全序列。
经亲和层析后的重组蛋白质在SDS-PAGE下显示为单一条带,大小约为35 ku,符合预期大小(加上pET32a载体上的Trx标签约20 ku)。通过与小鼠和绵羊棘球蚴阳性血清进行免疫印迹反应,发现重组Eg-SOD能够被阳性血清特异性的识别(图3),说明Eg-SOD具有较好的反应原性。以羟胺法针对Cu/Zn SOD酶活性进行测试,显示rEg-SOD具有较强的酶活性,经NaN3处理后活性依然不减,达到(464.55±19.99)U·mg-1(表1),说明rEg-SOD不是Mn SOD而是Cu/Zn SOD。
2.3ELISA
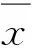
表1重组Eg-SOD酶活性的测定
Table 1Enzyme activity analysis of recombinant Eg-SOD
酶活力计算公式为:酶活力(U·mg-1)=(对照组OD值-试验组OD值)÷对照组OD值÷50%×反应稀释倍数÷蛋白质浓度Computational formula:Enzyme activity (U·mg-1) =[OD value (Con)-OD value (Exp)]÷OD value (Con)÷50%×Dilution ratio÷Protein concentration
2.4Eg-SOD在细粒棘球绦虫各生活史阶段的定位
免疫荧光定位所用多克隆血清经Western blot验证,能够特异性的识别虫体中的Eg-SOD蛋白(图3),故可以用作下一步试验。经荧光免疫定位试验显示,Eg-SOD大量且广泛地存在于虫体的各个生活时期,在原头蚴皮层下部、整个生发层和虫卵卵壳外层有大量表达;在原头蚴皮层外部、成虫皮层外部有少量表达(图5)。
3讨论
铜锌超氧化物歧化酶作为超氧自由基清除剂,广泛地分布于各种生物器官之中,清除细胞内的氧自由基,避免其形成对机体有毒害作用的氧自由基(如过氧化氢,次氯酸盐以及过氧亚硝酸盐等),从而保护机体细胞[19]。正常情况下,在机体有氧代谢过程中即会产生少量的ROS,它们会被自身的SOD酶及时地还原。在微生物感染过程中,宿主往往通过中性粒细胞、嗜酸性粒细胞或者嗜碱性粒细胞等通过NADPH氧化酶等产生氧自由基来对病原微生物进行杀伤[20]。在寄生虫的寄生过程中,它们能够成功地逃避宿主免疫系统的杀伤,有一部分原因就是因为它们自身具有发达的抗氧化酶系统(如:SOD、谷胱甘肽转移酶、谷胱甘肽还原酶、硫氧还原蛋白等)[9]。在此体系中SOD具有重要的作用,它能将超氧自由基歧化为水和过氧化氢,后者在过氧化氢酶等的作用下进一步分解为对机体无害的水,从而化解氧化压力。
在本研究中,作者对细粒棘球绦虫的Cu/ZnSOD基因结构和蛋白质活性进行了分析。Eg-SOD基因与其他绦虫的基因在结构和序列上相似度较高,Cu2+和Zn2+离子结合位点、二硫键结合位点、以及超氧自由基结合位点与其它动物Cu/Zn SOD完全保守,提示Eg-SOD基因是一个非常保守的基因。对其他寄生虫Cu/Zn SOD的研究表明,阿苯达唑和噻苯达唑等苯并咪唑类抗寄生虫药物能够特异性地抑制寄生虫SOD酶活性,而不损害宿主SOD酶活性[16]。系统进化树分析显示,绦虫Cu/ZnSOD基因能够与其哺乳动物宿主基因明显地区分开来,说明了它们之间存在着较大的差异,这使得寄生虫Cu/Zn SOD作为药物靶点成为可能。
G.Salinas等[18]曾对细粒棘球绦虫各时期虫体及组分中SOD酶活性进行了分析,显示大部分的酶活性来自于Cu/Zn SOD,而Mn SOD只有少部分组织中才有,且活性较低,说明Cu/Zn SOD在细粒棘球绦虫抗氧化系统中的重要地位。本研究通过免疫组织化学的方法也发现Cu/Zn SOD酶在细粒棘球绦虫各时期虫体和组织中广泛分布,并且在原头蚴和虫卵中的含量也相对较高。G.Salinas等的研究也曾指出在原头蚴中的Cu/Zn SOD酶活性最高。结合本研究结果,推测当细粒棘球蚴在寄生于中间宿主体内时经受的氧化压力最强,当某些包囊中的原头蚴不能再承受这种压力以后,就可能会产生细胞凋亡等过程而被杀死,从而产生了不育包囊。
免疫印迹和ELISA结果显示rEg-SOD具有良好的反应原性,对小鼠阳性血清以及自然感染细粒棘球蚴的绵羊血清识别率均为100%,提示其可作为一个候选的诊断抗原。但是,由于阳性血清的种类和数量还比较欠缺,还需要来自更多患病动物或人类的阳性血清对其敏感性进行分析;同时还需要其他动物寄生虫病(如脑多头蚴病等)阳性血清对其特异性进行分析。本研究通过原核表达纯化出具有较高酶活性和反应原性的重组蛋白质,为后续将rEg-SOD作为人和动物包虫病诊断抗原的研究奠定了良好的基础。
参考文献(References):
[1]WANG Z,WANG X,LIU X.Echinococcosis in China,a review of the epidemiology ofEchinococcusspp[J].Ecohealth,2008,5(2):115-126.
[2]YANG Y R,SUN T,LI Z,et al. Community surveys and risk factor analysis of human alveolar and cystic echinococcosis in Ningxia Hui Autonomous Region,China[J].BullWorldHealthOrgan,2006,84(9):714-721.
[3]MORO P,SCHANTZ P M.Echinococcosis:a review[J].IntJInfectDis,2009,13(2):125-133.
[4]McMANUS D P,GRAY D J,ZHANG W, et al. Diagnosis,treatment,and management of echinococcosis[J].BMJ,2012,344:e3866.
[5]AMRI M,AISSA S A,BELGUENDOUZ H, et al.Invitroantihydatic action of IFN-γ is dependent on the nitric oxide pathway[J].JInterferonCytokineRes,2007,27(9):781-787.
[6]CARDONI R L,ANTUNEZ M I,MORALES C,et al. Release of reactive oxygen species by phagocytic cells in response to live parasites in mice infected withTrypanosomacruzi[J].AmJTropMedHyg,1997,56(3):329-334.
[7]STEERS N J,ROGAN M T,HEATH S.In-vitrosusceptibility of hydatid cysts ofEchinococcusgranulosusto nitric oxide and the effect of the laminated layer on nitric oxide production[J].ParasiteImmunol,2001,23(8):411-417.
[8]HAHN U K,BENDER R C,BAYNE C J.Killing ofSchistosomamansonisporocysts by hemocytes from resistantBiomphalariaglabrata:role of reactive oxygen species[J].JParasitol,2001,87(2):292-299.
[9]CHIUMIENTO L,BRUSCHI F.Enzymatic antioxidant systems in helminth parasites[J].ParasitolRes,2009,105(3):593-603.
[10]SALINAS G.An update on redox biology of parasites[J].AntioxidRedoxSignal,2013,19(7):661-664.
[11]CARVALHO-QUEIROZ C,COOK R,WANG C C,et al. Cross-reactivity ofSchistosomamansonicytosolic superoxide dismutase,a protective vaccine candidate,with host superoxide dismutase and identification of parasite-specific B epitopes[J].InfectImmun,2004,72(5):2635-2647.
[12]KIM T S,JUNG Y,NA B K, et al. Molecular cloning and expression of Cu/Zn-containing superoxide dismutase fromFasciolahepatica[J].InfectImmun,2000,68(7):3941-3948.
[13]VACA-PANIAGUA F,TORRES-RIVERA A,PARRA-UNDA R,et al.Taeniasolium:antioxidant metabolism enzymes as targets for cestocidal drugs and vaccines[J].CurrTopMedChem,2008,8(5):393-399.
[14]AJONINA-EKOTI I,NDJONKA D,TANYI M K,et al. Functional characterization and immune recognition of the extracellular superoxide dismutase from the human pathogenic parasiteOnchocercavolvulus(OvEC-SOD)[J].ActaTrop,2012,124(1):15-26.
[15]KHAWSAK P,KANJANAVAS P,KIATSOMCHAI P,et al. Expression and characterization of Cu/Zn superoxide dismutase fromWuchereriabancrofti[J].ParasitolRes,2012,110(2):629-636.
[17]SANCHEZ-MORENO M,ENTRALA E,JANSSEN D,et al. Inhibition of superoxide dismutase fromAscarissuumby benzimidazoles and synthesized pyrimidine and glycine derivatives[J].Pharmacology,1996,52(1):61-68.
[18]SALINAS G,CARDOZO S.Echinococcusgranulosus:Heterogeneity and differential expression of superoxide dismutases[J].ExpParasitol,2000,94(1):56-59.
[19]VAN RAAMSDONK J M,HEKIMI S.Superoxide dismutase is dispensable for normal animal lifespan[J].ProcNatlAcadSciUSA,2012,109(15):5785-5790.
[20]BEAMAN L,BEAMAN B L.The role of oxygen and its derivatives in microbial pathogenesis and host defense[J].AnnuRevMicrobiol,1984,38:27-48.
(编辑白永平)
Prokaryotic Expression and Characterization of Cu/Zn Superoxide Dismutase ofEchinococcusgranulosus
SONG Xing-ju1,HU Dan-dan1,ZHONG Xiu-qin1,YANG Ai-guo2,GUO Li2,MAO Guang-qiong2,WANG Ning1,YAN Min1,WANG Tao1,GU Xiao-bin1,YANG Guang-you1*
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.SichuanCentersforAnimalDiseaseControlandPreventive,Chengdu610041,China)
Key words:Echinococcusgranulosus;Cu/Zn superoxide dismutase;immunolocalization
Abstract:The aim of this study was to characterise the Cu/Zn superoxide dismutase ofEchinococcusgranulosus(Eg-SOD),and analyze its role in the parasite antioxidant system.The recombinant Eg-SOD was expressed inE.coli,and the enzymatic activity was measured,and analyses including western blotting,ELISA and immunofluorescence localization were also performed.The recombinant Eg-SOD was expressed as soluble protein,and its activity was up to (464.55 ±19.99) U·mg-1measured by hydroxylamine method.As showed by the result of western blot,the recombinant Eg-SOD could be recognized by the serum of mice secondary experimentally infected withE.granulosusprotoscolexes,and showed a high immunogenicity;ELISA tests showed that recombinant Eg-SOD could recognize all the sera from mice experimentally infected with protoscolexs and from sheep naturally infected withE.granulosus,and have 37.5% cross-reactions with sera from sheep infected withCysticercustenuicollis,which indicates Eg-SOD might be a potential diagnose antigen.The immunolocalization of Eg-SOD showed a wide extent of distribution,mostly in the tissue clearance of adult worms and protoscolexes,and fewer on the tegument.These results provide the fundamental understanding of Eg-SOD,and revealed its capable of antioxidation effect.
doi:10.11843/j.issn.0366-6964.2016.02.018
收稿日期:2015-06-03
基金项目:四川省科技支撑计划项目(2015NZ0041)
作者简介:宋星桔(1991-),女,四川资阳人,硕士,主要从事动物寄生虫病学研究,E-mail:18728153735@163.com *通信作者:杨光友,教授,博导,从事动物寄生虫病学研究,E-mail:guangyou1963@aliyun.com
中图分类号:S852.734
文献标志码:A
文章编号:0366-6964(2016)02-0346-08
