水稻土嗜中性微好氧亚铁氧化菌多样性及微生物成矿研究
2016-06-30陈娅婷李芳柏李晓敏
陈娅婷,李芳柏,李晓敏
1.中国科学院广州地球化学研究所,广东 广州 510640;2.广东省生态环境与土壤研究所,广东 广州 510650;3.中国科学院大学,北京 100049
水稻土嗜中性微好氧亚铁氧化菌多样性及微生物成矿研究
陈娅婷1,2,3,李芳柏2*,李晓敏2
1.中国科学院广州地球化学研究所,广东 广州 510640;2.广东省生态环境与土壤研究所,广东 广州 510650;3.中国科学院大学,北京 100049
摘要:微生物驱动亚铁氧化过程在水稻土中十分普遍,该过程被认为是水稻土中联接各生物地球化学过程的中心枢纽。嗜中性微好氧亚铁氧化菌能够利用氧气作为电子受体将亚铁氧化成三价铁,获得生长所需能量。然而,对水稻土中微好氧亚铁氧化菌的多样性与分布及其微生物成矿类型仍然未知。采用铁氧反向浓度梯度管法富集培养并分离水稻土中微好氧亚铁氧化菌,利用16S rRNA基因测序手段分析培养过程中微好氧亚铁氧化菌群落多样性与分布,并初步研究分离得到的亚铁氧化菌的亚铁氧化能力与生物成矿类型。结果表明,在富集培养和传代培养过程中,Azospira、Magnetospirillum、Clostridium和Rhodoplanes等属在群落中占优势。在分离最后阶段,得到几种细菌的混合菌团,可能是由于这几种亚铁氧化菌存在互养关系而难以纯化分离,其中占优势的为Azospira(63.9%)。Azospira是一类已知硝酸盐依赖型FeOB,可以利用硝酸盐、氯酸盐和高氯酸盐为电子受体进行厌氧亚铁氧化。混合菌团具有活跃的亚铁氧化能力,反应第15天生成6.9 mmol·L-1HCl-Fe。XRD结果表明菌团氧化亚铁形成的三价铁矿物类型为无定形铁氧化物。TEM结果显示微好氧FeOB菌体呈杆状,细菌表面和周围散布着颗粒状的物质,可能是由无定形铁氧化物组成。综上所述,认为反硝化细菌可能在水稻土有氧-无氧界面进行微好氧亚铁氧化,其氧化亚铁的产物为无定形铁氧化物。
关键词:微好氧亚铁氧化;生物成矿;水稻土;Azospira;无定形铁氧化物
*通讯联系人,E-mail:cefbli@soil.gd.cn
引用格式:陈娅婷,李芳柏,李晓敏.水稻土嗜中性微好氧亚铁氧化菌多样性及微生物成矿研究[J].生态环境学报,2016,25(4):547-554.
CHEN Yating,LI Fangbai,LI Xiaomin.Diversity and Biomineralization of Microaerophilic Iron-oxidizing Bacteria in Paddy Soil [J].Ecology and Environmental Sciences,2016,25(4):547-554.
铁(Fe)是一种分布广泛的过渡金属元素,是土壤中重要的氧化还原活性元素(Straub et al.,2004)。铁循环对土壤中其他元素和污染物如C、N和金属的迁移转化有显著的影响(马小兰等,2009;钟晓兰等,2009)。铁循环包括Fe(Ⅲ)还原与Fe(Ⅱ)氧化两个过程,需要微生物提供基本驱动力(张伟等,2013)。在中性环境下,亚铁氧化细菌(Fe(Ⅱ)-oxidizing bacteria,FeOB)与非生物铁氧化过程竞争,通过微好氧或厌氧呼吸催化Fe(Ⅱ)氧化生成Fe(Ⅲ),从而获得生长所需能量,促进铁元素氧化还原循环(Emerson et al.,2010)562。
微好氧FeOB是一类在低氧(0.1~1.5 mg·L-1)条件下(Druschel et al.,2008),以Fe(Ⅱ)作为能量来源,以CO2作为碳源生长的细菌,其反应方程式为:Fe2++0.25O2+H+→Fe3++0.5H2O。这类细菌广泛分布于淡水和海洋环境的氧化还原过渡带,包括:富铁地下水、沼泽、湿地植物根际、深海热泉和水井等(Emerson et al.,2010)569-574。目前已分离的微好氧FeOB包括:Gallionella ferruginea,Sideroxydans lithotrophicus,Ferritrophicum radicicola 和Mariprofundus ferrooxydans等(Emerson et al.,2010)564-569。尽管这些细菌的分布及系统发育地位多样,它们氧化Fe(Ⅱ)获得能量的生理过程是相同的。中性环境中,FeOB氧化可溶性Fe(Ⅱ)生成难溶于水的Fe(Ⅲ),并以各种铁(氢)氧化物形式沉淀。这些铁(氢)氧化物为异化铁还原作用(铁呼吸)及污染物氧化还原转化提供理想底物(Lovley,1991;Klausen et al.,1995)。
不同细菌驱动的Fe(Ⅱ)氧化会产生不同类型和晶体形态的Fe(Ⅲ)矿物,这可能是由于生物和非生物作用的结合影响Fe(Ⅲ)的沉淀过程。细菌铁氧化形成的Fe(Ⅲ)矿物包括:弱结晶状氧化铁(Croal et al.,2004)、水铁矿(ferrihydrite)(Kennedy et al.,2003)、针铁矿(goethite)(Miot et al.,2009a)、纤铁矿(lepidocrocite)(Kappler et al.,2004)、磁铁矿(magnetite)(Chaudhuri et al.,2001)、绿锈(green rust)(Pantke et al.,2012)和磷酸铁(iron phosphate)(Miot et al.,2009b)。据报道,生物成矿的多样性可能与不同的地球化学条件、不同的酶催化机制或者不同的细胞与Fe(Ⅲ)间的互相作用等有关。
水稻土是一类介于陆地和水生生态系统的中间系统(Ding et al.,2015),是最重要的研究铁氧化还原的模式系统之一。珠江三角洲地区土壤含铁量高达2%(Tao et al.,2012)。稻田淹水时,氧气通过水稻根系的通气组织及动物的洞穴进入厌氧土壤中(Wang,2011),从而形成了Fe(Ⅱ)和O2的逆浓度梯度,为微好氧FeOB的生长提供了潜在的栖息地(Emerson et al.,1999)。本研究采用凝胶梯度管法富集培养水稻土中微好氧FeOB,利用分子生物学技术分析了培养过程中FeOB群落组成的变化,并研究了微好氧FeOB的亚铁氧化速率、细菌形态、生物成矿类型等,从而探讨水稻土中微好氧FeOB的多样性及其Fe(Ⅱ)氧化过程。
1 材料与方法
1.1土壤样品采集及理化指标检测
实验所用的水稻土样品采自广东省广州市的华南植物园稻田(N23°10′42.14″,E113°21′8.14″)。用于富集培养的水稻土采集前已经淹水7~8周,土壤pH约为6.0,含总铁27.9 g·kg-1,游离态铁17.9 g·kg-1,无定形铁4.9 g·kg-1,络合态铁1.1 g·kg-1及有机质41.1 g·kg-1。共采集了约200 g淹水水稻土,部分水稻土转入4 ℃冰箱冷藏,用于富集培养FeOB。部分样品自然风干后过100目筛备测土壤理化指标。土壤理化指标测定的方法参照《土壤农业化学分析方法》(鲁如坤,2000)。部分样品利用放射性同位素钴(60Co)进行高能γ射线灭菌后,作为培养体系中的灭菌对照。
1.2梯度管法富集培养FeOB
微好氧FeOB培养采用Fe(Ⅱ)-O2逆浓度梯度管法。该方法是向Modified Mineral Wolfe's Medium (MWMM)中添加0.15%的琼脂,获得半固态梯度管,FeOB优先生长于管内氧化还原分界面(Emerson et al.,2005)。培养管底部包括1.25 mL FeS层作为铁源并提供还原能力。上层培养基包括6 mL MWMM及1 μL·mL-1维生素和矿物元素溶液。此外,培养基中加入终浓度为5 mmol·L-1的NaHCO3作为缓冲剂和碳源,并充入CO2调节pH最终达到6.0。培养管静置24 h后接种微生物。新鲜水稻土与超纯水按1∶1(wt/vol)混合后作为富集FeOB的接种液。接种后于黑暗条件下培养15 d,培养温度为30 ℃。
微好氧FeOB的分离通过连续传代培养和梯度稀释法(Emerson et al.,1997)4785。即将富集培养过程中形成的铁氧化细胞带连续传代培养3代后,重采样进行梯度稀释并接种于培养管中,梯度稀释范围为10-3~10-8,将在最高稀释度中生长的细胞重采样后继续进行梯度稀释并接种,重复多次后可在培养管中得到微好氧FeOB纯培养物,接着进行后续实验。
1.3微生物DNA提取、16S rRNA基因扩增与焦磷酸测序
微生物总群落DNA提取采用PowerSoil™DNA Isolation Kit试剂盒。采用细菌的通用引物515F(5′-GTGCCAGCMGCCGCGG-3′)和806R (5′-GGACTACVSGGGTATCTAAT-3′)对16S rRNA基因V4区进行扩增。正向引物加入样品特异的12-bp条形码序列(barcode)。PCR扩增体系及反应条件参照Chen et al.(2014)。所有样品PCR产物等摩尔混合并用QIAquick Gel Extraction Kit试剂盒进行纯化,合格后用于Illumina MiSeq系统完成测序。
1.4生物信息学及统计学分析
通过Illumina测序获得原始配对数据后,首先利用Sickle软件(版本1.33)(Joshi et al.,2011)去除质量评分低于25的序列并利用FLASH软件(版本1.2.11)进行序列拼接(Fouhy et al.,2015),以获得16S rRNA基因中整个V4高变区的序列。对序列进行降噪、降低测序错误和去除嵌合体处理后,高质量的V4序列依据上述特有的12 bp的barcode分配到各个样品中,再按照97%的相似性划分OTU(operational taxonomic unit,OTU)。每个OTU的代表序列用PyNAST算法(Desantis et al.,2006)对齐后用FastTree构建系统发育树(Price et al.,2009)。最后,将OTU代表序列与Greengene 16S rRNA基因数据库中的序列进行比对,按照0.5的置信度对OTU进行物种分类(Wang et al.,2007)。所有数据的统计分析均用PASW Statistics 18(SPSS Inc.)软件进行。
1.516S rRNA基因克隆文库
利用16S rRNA基因克隆文库分析分离最后阶段的细胞带的微生物组成。细菌16S rRNA片段的PCR扩增和纯化采用通用引物扩增细菌16S rRNA。正向引物为27F(5′-AGAGTTTGATCMTGGCTC AG-3′),反向引物为1492 R(5′-GGTTACCTTGTTA CGACTT-3′)。PCR的反应体系如下:总体积25 μL,包括:1 U Ex Taq DNA聚合酶(TAKARA),2.5 μL聚合酶缓冲溶液,2 μL dNTP混合物,正反向引物各0.4 μmol·L-1,模板50 ng。PCR反应条件如下:94 ℃ 4 min,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 90 s(30个循环),72 ℃最终延伸10 min。PCR产物用纯化试剂盒(OMEGA)纯化,具体方法流程按照说明书进行。
1.6亚铁动力学测定
以分离得到的微好氧FeOB为接种物进行培养,培养时间为15 d,取反应第0、3、6、9和15天样品,采用显色法测试样品中HCl-Fe(Stookey,1970)。具体如下:吸取培养管中全部铁氧化带(1~2 mL),8000 rpm离心5 min,去除部分上清液,将沉淀与剩余上清液混合定量至1 mL后,迅速加入0.5 mol·L-1HCl溶液,并置于摇床150 rpm浸提1.5 h,过滤后所得滤液采用邻菲罗啉-分光光度计法测定总铁浓度(HCl-Total Fe)。实验中设置了不接种对照(Non-inocula)、灭菌对照(Killed-inocula)和不含铁源只含琼脂对照(Agar only)。对照组样品则是在培养管中,在与实验组铁氧化带形成的同一高度位置,吸取1 mL样品,其余样品采集方法同上。每个样品设置3个重复。
1.7X-射线衍射(XRD)
收集微好氧FeOB培养第15天的铁氧化带样品,利用X-射线衍射分析铁氧化物组成成分。收集的铁氧化带离心(8000 rpm)5 min后去上清,用充入N2的超纯水清洗3次后冷冻干燥,直接用于XRD测试。XRD测角范围(2θ)为5°到80°,扫描步长0.02°,扫描速度0.1 s/步。使用JADE 5.0 (Materials Data Inc.)软件解析X-射线衍射谱图。
1.8透射电子显微镜
透射电子显微镜(Transmission electron microscopy,TEM)样品采用2.5%戊二醛溶液做前固定处理,以1%锇酸做后固定,用1%乙酸双氧铀做前染色处理,不同梯度乙醇溶液逐级脱水后嵌入树脂中。超微切片机切片后,用乙酸双氧铀和柠檬酸铅做后染色。所得样品置于透射电子显微镜下观察菌体形态并拍片(Kappler et al.,2005)。
2 结果与讨论
2.1微好氧FeOB培养与分离
接种3 d后,细菌表现出明显的生长趋势,在Fe(Ⅱ)-O2梯度管中,在管内空气-培养基交界面下方约1.0 cm处形成明显的红褐色铁氧化物细菌混合带(图1),而在不接种和灭菌对照中并没有出现铁氧化带。后续的显微观察及DNA提取证明了细菌生长在铁氧化带中。
随着传代次数增加,褐色铁氧化带的形成越来越慢。在富集培养初始,经过约36 h的培养,培养管中就会出现一条亮黄色铁氧化带,而经过3次传代后,需经过3~4 d才能在培养管中看到白色细胞带,观察到褐色铁氧化带的时间则需要约6 d。此外,随着传代次数增加,培养管中的细胞带也变得越来越窄。该结果与Wang et al.(2009)在湿地土壤微好氧FeOB的研究结果一致。导致这种现象的原因可能是群落中很多非优势的FeOB经过多次传代后逐渐减少,而菌团中优势FeOB物种与其他非优势FeOB为共生关系,需要依赖这些非优势的FeOB才能进行生长。

图1 梯度管中微好氧亚铁氧化菌生长反应(接种,右管)和非生物铁氧化反应(不接种,左管)Fig.1 Gradient tubes showing microaerophillic Fe (II)-oxidizing bacterial (Inocula,right) and abiotic iron oxidation (Non-inocula,left)
2.2FeOB群落组成及多样性
水稻土中微生物群落组成复杂,主要包括:Betaproteobacteria(57.3%)、Bacteroidetes(5.3%)、Alphaproteobacteria(5.0%)、Gammaproteobacteria (4.7%)、Acidobacteria(4.0%)、Firmicutes(3.7%)、Verrucomicrobia(3.2%)、Deltaproteobacteria(2.8%)、Actinobacteria(1.1%)(图2)。在富集培养和传代培养的微生物群落中,丰度较高的门包括:Betaproteobacteria(平均63.5%,27.4%~92.0%)、Bacteroidetes(平均14.9%,1.7%~36.3%)、Alphaproteobacteria(平均7.1%,1.8%~15.6%)、Firmicutes(平均6.2%,1.2%~15.8%)、Gammaproteobacteria(平均2.8%,0.9%~5.2%)、Deltaproteobacteria(平均2.4%,0.4%~4.5%)、Verrucomicrobia(平均2.0%,0.8%~5.4%),这些门共占群落的99%以上(图2)。这与之前报道的微好氧FeOB的研究一致(Emerson et al.,2010)565。

图2 不同培养世代梯度管细胞带中优势微生物门的分布Fig.2 Relative abundance (%,n=3) of the dominant microbial phyla of the cell band from gradient tubes at different culture generations

图3 Illumina焦磷酸测序不同培养世代梯度管细胞带中相对丰度排名前10的微生物属及16S rRNA克隆文库揭示FeOB混合物中优势属的分布(饼状插图)Fig.3 Relative abundance (%,n=3) of top 10 genera in the cell band of different culture enerations revealed by Illumina pyrosequencing.The relative abundance of dominant genera in the isolated mixture of FeOB revealed by 16S rRNA clone library are also shown in the inserted pie chart
在属水平(图3),水稻土中丰度最高的属是Gammaproteobacteria的Pseudomonas(1.9%),其他丰度较高的属包括:Magnetospirillum(1.9%)、Azospirillum(1.5%)、Clostridium(1.0%)、Azospira (0.8%)、Methyloversatilis(0.7%)、Rhodoplanes (0.6%)、Coprococcus(0.4%)等。在富集培养和传代培养的微生物群落中检测到的属较丰富,其中,Azospira相对丰度最高,在3次传代培养中平均相对丰度为31.2%(29.1%~38.6%)。Magnetospirillum在首次富集培养中丰度高达34.6%,据报道,该菌为微好氧趋磁细菌,能够吸收铁并转化成磁铁矿(Fe3O4)或硫复铁矿(Fe3S4)颗粒(Lefèvre et al.,2012)。其他丰度较高的属包括Clostridium(4.3%,0.2%~14.4%)、Rhodoplanes(1.2%,0.06%~4.5%)等。图3还揭示了传代培养过程中各优势属的变化趋势。富集培养细菌经过3次连续传代后,Clostridium、Azospira、Rhodoplanes和Azovibrio的相对丰度呈增加趋势,其中Clostridium的相对丰度从2.5%增加到14.3%,Azospira的相对丰度从1.6%增加到32.0%,表明这些细菌经过培养得到了富集,可能在亚铁氧化过程中扮演重要的角色;而Magnetospirillum、Azospirillum及Pseudomonas的相对丰度呈降低趋势,相对丰度分别从34.6%、0.85%和0.95%降低到0.09%、0.15%和0.67%,表明这些细菌在利用Fe(Ⅱ)生长的竞争中处于劣质,逐渐被淘汰。
2.3亚铁氧化动力学
如图4所示,混合菌团的铁氧化速率较高,浓度在第15天达到6.9 mmol·L-1,而灭菌对照、不接种对照和只含琼脂对照中的HCl-Fe浓度较低,分别为0.88、0.36和0.11 mmol·L-1。由此可见,培养过程中生物氧化比非生物氧化更占优势,表明分离得到的微好氧FeOB菌团具有活跃的亚铁氧化能力。这一结果比淡水、海洋及湿地中分离的微好氧FeOB菌株的亚铁氧化能力高,因为分离自地下水的微好氧FeOB菌株ES-1和ES-2,其氧化亚铁生成的HCl-Fe浓度仅为2.75和3.75 mmol·L-1(Emerson et al.,1997)4789。

图4 混合菌团生长过程中细胞带及实验对照中HCl-总铁的浓度Fig.4 The concentration of HCl-total Fe of the cell band during growth and controls
2.4XRD分析铁氧化物组成成分
为了表征微好氧Fe(Ⅱ)氧化过程中产生的Fe(Ⅲ)沉淀的组成成分,采用XRD分析培养第15天的铁氧化物。如图5所示,细菌氧化Fe(Ⅱ)形成Fe(Ⅲ)沉淀的XRD图谱中没有发现明显的信号,表明微好氧FeOB生物成矿的类型主要为弱结晶或无定形Fe(Ⅲ)氧化物。该结果与之前研究微好氧铁氧化过程生物成矿的结果一致。Emerson et al.(1997)描述了微好氧FeOB生物成矿类型为弱结晶Fe(Ⅲ)沉淀。Weiss et al.(2003)报道了从湿地植物根际分离出来的中性亚铁氧化菌生物成矿类型为无定形铁氧化物。由于Fe(Ⅱ)氧化产生Fe(Ⅲ),而Fe(Ⅲ)在中性环境中会形成无定形铁氧化物,因此,这一结果是合理的。弱结晶Fe(Ⅲ)氧化物以干燥形式可保存数年,而在溶液中,根据pH和溶液化学条件,可转化成针铁矿、赤铁矿和纤铁矿,该过程经历原子重组(从三角晶系转化为斜方晶系)、溶解和再沉淀,需要还原剂催化,如Fe(Ⅱ)和半胱氨酸等(Schwertmann et al.,2008)。本研究中,由于微好氧FeOB的培养体系为半固体培养基,呈胶体状的琼脂阻止了弱结晶Fe(Ⅲ)向结晶度更高的Fe(Ⅲ)矿物转化,因此,细菌亚铁氧化的产物为无定形铁氧化物。

图5 微生物铁氧化生成Fe(III)氧化物XRD图谱Fig.5 X-ray diffractograms of Fe(III) oxides produced by microbial iron oxidation
2.5透射电子显微镜
TEM结果显示梯度管中分离得到的微好氧FeOB菌体呈杆状(图6a),细菌宽约0.7~1.2 µm。球状颗粒(约几十纳米)紧紧包裹在细胞壁上(图6a),细菌周围也散布着一些颗粒状的物质(图6b)。结合XRD结果(图5),可以认为这些球状颗粒是由无定形铁氧化物组成的。
2.6水稻土中微好氧FeOB及其生物成矿机制与环境意义
本研究中,16S rRNA高通量测序结果显示,在富集培养和传代培养过程中,Azospira、Magnetospirillum、Clostridium和Rhodoplanes等属在群落中明显得到富集,表明这些细菌可能在水稻土微好氧亚铁氧化过程中扮演着重要的角色。其中,Magnetospirillum可以利用硝酸盐作为最终电子受体进行厌氧生长,也可以在微氧条件下以O2作为电子受体生长(Taoka et al.,2003)。有趣的是,虽然目前并没有报道证实Magnetospirillum具有铁氧化能力,但是有研究发现这类细菌能够在以FeS作为唯一电子受体的梯度管中进行无机自养生长(Geelhoed et al.,2009),表明Magnetospirillum可能具有亚铁氧化能力。根据此前的研究,通过连续传代和梯度稀释可以获得FeOB纯培养物(Emerson et al.,1997)4786。但在本研究中,分离最后阶段仍存在几种细菌的混合菌团,其中占优势的为Azospira sp.,相对丰度为63.9%(图3)。Azospira是一类已知的广泛存在于水体和底泥中的硝酸盐依赖型FeOB(Lack et al.,2002),可以利用硝酸盐、氯酸盐和高氯酸盐为电子受体进行厌氧亚铁氧化(Weber et al.,2006),该菌在湿地植物根际微好氧FeOB混合菌团中也有发现(Wang et al.,2009)。但是,目前没有直接证据证实该菌可以在微氧条件下氧化铁(Ⅱ)。本研究中,富集培养过程以微氧条件为主,且培养体系中不存在其他可替代的电子受体。因此,我们猜测硝酸盐依赖型FeOB在水稻土有氧-无氧界面的Fe循环中扮演着重要的角色。这可能是由于水稻土中长期施以氮肥,导致由反硝化细菌驱动的硝酸盐依赖型亚铁氧化过程活跃(Ratering et al.,2001),考虑到反硝化细菌普遍具有还原氧气和氧化亚铁的能力,以及水稻根际泌氧形成的微氧环境(Ikenaga et al.,2003),我们认为硝酸盐依赖型FeOB可转化为微好氧FeOB在有氧-无氧界面发生亚铁氧化(Benz et al.,1998)。此外,本研究中培养的微好氧FeOB与之前报道的FeOB在系统发育上相近。然而,利用16S rRNA基因测序技术并没有在FeOB菌团中发现传统的微好氧FeOB—Gallionella和Leptothrix占优势(图3),表明水稻土中优势FeOB与其他环境(如淡水和海洋)有所区别。
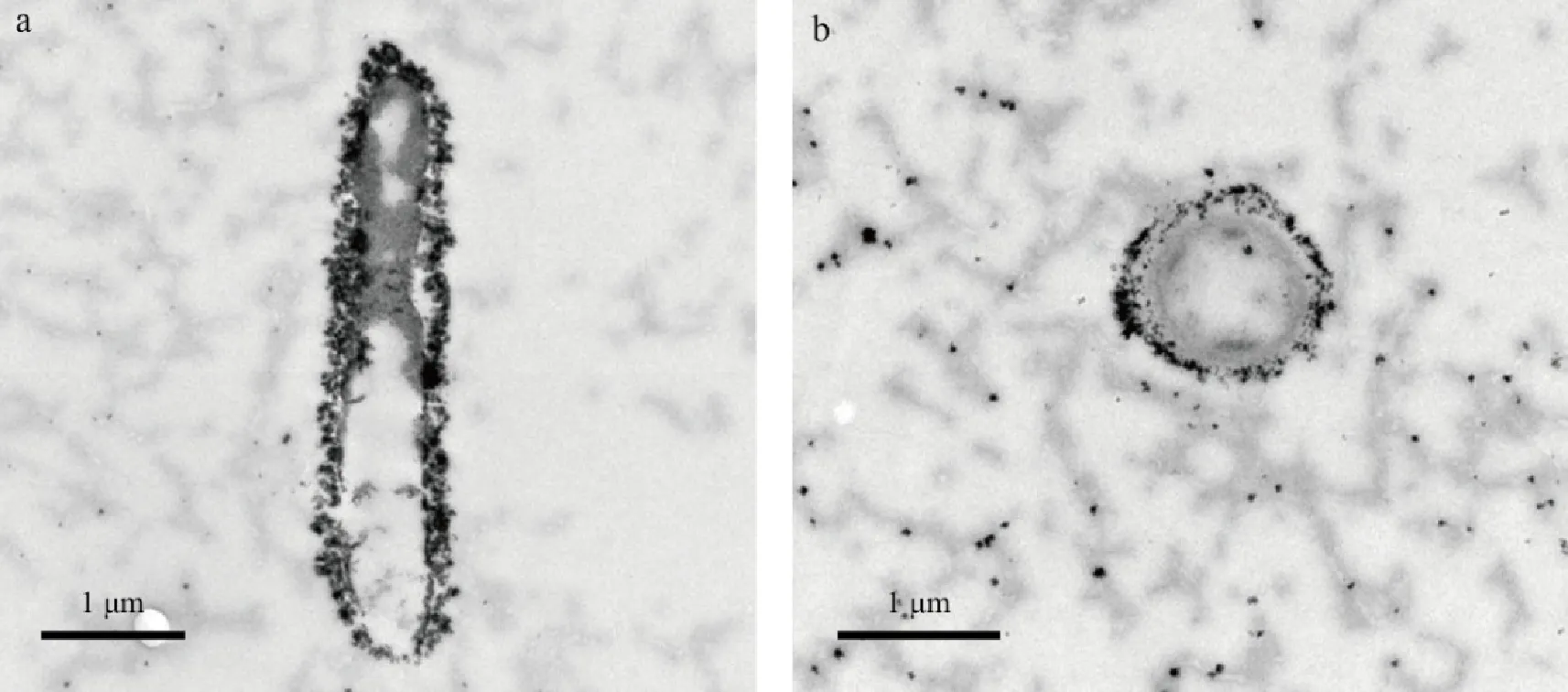
图6 半固体培养基中亚铁氧化细菌的透射电镜图Fig.6 TEM images of bacteria in semi-solid enrichment cultures
结合XRD和TEM结果,微好氧细菌氧化亚铁生成的主要产物是无定形铁氧化物,通常以弱结晶状水铁矿形式存在。Peng et al.(2010)发现海底热液中嗜中性微好氧FeOB Gallionella通过分泌胞外物质,形成螺旋鞘状物为铁氧化矿物的沉淀提供模板,这类有机纤维主要由多糖与脂类组成。而淡水微好氧FeOB Leptothrix ochracea则是通过在细胞表面产生多糖黏液层沉淀铁氧化物(Emerson et al.,1994)。本研究中,TEM结果并未观察到菌体表面形成螺旋鞘状物,铁氧化物紧紧结合在细胞壁上,猜测细菌是通过表面产生类似多糖物质作为模板供氧化物矿物沉淀。
细菌亚铁氧化作用生成的Fe(Ⅲ)氧化物由于表面积大,表面活性高,对土壤、沉积物或水体中有机质、重金属和非金属元素的沉降及迁移存在显著影响,并对其他重要元素如碳、氮等的生物地球化学循环(包括反硝化作用和甲烷形成等)具有重要意义。因此,对亚铁氧化过程及生物成矿的深入研究,不仅有助于深刻理解有关生源要素元素的地球化学过程及其在全球气候变化中的作用,同时还能为环境中的毒性重金属及有机污染物的生物修复提供理论基础。
3 结论
采用梯度管实验与高通量测序相结合的方法分析了水稻土中的微好氧亚铁氧化细菌,揭示了培养过程中微生物群落组成变化,分析了分离到的FeOB菌团的铁氧化能力及微生物成矿类型。然而,优势FeOB在亚铁氧化生物成矿中的生理及生化依据有待进一步研究。后续研究可对群落中优势的微好氧FeOB进行分离纯化,通过分析纯培养微生物的全基因组,更好地了解铁氧化功能基因,从而为中性亚铁氧化过程的研究奠定基础。
参考文献:
BENZ M,BRUNE A,SCHINK B.1998.Anaerobic and aerobic oxidation of ferrous iron at neutral pH by chemoheterotrophic nitrate-reducing bacteria [J].Archives of Microbiology,169(2):159-165.
CHAUDHURI S K,LACK J G,COATES J D.2001.Biogenic magnetite formation through anaerobic biooxidation of Fe (II) [J].Applied andEnvironmental Microbiology,67(6):2844-2848.
CHEN Y,LI J,CHEN L,et al.2014.Biogeochemical processes governing natural pyrite oxidation and release of acid metalliferous drainage [J].Environmental Science and Technology,48(10):5537-5545.
CROAL L R,GRANLNICK J A,MALASARN D,et al.2004.The genetics of geochemistry [J].Annual Review of Genetics,38:175-202.
DESANTIS T Z,HUGENHOLTZ P,KELLER K,et al.2006.NAST:a multiple sequence alignment server for comparative analysis of 16S rRNA genes [J].Nucleic Acids Research,34(suppl 2):W394-W399.
DING L J,SU J Q,XU H J,et al.2015.Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-13C-acetate probing coupled with pyrosequencing [J].The ISME Journal,9(3):721-734.
DRUSCHEL G K,EMERSON D,SUTKA R,et al.2008.Low-oxygen and chemical kinetic constraints on the geochemical niche of neutrophilic iron (Ⅱ) oxidizing microorganisms [J].Geochimica et Cosmochimica Acta,72(14):3358-3370.
EDWARDS K J,ROGERS D R,WIRSEN C O,et al.2003.Isolation and characterization of novel psychrophilic,neutrophilic,Fe-oxidizing,chemolithoautotrophic α-and γ-Proteobacteria from the deep sea [J].Applied and Environmental Microbiology,69(5):2906-2913.
EMERSON D,FLEMING E J,MCBETH J M.2010.Iron-oxidizing bacteria:an environmental and genomic perspective [J].Annual Review of Microbiology,64:561-583.
EMERSON D,FLOYD M M.2005.Enrichment and Isolation of Iron-Oxidizing Bacteria at Neutral pH [J].Methods in Enzymology,397:112-123.
EMERSON D,MOYER C.1997.Isolation and characterization of novel iron-oxidizing bacteria that grow at circumneutral pH [J].Applied and Environmental Microbiology,63(12):4784-4792.
EMERSON D,REVSBECH N P.1994.Investigation of an iron-oxidizing microbial mat community located near Aarhus,Denmark:field studies [J].Applied and Environmental Microbiolog,60(11):4022-4031.
EMERSON D,WEISS J V,MEGONIGAL J P.1999.Iron-oxidizing bacteria are associated with ferric hydroxide precipitates (Fe-plaque)on the roots of wetland plants [J].Applied and Environmental Microbiology,65(6):2758-2761.
FOUHY F,DEANE J,REA M C,et al.2015.The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations [J].PloS one,10(3):e0119355.
GEELHOED J S,SOROKIN D Y.2009.EPPING E,et al.Microbial sulfide oxidation in the oxic-anoxic transition zone of freshwater sediment:involvement of lithoautotrophic Magnetospirillum strain J10 [J].FEMS Microbiology Ecology,70(1):54-65.
IKENAGA M,ASAKAWA S,MURAOKA Y,et al.2003.Bacterial communities associated with nodal roots of rice plants along with the growth stages:estimation by PCR-DGGE and sequence analyses [J].Soil Science and Plant Nutrition,49(4):591-602.
JOSHI N A,FASS J N.2011.Sickle:a sliding-window,adaptive,quality-based trimming tool for FastQ files [J].Available from:github.com/najoshi/sickle.
KAPPLER A,NEWMAN D K.2004.Formation of Fe (Ⅲ)-minerals by Fe(Ⅱ)-oxidizing photoautotrophic bacteria [J].Geochimica et Cosmochimica Acta,68(6):1217-1226.
KAPPLER A,SCHINK B,NEWMAN D K.2005.Fe (Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe(Ⅱ)-oxidizer strain BoFeN1 [J].Geobiology,3(4):235-245.
KENNEDY C B,MARTINEZ R E,SCOTT S D,et al.2003.Surface chemistry and reactivity of bacteriogenic iron oxides from Axial Volcano,Juan de Fuca Ridge,north-east Pacific Ocean [J].Geobiology,1(1):59-69.
KLAUSEN J,TROEBER S P,HADERLEIN S B,et al.1995.Reduction of substituted nitrobenzenes by Fe (Ⅱ) in aqueous mineral suspensions [J].Environmental Science and Technology,29(9):2396-2404
LACK J G,CHAUDHURI S K,CHAKRABORTY R,et al.2002.Anaerobic biooxidation of Fe (Ⅱ) by Dechlorosoma suillum [J].Microbial Ecology,43(4):424-431.
LEFÈVRE C T,VILORIA N,SCHMIDT M L,et al.2012.Novel magnetite-producing magnetotactic bacteria belonging to the Gammaproteobacteria [J].The ISME Journal,6(2):440-450.
LOVLEY D R.1991.Dissimilatory Fe (Ⅲ) and Mn (Ⅳ) reduction [J].Microbiological Reviews,55(2):259-287.
MIOT J,BENZERARA K,MORIN G,et al.2009b.Transformation of vivianite by anaerobic nitrate-reducing iron-oxidizing bacteria [J].Geobiology,7(3):373-384.
MIOT J,BENZERARA K,OBST M,et al.2009a.Extracellular iron biomineralization by photoautotrophic iron-oxidizing bacteria [J].Applied and Environmental Microbiology,75(17):5586-5591.
PANTKE C,OBST M,BENZERARA K,et al.2012.Green rust formation during Fe (Ⅱ) oxidation by the nitrate-reducing Acidovorax sp.strain BoFeN1 [J].Environmental Science and Technology,46(3):1439-1446.
PENG X T,ZHOU H Y,LI J T,et al.2010.Intracellular and extracellular mineralization of a microbial community in the Edmond deep-sea vent field environment [J].Sedimentary Geology,229(4):193-206.
PRICE M N,DEHAL P S,ARKIN A P.2009.FastTree:computing large minimum evolution trees with profiles instead of a distance matrix [J].Molecular Biology and Evolution,26(7):1641-1650.
RATERING S,SCHNELL S.2001.Nitrate-dependent iron (Ⅱ) oxidation in paddy soil [J].Environmental Microbiology,3(2):100-109.
SCHWERTMANN U,CORNELL R M.2008.Iron oxides in the laboratory:preparation and characterization[M].John Wiley & Sons.
STOOKEY L L.1970.Ferrozine—a new spectrophotometric reagent for iron [J].Analytical Chemistry,42(7):779-781.
STRAUB K L,SCHÖNHUBER W A,BUCHHOLZ-CLEVEN B E E,et al.2004.Diversity of ferrous iron-oxidizing,nitrate-reducing bacteria and their involvement in oxygen-independent iron cycling [J].Geomicrobiology Journal,21(6):371-378.
TAO L,ZHANG W,LI H,et al.2012.Effect of pH and weathering indices on the reductive transformation of 2-nitrophenol in south China [J].Soil Science Society of America Journal,76(5):1579-1591.
TAOKA A,YOSHIMATSU K,KANEMORI M,et al.2003.Nitrate reductase from the magnetotactic bacterium Magnetospirillum magnetotacticum MS-1:purification and sequence analyses [J].Canadian Journal of Microbiology,49(3):197-206.
WANG J,MUYZER G,BODELIER P L E,et al.2009.Diversity of iron oxidizers in wetland soils revealed by novel 16S rRNA primers targeting Gallionella-related bacteria [J].The ISME Journal,3(6):715-725.
WANG J.2011.Ecology of neutrophilic iron-oxidizing bacteria in wetland soils [M].Netherlands Institute of Ecology.
WANG Q,GARRITY G M,TIEDJE J M,et al.2007.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy [J].Applied and Environmental Microbiology,73(16):5261-5267.
WEBER K A,ACHENBACH L A,COATES J D.2006.Microorganisms pumping iron:anaerobic microbial iron oxidation and reduction [J].Nature Reviews Microbiology,4(10):752-764.
WEISS J V,EMERSON D,BACKER S M,et al.2003.Enumeration of Fe(Ⅱ)-oxidizing and Fe (III)-reducing bacteria in the root zone of wetland plants:implications for a rhizosphere iron cycle [J].Biogeochemistry,64(1):77-96.
鲁如坤.2000.土壤农业化学分析方法[M].北京:中国农业科技出版社.
马小兰,丁琳洁,董军,等.2012.地下环境中铁氧化物生物异化还原耦合降解硝基苯的影响因素研究[J].生态环境学报,21(6):1109-1114.
张伟,刘同旭,李芳柏,等.2013.铁还原茵介导的氧化铁还原与硝酸盐还原的竞争效应研究[J].生态环境学报,22(1):123-128.
钟晓兰,周生路,黄明丽,等.2009.土壤重金属的形态分布特征及其影响因素[J].生态环境学报,18(4):1266-1273.
Diversity and Biomineralization of Microaerophilic Iron-oxidizing Bacteria in Paddy Soil
CHEN Yating1,2,3,LI Fangbai2,LI Xiaomin2
1.Guangzhou Institute of Geochemistry,Chinese Academy of Sciences,Guangzhou 510640,China;2.Guangdong Institute of Eco-Environmental and Soil Sciences,Guangzhou 510650,China;3.Graduate University of Chinese Academy of Sciences,Beijing 100049,China
Abstract:Microbially mediated iron oxidation is prevalent and thought to be central to many biogeochemical processes in paddy soils.Neutrophilic,microaerophilic Fe(Ⅱ)-oxidizing bacteria (FeOB) can oxidize Fe(Ⅱ) using O2as electron acceptor to gain energy for growth,yet little is known about the diversity and distribution of FeOB and the formation of Fe(Ⅲ)-minerals by microaerophilic FeOB in paddy soil.In this study,gradient tubes with opposing gradient Fe(Ⅱ) and O2were used to enrich and isolate microaerophilic FeOB from paddy soil,where 16S rRNA gene sequencing methods were used to profile the microbial diversity and distribution of FeOB in continuous cultivation and then the ability of Fe(Ⅱ) oxidation by the isolated FeOB and the Fe(Ⅲ) products were tested as well.The results showed that Azospira,Magnetospirillum,Clostridium and Rhodoplanes were abundant in the cultured communities.A mixture of several species remained together till the last stage of isolation,which might due to the syntrophic associations among the FeOBs.Among them,Azospira was the dominant FeOB with a relative abundance of 63.9%.Azospira is a well-known nitrate-reducing FeOB,which is capable of utilizing nitrate,chlorate or perchlorate as alternative electron acceptors.The isolated FeOB mixture actively oxidized Fe(Ⅱ),the concentration of HCl-Fe was 6.9 mmol·L-1on day 15.XRD results revealed that amorphous iron oxides were formed as the products of microbial iron oxidation.TEM results showed that cells of microaerophilic FeOB were rod-shaped with globular shaped particles sparsely deposited on the surface or around the cell,which might consist of amorphous Fe(Ⅲ) oxides.Overall,our results revealed that denitrifying bacteria might be capable of microaerophilic Fe(Ⅱ) oxidation which could be stimulated in the oxic-anoxic interface in paddy soil,and amorphous iron oxides were formed as microbial Fe(Ⅱ) oxidation by such bacteria.
Key words:microaerophilic Fe(Ⅱ)-oxidation; biomineralization; paddy soil; Azospira; amorphous iron oxides
DOI:10.16258/j.cnki.1674-5906.2016.04.001
中图分类号:S154.3; X172
文献标志码:A
文章编号:1674-5906(2016)04-0547-08
基金项目:国家自然科学基金重点项目(41330857)
作者简介:陈娅婷(1987年生),女,博士研究生,主要从事土壤微生物研究。E-mail:cyt160@163.com
收稿日期:2016-03-21
