莽草酸抑制BLM解旋酶活性及肝癌细胞的研究
2016-06-28葛章文吴利张望明贵州省人民医院检验科贵州贵阳55000遵义县人民医院检验科贵州遵义5600贵阳中医学院第一附属医院检验科贵州贵阳55000
葛章文,吴利,张望明.贵州省人民医院检验科,贵州贵阳 55000;.遵义县人民医院检验科,贵州遵义 5600;.贵阳中医学院第一附属医院检验科,贵州贵阳 55000
莽草酸抑制BLM解旋酶活性及肝癌细胞的研究
葛章文1,吴利2,张望明3
1.贵州省人民医院检验科,贵州贵阳550002;2.遵义县人民医院检验科,贵州遵义563100;3.贵阳中医学院第一附属医院检验科,贵州贵阳550002
[摘要]目的研究莽草酸(shikimic acid)对BLM解旋酶的生物学特性的影响及对肝癌细胞的抑制作用。方法2012年11月—2013年7月应用荧光偏振技术研究莽草酸对BLM解旋酶的DNA结合活性,CCK-8检测莽草酸对肝癌细胞增殖的抑制作用。结果培养24h,A100(100 μmol/L)、A50(50 μmol/L)、A25(25 μmol/L)三组与不加药对照组相比,抑制率分别为25.73%、21.31%、18.25%,对肝癌细胞HepG2增殖具有抑制作用(P<0.05)。结论①莽草酸不能结合BLM解旋酶,不能抑制其与DNA的结合,不能抑制BLM解旋酶的生物学活性。②莽草酸对HpG2细胞的生长有一定的抑制作用,HpG2细胞的生长抑制作用随药物作用时间的延长有减弱的表现。③莽草酸抑制肿瘤细胞生长的作用机制不是其通过对BLM解旋酶DNA结合活性的抑制来实现的。
[关键词]莽草酸;BLM解旋酶;DNA结合活性;HpG2;CCK-8
解旋酶第二大超家族中的RecQ解旋酶家族是其中最保守的一个家族,RecQ解旋酶家族在各种生物体的遗传稳定性的维持中发挥着非常重要的作用[1]。目前仍未见有关人DNA解旋酶结构、功能受莽草酸影响的相关报道。该课题于2012年11月—2013年7月采用荧光偏振和CCK-8技术,研究了莽草酸对BLM642-1290解旋酶的结构和功能的影响,为人类BLM解旋酶缺陷与肿瘤、遗传性疾病、环境相关疾病关系及致病机制的研究提供理论依据。
1资料与方法
1.1 BLM642~1290解旋酶的制备
BLM642~1290重组菌pET-15b-BLM642-1290-BL21由法国巴黎第十一大学居里研究所的奚绪光主任研究员馈赠.含有6个组氨酸串联标签(6×His)的BLM重组大肠杆菌,IPTG诱导BLM解旋酶表达20h(18℃、190 rpm),收集菌体超声破碎,经镍离子亲和层析柱分离纯化,获得可用于开展酶活性研究的重组BLM解旋酶。莽草酸购自阿拉丁(aladdin)公司。
1.2 DNA底物
带有荧光标记的和不带标记的单链DNA(ssDNA)底物:委托北京鼎国昌盛生物技术有限责任公司合成。序列如下:A1(45bp):5'-AATCCGTCGAGCAGAGTTAGG ttaggttaggttagtttttttttt-3';A2(21bp):3'-FAM-TTAGGCAGCTCGTCTCAATCC-5'。(注:FAM为羧基荧光素)
1.3莽草酸对大肠杆菌BLM解旋酶结合活性影响的检测
采用两种方法完成:①向测定管中加入ddH2O、15μL10×Buffer、3μL DNA(双链DNA(A1A2)、单链DNA(A2)),置于荧光偏振仪中检测荧光各向异性值至稳定,加入不同终浓度的莽草酸,测定荧光各向异性值至稳定,再加入BLM解旋酶使DNA底物饱和,测定荧光各向异性值至稳定。记录荧光各向异性值的变化。②向测定管中加入ddH2O、15μL 10×Buffer、3μL DNA(双链DNA(A1A2)、单链DNA(A2)),置于荧光偏振仪中检测荧光各向异性值至稳定,加入BLM解旋酶使DNA底物饱和,测定荧光各向异性值至稳定,加入不同终浓度的莽草酸,测定荧光各向异性值至稳定。本实验中通过调节ddH2O的体积,使反应体系总体积保持在150μL。
1.4莽草酸对肝癌细胞系HpG2生长抑制作用的研究
CCK-8检测莽草酸对肝癌细胞增殖的抑制作用。
1.4.1实验分组正常对照组:10%FBS的高糖DMEM。乙醇对照组:10%FBS的高糖DMEM+无水乙醇(浓度小于0.01%)。实验组10%FBS的高糖DMEM+莽草酸(0.5,2.5,5.0,10.0,25.0,50.0,100 μmol/L)
1.4.2 CCK-8检测莽草酸对肝癌细胞增殖的抑制作用
①在24孔板里培养肝癌HpG2细胞,分别于一周内每天天消化细胞进行计数,得出细胞生长曲线。②取处于生长对数期的肝癌细胞,在96孔板中接种细胞悬液(8×103/孔),将96板放在培养箱中预培养(37℃,5% CO2)。③细胞贴壁后,对实验组和对照组进行饥饿培养3h,后根据实验分组,加入莽草酸培养细胞,设无细胞组为空白对照组,每组设5个复空,分别于24,48和72h后向每孔加入10μL CCK溶液和90 uL的细胞培养基。④将培养板在培养箱内孵育1~4h。⑤用酶标仪测定在450 nm处的吸光度。
1.5统计方法
全部资料采用SPSS 17.0统计学软件进行分析。药物组与不加药物对照组BLM表达水平比较,采用两独立样本t检验,计数资料以%表示,采用Χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1莽草酸对BLM642-1290解旋酶结合活性的影响
莽草酸对BLM642-1290解旋酶的结合活性无明显的影响(Fig1)。无论以dsDNA(Fig 1B,D)还是ssDNA(Fig 1A,C)作底物时,体系的荧光各向异性值均无明显变化(P>0.05),说明莽草酸不能抑制BLM解旋酶的结合活性。
图A、B.随着莽草酸浓度升高,单链DNA(A2)和双链DNA(A1A2)与莽草酸反应后荧光偏振值无明显变化,说明莽草酸不与单链DNA(A2)或者双链DNA(A1A2)结合,加入酶后荧光偏振值明显升高并且与药物浓度无关,说明先前加入的莽草酸不能抑制BLM解旋酶与单链DNA或者双链DNA(A1A2)的结合。图C、 D.加入酶后荧光偏振值明显升高,说明酶与单链DNA(A2)或者双链DNA(A1A2)发生结合,加药物后随着药物浓度升高荧光偏振值无明显变化,说明加入的莽草酸对BLM解旋酶与单链DNA(A2)或者双链DNA(A1A2)的结合无抑制作用。
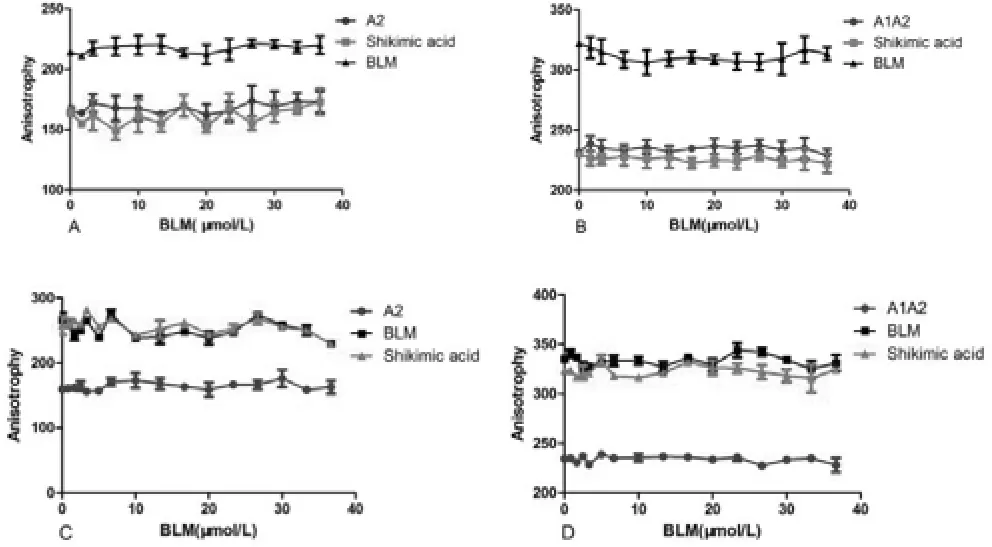
图1 BLM解旋酶的DNA结合活性注:A、B:将BLM解旋酶加入DNA和不同浓度莽草酸混合物中;C、D:将不同浓度莽草酸加入DNA和BLM解旋酶混合物中。
2.2莽草酸对肝癌细胞系HpG2生长抑制作用的研究
莽草酸对HpG2细胞的生长有一定的抑制作用。加药24h后监测,A100(100 μmol/L)、A50(50 μmol/L)、A25(25 μmol/L)3组与不加药对照组相比,抑制率分别为25.73%、21.31%、18.25%,对肝癌细胞HepG2增殖具有抑制作用(P<0.05)。培养48h,仅A100(100 μmol/L)组显示有抑制作用,抑制率为8.19%。培养72h,所有组对HpG2细胞均无抑制作用(P>0.05)。
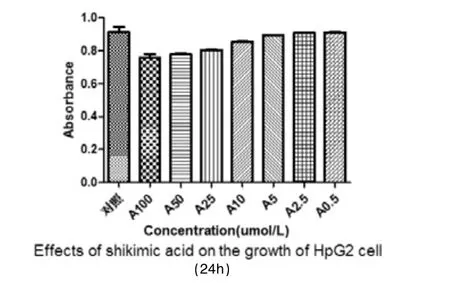
图2 莽草酸加药24h后CCK-8注:与不加药物对照组比较,A100(100 μmol/L)、A50(50 μmol/L)、A25(25 μmol/L)3组P<0.05,抑制率分别为25.73%、21.31%、18.25%。其余组P>0.05,无抑制作用。n=4。
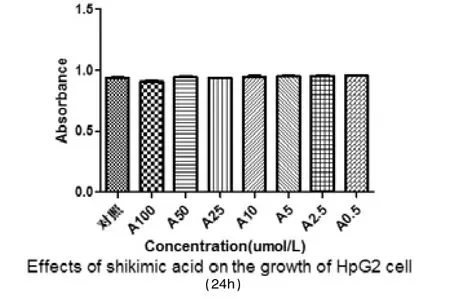
图3 莽草酸加药48h后CCK-8注:与不加药物对照组比较,A100组P<0.05,抑制率为8.19%。其余组P>0.05,无抑制作用。n=4。
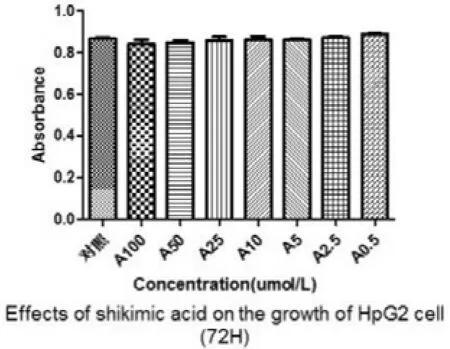
图4 莽草酸加药72h后CCK-8注:与不加药物对照组比较,P>0.05,均无抑制作用。n=4。
3讨论
3.1荧光偏振技术研究莽草酸对BLM解旋酶的DNA结合活性
荧光偏振技术被广泛应用于荧光免疫分析、食品安全与环境监测、药物筛选、测定蛋白质-核酸及蛋白质-蛋白质的相互作用[2]等领域。利用荧光偏振技术,许厚强等[3]发现甘草次酸对BLM解旋酶的活性有抑制作用。此实验研究发现莽草酸与单、双链DNA均不能发生结合反应,图1中A图显示莽草酸与单链DNA(A2)反应后使得荧光各向异性值未见升高,而B图显示莽草酸与双链DNA(A1A2)的反应后荧光各向异性值也未见升高,可知莽草酸与单链DNA和双链DNA均不能结合。加入BLM解旋酶后,发现荧光各向异性值明显增高,但是随着莽草酸浓度增加,经不同浓度莽草酸作用后的DNA链与BLM解旋酶发生反应后的荧光各向异性值无明显变化(P>0.05),这就说明莽草酸不能抑制DNA链与BLM解旋酶结合。同时,我们采用在加入DNA链后,先加入BLM解旋酶再加入不同浓度莽草酸进行测试,图1中C、D图显示:加入BLM解旋酶后荧光各向异性值迅速升高,说明DNA链与BLM解旋酶发生了结合。再加入不同浓度莽草酸,反应后的荧光各向异性值与加入BLM解旋酶时荧光各向异性值相比无明显变化(P>0.05)。说明莽草酸不能与DNA链与BLM解旋酶发生反应后的复合体结合。
3.2莽草酸对肝癌细胞系HpG2生长抑制作用的研究
在对CCK-8实验的结果分析中我们发现,在芒草酸浓度较低时(0.5 μmol/L、2.5 μmol/L、5 μmol/L),其对HpG2细胞无抑制作用。加药24h后监测,A100(100 μmol/L)、A50(50 μmol/L)、A25(25 μmol/L)3组与不加药对照组相比,抑制率分别为25.73%、21.31%、18.25%,对肝癌细胞HepG2增殖具有抑制作用(P<0.05),加药组随着药物浓度的升高,莽草酸对肝癌细胞的抑制作用越来越大,呈现剂量-效应关系。加药48h后监测,仅A100(100 μmol/L)组显示有抑制作用,抑制率为8.19%。加药72h后,所有组对HpG2细胞均无抑制作用(P>0.05)。HpG2细胞的生长抑制作用随药物作用时间的延长却有减弱的表现。在查阅相关文献后[3],我们分析发生该现象的原因可能是所试肿瘤细胞在莽草酸作用下产生了耐药。易雪等[4]所做的研究工作对我们很有启发意义,他们在用丝裂霉素C作用于Jurkat细胞的研究中发现MMC对Jurkat细胞作用48h的凋亡率相比24h反而下降,而在MMC作用于Jurkat细胞48h后BLM mRNA的水平要明显高于MMC作用24h的水平。孟惠惠[5]、赖卫强[6]等发现多株肿瘤细胞和白血病骨髓细胞中BLM解旋酶表达量高于正常细胞,Darya Bogdanova等[7-8]发现乳腺癌和卵巢癌中有BLM基因突变的发生,所以我们思考,所试肿瘤细胞对莽草酸耐药现象的发生可能也与BLM基因的高表达或者突变有关。
[参考文献]
[1]Fekret Osman,et al.The RecQ DNA helicase Rqh1 constrains Exonuclease 1-dependent recombination at stalled replication forks[J].scientific reports.2016,6:22837
[2]骆衡,许厚强,陈祥等.荧光偏振技术研究Bloom解旋酶催化核心与双链DNA的相互作用[J].生物化学与生物物理进展,2013,40(3):255-256
[3]刘金河,徐厚强,孟惠惠,等.甘草次酸对Bloom解旋酶生物学特性的影响[J].中国生物化学与分子生物学报.2014,30(9):919-916
[4]易雪,程辉,邹萍,等.丝裂霉素诱发Jurkat细胞DNA损伤修复机制中blm基因的作用研究[J].中国实验血液学杂志,2010(5):1155-1158.
[5]孟惠惠,许厚强,刘金河,等.三种癌细胞株中Bloom综合征解旋酶(BLM)的表达水平高于正常细胞[J].细胞与分子免疫学杂志,2014,30(6):649-651.
[6]赖卫强,张亚强,刘金河,等.BLM基因在白血病骨髓细胞中的表达及其临床价值[J].中国乡村医药,2014,21(10):61-62.
[7]Darya Prokofyeva.Nonsense mutation p.Q548X in BLM,the gene mutated in Bloom's syndrome,is associated with breast cancer in Slavic populations[J].Breast Cancer Research and Treatment,2013,137(2):533-539.
[8]Bogdanova N.Prevalence of the BLM nonsense mutation,p.Q548X,in ovarian cancer patients from Central and Eastern Europe[J].Fam Cancer,2015,14(1):145-149.
The Research of Effects of Shikimic Acid on BLM Helicase Activities and Hepatoma Cells
GE Zhang-wen1,WU Li2,ZHANG Wang-ming3
1.Clinical Laboratory,The People's Hospital of Guizhou Province,Guiyang,Guizhou Province,550002 China;2.Clinical Laboratory,The People's Hospital of Zunyi County,Zunyi,Guizhou Province,563100 China;3.Clinical Laboratory,The First Affiliated Hospital of Guiyang College of Traditional Chinese Medicine,Guiyang,Guizhou Province,550002 China
[Abstract]Objective To study the effects of shikimic acid on biological properties of BLM helicase and inhibitory effect on hepatoma cells.Methods From November 2012—July 2013,effects of shikimic acid on DNA-binding activity were detected by fluorescence polarization;Effects of shikimic acid on the growth of hepatoma cells were detected by CCK-8.Results Culture for 24h,compared with the control group,the inhibition rate of A100(100 μmol/L),A50(50 μmol/L)and A25(25 μmol/L)group were 25.73%,21.31%and 18.25%respectively(P<0.05).Conclusion 1.Shikimic acid can not bound to BLM helicase,inhibit its binding to DNA and inhibit the biological activities of the helicase .2.Shikimic acid have a mild inhibitory effect on the growth of hepatoma cancer cell line HepG2,but its inhibitory effect decreased with the drug action time prolonged.3.the mechanism of shikimic acid to inhibit the growth of HepG2 cells is not the activity suppression on the DNA binding activity of the BLM helicase.
[Key words]Shikimic acid;BLM helicase;DNA binding activity;HpG2;CCK-8
[中图分类号]R5
[文献标识码]A
[文章编号]1674-0742(2016)06(a)-0009-03
DOI:10.16662/j.cnki.1674-0742.2015.16.009
[作者简介]葛章文(1987.2-),男,湖南人,硕士,初级检验技师,主要从事肿瘤生物治疗的研究工作。
[通讯作者]张望明(1986.7-),男,湖南人,硕士,主管检验师,研究方向:肿瘤生物治疗。Email:83142903@qq.com
收稿日期:(2016-03-05)
