银杏4-香豆酸辅酶 A 连接酶基因的克隆与序列分析
2016-06-27雷静许锋王晓辉张威威廖咏玲
雷静,许锋,王晓辉,张威威,廖咏玲
(长江大学园艺园林学院,湖北 荆州434025)
银杏4-香豆酸辅酶 A 连接酶基因的克隆与序列分析
雷静,许锋,王晓辉,张威威,廖咏玲
(长江大学园艺园林学院,湖北 荆州434025)
[摘要]根据银杏(Ginkgo biloba L.)转录组中的基因序列设计引物,从银杏中克隆到了4-香豆酸辅酶A连接酶(4-coumarate:CoA ligase,4CL)的cDNA片段,命名为Gb4CL,GenBank 登录号为KU820947。Gb4CL全长1736bp,含有1个1671bp的ORF,编码557个氨基酸。核苷酸和蛋白质序列多重比较结果显示,Gb4CL与其他植物的4CL基因的核苷酸与蛋白质序列均高度同源。Gb4CL编码的蛋白质与日本柳杉(Cryptomeria japonica)、白豆杉(Pseudotaxus chienii)、北美云杉(Picea sitchensis)的4CL氨基酸同源性分别为82%、83%、80%。4CL系统进化树显示,Gb4CL与裸子植物亲缘关系最近。该研究通过克隆Gb4CL基因,并进行相关的生物信息学分析,可为掌握银杏木质素生物合成中关键基因的调控机理提供参考。
[关键词]银杏(Ginkgo biloba L.);4CL;基因克隆;序列分析
银杏(GinkgobilobaL.)是我国特产的古老珍贵树种,具有极高的经济、生态、观赏和科研价值,其药用价值也已受到世界范围内研究者广泛关注。银杏叶片主要含有2种活性成分——黄酮类化合物(Flavonoids)和萜内酯(银杏内酯 Ginkgolides)。其中木质素合成涉及到的重要次生代谢途径,即苯丙氨酸代谢途径(phenylpropanoid pathway)中生成的如香豆素、黄酮醇、木质素、软木酷及其他的苯类化合物,对植物维持细胞壁结构、抗病害、抗紫外线损伤、作为花粉发育和植物与微生物相互作用的信号分子等生长与发育过程作用显著[1,2]。同时在人类生活中这类次生代谢产物还可作为药物、食品添加剂、芳香剂、染料等,具有极大的经济和社会价值。因此利用基因工程手段研究改造相关基因次生代谢产物的合成具有重大的实际意义。
4-香豆酸辅酶 A 连接酶(4-coumarate:CoA ligase,4CL)是苯丙氨酸途径中的关键性限速酶,作用于苯丙酸途径中最后一步反应,分别催化p-香豆酸、咖啡酸、阿魏酸和芥子酸生成相应的辅酶A(CoA)酯,这些硫酯处于苯丙酸代谢途径和各种末端产物特异合成途径的分支点,其中生成的香豆酰CoA、阿魏酰CoA 及芥子酰CoA 转化为肉桂醇衍生物后,通过还原反应生成木质素单体[3]。人们对4CL有较为明确的认识始自4CL基因的克隆。迄今已从多种植物中分离到编码4CL的基因,如欧芹(Petroselinumcrispum)[4]、马铃薯(Solanumtuberosum)[5]、火炬松(Pinustaeda)[6]、烟草(Nicotianatabacum)[7]、大豆(Glycinemax)[8]、拟南芥(Arabidopsisthaliana)[9]、花楸(Sorbusaucuparia)[10]、小立碗藓(Physcomitrellapatens)[11]、钝鲮紫背苔(Plagiochasmaappendiculatum)[12]等。而有关银杏4CL基因克隆的研究尚未见报道。为此,本研究以银杏为材料,对其4CL基因进行克隆,并做相关核苷酸、蛋白质、进化树分析研究,以期为进一步研究银杏4CL基因的功能提供参考。
1材料与方法
1.1材料
银杏取自长江大学银杏科技园,品种为家佛手,取十五年生银杏的叶,采集后液氮速冻存放于-80℃冰箱中。
实验所用大肠杆菌DH5α为长江大学园艺园林学院园艺生物技术实验室保存,pMD18-T vector kit购自香港Invitrogen公司,AMV反转录酶、dNTPs、RNasin和TaqDNA聚合酶购自美国Promega(Madison,WI,USA)公司。引物合成及序列测定由上海生工生物工程技术服务有限公司(Shanghai Sangon Biotechnology Company China)完成。
1.2方法
1.2.1总 RNA 的提取
按照蔡荣等[13]的方法提取银杏叶的总RNA,利用琼脂糖凝胶电泳和分光光度计分析总RNA 的纯度和浓度,保存于-80℃冰箱中备用。
1.2.2银杏4CL基因cDNA的克隆
取银杏叶总RNA1μg用于cDNA第一链的合成,具体操作按照AMV Reverse Transcriptase kit说明书。根据银杏转录组中4CL基因序列设计引物,上游引物Gb4CLup:5’-ATGGCTCTTATTGCGCCTTCT-3’;下游引物Gb4CLdown:5’-GCATTTGTGACGCACGAGAA-3’,以合成的cDNA第一链为模板,扩增得到银杏4CL基因开放阅读框(ORF)序列。反应程序为:94℃预变性4min;94℃变性30s,55℃退火30s,72℃延伸90s,共32个循环;最后于72℃下延伸10min。1%琼脂糖凝胶电泳检测 PCR 产物,并用高纯度 PCR 产物纯化试剂盒回收 PCR 产物。按照pMD18-T 载体试剂盒说明书,将回收片段与pMD18-T 载体连接,转化大肠杆菌DH5α菌株,选取阳性克隆提取质粒DNA,经酶切鉴定后测序。
1.2.3生物信息学分析

M.DL2000 DNA Marker;1.Gb4CL基因PCR扩增产物图1 Gb4CL基因片段PCR扩增图
Gb4CL基因cDNA序列的ORF查找及翻译借助DNAMAN 6.0和Vector NTI 10.0完成,核酸和蛋白质同源性分析在NCBI(http://www.ncbi.nlm.nih.gov/BLAST/)上用BLAST 完成。然后利用Vector NTI 10.0完成4CL氨基酸序列比对,通过Clustal X1.83和MEGA 4.0 构建4CL基因的分子进化树,并进行Bootstrap检测。
2结果与分析
2.1Gb4CL 基因cDNA克隆及其核苷酸序列分析
以合成的银杏cDNA第一条链为模板,利用Gb4CLup和Gb4CLdown引物组合,通过RT-PCR方法克隆得到的银杏4CL基因cDNA片段,命名为Gb4CL,GenBank 登录号为KU820947,PCR扩增电泳结果见图1。该片段克隆测序全长为1736bp,ORF有1671bp,编码557个氨基酸。核苷酸序列比对显示,该片段与其他植物4CL基因序列相似性大于70%(表1),如与芝麻(Sesamumindicum)4CL的同源性为73%,与马铃薯(Solanumtubero-

表1 银杏4CL基因与其他植物4CL基因核苷酸序列同源性比较
sum)、番茄(Solanumpennellii)、潘那利番茄(Solanumlycopersicum) 4CL的同源性均为70%。因此,可以初步推测该片段为银杏4CL基因家族成员之一。
2.2Gb4CL 蛋白质分析
根据Gb4CL核苷酸序列的ORF推测的4CL氨基酸序列结果见图2。利用 Computer pI/Mw软件分析推Gb4CL蛋白质等电点和分子量分别为 5.62和60ku,与所报道的其他植物的4CL蛋白质性质相似。利用Vector NTI 10.0对Gb4CL蛋白质序列与其他植物4CL蛋白质序列进行比较。Gb4CL多肽与其他植物4CL氨基酸序列之间的相似性大于70%(图3),与同为裸子植物的日本柳杉(Cryptomeriajaponica,AFJ73433.1)、白豆杉(Pseudotaxuschienii,AFJ73459.1)、北美云杉(Piceasitchensis,ABR17998.1)的同源性分别为82%、83%、80%,与锤枝桦(Betulapendula,AIR95613.1)和可可(Theobromacacao,XP_007014191.1)的同源性为71%,与土肉桂(Cinnamomumosmophloeum,AFG26323.1)、水曲柳(Fraxinusmandshurica,AHL44986.1)和甜椒(Capsicumannuum,ACF17632.1)的同源性为70%,说明 Gb4CL与其他植物中4CL蛋白质的序列和功能极为相似。
Gb4CL序列中也具有完整保守的功能结构域(motif),如图3中肽基序BOXI在4CL蛋白序列中几乎绝对保守,被认为是4CL催化反应中保守的AMP结合功能域,负责催化木质素合成途径中4-香豆酸和辅酶A的连接,而且与荧光素酶、长链脂肪酰基2CoA合成酶、肽合成酶中发现的保守基序相似,也是腺苷酸形成酶超家族(the superfamily of adenylate-forming enzymes)的分类依据之一[14]。肽基序BOXII在所有 4CL 中绝对保守,其中甘氨酸Gly(G)、谷氨酸Glu(E)、半胱氨酸Cys(C)是最为保守的氨基酸位点,且中心的 C 残基被认为直接参与催化进程[15]。这与黄胜雄等[16]的研究相一致。

方框中为起始子和终止子,下划线为特异引物Gb4Clup和Gb4Cldown图2 Gb4CL基因核酸序列及其所推导的氨基酸序列
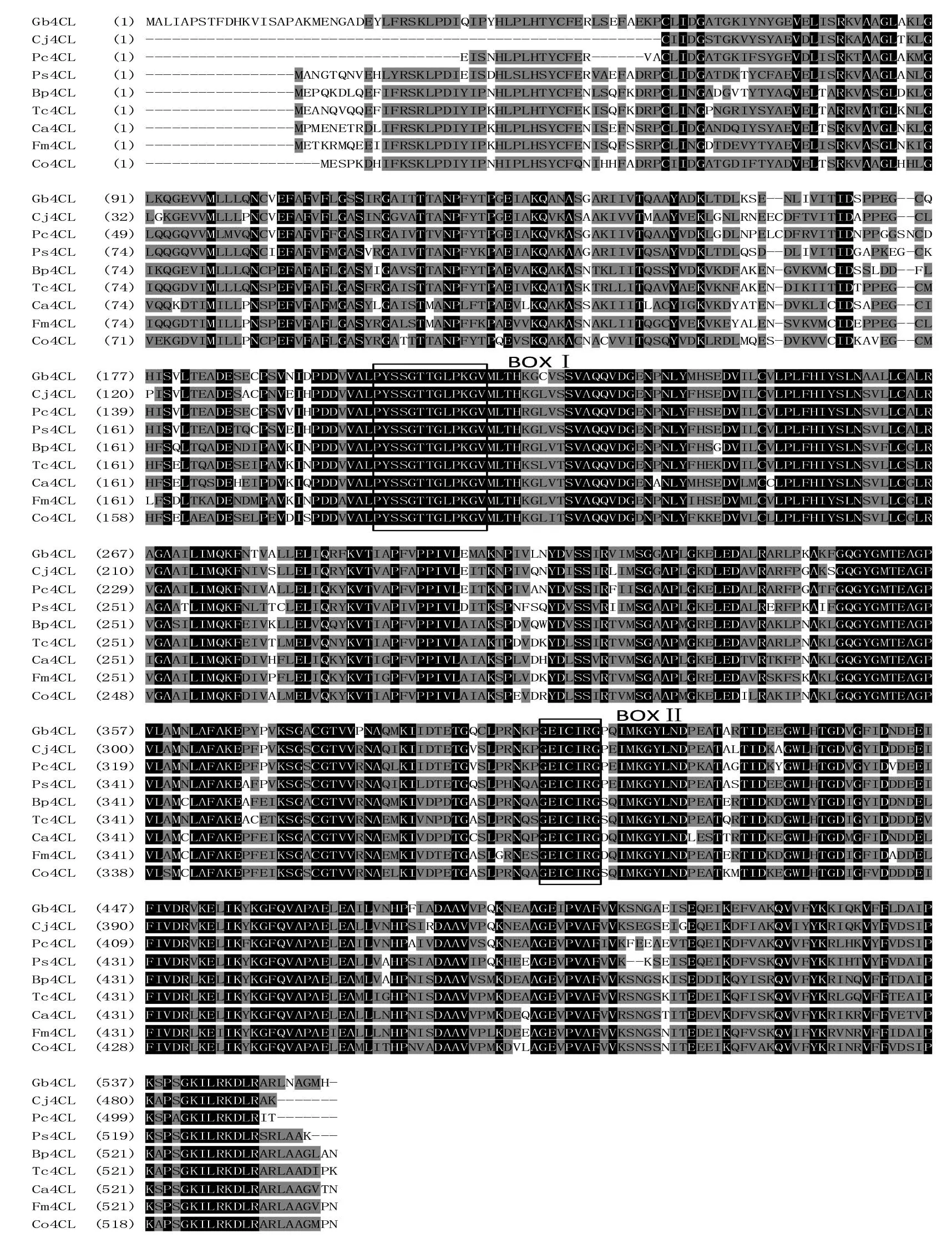
氨基酸完全一致的序列用黑底白字表示,完全不相似氨基酸序列用白底黑字表示,部分相似的氨基酸序列用灰底黑字表示。BOX I表示保守的AMP结合功能域;BOX II表示GEICIRG保守区。蛋白质简称、植物学名及GenBank登录号如下:Cj4CL日本柳杉(Cryptomeria japonica),AFJ73433.1;Pc4CL白豆杉(Pseudotaxus chienii),AFJ73459.1;Ps4CL北美云杉(Picea sitchensis),ABR17998.1;Bp4CL锤枝桦(Betula pendula),AIR95613.1;Tc4CL可可(Theobroma cacao),XP_007014191.1;Ca4CL甜椒(Capsicum annuum),ACF17632.1;Fm4CL水曲柳(Fraxinus mandshurica),AHL44986.1;Co4CL土肉桂(Cinnamomum osmophloeum),AFG26323.1图3 Gb4CL蛋白质与其他植物4CL蛋白质氨基酸序列的多重比较
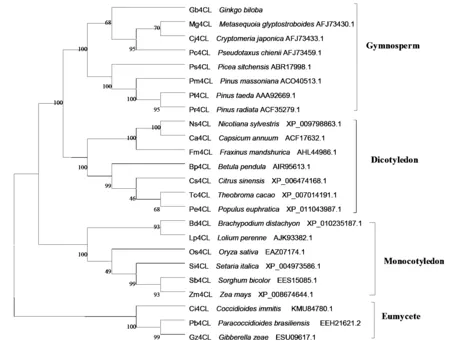
图4 Gb4CL蛋白与其他植物4CL蛋白氨基酸序列的系统进化树
2.3Gb4CL 分子进化分析
利用软件 Clustal x 1.83 和 MEGA 4.0通过 Neighbor-joining(NJ)方法构建了Gb4CL 的系统进化树(图4)。分析表明:在裸子植物(Gymnosperm)、单子叶植物(Monocotyledon)、双子叶植物(Dicotyledon)和真菌(Eumycete)中4CL都有相同的进化起源,4CL基因家族在进化上存在一定的保守性,银杏Gb4CL蛋白与同一分类中的水杉(Metasequoiaglyptostroboides,AFJ73430.1)、白豆杉(Pseudotaxuschienii,AFJ73459.1)、日本柳杉(Cryptomeriajaponica,AFJ73433.1)的亲缘性最近,与同一分类中的其他松科植物北美云杉(Piceasitchensis,ABR17998.1)、马尾松(Pinusmassoniana,ACO40513.1)、火炬松(Pinustaeda,AAA92669.1)、辐射松(Pinusradiata,ACF35279.1)同源性也达到80%,在进化距离上较单子叶植物而言,裸子植物4CL与双子叶植物亲缘关系更近,处于同一分支上,与真菌类亲缘关系最远,这表明在裸子植物和被子植物分化之前这些4CL基因就已经存在于植物中,在植物中的进化时间超前于裸子植物和被子植物分化的时间。
3小结与讨论
本研究首次从银杏中克隆得到其4CL基因,并将其命名为Gb4CL,利用生物信息学软件进行多序列比对分析,结果显示Gb4CL与其他植物已分离的4CL基因有较高的同源性,并含有共同的功能结构域BOXI(PYSSGTTGLPKLGV)和BOX II(GEICIRG)。4CL基因在植物中多是以基因家族的形式存在的,目前发现的4CL基因可分为2类:Ⅰ类的4CLs主要与木质素的生物合成有关,Ⅱ类的4CLs主要调控类黄酮的生物合成[17]。目前已有多项研究显示通过抑制4CL基因活性可以降低植物中木质素含量,4CL基因的过量表达可以增加木质素的含量,进而增强植物抗病性和抗倒伏能力[18~20],而对4CL基因的正向或负向调控可能仅仅只是影响了木质素的合成,对苯丙氨酸途径中其他次生代谢产物的合成影响不大,不干扰植物的正常生长发育[19,21]。开展植物木质素生物合成途径的研究,不仅是在模式植物,而且在一些木本植物如银杏中同样有利于更好地揭示植物次生代谢途径在木质素积累中的调控作用。由于银杏具有极大的生物效能,因此进行银杏次生代谢过程中相关基因的克隆和鉴定对其生物工程改良具有很大的推动作用。
[参考文献]
[1]Fukasawa-Akada T,Kung S,Watson J C.Phenylalanineammonia-lyasegene structure,expression,andevolution inNicotiana[J].Plant Mol Biol,1996,30:711~722.
[2]Zhong R,Morrison W H,Himmelsbach D S,etal.Essential role of caffeoyl Co-enzyme A O-methyltransferase in lignin biosynthesis in woody poplar plants[J].Plant Physiol,2000,124:563~578.
[3]Whetten R,Sederoff R.Lignin biosynthesis[J].Plant Cell,1995,7:1001~1013.
[4]Neutaedter D A,Lee S P,Douglas C J.A novel parsley 4CL1 cis-element is required for developmentally regulated expression and protein-DNA complex formation[J].Plant J,1999,18:77~88.
[5]Becker-André M,Schulze-Lefert P,Hahlbrock K.Structural comparison,modes of expression,and putative cis-acting elements of the two 4-coumarate:CoA ligase genes inpotato[J].J Biol Chem,1991,266:8551~8559.
[6]Zhang X,Chiang V.Molecular cloning of 4-coumarate:coenzyme A ligase inloblollypineand the roles of thisenzyme in the biosynthesis of lignin in compression wood[J].Plant Physiol,1997,113:65~74.
[7]Lee D,Douglas C J.Two divergent members of a tobacco4-coumarate:coenzyme A ligase (4CL) gene family[J].Plant Physiol,1996,112:193~205.
[8]Lindermayr C,Möllers B,Fliegmannm J,etal.Divergent members of asoybean (GlycinemaxL.) 4-coumarate:coenzyme A ligasegene family:Primary structures,catalytic properties,and differential expression[J].Eur J Biochem,2002,269:1304~1315.
[9]Yi Li,Kim J I,Pysh L,etal.Four isoforms ofArabidopsisthaliana4-coumarate:CoA ligase (4CL) haveoverlapping yet distinct roles in phenylpropanoid metabolism[J].Plant Physiol,2015,10:1~37.
[10]Gaid M M,Scharnhop H,Ramadan Hn,etal.4-Coumarate:CoA ligase family members from elicitor-treatedSorbusaucupariacell cultures[J].J Plant Physiol,2011,168:944~951.
[11]Silber M V,Meimberg H,Ebela J.Identification of a 4-coumarate:CoA ligase gene family in the moss,Physcomitrellapatens[J].Phytochemistry,2008,69:2449~2456.
[12]Shuai G,Hai N,Rui X,etal.Cloning and functional characterization of a 4-coumarate CoA ligasefrom liverwortPlagiochasmaappendiculatum[J].Phytochemistry,2015,111:48~58.
[13]蔡荣,许锋,陈柳吉,等.银杏不同组织的总RNA提取方法的改进[J].生物技术,2007,17(4):38~41.
[14]Fulda M,Heinz E,Wolter F P.The fadD gene ofEscherichiacoliK12 is located close tornd at 39.6 min of the chromosomal mapand is a new member of the AMP-binding protein family[J].Mol Gen Genet,1994,242:241~249.
[15]Stuible H,Kombrink E.Identification of the substrate specificity-conferring amino acid residues of 4-coumarate:Coenzyme A ligase allowsthe rational design of mutant enzymes with new catalytic properties[J].J Biol Chem,2001,276:26893~26897.
[16]黄胜雄,胡尚连,孙霞,等.木质素生物合成酶4CL基因的遗传进化分析[J].西北农林科技大学学报(自然科学版),2008,36(10):199~206.
[17]Wei X,Wang X.Evolution of 4-coumarate:coenzyme A ligase(4CL) gene and divergence ofLarix(Pinaceae)[J].Mol Phylogenet Evol,2004,31:542~553.
[18]贾彩红,赵华燕,王宏芝,等.抑制4CL基因表达获得低木转基因毛白杨[J].科学通报,2004,49(7):662~666.
[19]杨向东,王汉中,胡赞民,等.毛白杨4CLcDNA的克隆、表达及活性分析[J].华中农业大学学报,2006,25(2):101~105.
[20]黄杰恒,李威,曲存民,等.甘蓝型油菜不同抗倒性材料中木质素代谢途径关键基因表达特点[J].作物学报,2013,39(8):1339~1344.
[21]Hu J,Li G,Struss D,etal.SCAR and RAPD markers associated with 18 carbon fatty acids in rapeseed,Brassicanapus[J].Plant Breed,1999,118:145~150.
[收稿日期]2016-03-03
[基金项目]国家自然科学基金项目(31000904)。
[作者简介]雷静 (1989-),女,硕士生,研究方向为林木遗传育种。通信作者:许锋,xufeng198@126.com。
[中图分类号]Q785
[文献标识码]A
[文章编号]1673-1409(2016)15-0042-07
[引著格式]雷静,许锋,王晓辉,等.银杏4-香豆酸辅酶 A 连接酶基因的克隆与序列分析[J].长江大学学报(自科版) ,2016,13(15):42~48.
