果胶酶液体发酵条件优化与酶学特性研究
2016-06-23王齐玮刘盛全李晓平安徽农业大学林学与园林学院安徽合肥30036云南省木材胶黏剂及胶合制品重点实验室云南昆明6504
王齐玮,刘盛全,李晓平,吴 宁,候 庆(.安徽农业大学 林学与园林学院,安徽 合肥 30036;.云南省木材胶黏剂及胶合制品重点实验室,云南 昆明 6504)
果胶酶液体发酵条件优化与酶学特性研究
王齐玮1,2,刘盛全1,李晓平2,吴 宁2,候 庆2
(1.安徽农业大学 林学与园林学院,安徽 合肥 230036;2.云南省木材胶黏剂及胶合制品重点实验室,云南 昆明 650224)
摘 要:本文通过液体摇瓶发酵,采用DNS法测定酶活性,研究不同条件对果胶酶活性的影响以及果胶酶的酶学特性。结果表明对于HS021号菌,适宜的发酵条件为初始发酵液pH 6.0,菌龄和发酵时间24 h,加入0.05% Na+,果胶酶活性可达17.67 U/mL,最适温度为50℃,最适pH 5.0。对于HS047号菌,适宜的发酵条件为初始发酵液pH 6.0,菌龄和发酵时间24 h,果胶酶活性可达15.66 U/mL,最适温度为45℃,最适pH 5.0。对于HS053号菌,适宜的发酵条件为初始发酵液pH 6.0,菌龄24 h,发酵时间48 h,加入0.05% 的Na+,果胶酶活性可达11.32 U/mL,最适温度为55℃,最适pH5.0。对于HS053号菌木粉发酵液可以替代果胶底物发酵液。紫外诱导后,酶活均下降。
关键词:果胶酶;芽孢杆菌;液体发酵;条件优化;酶学特性
果胶是一种多糖类物质,其化学结构比较复杂,在植物中含量较少但非常重要,起到对植物细胞的物质支持作用,是植物细胞壁和胞间层的主要成分。果胶在植物细胞组织中与纤维素、半纤维素、木质素和蛋白质等相互交联,使相邻纤维细胞紧密的粘结在一起,表现出固有的形态[1-2],因此利用果胶酶对原料进行预处理,降解胞间层中的一部分果胶质,可以起到纤维分离的目的。纤维分离是纤维板制造、制浆造纸和纺织生产中的关键技术,传统的纤维分离通常采用酸碱处理法、机械法、热磨法和传统微生物法等,这些分离方法不仅需要专门的设备、耗时耗能、还会形成二次污染,而利用果胶酶法分离纤维则是一种绿色、环保的生产工艺。利用果胶酶对原料进行预处理后再进行纤维分离可以大大降低纤维分离的能耗,同时降低纤维分离对环境造成的污染等[3-6]。
果胶酶是指可以分解果胶的一类酶的总称,果胶酶广泛存在于动物、植物和微生物中,但动、植物等天然来源的果胶酶产量低且提取十分困难,不能满足生产和实验的需要。许多霉菌及少量的细菌和酵母菌等都可产生果胶酶,主要以曲霉和杆菌为主[7-9]。果胶酶被研究应用于纤维分离[4-6]、纺织[10-11]、造纸[12](尤其是利用麻类纤维包括亚麻、黄麻、大麻等原料)等领域,仅在实验室内取得了成功,因为目前市售的食品级果胶酶主要来源于黑曲霉,其最适pH值一般在3.5~4.0范围,而木质材料自然酸碱性一般为5.5~5.8范围,同时木质材料复杂的化学成分,也导致果胶酶不能很好的发挥作用。课题组从工业大麻籽内生菌中筛选到5株产果胶酶菌株,通过扫描电镜观察自制果胶酶溶液处理工业大麻杆效果,并与市购的4种果胶酶处理效果对比,结果表明自制果胶酶可以完全适应生物质材料的自身酸碱环境,工业大麻杆样品纤维的剥离程度最高,能有效的用于生物质材料中果胶质的分解[13]。但果胶酶的酶活力低,生产成本高,限制了该酶的广泛应用,本文主要研究影响果胶酶发酵的所有因素,同时进行了酶学特性的研究,以制备出高活性的新型果胶酶。
1 实验
1.1 菌种
实验中采用了5株来自工业大麻籽的内生菌,分别为 Bacillus s iamensis (HS017)、Brevibacillus agri (HS021)、Bacillus subtilis subsp (HS036)、Bacillus methylotrophicus (HS047)、Brevibacillus parabrevis (HS053)。
1.2 发酵液
实验中共采用了5种发酵液,用于优化果胶酶的发酵条件和确定发酵液对果胶酶活性的影响,发酵液的配方分别如下:1)液体发酵液:酵母粉4 g,果胶0.4 g,葡萄糖3.6 g,麦芽粉3 g,蒸馏水1 000 mL;2)麸皮发酵液:麸皮粉11 g,蒸馏水1 000 mL;3)柚子粉发酵液:柚子粉11 g,蒸馏水1 000 mL;4)工业大麻杆发酵液:工业大麻杆粉11 g,蒸馏水1 000 mL;5)木粉发酵液:木粉11 g,蒸馏水1 000 mL。将发酵液配制好后在121℃的灭菌锅中灭菌15 min,待发酵液冷却后接菌,并置于摇床中进行发酵。
1.3 方法
1.3.1 液态发酵
用无菌竹签将一个火柴头大小的菌体挑入装有100 mL液体发酵液的250 mL摇瓶中,放入摇床振荡一定时间,设定温度37℃,转数200 r/min。
1.3.2 酶活测定[14]
1)半乳糖醛酸标准曲线绘制
分别取浓度为1.000 0 g/L半乳糖醛酸标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6mL,用蒸馏水全部补至5 mL,加3 mL DNS试剂,沸水浴5 min,冷却后,用蒸馏水定容至25.0 mL,以空白参比调零,用分光光度计在540 nm波长下测吸光值。将上述测得的数据,以吸光度为纵坐标,半乳糖醛酸含量为横坐标,绘制半乳糖醛酸标准曲线,如图1所示。其直线回归方程为y=0.196 x-0.057 3,相关系数0.97,标准曲线斜率K=0.196。
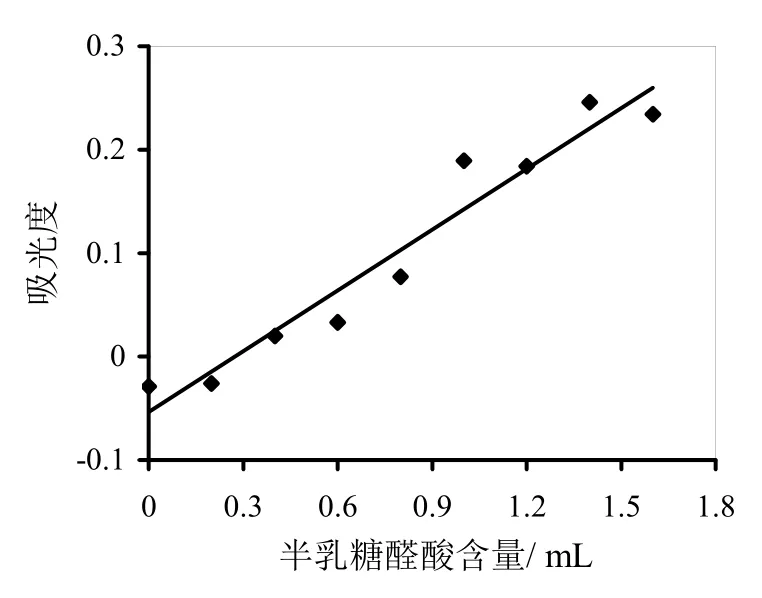
图1 半乳糖醛酸标准曲线
2)果胶酶活性测定
向甲乙试管中分别加入1%浓度果胶溶液5 mL,在50℃水浴锅中水浴5 min。接着分别向甲乙两管中加入相应pH的柠檬酸―柠檬酸钠缓冲液4 mL,向甲管加1 mL稀释酶液,立即摇匀,在50℃水浴锅中水浴30 min,同时立即给乙管加1 mL稀释酶液,放入沸水浴中煮沸5 min,终止反应,冷却。最后分别取甲乙两管中2 mL于两支25 mL比色管中,分别给甲乙两管加蒸馏水2 mL和3 mL DNS试剂,充分混合,于沸水浴煮沸5 min,取出,立即冷却。最后加蒸馏水定容到25 mL。以标准空白为基准调零。在540 nm处测吸光值。
3)酶活力计算

式中,A甲为酶样吸光度,A乙为酶空白吸光度,K为标准曲线斜率,5为测定酶活力时取了反应液的1/5,t为反应时间(h),A甲、A乙吸光度应在建立标准曲线的吸光值内。
酶活力定义:1.0 mL酶液在50℃、一定pH条件下,1 h分解果胶产生1.0 mg D-半乳糖醛酸为一个酶活力单位,即1U。
1.3.3 发酵条件优化分别研究了发酵液pH值、菌龄、发酵时间、替代果胶底物、金属离子和紫外诱导对果胶酶活性的影响。1)发酵液pH值对果胶酶活性的影响
将5株菌分别在发酵液pH值5.5、6.0、6.5、7.0下进行发酵,在pH5.5环境下测定发酵所得的果胶酶酶液活性,确定最佳发酵液pH值,同时筛选三株酶活比较高的菌株进行后期的试验。
2)菌龄和发酵时间对果胶酶活性的影响
分别测得菌龄24、48、72 h,发酵时间24、48、72、96、120 h下发酵制备的果胶酶活性。获得最佳菌龄和最佳发酵时间。
3)替代果胶底物发酵液对果胶酶活性的影响
在生产果胶酶时,果胶物质既是碳源,又是酶的诱导物,对产酶影响较大。考虑到纯果胶价格昂贵,本实验分别利用麸皮、柚子粉、工业大麻杆、木粉四种发酵液,在最佳菌龄和最佳发酵时间下,发酵生产果胶酶,并测其果胶酶活性,试图找到合适的替代发酵液。
4)金属离子对果胶酶活性的影响
精确称取一定量的含Mg2+、Na+、K+、Ca+氯化盐及含Cu2+、Ge2+的硫酸盐。按照0.01%、0.05%、0.1%加入发酵液中,进行果胶酶的发酵制备,然后在最佳菌龄和最佳发酵时间下测定各金属离子处理液的酶活力。计算其相对酶活,以此来评价金属离子对果胶酶活性的影响。
5)紫外诱导
微生物是发酵的原动力。在发酵工业中要取得生产的高效益,就要有优良的生产菌株。紫外诱导是诱变育种最常用的一种方式,采用15 W紫外线杀菌灯,照射距20~30 cm。设定紫外诱导时间15、30、45、60 min,诱导后的菌体进行发酵制备果胶酶液,并测定其酶活性。
1.3.4 酶学特性研究
研究了果胶酶的最适温度和最适pH值,具体实验方案如下:
1)酶的最适温度
在30 ℃、35℃、40 ℃、45℃、50 ℃、55℃、60 ℃,pH 5.5的条件下,反应30 min,测定果胶酶酶活。将最大的酶活力记为100%,其他的酶活力以它的百分比来计。
2)酶的最适pH
在最适温度条件下,设定pH 3.5、4.0、4.5、5.0、5.5、6.0、6.5和7.0分别反应30 min,测定果胶酶酶活。将最大的酶活力记为100%,其他的酶活力以它的百分比来计。
2 结果与讨论
2.1 果胶酶液体发酵条件的优化
2.1.1 发酵液pH值对果胶酶活性的影响
图2为发酵液pH对果胶酶活性的影响。由图2可知,在发酵液pH为6.0时得到的果胶酶活性最高,固发酵液pH应设定在6.0为最佳。HS017、HS036两株菌的酶活相对较低,故后期试验将不再进行研究。
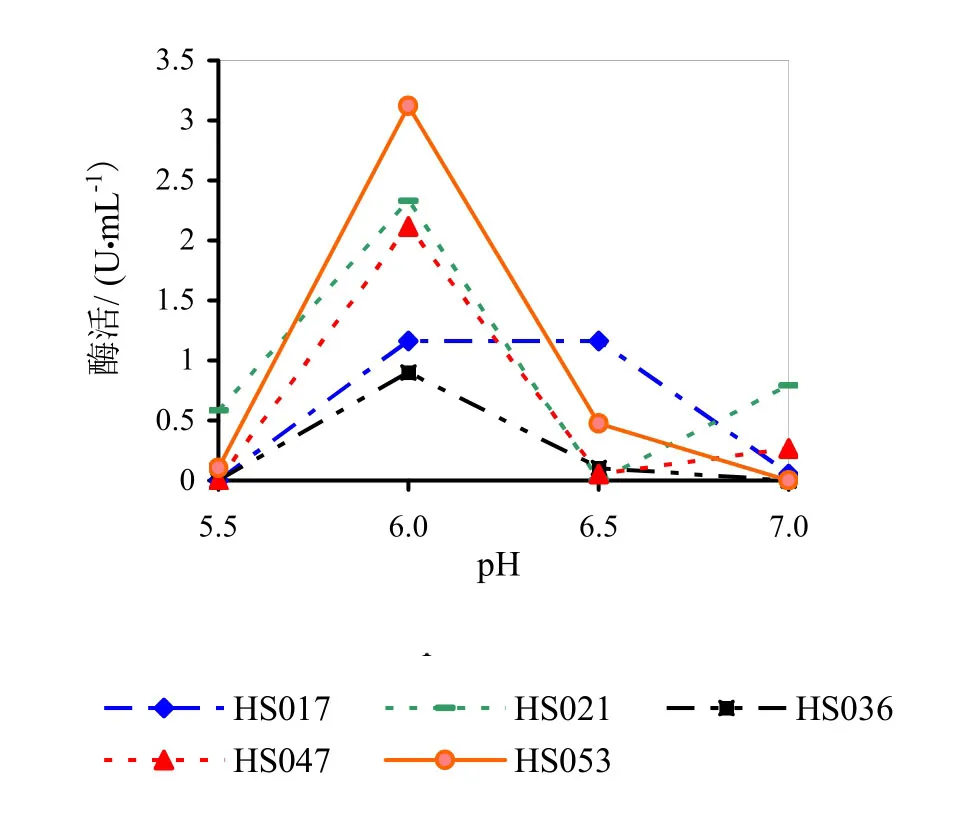
图2 发酵液pH对果胶酶活性的影响
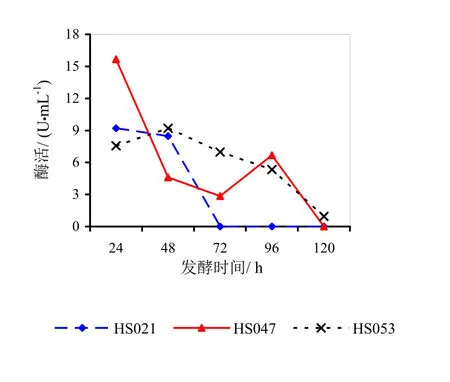
图3 菌龄24 h时不同发酵时间对酶活的影响
2.1.2 最佳菌龄和最佳发酵时间确定
图3~5分别为菌龄24、48、72 h时不同发酵时间对酶活影响的折线图。
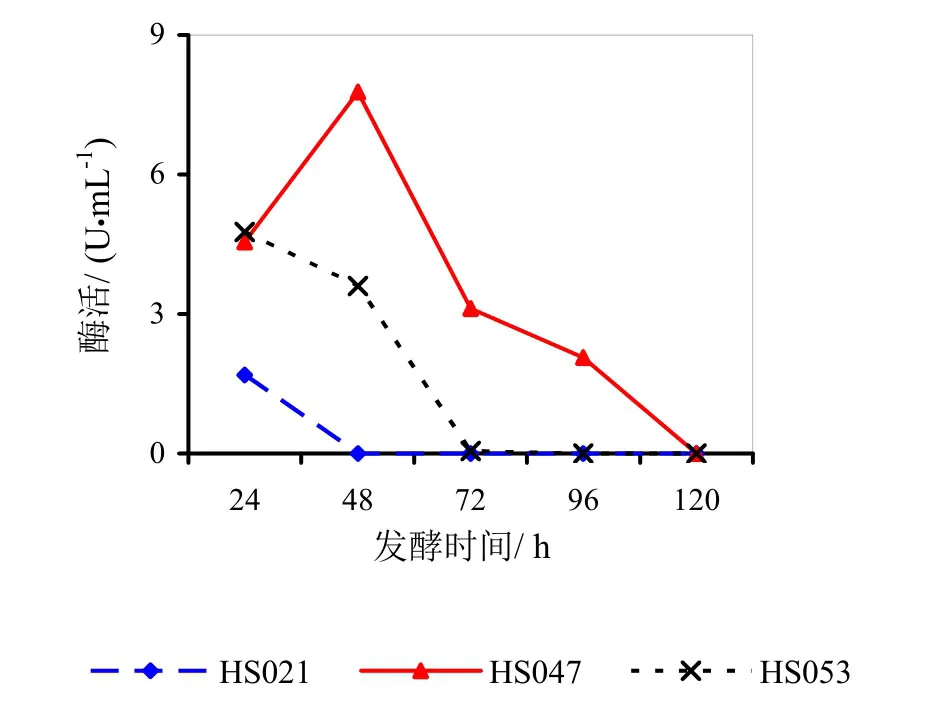
图4 菌龄48 h时不同发酵时间对酶活的影响
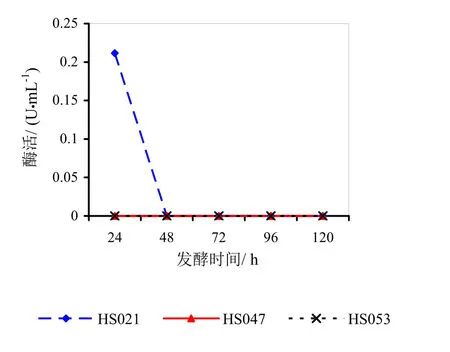
图5 菌龄72 h时不同发酵时间对酶活的影响
由图3~5分析可得,HS021、HS047号菌的最佳菌龄和最佳发酵时间都为24 h。HS053号菌的最佳菌龄为24 h,最佳发酵时间为48 h。
2.1.3 替代发酵液对果胶酶活性的影响
图6~8分别是四种替代发酵液对HS021、HS047、HS053号菌酶活的影响。通过图6~8柱状图的分析可知,麸皮和木粉替代发酵液对HS053号菌发酵液酶活有促进作用,相对酶活分别为106.9%和121.3%。木粉替代发酵液相对酶活较高可能是因为木粉中含有的金属离子对粗酶液酶活起到了促进作用,其他替代发酵液均无促进作用。
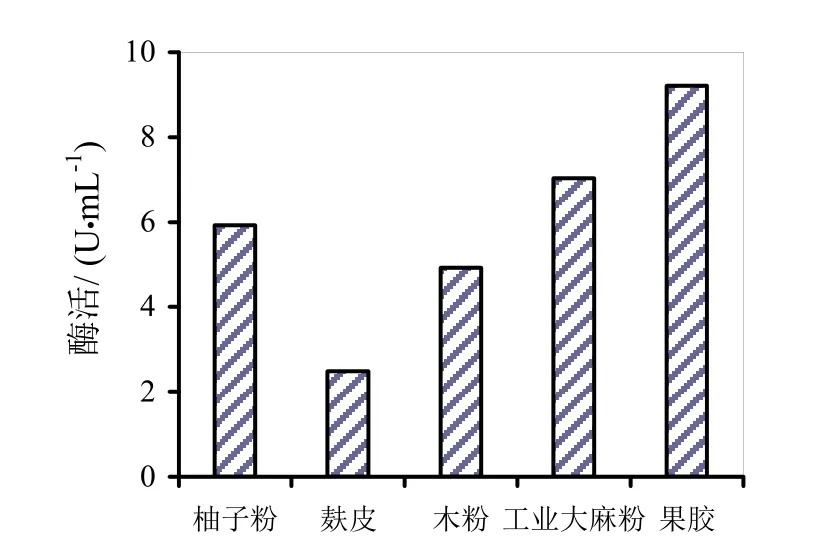
图6 四种替代发酵液对HS021号菌酶活的影响
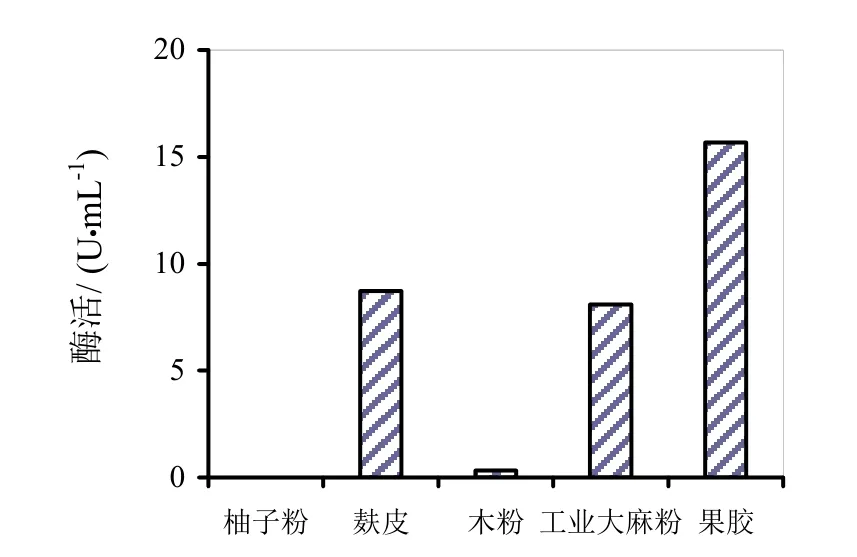
图7 四种替代发酵液对HS047号菌酶活的影响
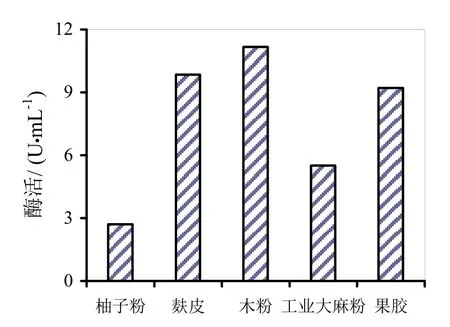
图8 四种替代发酵液对HS053号菌酶活的影响
2.1.4 金属离子对粗酶液果胶酶活性的影响
由图9~14可知,Mg2+、Na+促进了HS021粗酶液果胶酶活性。加入0.01%浓度的Mg2+酶液相对酶活力为106.3%,加入0.05%浓度的Mg2+酶液相对酶活力为132.2%,加入0.05%浓度的Na+酶液相对酶活力为192.0%。Na+对HS053号菌粗酶液果胶酶活性有促进作用,加入0.05%浓度的Na+酶液相对酶活力为123.0%。HS047号菌酶液没有促进离子。说明粗酶液中添加不同的金属离子对果胶酶活性有很大的影响。
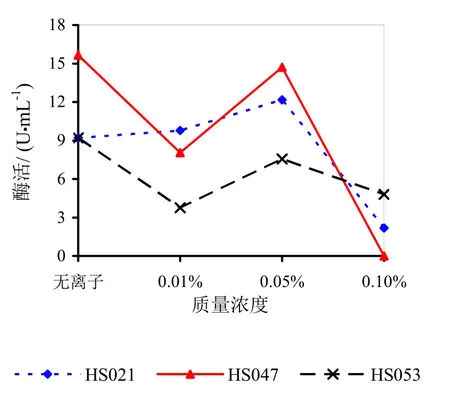
图9 不同浓度Mg2+对果胶酶活性的影响
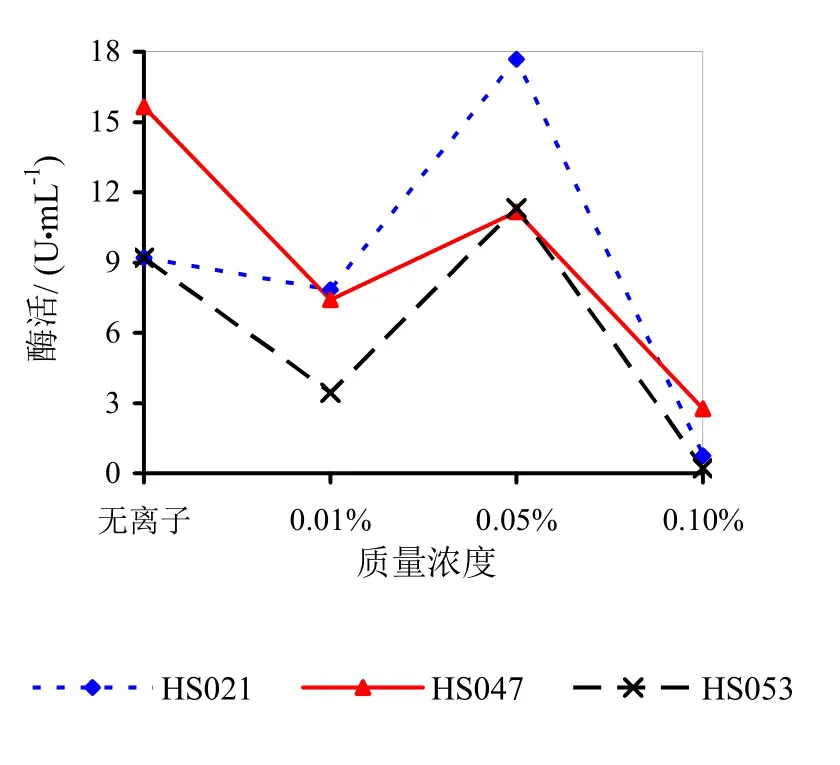
图10 不同浓度Na+对果胶酶活性的影响
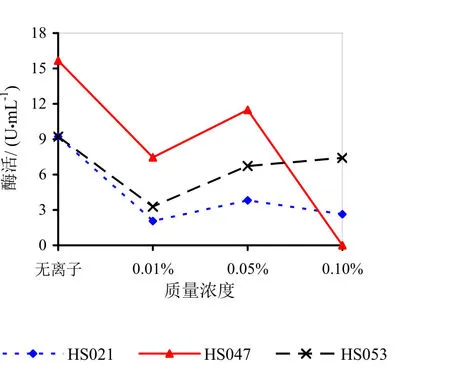
图11 不同浓度K+对果胶酶活性的影响
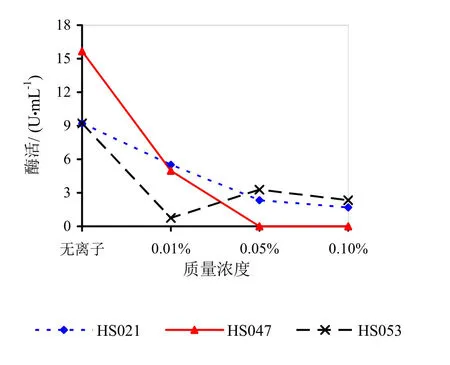
图12 不同浓度Ca2+对果胶酶活性的影响
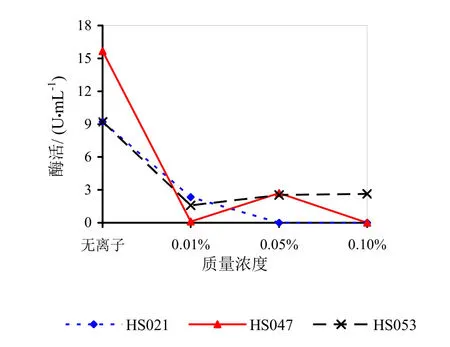
图13 不同浓度Cu对果胶酶活性的影响
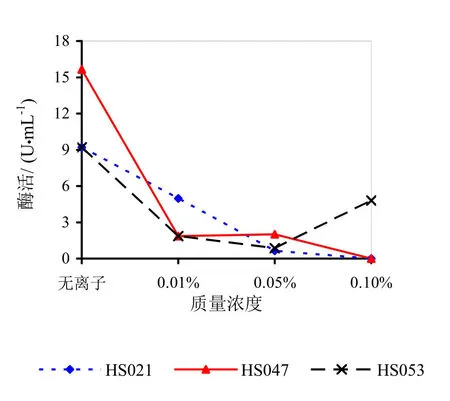
图14 不同浓度Ge对果胶酶活性的影响
2.1.5 紫外诱导对果胶酶活性的影响
图15说明紫外诱导后的菌体发酵制备的果胶酶酶活均出现了不同程度的降低甚至失活。HS021号菌诱导30 min活性降低,诱导超过30 min活性有一定升高。HS047、HS053号菌诱导30 min后均死亡。
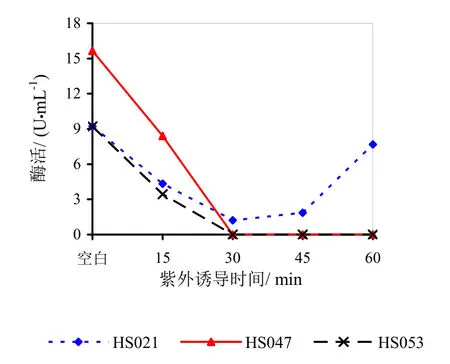
图15 紫外诱导对果胶酶活性的影响
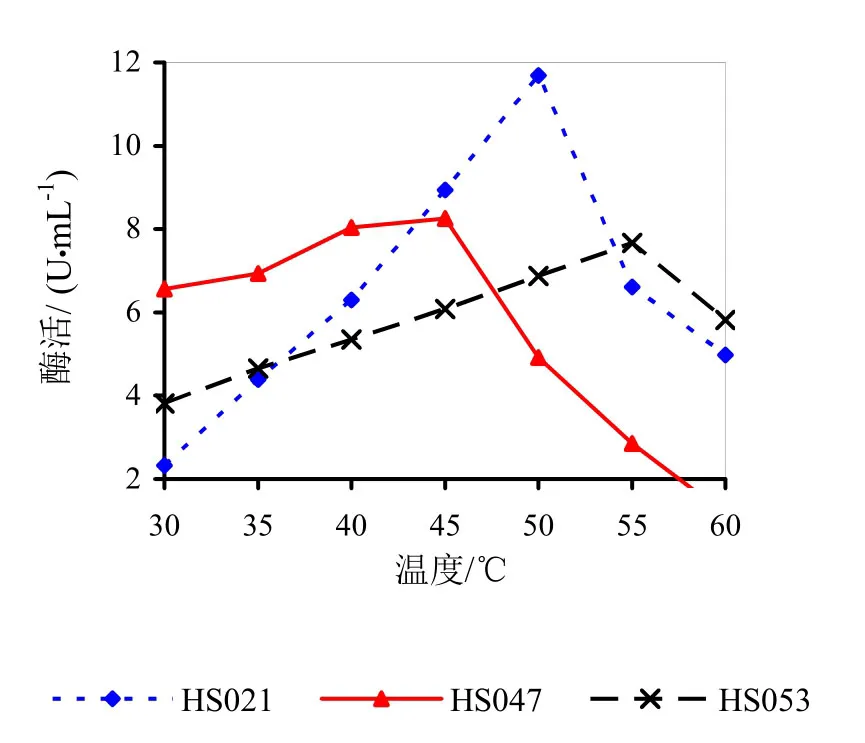
图16 不同反应温度下的相对酶活
2.1.6 酶的酶学特性
在pH 5.5的0.2 mol/L Na2HPO4-0.l mol/L 柠檬酸缓冲体系中,酶液在不同温度下进行酶促反应。如图16所示。由图16可知,HS021号菌果胶粗酶液最适反应温度范围为45~55℃,最适温度为50℃。HS047号菌果胶粗酶液最适反应温度范围为40~50℃,最适温度为45℃。HS053号菌果胶粗酶液最适反应温度范围为50~60℃,最适温度为55℃。
不同pH下的相对酶活如图17所示。由图17可知,pH对菌株产果胶酶酶活的影响很大,HS021号菌最适pH范围4.5~5.5,在pH5.0时候酶活达到最高值。HS047号菌最适pH范围4.0~5.0,在pH4.5时候酶活达到最高值。HS053号菌最适pH范围4.5~5.5,在pH5.0时候酶活达到最高值。
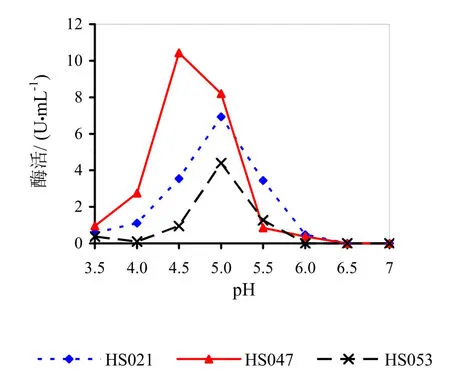
图17 不同pH下的相对酶活
3 结论
利用液体发酵果胶酶受到多种因素影响,经过分析研究得出对于HS021号菌,适宜的发酵条件为初始发酵液pH值6.0,菌龄和发酵时间24 h,加入0.05%浓度的Na+,果胶酶活性可以达到17.67 U/mL,最适温度为50℃,最适pH 5.0。对于HS047号菌,适宜的发酵条件为初始发酵液pH值6.0,菌龄和发酵时间24 h,果胶酶活性可以达到15.66 U/mL,最适温度为45℃,最适pH 5.0。对于HS053号菌,适宜的发酵条件为初始发酵液pH值6.0,菌龄24 h,发酵时间48 h,加入0.05%浓度的Na+,果胶酶活性可以达到11.32 U/mL,最适温度为55℃,最适pH 5.0。对于HS053号菌木粉发酵液可以替代果胶底物发酵液。紫外诱导后,酶活均下降。
参考文献:
[1] Baskin T.Anisotropic expansion of the plant cell wall[J].Annu Rev Cell Dev Biol,2005,21: 203-222.
[2] Caffall K H,Mohnen D.The structure,function,and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydrate Research,2009,344(14): 1879-1900.
[3] Pramod k,Bajpai.Solving the problems of recycled fiber processing with enzymes[J].Bio Resources,2010,5(2): 1311-1325.
[4] 吴宁,杜官本,李晓平.果胶酶预处理对木材纤维分离的影响初探[J].纤维素科学与技术,2015,23(1): 21-28.
[5] 吴宁,肖瑞,杜官本,等.果胶酶预处理对竹材纤维分离的影响[J].木材加工机械,2015,26(2): 34-38.
[6] 吴宁,杜官本,李晓平.果胶酶预处理对工业大麻秆纤维分离影响初探[J].西部林业科学,2015,44(3): 85-89.
[7] Piccoli-Valle R H,Passos F J V,Brandi I V,et al .Influence of different mixing and aeration regimens on pectin lyase production by Penicillium griseoroseum[J].Process Biochemistry,2003,38: 849-854.
[8] Kashyap D R,Vohra P K,Chopra S,et al .Applications of pectinases in the commercial sector: A review[J].Process Biochemistry,2001,77(3): 215-227.
[9] 顾红燕,齐鸿雁,张洪勋.高大毛霉制取果胶酶发酵条件实验[J].过程工程学报,2002,2(3): 252-256.
[10] Cao J,Zheng L,Chen S.Screening of pectinase producer from alkalophilic bacteria and study on its potential application in degumming of rammie[J].Enzyme and Microbial Technology,1992,14(12): 1013-1016.
[11] 樊增禄.权衡果胶酶Bioperp处理对棉织物性能的影响[J].印染助剂,2002,19(5): 11-13.
[12] Reid I,Ricard M.Pectinase in papermaking: Solving retention problems in mechanical pulps bleached with hydrogen peroxide[J].Enzyme and Microbial Technology,2000,26(2-4): 115-123.
[13] 王齐玮,李晓平,李文均,等.大麻籽内生菌果胶酶的菌株筛选初探[J].纤维素科学与技术,2015,23(1): 55-59.
[14] 李鸿玉,李祖明.果胶酶及其应用[M].北京: 知识产权出版社,2010: 175-177.
Study of Liquid Fermentation and Characteristics of Pectinase
WANG Qi-wei1,2, LIU Sheng-quan1, LI Xiao-ping2, WU Ning2, HOU Qing2
(1.Forestry and Landscape Architecture, Anhui Agricultural University, Hefei 230036, China; 2.Yunnan Key Laboratory of Wood Adhesives and Glue Products, Kunming 650224, China)
Abstract:Pectinase is widely used in industrial production, mainly by microbial fermentation.The pectinase was produced via flask culture and its activity was determined by DNS.The effect of different conditions of pectinase activity and enzymatic properties of pectinase was studied.The results showed that for HS021 bacteria, the optimum fermentation conditions were initial pH6.0, bacteria age and fermentation time 24 h, added 0.05% Na+, pectinase activity reached 17.67 U/mL, the optimum temperature 50℃, the optimum pH 5.0.For HS047 bacteria, the optimum fermentation conditions were initial pH6.0, bacteria age and fermentation time 24 h, pectinase activity reached 15.66 U/mL, the optimum temperature 45℃, the optimum pH 5.0.For HS053 bacteria, the optimum fermentation conditions were initial pH6.0, bacteria age 24 h, fermentation time 48 h, added 0.05% Na+, pectinase activity reached 11.32 U/mL, the optimal temperature 55℃, the optimum pH 5.0.For HS053 bacteria broth flour could replace pectin substrate fermentation broth.After UV induction, enzyme activity decreased.
Key words:pectinase, bacillus, liquid fermentation, condition optimization, enzymatic characteristics
中图分类号:TQ920.1
文献标识码:A
文章编号:1004-8405(2016)01-0014-08
DOI:10.16561/j.cnki.xws.2016.01.08
收稿日期:2015-11-11
基金项目:国家林业局行业公益项目(201404515);云南省中青年学术带头人后备人才项目(2015HB048)。
作者简介:王齐玮(1991~),博士研究生;研究方向:生物质复合材料。
* 通讯作者:李晓平(1980~),博士,副教授;研究方向:生物质复合材料。lxp810525@163.com
