马铃薯晚疫病菌单孢子囊分离技术的改进
2016-06-14谢业焜吴娥娇李冬亮靳宇佳詹家绥
谢业焜+吴娥娇+李冬亮+靳宇佳+詹家绥
摘要:针对现行马铃薯晚疫病菌研究中单孢子囊分离方法操作难度大、耗时久、成功率低的问题,在已有的悬浮液分离方法的基础上,利用单个孢子囊含有多个游动孢子,且每个游动孢子遗传物质相同的特点,分离获得单个孢子囊后,采用低温刺激其释放游动孢子,形成了一套分离单个孢子囊的新方法。结果表明,改进后的方法成功率提高了近5倍,操作时间减少了50%,同时操作难度也大大降低,是病原群体研究试验中快速、大批量分离单孢子囊的一种行之有效的方法。该方法成功地应用于马铃薯晚疫病菌(Phytophthora infestans)群体遗传和竞争试验研究。
关键词:马铃薯晚疫病菌;单孢子囊分离;孢子囊;游动孢子
中图分类号: S435.32
文献标志码: A
文章编号:1002-1302(2016)04-0172-02
马铃薯晚疫病是由致病疫霉(Phytophthora infestans)引起的具有很强的破坏力的、给马铃薯生产造成极大危害的病害[1],每年因马铃薯晚疫病造成的直接损失高达数10亿美元[2],因此,明确马铃薯晚疫病的发生、发展和进化规律,对马铃薯晚疫病的管控十分重要。当今研究多集中于病原菌毒力的增减,很少涉及到病原菌的生存策略[3]。在自然环境中,由于寄主资源有限,同一寄主可能会被多个病原菌侵染,病原菌之间会为了有限的资源展开竞争[4-5]。病原菌对寄主多重侵染时会采取什么样的繁殖策略,有什么因素会对其造成影响,目前对此众说纷纭[6-8]。本研究旨在通过探究不同基因型的病原菌侵染同一寄主时,竞争力有何变化,探讨不同病原菌在有限的生存空间中采用何种生存策略。
本研究的技术路线为:(1)选取2个SSR等位基因位点有差异的自育交配型菌株;(2)两两单独、两两混合按1 ∶1的比例接种到马铃薯叶片(感病品种Favorite)上,每处理重复5次;(3)接菌后第3天开始拍照,至第7天结束;(4)从2个不同菌株混合的处理中分离获得50个孢子囊,分别培养,提取DNA,进行SSR分析;(5)使用ASSESS[9]计算病斑大小与发病面积,检验不同等位基因的菌株致病力强弱。
为了得到混合侵染后不同菌株竞争力强弱的结果,必须从混合接种的叶片上分离大量的单孢子囊。而传统的单孢子囊分离方法——水琼脂平板划线法[10]存在以下不足:(1)水琼脂不含营养物质,孢子囊萌发后无法从水琼脂上获取营养,往往难以长到黑麦培养基上;(2)镜检费时费力,即使操作熟练也需要花3~10 min才能完成1个单孢子囊的分离;(3)水琼脂厚度难以控制,太厚不利于镜检,太薄又易碎,难以转移到黑麦培养基上。由于离体的马铃薯叶片在被马铃薯晚疫病菌侵染后极易腐烂,腐烂后的叶片杂菌极多,无法进行单孢子囊分离,而传统的水琼脂平板划线法效率低下,无法满足试验需要。为此,本试验在袁军海等的研究方法[11]基础上进行改进,探寻一种能够快速、高效,适合大批量获取单个孢子囊的方法。
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试菌株分别于2010年、2011年采自云南省和贵州省安顺市,根据省份和市区首写字母依次编号命名为YN3和AS22。
1.1.2 黑麦培养基 黑麦培养基的制作借鉴Caten等的方法[12]:取50 g黑麦于烧杯中,用自来水冲洗干净,加入适量去离子水,室温下浸泡15~20 h,充分研磨后于65 ℃水浴2 h,用4层纱布过滤去渣,加热煮沸并于滤液中加入12 g琼脂粉,待琼脂粉充分融化后用去离子水定容至1 L,分装,灭菌。
1.1.3 主要器材 三目生物显微镜、血球计数板、恒温培养箱、培养皿(直径9 cm)、玻片等。
1.2 方法
1.2.1 水琼脂平板划线法 先倒1层大约1 mm的水琼脂平板,然后将孢子囊悬浮液滴在平板上,于10×10倍显微镜下观察,将含有单个孢子囊的部分小心切下,用镊子将含有孢子囊的一面朝上置于黑麦培养基上,封口,置于18 ℃恒温培养箱中培养,及时观察其萌发情况。
1.2.2 改进后的分离方法 改进后的分离方法具体操作如下:
(1)用接种针从发病的马铃薯叶片上挑取少许菌丝,在含有200 μL无菌水的2 mL离心管中搅拌数次,待接种针上的菌丝和孢子囊混入无菌水后,用转速为1 500 r/min的涡旋机涡旋30 s,重复2次。随后用血球计数板调整孢子囊悬浮液浓度,将孢子囊悬浮液浓度调整到1个/2 μL。(2)于1片载玻片上放置3个已用75%乙醇灭菌的盖玻片,分别在3个盖玻片上滴1滴孢子囊悬浮液,然后于10×10倍显微镜下镜检,若观测到单个孢子囊,则在液滴上加盖1块0.8 cm×0.8 cm 的黑麦培养基,随后将其转移至灭菌过的空培养皿中,封口。(3)将培养皿放至4 ℃冰箱中低温处理2~3 h,刺激孢子囊释放游动孢子[13],然后转移到11 ℃的环境存放 16~18 h,促进游动孢子萌发[14],最后放置18 ℃的恒温培养箱中培养4~10 d。(4)待萌发的孢子囊在黑麦培养基块上产生菌丝,在超净工作台中将其转移至黑麦培养基平板上培养,于18 ℃恒温培养箱中培养,即可得到由单个孢子囊生长而来的菌株。
2 结果与分析
2.1 单独侵染与多重侵染病斑面积比较
接种后5 d,YN3菌株单独侵染时相对病斑面积约为12%,AS22菌株单独侵染时相对病斑面积约为7%,而将二者按相同的比例混合,进行多重侵染时,相对病斑面积约为24%,相对病斑面积显著增加了近2倍。
2.2 多重侵染单孢子囊分离情况
YN3菌株所占比例为57%,大于AS22菌株所占的43%,这结果符合单独侵染时,YN3菌株的侵染力大于AS22菌株。
2.3 单孢子囊分离结果
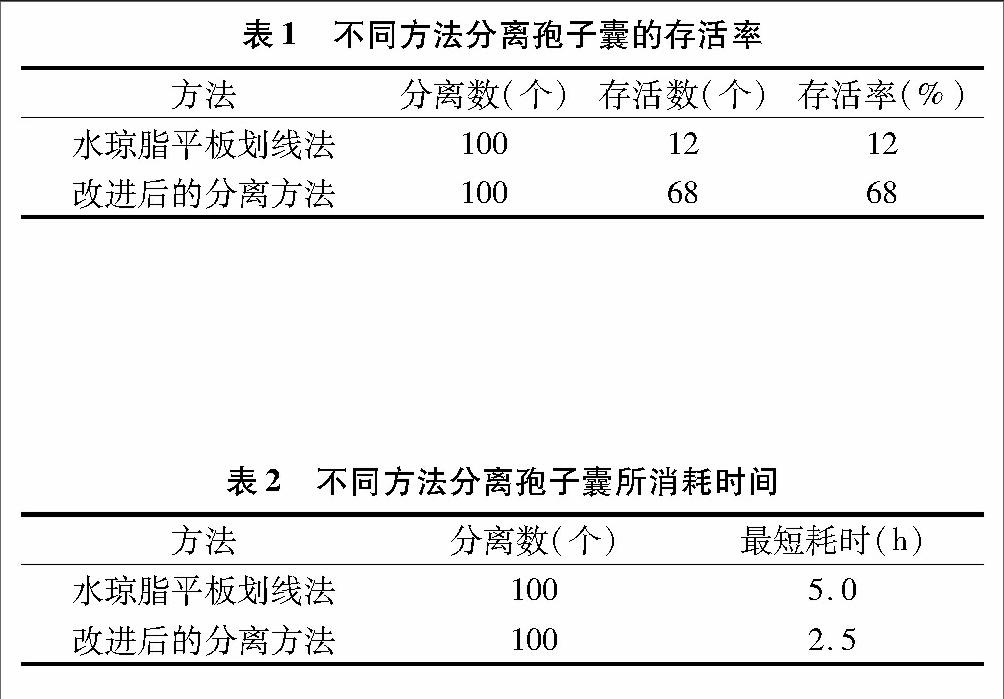
2种单孢子囊分离结果见表1,对同一菌株采用水琼脂平板划线法分离100个孢子囊,最后仅能存活12个分离物,存活率仅为12%;而采用改进后的方法分离100个孢子囊,最后能存活68个分离物,存活率达到了68%,存活率是改进前的5.7倍。
3 讨论
从试验得到的数据来看,将2个不同基因型的马铃薯晚疫病菌混合接种到同一叶片上,在接种量(孢子囊数量)保持一致的条件下,混合侵染后的侵染能力明显大于单独侵染。单独侵染时,YN3的相对病斑面积是AS22的 1.71 倍;混合侵染的叶片上YN3的孢子囊数量是AS22的 1.33 倍。表明单独侵染和混合侵染时,2个菌株毒力的提高大致呈相同比例,也就是说,混合侵染使得2个菌株互相竞争,为了争取更多的生存空间和资源,二者都提高了自身的毒力,使得自身能在竞争中保持竞争力,避免资源被对方完全占据而失去生存空间。
对于混合侵染时病原物的侵染力有何变化,已有众多学者开展了研究[6-8],前人研究结果表明,由于寄主资源有限,混合侵染会使得病原物之间的竞争加剧,从而使得病原物的侵染力提升[4-5]。然而也有一部分试验观察到,混合侵染不仅没有使病原物的侵染力上升,侵染力相比单独侵染时反而下降了[15]。本研究结果表明,混合侵染后病原物的侵染力出现显著的提升,且二者的竞争力关系没有发生显著的改变。有些试验的结论[15]却与之相反,甚至在相同病原物、相同寄主的试验中也出现了这种情况[3]。今后研究要增加病原物的数量,主要是增加侵染力不同的菌株之间的竞争情况,还有多重侵染时会发生什么情况。将来计划除了本试验中使用的2株马铃薯晚疫病菌株,再增加2株侵染力相当,但是与本试验所使用菌株有明显差异的马铃薯晚疫病菌菌株,按两两组合、3个组合、4个组合进行混合侵染,以便得到更为丰富的试验结果。
当前所使用的单孢子囊分离方法——水琼脂平板划线法明显无法满足如此大量的分离工作。目前,针对马铃薯晚疫病菌的单孢分离对象主要有2种,一是分离游动孢子;二是分离孢子囊。因为游动孢子体积极小,只有配制成悬浮液方能分离。但是配制成悬浮液后,因为游动孢子体积太小,且不断在悬浮液中游动,镜检后也很难确定其位置,所以分离难度大。孢子囊相对游动孢子大得多,而且在悬浮液液滴中不易移动,容易镜检确定位置,便于分离。
污染率高、萌发率低是影响单孢子囊分离存活率的两大主要问题。杨志辉等采用单游动孢子的方法分离马铃薯晚疫病菌,平均分离率可高达51.6%[16],如果每个游动孢子都有这样的分离率,一个孢子囊有6个以上的游动孢子[17],完全释放后至少能有3个游动孢子存活。根据上述思路,我们针对单个孢子囊的分离进行改进,用低温刺激的方法促进孢子囊释放游动孢子,进而利用游动孢子的数量来提升存活率。
改进后方法相比较于水琼脂平板划线法,主要改进之处是操作难度降低,工作效率和存活率提高。水琼脂平板划线法首先要镜检,要找到一处只有单个孢子囊的地方,然后还要在显微镜下划线切割,该过程如果操作不当很容易把多余的孢子囊也切割下来。划线切割完成后还要用镊子转移水琼脂块,为了方便镜检,水琼脂平板一般都倒得很薄,所以镊子很容易把水琼脂捏碎,即转移操作难度较大,改进后的方法克服了这一难题。同时,改进后的方法镜检快,只需要检查液滴上是否有单个孢子囊。镜检后操作也很简单,只需要在液滴上加盖1块0.8 cm×0.8 cm的黑麦培养基,再转移到空的培养皿中即可。从实际操作时间来看,改进后的方法大大节省了操作时间,提高了工作效率,为马铃薯晚疫病菌甚至致病疫霉的群体研究带来了极大便利。
参考文献:
[1]Akino S,Takemoto D,Hosaka K. Phytophthora infestans:a review of past and current studies on potato late blight[J]. Journal of General Plant Pathology,2014,80(1):24-37.
[2]Nowicki M,Foolad M R,Nowakowska M,et al. Potato and tomato late blight caused by Phytophthora infestans:an overview of pathology and resistance breeding[J]. Plant Disease,2012,96(1):4-17.
[3]Clement J A J,Magalon H,Glais I,et al. To be or not to be solitary:Phytophthora infestans dilemma for optimizing its reproductive fitness in multiple infections[J]. PLoS One,2012,7(6):e37838.
[4]van Baalen M,Sabelis W. M. The dynamics of multiple infection and the evolution of virulence[J]. American Naturalist,1995,146(6):881-910.
[5]Brown S P,Hochberg M E,Grenfell B T. Does multiple infection select for raised virulence?[J]. Trends in Microbiology,2002,10(9):401-405.
[6]Frank S A. Models of parasite virulence[J]. Quarterly Review of Biology,1996,71(1):37-78.
[7]Davies C M,Fairbrother E,Webster J P. Mixed strain schistosome infections of snails and the evolution of parasite virulence[J]. Parasitology,2002,124(1):31-38.
[8]Staves P A,Knell R J.. Virulence and competitiveness:testing the relationship during inter-and intraspecific mixed infections[J]. Evolution,2010,64(9):2643-2652.
[9]冷伟锋,杨 雪,刘 琦,等. 基于ASSESS图像处理软件的植物病害评估[J]. 中国植保导刊,2014,34(2):10-12.
[10]张书建,何月秋. 介绍一种简单的真菌单孢子分离法[J]. 云南农业大学学报,2003,18(3):315-316.
[11]袁军海,姚裕琪. 马铃薯晚疫病菌单孢分离技术的改进[J]. 植物保护,2002,28(2):58-58.
[12]Caten E C,Jinks J L. Spontaneous variability of single isolates of Phytophthora infestans. Ⅰ. Cultural variation[J]. Canadian Journal of Botany,1968,46(4):329-348.
[13]Latijnhouwers M,Munnik T,Govers F. Phospholipase D in Phytophthora infestans and its role in zoospore encystment[J]. Molecular Plant-Microbe Interactions,2002,15(9):939-946.
[14]Grenville-Briggs L J,Anderson V L,Fugelstad J,et al. Cellulose synthesis in Phytophthora infestans is required for normal appressorium formation and successful infection of potato[J]. Plant Cell,2008,20(3):720-738.
[15]Ben-Ami F,Mouton L,Ebert D. The effects of multiple infections on the expression and evolution of virulence in a Daphnia-endoparasite system[J]. Evolution,2008,62(7):1700-1711.
[16]杨志辉,朱杰华,郭 强,等. 马铃薯晚疫病菌单孢分离物生物学特性的初步研究[J]. 菌物系统,2003,22(1):148-152.
[17]Bohl W H,Hamm P B,Nolte P,et al. Managing late blight on irrigated potatoes in the Pacific Northwest[M]. University of Idaho Cooperative Extension System,2003. 胡彦江,张茹琴. 光照对花生网斑病菌生长、产孢及致病力的影响[J]. 江苏农业科学,2016,44(4):174-176 .
