盐酸右美托咪啶对缺血再灌注肾损伤小鼠的肾小管保护作用
2016-06-07卜林陈艳
卜林,陈艳
(徐州医学院附属医院1.重症医学科,2.肾脏内科,江苏徐州221003)
盐酸右美托咪啶对缺血再灌注肾损伤小鼠的肾小管保护作用
卜林1,陈艳2
(徐州医学院附属医院1.重症医学科,2.肾脏内科,江苏徐州221003)
摘要:目的缺血再灌注肾损伤(IR)是围手术期常见的疾病,本研究通过构建缺血再灌注肾损伤模型,观察右美托咪啶(Dex)注射对受损肾小管的保护作用及机制。方法将60只小鼠随机分为对照组、IR模型组和IR+Dex组(简称Dex组),制备IR模型后24 h分别处死3组小鼠取肾组织。用全自动生化分析仪测定血肌酐(Scr)及尿素氮(BUN)。采用HE染色观察各组小鼠肾组织的形态,评定肾小管损伤程度;免疫组织化学染色测定低氧诱导因子-1α(HIF-1α)、单核细胞趋化蛋白-1(MCP-1)的表达。结果对照组的肾小管结构与形态均正常。IR模型组肾小管损害明显、HIF-1α及MCP-1表达均增高。而Dex组肾小管损害程度较轻,HIF-1α及MCP-1表达均较IR模型组减低,肾小管上皮细胞低氧程度及炎症反应均较IR模型组明显减轻。Dex组小鼠的血肌酐及尿素氮水平较IR模型组明显降低。结论Dex可以通过抑制炎症反应、减轻肾小管上皮细胞低氧程度从而减轻IR小鼠肾小管的损害,保护肾脏功能。
关键词:缺血再灌注损伤;肾小管上皮细胞;右美托咪啶
围手术期急性肾损害(acute kidney injury,AKI)主要由包括手术在内的各种原因引起的肾脏缺血再灌注损伤(ischemia reperfusion injury,IRI)所致,表现为肾小球滤过率急剧减少,出现氮质血症[1]。AKI是围手术期常见的并发症之一,也是重症监护病房(intensive care unit,ICU)常见的急危重症。肾脏缺血再灌注不仅使自身受损,还导致多器官功能障碍。尽管目前诊治手段大大改善,但AKI的发病率和病死率仍居高不下,造成住院时间延长,诊治费用增加,死亡率增高。
右美托咪啶(Dexmedetomidine,Dex)是一种新型的、特异性、高选择性α2肾上腺素能受体激动剂,具有镇静、镇痛、抗交感、稳定血流动力学和利尿作用[2-3],目前主要用于ICU镇静和临床麻醉。本实验通过观察Dex注射对受损肾小管的保护作用及其机制,旨在为临床围手术期防治AKI发生提供新的理论和应用依据。
1 材料和方法
1.1材料
1.1.1动物昆明小鼠60只,清洁级,体重20~25 g,由徐州医学院实验动物中心提供。
1.1.2主要试剂兔抗免疫组织化学染色测定低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)多克隆抗体(美国Santa Cruz公司),β-Tubulin(美国Santa Cruz公司),兔抗单核细胞趋化蛋白1(mononuclear macrophage antigen 1,MCP1)单克隆抗体(Boster Biotechnology公司)。
1.2方法
1.2.1模型制备与分组将60只小鼠随机分为对照组、IR模型组和Dex组,每组20只。对照组:不做任何处理;IR模型组:用1.5%异氟烷诱导麻醉小鼠后将其放置于变温毯上,维持体温(36.0±0.1)℃。常规备皮、消毒。沿腹部正中剪开皮肤,暴露腹白线,沿之剪开后暴露腹腔。轻轻推移肾周组织后分别用微血管夹夹闭左、右侧肾蒂,可以看到两侧肾脏颜色由鲜红变成暗红。然后将肾周组织归位,开放的腹腔用湿纱布覆盖。待双侧肾脏缺血25 min后,移除微血管夹,让肾脏重获血液灌注,可以看到肾脏颜色由暗红变成鲜红。缝合关闭腹腔。24 h后处死小鼠,取出肾组织备检。Dex组:在IR模型组中肾脏获得再灌注后立即给予腹腔注射Dex 25.0μg/kg。
1.2.2肾组织形态学检查常规石蜡包埋,组织切片进行苏木素-伊红(hematoxylin-esosin,HE)染色,光学显微镜观察。肾小管损伤程度分析:每个标本随机选取10个视野,每个视野分别测量肾小管间质相对面积,按照DJUDJAJ等[4]方法,按肾小管损伤程度将组织学评分分为0~3:0=正常肾组织;1=中等程度损伤;3=肾小管坏死病变。进行组织学评分。
1.2.3HIF-1α及MCP1的表达标本石蜡包埋,连续切片,厚度3μm。贴附于载玻片上,60℃烤箱烘烤3 h。常规脱蜡至水后,分别经3%过氧化氢H2O2封闭,消除内源性过氧化物酶的活性。一抗:兔抗HIF-1α多克隆抗体(1∶100)、兔抗MCP1单克隆抗体(1∶100);二抗:IgG即用型M.0.M.TM免疫组织化学试剂盒,按ABC法进行染色,DAB显色。均采用PBS缓冲液代替一抗作为阴性对照。每张切片随机选取5个高倍视野(×400),利用Image-Pro Plus 6.0软件计算其积分光密度值(integral optical density,IOD),取其平均值。
1.2.4Western blot检测HIF-1α表达取新鲜肾组织加裂解液后匀浆、离心、取上清液测蛋白浓度。聚丙烯酰胺凝胶电泳、转膜、封闭,加一抗、二抗,显色剂显色处理。以β-Tubulin为参照,测定HIF-1α蛋白的相对表达量,即各组HIF-1α/β-Tubulin ratio值之间比较。
1.2.5肾功能变化在处死小鼠同时每只取静脉血2 ml,在高速离心机上离心,吸取血清,在全自动生化分析仪上检测BUN及Scr。
1.3统计学方法
采用SPSS13.0统计软件进行数据分析,计量资料用均数±标准差(±s)描述;组间均数比较采用单因素方差分析。以α=0.05为检验水准,当P<0.05时,差异有统计学意义。
2 结果
2.1肾脏形态学变化
各组小鼠肾组织HE染色显示:对照组小鼠肾组织结构形态正常;IR模型组出现不同程度的肾小管扩张萎缩、空泡变性,肾小管上皮细胞扁平、核染色缺失、炎症细胞浸润;Dex组小鼠肾脏组织病理改变较IR模型组明显减轻。见图1。
各组小鼠肾脏组织组织学评分结果显示:对照组(0.23±0.01),IR模型组(4.46±0.11),Dex组(1.51± 0.04),3组间比较差异有统计学意义。见图2。
2.2肾组织HIF-1α免疫组织化学染色
对照组肾小管上皮细胞基本正常,HIF-1α表达微弱。IR模型组肾小管上皮细胞低氧严重,HIF-1α表达显著增多。Dex组小鼠肾脏组织病理改变较IR模型组明显减轻,HIF-1α表达较IR模型组显著减少。见图3。
各组小鼠肾组织HIF-1α染色IOD值比较,IR模型组肾小管HIF-1α大量表达,而Dex组HIF-1α较IR模型组表达显著减少。3组标本IOD值间比较差异有统计学意义。见图4。
2.3肾组织MCP1免疫组织化学染色
对照组肾小管上皮细胞基本正常,MCP1表达微弱。IR模型组肾小管损伤严重,炎症细胞浸润,MCP1表达显著增多。Dex组小鼠肾脏组织病理改变较IR模型组显著减轻,MCP1表达较IR模型组显著减少。见图5。
与对照组比较,IR模型组肾小管MCP1大量表达(P=0.042)。而Dex组MCP1较IR模型组表达显著减少(P=0.031)。3组标本IOD值间比较差异有统计学意义。见图6,表1。
2.4HIF-1α蛋白表达
对照组HIF-1α蛋白表达微弱,IR模型组HIF-1α蛋白大量表达,而Dex组HIF-1α蛋白表达水平较IR模型组显著降低。见图7。

图1 各组小鼠肾组织HE染色(×40)
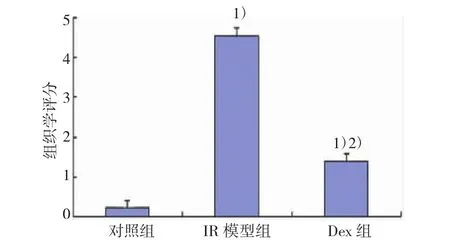
图2 各组小鼠肾小管损伤程度组织学评分

图3 各组小鼠肾组织HIF-1α染色(×40)

图4 各组小鼠肾组织HIF-1α染色IOD值比较

图5 各组小鼠肾组织MCP1染色(×40)

图6 各组小鼠肾组织MCP1染色IOD值比较
各组HIF-1α/β-Tubulin ratio值之间比较:对照组HIF-1α蛋白表达微弱,HIF-1α/β-Tubulin ratio值小,IR模型组HIF-1α蛋白大量表达,HIF-1α/β-Tubulin ratio值显著增加,而Dex组HIF-1α蛋白表达水平较IR模型组显著降低,差异有统计学意义(P<0.05)。见图8。
2.5肾功能变化
双肾缺血25 min再灌注24 h后,血浆肌酐水平从(30.62±2.55)μmol/L升高至(78.34±5.17)μmol/L(P =0.004),血尿素氮水平从(6.26±0.34)mmol/L升高至(23.39±4.15)mmol/L(P=0.006)。缺血再灌注后应用Dex 25μg/kg,可显著改善IR之后的肾功能,肌酐(54.09±3.27)μmol/L(P=0.035);尿素氮(18.33±4.07)mmol/L(P=0.023)。见表2。
表1 各组小鼠24 h免疫组织化学IOD值比较(n=20,±s)

表1 各组小鼠24 h免疫组织化学IOD值比较(n=20,±s)
注:1)与同期对照组比较,P<0.05;2)与同期IR模型组比较,P<0.05
组别 MCP1(×103)对照组 1.82±0.02 IR模型组 7.62±0.131)Dex组 3.87±0.052)HIF-1α(×103)0.15±0.03 0.75±0.121)0.41±0.062)
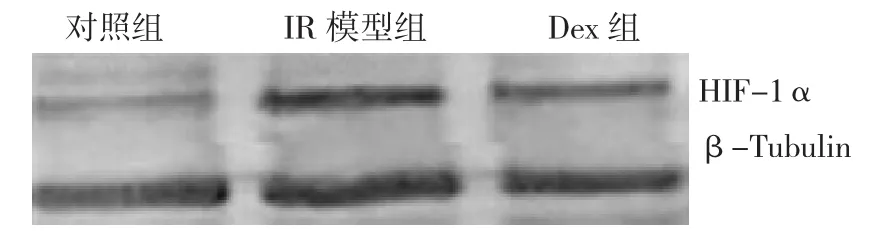
图7 各组小鼠肾组织HIF-1α蛋白表达
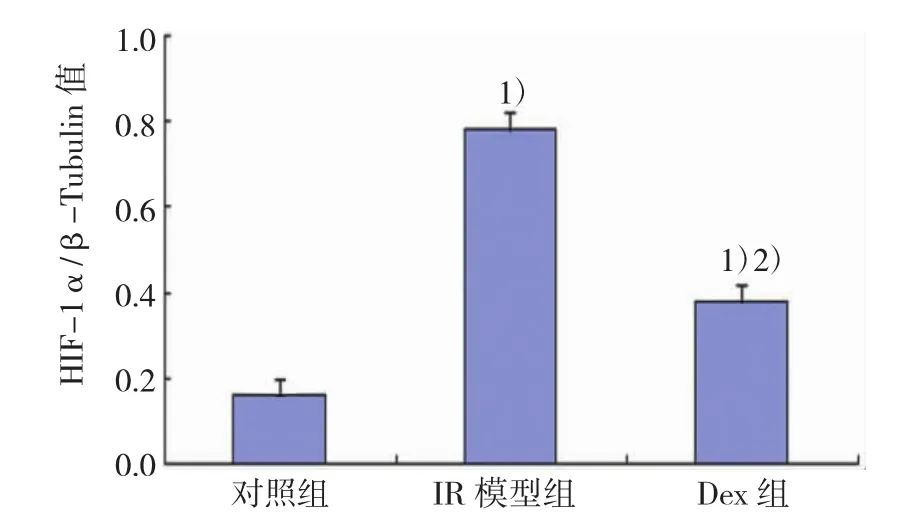
图8 各组小鼠肾组织HIF-1α蛋白表达比较
表2 24 h后3组小鼠血肌酐及尿素氮比较(n=20,±s)

表2 24 h后3组小鼠血肌酐及尿素氮比较(n=20,±s)
注:1)与同期对照组比较,P<0.05;2)与同期IR模型组比较,P<0.05
组别 BUN/(mmol/L)对照组 6.26±0.34 IR模型组 23.39±4.151)Dex组 18.33±4.071)2)Scr/(μmol/L)30.62±2.55 78.34±5.171)54.09±3.271)2)
3 讨论
肾脏缺血再灌注损伤是一个复杂的过程,休克、体外循环术后、围产期窒息等过程常发生肾缺血性损伤,严重者将导致急性肾功能衰竭的发生,也是患者入住ICU的主要原因。肾IR损伤病变的本质包括肾小管可逆性非致死性功能障碍和致死性损伤[5]。近年来,研究认为,凋亡和炎症反应在肾IRI的病理生理过程中占有核心地位[6]。HUANG等[7]认为,炎症反应是IRI最为主要的特征之一。而剧烈的炎症反应导致急性肾小管坏死,坏死后的小管碎屑作为一种危险信号在循环中进一步激发炎症反应,使肾小管上皮细胞处于缺氧状态。因此,针对急性肾损伤的早期抗炎治疗具有重要的价值[8]。
Dex是新一代α2AR激动剂,分布半衰期为约5 min,消除半衰期约2 h,不良反应相对轻且少。临床上主要作为手术麻醉辅助药和ICU镇静。此外,Dex还具有镇痛、抑制交感兴奋、抗焦虑、稳定血流动力学和利尿效应[3]。BILLINGS等[9]研究发现,Dex可以维持小鼠肾髓质血流从而防止造影剂肾病发生。KOCOGLU等[2]在肾缺血再灌注损伤大鼠研究中发现,Dex预处理可降低肾缺血再灌注损伤,提高肾脏对缺血的耐受性。因此,笔者推测,Dex能够通过减轻肾损伤后炎症反应、阻止肾小管上皮细胞凋亡加剧从而降低缺血再灌注后肾损伤的程度。
本实验通过HE染色发现,对照组小鼠肾组织结构形态正常,而IR模型组出现不同程度的肾小管扩张、萎缩、空泡变性,肾小管上皮细胞扁平、核染色缺失、炎症细胞浸润。但Dex组小鼠肾脏组织病理改变较IR模型组明显减轻。说明Dex本身对肾脏不会造成损伤,Dex能够减轻IR后受损肾脏的病变程度,从一定程度上维持肾脏结构与形态的稳定,进而改善肾脏功能。
HIF-1α是迄今为止发现的唯一一个在缺氧状态下发挥活性的特异性转录因子,是细胞低氧的可靠标记物,是反映低氧状态的一个敏感指标[10]。HAUCK等[11]认为,缺氧导致细胞死亡的主要方式是通过诱导细胞凋亡来实现的。细胞内氧浓度对HIF-1α的表达进行着精细的调节,随着氧浓度的下降,其表达增加。本研究发现,对照组HIF-1α表达较微弱,IR模型组HIF-1α大量表达,而Dex组HIF-1α较IR模型组表达显著减少。说明Dex能够减轻肾IR后受损肾小管上皮细胞低氧状态,从而减轻肾脏损害。
MCP1是趋化因子CC亚家族中的一员,在正常情况下肾组织中仅有少量表达。然而,在病理状态下,MCP1在肾小管间质中可广泛表达。刘雷等[5]认为,MCP1启动并放大炎症反应过程,在肾IRI中发挥重要作用。本实验通过研究发现,对照组MCP1表达较微弱,IR模型组MCP1大量表达,而Dex组MCP1蛋白表达水平较IR模型组显著减少。说明Dex能够通过减轻IR后肾组织炎症反应,从而保护肾脏功能。从表2可以看出,Dex组小鼠肾功能较IR模型组明显改善。
IR的炎症反应始于缺血阶段,再灌注之后补体系统被激活,引发后天免疫系统的级联反应,促进炎症的发展[8],炎症反应的发展可能会导致肾小管上皮细胞处于缺氧状态加剧。因此,针对ARF/AKI的早期抗炎治疗具有重要的价值。通过以上研究结果,笔者推测Dex参与肾脏IRI后的病理生理过程,主要通过下调MCP1和HIF-1α的表达,从而减轻肾脏炎症反应,降低肾小管上皮细胞缺氧程度,进而保护肾脏功能。希望能够为临床早期防治IR后肾损伤及其他脏器损伤提供新的治疗思路。
参考文献:
[1]BORTHWICK E,FERGUSON A. Perioperative acute kidney injury:risk factors,recognition,management and outcomes[J]. BMJ, 2010,341:c3365.
[2]KOCOGLU H,OZTURK H,OZTURK H,et al. Effect of dexmedetomidine on ischemia-reperfusion injury in rat kidney:a histopathologic study[J]. Ren Fail,2009,31(1):70-74.
[3]CAROLLO DS,NOSSAMAN BD,RAMADHYANI U. Dexmedetomidine:a review of clinical applications[J]. Curr Opin Anaesthesiol,2008,21(4):457-461.
[4]DJUDJAJ S,CHATZIANTONIOU C,RAFFETSEDER U,et al. Notch-3 receptor activation drives inflammation and fibrosis following tubulointerstitial kidney injury[J]. J Pathol,2012,228(3):286-299.
[5]刘雷,孟建中.单核细胞趋化蛋白-1对缺血再灌注肾损伤的影响机制[J].国际移植与血液净化杂志. 2007,5(5):18-20.
[6]DAEMEN M A,DE VRIES B,BUURMAN W A. Apoptosis and inflammation in renal reperfusion injury[J]. Transplantation,2002,73(11):1693-1700.
[7]HUANG Y,RABB H,WOMER K L. Ischemia-reperfusion and immediate T cell responses[J]. Cell Immunol,2007,248(1):4-11.
[8]THURMAN J M. Triggers of inflammation after renal ischemia/reperfusion[J]. Clin Immunol,2007,123(1):7-13.
[9]BILLINGS F T,CHEN S W,KIM M,et al. Alpha2-adrenergic agonists protect against radiocontrast-induced nephropathy in mice[J]. Am J Physiol,2008,295(3):741-748.
[10]STRAVODIMOS K G,KORITSIADIS G,LAZARIS A C,et al. Hydronephrosis promotes expression of hypoxia-inducible factor 1 alpha[J]. Urol Int,2009,82(1):38-42.
[11]HAUCK I,HANSMANN,DIETZ R,et al. Inhibition of hypoxis-induced apoptosis by modulation of retinlblastoma protein-dependent signaling in cardiomyocytes[J]. Cire Res,2002,91(9):782-789.
(张蕾编辑)
论著
Protective effect of Dexmedetomidin on kidney injury induced by renal ischemia-reperfusion and its mechanism
Lin Bu1,Yan Chen2
(1. Intensive Care Unit,2. Department of Nephrology,the Affiliated Hospital,Xuzhou Medical College,Xuzhou,Jiangsu 221003,China)
Abstract:Objective To establish a mouse model of ischemia-reperfusion injury(IRI)and to investigate the protective effects of Dexmedetomidine(Dex)injection on renal tubules,so as to provide new available methods for acute kidney injury(AKI). Methods Sixty female mice were randomly divided into three groups∶control group,renal IRI group and Dex group,with 20 mice in each group. The mice were sacrificed at the 24th hour after surgery,then the bilateral kidneys and blood samples were collected. The blood urea nitrogen(BUN)and serum creatinine(Scr)were measured by automatic biochemistry analyzer. HE staining was used to observe the pathology of the kidneys. Immunohistochemistry and Western blot were used to detect the expression of hypoxia inducible factor-1α(HIF-1α)and monocyte chemoattractant protein-1(MCP-1). Results There was no significant changes of renal tubules in the control group. In the renal IRI group,renal tubular epithelial cells were obviously damaged,and their expressions of HIF-1α and MCP-1 noticeably increased. However,renal tubular injury in the Dex group was lighter than that of the IR group;the expressions of HIF-1α and MCP-1,the hypoxia degree and inflammatory reaction of renal tubules as well as the levels of BUN and Scr of the Dex group were lower than those of the IR group. Conclusions It maybook=2,ebook=7be naturally speculated that Dex can protect renal function through reducing inflammatory reaction and hypoxia degree of damaged renal tubular epithelial cells following renal IR.
Keywords:ischemia-reperfusion;tubular epithelial cell;Dexmedetomidin
中图分类号:R692;R-332
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.10.001
文章编号:1005-8982(2016)10-0001-05
收稿日期:2015-11-23
