沉积物再悬浮对浅水湖泊沉水植物光合作用及生长影响的研究进展
2016-06-05谷娇宁晓雨靳辉何虎朱小龙谈冰畅李宽意
谷娇, 宁晓雨, 靳辉,2, 何虎, 朱小龙,2, 谈冰畅, 李宽意,*
1. 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 21008
2. 江南大学, 无锡 214122
沉积物再悬浮对浅水湖泊沉水植物光合作用及生长影响的研究进展
谷娇1, 宁晓雨1, 靳辉1,2, 何虎1, 朱小龙1,2, 谈冰畅1, 李宽意1,*
1. 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 21008
2. 江南大学, 无锡 214122
沉水植物是水生态系统中重要的初级生产者, 其生长和分布受到诸多环境因子的影响。文章综述了沉积物再悬浮对沉水植物影响的研究进展, 总结了沉积物再悬浮对湖泊沉水植物光合作用、生长发育、繁殖等方面存在的影响, 并对存在的问题与今后的研究方向进行了探讨和展望。
沉积物再悬浮; 沉水植物; 光合作用; 生长
1 前言
风浪或鱼类扰动造成的沉积物再悬浮是大型浅水湖泊中普遍存在的现象。例如: 张运林等[9]通过野外调查发现太湖沉积物悬浮的临界风速在5—6.5 m·s-1之间(四级风), 一旦超过临界风速, 底部沉积物就会发生大规模的再悬浮。沉积物再悬浮打破了沉积物—水界面的物质平衡, 增加了水体悬浮颗粒物浓度, 对湖泊生态系统产生较大影响[10-11]。就沉水植物而言, 沉积物再悬浮改变了水下光照条件,从而影响到植物的光合作用[12]; 还可能改变沉水植物与水体间气体、营养物质的交换, 降低溶解无机碳的供应,从而影响沉水植物的生长、繁殖与分布[13-14]。本文综述了沉积物再悬浮对沉水植物光合作用和生长发育等生理生态方面的影响, 以期为沉水植物生理生态学研究及沉水植被的恢复与重建提供科学参考。
2 沉积物再悬浮的发生机制及其对水体环境状态的影响
2.1 沉积物再悬浮的发生机制
自上世纪80年代起, 国内外学者就开始对再悬浮这一现象的发生机理进行了关注, 研究发现, 影响沉积物再悬浮的因素主要包括自然因素(风、波浪、潮流等)、生物扰动(蛤类、水丝蚓等)、人为活动(船舶运输、清淤、挖掘采沙、拖网捕鱼等)以及底质条件(床面形态、沉积物中值粒径、容重等)。因此,外力干扰是沉积物再悬浮的动力来源。当外力干扰产生的切应力达到可搬动沉积物颗粒的程度时再悬浮发生, 这时的切应力是沉积物再悬浮的临界切应力。不同强度的外力干扰在沉积物表面产生的切应力大小不同, 切应力越大, 沉积物再悬浮的强度越大。沉积物再悬浮量与切应力间的关系可用如下关系式描述:
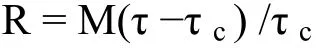
其中, R(kg·m-2·s-1)为沉积物再悬浮过程中进入水体中的颗粒物通量; τ(N·m-2)为干扰在水体沉积物表面产生的切应力; τc(N·m-2)为沉积物颗粒发生再悬浮的临界切应力; M(kg·m-2·s-1)为沉积物再悬浮系数。M值的大小取决于沉积物性质, 包括沉积物类型、组成、密度及厚度以及环境因素。当τ<τc时, 沉积物颗粒不会发生再悬浮; τ>τc时, 沉积物颗粒发生再悬浮, 且进入水体的颗粒物量随着切应力的增加而线性增加。国内秦伯强等[15-16]在野外调查观测与实验室试验分析的基础上, 发现太湖中沉积物悬浮主要是由波动作用引起的, 太湖水土界面处物质交换主要发生在沉积物表层5—10 cm范围内, 在所有观测时刻中, 切应力最大为0.07 N·m-2。此外, Hawley[17]对在几个不同风暴影响下所计算出的最小切应力为0.071 N·m-2, 而其认为一般情况下能引起悬浮的临界应力为0.1 N·m-2。研究表明湖泊沉积物再悬浮的临界切应力一般在0.01—0.1 N·m-2之间。
2.2 沉积物再悬浮改变水体环境状态
中国某物流集团高管则给出了自己的判断。他认为,中美贸易战会对中国的家具行业、高新行业、机械行业、钢铁行业、纸制品行业以及服装行业造成重大影响,这些行业的进出口会受到严重影响。
浅水湖泊沉积物再悬浮影响水生态系统的物理和生物过程,比如降低水体透明度与真光层深度等,并对湖泊物质循环产生重要影响。如果湖泊沉积物是被污染的, 再悬浮还会增加水体有害物质的浓度,影响到整个生态系统[18]。
沉积物再悬浮加剧了营养盐输出从而对湖泊物质循环产生重要影响。有研究表明沉积物再悬浮促进了磷酸盐由沉积物向水体中的扩散, 其释放量和悬浮颗粒物含量呈正比[19]; 同时还会释放大量氨氮,其量级接近沉积物-水界面氨氮的扩散通量[20], 并且由于NO2--N是NH4+-N和NO3--N之间的一个中间产物,所以其变化受多种因素和过程的影响, 主要与沉积物中有机质的降解和间隙水中营养盐的分子扩散作用等有关。钱嫦萍等[21]模拟研究了崇明东滩沉积物再悬浮对沉积物-水界面N、P交换行为的影响, 发现再悬浮促进了沉积物中三态氮和无机磷的释放, 使上覆水体中N、P含量升高。Søndergaard等[22]通过对Arreso湖(丹麦, 面积41 km2, 平均水深3 m)的野外调查发现, 动力悬浮导致湖泊营养盐浓度增加, 可以达到原先浓度的20—30倍数量级。Gons等[23]通过对一个小型富营养化湖泊的再悬浮作用研究发现,再悬浮过程中向水体输入的颗粒有机碳是浮游植物白天固定碳的12—15倍。
沉积物再悬浮还增加了上覆水体中的颗粒态和水溶态重金属浓度。Kalnejais等[24]发现当干扰产生的切应力超过临界切应力导致沉积物再悬浮后, 随着切应力的增大上覆水体中颗粒态重金属含量快速增加, 其中Ag、Cu、Pb在最初再悬浮颗粒物中的质量分数最高, 富集程度最大, 之后随着切应力的增加而降低, 直至与沉积物本底值相近。除此之外,再悬浮使还原态沉积物暴露于有氧环境, 沉积物中有机质结合态重金属因有机质氧化降解而释放是另一个重要的沉积物再悬浮-重金属释放途径[25]。不同金属硫化物的稳定性和氧化速率不同, 再悬浮引起的沉积物硫化物氧化-释放各种重金属的速率亦不同。短期再悬浮实验表明, FeS和MnS在短时间(几分钟)内就能迅速被氧化, 而ZnS、CuS、PbS和CdS在几个小时内能保持相对稳定[26], 而且沉积物金属硫化物氧化后Zn的释放速率低于Pb和Cu, Cd的释放又比Cu和Zn延迟很多[27-28]。因此, 沉积物再悬浮导致重金属由相对稳定的结合态向易于生物利用的形态转变,增加了水体中重金属的生物有效性及毒害风险。
随着城市化、工业化以及农业现代化的不断发展,全球大部分的河、湖和海洋中杀虫剂、PCBs、PAHs以及其他有害化学元素含量急剧上升。由于沉积作用,水底沉积物成为这些污染物载体。而这些被污染的沉积物在水动力条件(潮汐、风、波浪、地震、航运、疏浚工程等等)和生物扰动作用(底栖、钻孔等)下又可被扬起发生再悬浮,吸附在悬浮沉积物上的污染物质由无氧环境进入有氧环境中将会被再一次释放出来,对水环境造成二次污染。已污染沉积物的再悬浮已被确认为是有机污染物(PAHs, PCBs和类醇)、放射性元素、一些微量金属元素以及营养盐等迁移和输送的一个重要过程。
3 沉积物再悬浮抑制沉水植物光合作用
3.1 沉积物再悬浮导致水下光强减弱
悬浮颗粒物通过吸收和散射作用影响水下光量。悬浮颗粒物增加了对光的吸收, 致使漫射衰减系数增加, 其中以非藻类颗粒物的吸收占主导, 一般超过40%, 总吸收对漫射衰减的贡献也在40%以上[29]。此外, 悬浮颗粒物还增强光的散射, 湖水中悬浮物粒径越大, 散射和消光系数越大, 对湖面反照率的贡献也越大。悬浮物质对水下光量的吸收、散射作用增加了湖水光学衰减系数, 降低了湖水透明度和真光层深度, 使得混浊水体中的光强随水深和浊度的增加而明显降低[30]。秦伯强和张运林等[31]通过水动力模拟实验研究发现, 风浪扰动引起水中悬浮物增加是改变水下光照分布的主要原因, 受动力扰动后悬浮物浓度增加、水体光学衰减系数从静止时的1 m-1增加到小水流时的2 m-1和大水流4 m-1,真光层深度也由最初的 4 m 降到 2 m 和 1 m。
沉积物再悬浮不仅会使光量衰减, 还会使光质发生显著变化。在浑浊水体中, 长波光如远红光(FR)被吸收, 造成红光/远红光(R:FR)比值增加; 同时光又被散射, 短波光(紫外光和蓝光)也被吸收, 导致此类水体中绿光穿透性强。张运林等[32]对长江中下游湖泊龙感湖的野外观测中发现, 在小风和中风浪作用下, 衰减系数最小值出现在580 nm附近的绿光波段, 大风浪时最小值则出现在700 nm的红光波段。
3.2 沉积物再悬浮影响沉水植物光合作用
沉积物再悬浮增加了水体浊度, 导致水下光照强度减弱[33], 从而影响植物的光合作用[34]。叶绿素荧光参数是评估叶片光合机构PSII的指标。沉积物再悬浮会导致植物叶片叶绿素含量、叶绿体光合作用过程中PSII活性( 光合作用有效量子产量)、光合速率均呈下降趋势, 这可能是由于植物可利用光能减少、出现光谱缺失, 以至相应的色素和光合元件发育停滞[35-36]。并且最大量子产量(Fv/Fm)值的降低随水体浊度的增加呈增加趋势, 高浊度水体还导致吸收的光能用于光化学电子传递的份额(qP)减少, PSII中开放的反应中心比例和参与CO2固定的电子数降低[37]。另外, 电子在光合链中的传递速率(ETR)随水体浊度升高显著下降, 导致参与CO2固定的电子减少, 叶片的电子库 (卡尔文循环)以及固定的CO2量也逐渐减少, 最终光合作用暗反应所需的能量和还原力减少, 光合作用降低。
水体浊度对沉水植物光合机构PSII的影响还体现在叶片对光的响应能力上, 即植物的快速光响应曲线(RLC)。快速光响应曲线(RLC)为电子传递速率随光强的变化曲线,以反映叶片的实际光化学效率。有实验证明, 随溶液悬浮泥沙浊度的升高植株光响应能力呈显著下降趋势。李强等[38]发现不同浊度中植株的最大相对电子传递效率(ETRmax)出现显著差异, 表现出对照>30 NTU>60 NTU>90 NTU的趋势; 萌发苗的最小饱和光照强度(EK)随水体浊度的增加呈下降趋势, 在对照和30 NTU水体中为500 (μmol photon·m-2·s-1), 而在60、90 NTU水体中下降至174 (μmol photon·m-2·s-1), 说明水体浊度导致了萌发苗光响应能力的显著降低。
沉积物再悬浮对沉水植物的影响并非只是遮光作用, 还可能导致沉水植物与水体间气体、营养物质交换的改变, 不利于植物光合系统的发育[13]。悬浮颗粒物附着在植物叶片表面会使植物体内ATP含量大幅上升, 增强叶器官的呼吸作用[39]。因为沉水植物为维持正常生命活动所需要的能量,不得不增强呼吸作用, 提高氧化磷酸化, 从而消耗大量光合产物, 减少了其用于形态建成和繁殖的物质支出,最终影响其种群的扩展, 这也是湖泊沉水植物种群退化的重要机制之一。另外, 附着在叶片上的悬浮颗粒还会干扰CO2的交换, 加上覆盖层阻挡光线,使光合强度下降, 淀粉生成减少。Ruiz和Romero[40]研究发现, 水体混浊度增加造成的光照强度下降能够限制大洋聚伞藻(Posidonia oceanic)的光合作用,并造成其地下茎光合产物-淀粉的含量下降。
4 沉积物再悬浮影响沉水植物生长
4.1 水体浊度升高抑制沉水植物生长繁殖
沉积物再悬浮对沉水植物生长的影响主要表现在对沉水植物萌发率、株高、叶片数、生物量等方面, 而这些影响主要是由沉积物再悬浮增加水体浊度、降低水下光强所致。
水体浊度会影响沉水植物萌发速率以及幼苗的生长发育。李强等[41]发现随着水体浊度的增加以及光照强度的下降, 菹草(Potamogeton cripus)萌发率、萌发苗株高和叶片数均显著降低, 并且浊度越高、时间越长, 抑制作用越明显, 叶片上部颜色变淡、发黄, 甚至导致地上部分叶片完全腐烂(视为死亡)。王文林等[42]研究表明, 当水体浑浊度≥120 NTU超过10 d, 菹草幼苗的生长就会表现出明显的抑制, 更长时间的胁迫(80 d)则造成菹草幼苗的大量死亡。潘国权等[17]认为在低浊度水体中, 苦草幼苗短期内具有对低光逆境的适应而会出现幼苗叶长和叶片数增加的现象, 且具有较高的光能利用率, 然而随着处理时间的延长和水体浊度的增加, 也会出现以上抑制生长的现象。
水体浊度还对沉水植物成体植株的生物量有重要影响。谢贻发等[43]通过室内模拟实验发现, 在有沉积物再悬浮的处理组中, 苦草和马来眼子菜(Potamogeton malaianus)的总生物量、地上部分生物量、地下部分生物量分别降低了35%、30%、45%和31%、27%、52%, 显著低于没有沉积物再悬浮的对照组中的生物量。刘伟龙等[44]研究马来眼子菜生物量在不同水域的变化特征时发现, 浊度低、透明度高的水体中, 马来眼子菜分布的密度和生物量均高于浊度高、透明度低的水体; 马来眼子菜匍匐于水面的茎叶形成的冠层与水体透明度显著负相关, 85%的叶片分布在透明度范围以内。苦草的分蘖组织分布在叶子的基部, 植株完全分布于水体中, 苦草叶片生长最活跃的部位是在叶片下端2 cm处, 相对于马来眼子菜更容易受到沉积物再悬浮的影响。而马来眼子菜具有顶端分裂组织, 叶片非常接近水面, 一旦马来眼子菜初始的繁殖体有足够的能量使顶端分生组织到达水面, 那么即使到达植株基部的光照不足, 其主要的生长组织也可以在光线充足的环境下生长。
水体浊度除了影响沉水植物的生长外, 对其繁殖也有抑制作用。对于克隆植物, 子株与母株之间有联系的通道, 它们通过通道可以进行物质交换。因此, 母株的生长状况可以影响到其克隆繁殖。一旦水下光照减弱, 母株生长受到抑制, 克隆繁殖也将受到影响。已有实验验证, 有沉积物再悬浮的处理组中植株分蘖少, 块茎数量也比对照组减少了44%[51]。
4.2 水体营养盐浓度增加影响沉水植物生长
沉积物再悬浮也是导致湖泊中营养物质释放的主要动力之一[45], 悬浮过程中由于吸附-解吸作用造成营养盐在沉积物和水体间迁移, 沉积物孔隙水中的营养盐也因此得以释放, 导致上覆水中营养盐浓度突然上升, 继而影响沉水植物的生长繁殖。
水体营养盐浓度过高会对沉水植物生长产生直接毒害作用。已有研究表明, 铵态氮是沉水植物生长所需要的重要营养物质, 但是高浓度的铵态氮对沉水植物的生长有抑制作用, 甚至会直接导致其消亡[46]。由于过量的NH4+-N抑制了Mg2+的吸收和运输,沉水植物叶片的可溶性蛋白含量显著下降, 会抑制植物的光合作用、破坏植物的光合作用系统[47]。另外, 高浓度的铵态氮会诱导沉水植物产生氧化应激,诱导植物体内抗氧化酶SOD、POD、CAT等活性发生变化,使植物体受到氧化损伤且导致植物体内碳氮代谢的不平衡[48-50]。颜昌宙等[51]比较研究了不同浓度0.5、1、2、4、8、16 mg·L-1的氨氮对轮叶黑藻(Hydrilla verticillata)的生理生化影响, 发现当浓度超过4 mg·L-1时, 轮叶黑藻的叶绿素、可溶性糖和蛋白质含量在第24天有明显降低,表明植物机体光合能力降低、代谢受到干扰。
高营养盐浓度还会通过促进浮游藻类、附着藻类生长对沉水植物产生间接影响[52]。首先, 某些浮游藻类在生长过程中释放出来的毒素, 会对沉水植物的生长与发育产生抑制作用[53]。浮游藻类产生的化感物质会抑制沉水植物叶绿素的合成[54]、阻断叶片内光电子的传递, 从而抑制了沉水植物的光合作用[55-56], 并且这种抑制作用会随着水体营养盐浓度的增加而增大[57]。其次, 浮游藻类、附着藻类通过遮光作用, 使沉水植物无法获得生长所必需的光[58],并在植物表面形成一个高O2、高pH、低CO2的环境,从而抑制了沉水植物的光合作用, 是沉水植被在富营养化水体中退化的关键因子[59-60]。Roberts等[61]研究表明, 附着生物对光合有效辐射的吸收可高达80%以上, 它们减少到达宿主植物表面的光合有效辐射, 直接影响宿主的光合速率, 进而影响宿主植物的生长。最后, 浮游藻类与附着藻类还与沉水植物竞争营养成分, 抑制沉水植物的生长。附着生物层阻碍宿主植物对水柱中营养盐的吸收利用, 尤其是对无机碳的吸收利用, 也会影响宿主植物的光合作用[62]。
4.3 水体重金属污染毒害破坏沉水植物生理生态结构
由于表层沉积物往往是重金属物质的载体, 在外力作用下沉积物可悬浮颗粒物常发生再悬浮,使上覆水体中的颗粒态和水溶态重金属浓度提高, 造成水体次生污染, 对水生植物产生直接的作用[63-64]。
水体重金属浓度提高对沉水植物的毒害作用,首先表现在影响沉水植物的形态和显微结构特征方面。不仅会使叶绿体的类囊体排列紊乱, 线粒体成空泡状, 还会使细胞核核膜断裂, 核仁散开。而叶绿体是光合作用的主要器官, 被膜断裂和解体必将极大削弱植物光合作用的效率。线粒体作为细胞的“动力站”, 前人研究认为空泡化会造成其全部功能的丧失, 核膜断裂和染色质散出也将使细胞核丧失正常的调控功能。王模善等[65]研究了重金属镉对3种沉水植物的影响, 发现随着镉浓度的增加和处理时间的增长, 3种植物逐渐表现出受毒害反应, 而且受毒害程度越来越深,具体表现为植物外观不健康、萎蔫,逐渐出现失绿、变黄现象,严重时植株断裂, 直至死亡。施国新等[66]研究证实, Cr6+、As3+对细胞的膜结构与非膜结构都产生毒害作用, 轮叶黑藻叶细胞随着毒害程度的加重, 核仁消失, 核膜破裂, 叶绿体和线粒体解体, 质壁分离使胞间连丝拉断, 最后细胞死亡。
其次, 重金属还会影响沉水植物抗氧化相关的酶活性变化[67-68]。POD, CAT是植物体内酶促防御系统的3个重要保护酶。其中SOD能清除O2, 形成H2O2, POD和CAT协同作用形成H2O。三者协调一致,能有效的阻止O2、H2O2在植物细胞内的累积, 使生物自由基的产生和清除维持动态平衡, 从而防止自由基毒害。但当重金属浓度过高时, 它们对活性氧的清除能力已大大削弱, 已经不能阻止自由基在细胞内的过量累积, 因此, 自由基不可避免的将对膜系统造成膜脂过氧化作用, 导致细胞代谢紊乱。陈愚等[69]认为一定浓度的镉能诱导沉水植物的硝酸还原酶活性, 抑制超氧化物歧化酶活性, 从而破坏沉水植物的抗氧化防御系统。
最后, 沉积物再悬浮引起水体重金属浓度提高还会影响沉水植物的叶绿素、蛋白质、光合与呼吸作用等生理生化特征[70]。重金属离子进入植物体内干扰了离子间原有的平衡系统, 造成正常离子的吸收、运输、渗透和调节方面的障碍, 从而使代谢紊乱; 另外, 较多的重金属有毒离子进入植物体内后,与某些酶蛋白的非活性基团结合使其变性, 或者取代某些酶和蛋白质行使功能时所必需的特定元素。高浓度重金属含量还会影响植物叶绿素, 导致植物缺绿, 加速了植物的衰老。Gupta和Chandra[71]发现, 苦草在不同浓度Hg胁迫下, 叶绿素、蛋白质以及 N、P、K含量随着Hg浓度的增加和处理时间的延长而明显下降。同样的结果在吴振斌等[72]的研究中也被证实, 他们还发现沉水植物的叶绿素a/b比值、净生产力、呼吸强度随Hg2+离子浓度增加不断下降, 且Hg2+、Cd2+对可溶性蛋白和叶绿素含量以及净生产力的影响有协同效应, 对呼吸作用的影响有叠加效应。
4.4 水体有害化学元素含量上升危害沉水植物生长
杀虫剂、除草剂、多环芳烃(PAHs)、多氯联苯(PCBs)是环境中普遍存在的典型持久性有机污染物(POPs), 可通过大气沉降、废水排放、地表径流等多种途径进入水体, 并吸附在颗粒物上进入沉积物,在沉积物中逐渐积累。当沉积物再悬浮时重新释放进入水体致使水体恶化, 对水生植物的生理生态构成威胁[73-74]。
有研究表明, 大型水生植物对除草剂很敏感,绝大多数除草剂抑制根和茎生长, 抑制植物的呼吸和光合作用。吴晓霞[75]发现金鱼藻生物量(干重)随丁草胺(除草剂)浓度的升高显著下降, 光合放氧速率及呼吸耗氧速率明显下降,除草剂对水生植物的毒害有可能影响整个水生生态系的功能。刘建武等[76]通过盆栽试验研究了PAHs污染对5种水生植物生理指标的影响。结果表明, PAHs对水生植物具有某些毒害作用, 导致叶片失绿变黄, 萎蔫甚至腐烂,在高浓度处理组中还出现成熟叶片由绿变紫红的症状。且随着浓度的增加(1.2 mg·L-1—16.1 mg·L-1)呼吸强度受到抑制,叶绿素含量降低。另有研究表明PCBs不仅致使植物体细胞表现出明显的“毒性效应”, 能够抑制色素体恢复, 阻止细胞分裂, 破坏细胞团分散, 畸变细胞形态, 加速细胞衰亡等; 还会干扰植物体内的蛋白质代谢, 使蛋白质的合成受阻。高浓度的 PCBs使植物体内活性氧的产生和清除失衡, 造成植物体内氧自由基积累, 导致对植物的损伤。
5 结论与展望
基于国内外研究成果, 本文系统阐述了沉积物再悬浮对沉水植物光合作用和生长的影响。沉积物再悬浮改变了水体环境, 如降低水下光强、影响湖泊物质循环、增加水体重金属浓度等。再悬浮导致的水体环境变化抑制了沉水植物的光合作用, 影响光合荧光参数, 降低叶片对光的响应能力, 并可能导致植株与水体间气体交换和营养物质交换的改变,最终影响沉水植物的生长与繁殖。
目前, 关于沉积物再悬浮对沉水植物生长的影响研究已取得了较大进展, 但仍然存在一些问题:(1)沉水植被消亡机理虽已有大量研究, 但是从沉积物再悬浮的角度来解释沉水植被的分布格局、揭示沉水植被消亡机理还少有报道。(2)沉积物性质不同, 发生再悬浮时释放的物质也不同。当污染的沉积物发生再悬浮时会向水体中释放各种溶解态的有机、无机污染物质, 这些都有可能影响沉水植物的生长发育。因此, 不同性质沉积物再悬浮对沉水植物生长发育的影响还需深入研究。(3)全球变暖导致许多湖区水位下降, 是否会加剧沉积物再悬浮对沉水植物生长的影响?目前有关沉积物再悬浮对沉水植物的影响研究大都为环境条件相对简单的室内实验, 真正意义上复杂多变的野外实验较少。怎样在全球变暖的大背景下结合天气、温度、光照、风浪、降水等综合因素来研究沉积物再悬浮对沉水植物的影响是今后研究工作的重点。(4)鱼类、风浪引起的沉积物再悬浮主要以无机悬浮颗粒为主, 是否可以利用短食物链的滤食性生物, 例如背角无齿蚌(Anodontawoodiana)、三角帆蚌(Hyriopisiscumingii)、河蚬(Corbicula fluminea)等, 过滤悬浮颗粒物以起到增加水体透明度、改善水质的作用从而促进沉水植物生长?这也许可以作为生态修复的有效途径之一。
[1] KLEEBERG A, HUPFER M, GUST G. Phosphorus entrainment due to resuspension in a lowland river, Spree, NE Germany-a laboratory microcosm study[J]. Water, Air, and Soil Pollution, 2007, 183(1-4): 129-142.
[2] DALLA VECCHIA F, LA ROCCA N, MORO I, et al. Morphogenetic, ultrastructural and physiological damages suffered by submerged leaves of Elodea Canadensis exposed to cadmium[J]. Plant Science, 2005, 168(2):329-338.
[3] FRITIOFF A, KAUTSKY L, GREGER M. Influence of temperature and salinity on heavy metal uptake by submersed plants[J]. Environmental Pollution, 2005, 133(2):265-274.
[4] VAN ELLEN D, VAN DE BUND W J. Impact of submerged macrophytes including charophytes on phytoand zooplankton communities: allelopathy versus other mechanisms[J]. Aquatic Botany, 2002, 72(3): 267-274.
[5] KORNER S, DUGDALE T. Is roach herbivory preventing re-colonization of submerged macrophytes in a shallow lake? [J]. Hydrobiologia, 2003, 506(1-3): 497-501.
[6] CIURLI A, ZUCCARINI P, ALPI A. Growth and nutrient absorption of two submerged aquatic macrophytes in mesocosms, for reinsertion in a eutrophicated shallow lake[J]. Wetlands Ecosystem Manage, 2009, 17(2):107-115.
[7] GOI A, TRAPIDO M, TUHKANEN T. A study of toxicity,boideradability, and some by-products of ozonised nitrophenols[J]. Advances in Environment Research, 2004, 8(3): 303-311.
[8] 王华, 逄勇, 刘申宝, 等. 沉水植物生长影响因子研究进展[J]. 生态学报, 2008, 28(8): 3959-3968.
[9] 张运林, 秦伯强, 陈伟民, 等. 太湖水体中悬浮物研究[J].长江流域资源与环境, 2004, 13(3): 266-270.
[10] SCHULZ M, KOZERSKI H P, PLUNTKE T, et al. The influence of macrophytes on sedimentation and nutrient retention in the lower River Spree (Germany)[J]. Water Research, 2003, 37(3): 569-578.
[11] JAMES W F, BARKO J W, BUTLER M G. Shear stress and sediment resuspension in relation to submersed macrophyte biomass[J]. Hydrobiologia, 2004, 515(1-3):181-191.
[12] SQUIRES M M, LESACK L F W. Spatial and temporal patterns of light attenuation among lakes of the Mackenzie Delta[J]. Freshwater Biology, 2003, 48(1): 1-20.
[13] KORNER S, NICKLISCH A. Allelopathic growth inhibition of selected phytoplankton species by submerged macrophytes[J]. Journal of Phycology, 2002, 38(5): 862-871.
[14] 秦伯强, 朱广伟. 长江中下游地区湖泊水和沉积物中营养盐的赋存、循环及其交换特征[J]. 中国科学, 2005, 35(增Ⅱ): 1-10.
[15] 秦伯强, 胡维平, 高光, 等. 太湖沉积物悬浮的动力机制及内源释放的概念性模式[J]. 科学通报, 2003, 48(17):1822-1831.
[16] 罗潋葱, 秦伯强. 波浪和湖流对太湖底泥悬浮的影响研究[J]. 水文, 2003, 23(4): 1-4.
[17] HAWLEY N. Sediment resuspension near the Keweenaw Peninsula, lake superior during the fall and winter 1990-1991[J]. Journal of Great Lakes Research, 2000, 26(4): 495-505.
[18] HAKANSON L. Intemal loading: A new solution to an old problem in aquatic sciences. Lakes & Reservoirs: Research & Management, 2004, 9(1): 3-23.
[19] 尤本胜, 王同成, 范成新, 等. 太湖草型湖区沉积物再悬浮对水体营养盐的影响[J]. 环境科学, 2008, 29(1): 26-31.
[20] WAINRIGHT S C. Sediment-to-water of particulate material and microbes by resuspension and their contribution to the planktonic food web[J]. Marine Ecology Progress Series. Oldendorf, 1990, 62(3): 271-281.
[21] 钱嫦萍, 陈振楼, 胡玲珍, 等. 崇明东滩沉积物再悬浮对沉积物-水界面氮、磷交换行为的影响[J]. 环境科学, 2003, 24(5): 114-119.
[22] SØNDERGAARD M, KRISTENSEN P, JEPPESEN E. Phosphorus release from resuspended sediment in the shallow and wind-exposed Lake Arreso, Denmark[J]. Hydrobiologia, 1992, 228(1): 91-99.
[23] GONS H J, VEENINGEN R, VAN KEULEN R. Effects of wind on a shallow lake ecosystem: Resuspension of particles in the Loosdrecht Lakes[J]. Hydrobiological Bulletin, 1986, 20(1-2): 109-120.
[24] KALNEJAIS L H, MARTIN W R, SIGNALL R P, et al. Role of sediment resuspension in the remobilization of particulate-phase metals from coastal sediments[J]. Environmental Science & Technology, 2007, 41(7): 2282-2288.
[25] CANTWFLL M G, BURGESS R M, KESTED D R. Release and phase partitioning of metals from anoxic estuarine sediments during periods of simulated resuspension[J]. Environmental Science & Technology, 2002, 36(24): 5328-5334.
[26] CAETANO M, MADUREIRA M J, VALE C. Metal remobilisation during resuspension of anoxic contaminated sediment: short-term laboratory study[J]. Water Air and Soil Pollution, 2003, 143(1-4): 23-40.
[27] CAILLE N, TIFFREAU C, LEYVAL C, et al. Solubility of metals in an anoxic sediment during prolonged aeration. Science of the Total Environment, 2003, 301(1-3):239-250.
[28] 路永正, 董德明, 沈秀娥, 等. 曝气对河流沉积物中重金属Cu, Pb, Zn和Cd释放的影响[J]. 吉林大学学报: 理学版, 2005, 43(6): 877-881.
[29] 张运林, 秦伯强, 杨龙元. 太湖梅梁湾水体悬浮颗粒物和 CDOM 的吸收特性[J]. 生态学报, 2006, 26 (12):3969-3979.
[30] 潘国权, 王国祥, 李强, 等. 浊度对苦草幼苗生长的影响[J]. 生态环境, 2007, 16(3): 762-766.
[31] 张运林, 秦伯强, 陈伟民, 等. 悬浮物浓度对水下光照和初级生产力的影响[J]. 水科学进展, 2004, 15(5): 615-620.
[32] 张运林, 秦伯强, 朱广伟, 等. 长江中下游浅水湖泊沉积物再悬浮对水下光场影响的研究[J]. 中国科学, 2005, 35(增刊11): 101-110.
[33] VERVUREN P J A, BLOM C, DE KROON H. Extreme flooding events on the Rhine and the survival and distribution of riparian plant species[J]. Journal of Ecology,2003, 91(1): 135-146.
[34] 苏睿丽, 李 伟. 沉水植物光合作用的特点与研究进展[J]. 植物学通报, 2005, 22(增刊): 128-138.
[35] 陈灿. 湖泊沉积物再悬浮对苦草光合机能的影响[J]. 环境科学与技术才, 2010, 33(1): 6-10.
[36] FANKHAUSER C. Light perception in plants: cytokinins and red light join forces to keep phytochrome bactive[J]. Trends in Plant Science, 2002, 7(4): 143-145.
[37] 马婷, 李强, 王国祥, 等. 悬浮泥沙溶液对金鱼藻快速光响应曲线的影响[J]. 武汉植物学研究, 2006, 24(6):531-535.
[38] 李强, 王国祥. 水体泥沙对苦草生长发育和叶片光合生理特性的影响[J]. 生态学报, 2009, 29(6): 2852-2860.
[39] 王友保, 张莉. 大气颗粒污染物对植物的伤害[J]. 生物学通报, 2002, 37(2): 17-18.
[40] RUIZ J M and ROMERO J. Effects of disturbances caused by coastal constructions on spatial structure, growth dynamics and photosynthesis of the seagrass Posidonia oceania[J]. Marine Pollution Bulletin, 2003, 46(12):1523-1533.
[41] 李强, 王国祥, 潘国权, 等. 水体浊度对菹草萌发及萌发苗光合荧光特性的影响[J]. 生态学报, 2006, 26(11):3594-3601.
[42] 王文林, 王国祥, 李强. 水体浊度对菹草(Potamogeton cripus)幼苗生长发育的影响[J]. 生态学报, 2006, 26(11):3586-3593.
[43] 谢贻发. 沉积物再悬浮对沉水植物生长的影响研究[J].环境科学学报, 2007, 27(1): 18-22.
[44] 刘伟龙, 胡维平, 谷孝鸿. 太湖马来眼子菜生物量变化及影响因素[J]. 生态学报, 2007, 27 (8): 3324-3333.
[45] 罗潋葱, 秦伯强, 胡维平, 等. 不同水动力扰动下太湖沉积物的悬浮特征[J]. 湖泊科学, 2004, 16(3): 273-275.
[46] CAO Te, NI Leyi, XIE Ping. Acute biochemical response of a submersed macrophyte, potamogeton crispus L., to high ammonium in an aquarium experiment[J]. Journal of Freshwater Ecology, 2004, 19(2): 279-284.
[47] BRITTO D T, KRONZUCKER H J. NH4+toxicity in higher plants: a critical review[J]. Journal of Plant Physiology, 2002, 159(6): 567-584.
[48] WHANG Chao, ZHANG Songhe, WANG Peifang, et al. Metabolic adaptations to ammonia-induced oxidmive stress in leaves of the submerged macrophyte Vallisneria natans (Lour.) Hara[J] . Aquatic Toxicology, 2008, 87(2): 88-98.
[49] CAO Te, XIE Ping, LI Zhongqiang, et al. Physiological stress of high NH4concentration in water column on the submersed macrophyteVallisneria Natans[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(3):296-299.
[50] NIMPTSCH J, PFLUGMACHER S. Ammonia triggers the promotion of oxidative stress in the aquatic macrophyte Myriophyllum mattogrossense[J]. Chemosphere, 2007, 66(4): 708-714.
[51] 颜昌宙, 曾阿妍, 金相灿, 等. 不同浓度氨氮对轮叶黑藻的生理影响[J]. 生态学报, 2007, 27(3): 1050-1055.
[52] SEHALLENBERG M, BURNS C W. Effects of sediment resuspension on phytoplankton production: teasing apart the influences of light, nutrients and algal entrainment[J]. Freshwater Biology, 2004, 49(2): 143-159.
[53] YIN Liyang, HUANG Jiaquan, Li Dunhai, et al. Microcystin-RR uptake and its effects on the growth of submerged macrophyte Vallisneria natans (lour.) hara[J]. Environmental Toxicology, 2005, 20(3): 308-313.
[54] ASAEDA T, SULTANA M, MANATUNGE J, et al. The effect of epiphytic algae on the growth and production of Potamogeton perfoliatus L. in two light conditions[J]. Environmental and Experimental Botany, 2004, 52(3):225-238.
[55] LIBORIUSSEN L, JEPPESEN E. Temporal dynamics in epipelic, pelagic and epiphytic algal production in a clear and a turbid shallow lake[J]. Freshwater Biology, 2003, 48(3): 418-431.
[56] JONES J I, YOUNG J O, EATON J W, et al. The influence of nutrient loading dissolved inorganic carbon and higher tropic levels on the interaction between submerged plants and periphyton[J]. Journal of Ecology, 2002, 90(1): 12-24.
[57] 秦伯强, 宋玉芝, 高光. 附着生物在浅水富营养化湖泊藻-草型生态系统转化过程中的作用[J]. 中国科学, 2006, 36(3): 283-288.
[58] ISTVANOVICS V, OSZTOICS A, HONTI M. Dynamics and ecological significance of daily internal load of phosphorus in shallow Lake Balaton, Hungary[J]. Freshwater Biology, 2004, 49(3): 232-252.
[59] 陈灿, 张浏, 赵兴青,等. 不同营养状态下附生藻类对菹草叶片光合机能的影响[J]. 湖泊科学, 2007, 19(4):485-49l.
[60] VADEBONEOEUR Y, LEDGE D M, CARPENTER S R. Whole-lake fertilization effects on distribution of primary preduction between benthic and pelagic habitats[J].Ecology, 2001, 82(4): 1065-1077.
[61] ROBERTS E, KROKER J, KOMER S, et al. The role of periphyton during the re-eolonization of a shallow lake with submerged macrophytes[J]. Hydrobiologia, 2003, 506 (1-3): 525-530.
[62] JONES J L, YOUNG J O, EATON J W, et al. The influence of nutrient loading dissolved inorganic carbon and higher trophic levels on the interaction between submerged plants and periphyton[J]. Journal of Ecology, 2002, 90(1): 12-24.
[63] CANTWELL M G, BURGESS R M. Variability of parameters measured during the resuspension of sediments with a particle entrainment simulator[J]. Chemosphere, 2004, 56(1): 51-58.
[64] CANTWELL M G, BURGESS R M, KING J W. Resuspension of contaminated field and formulated reference sediments Part I: Evaluation of metal release under controlled laboratory conditions[J]. Chemosphere, 2008, 73(11): 1824-1831.
[65] 王模善, 赵铁铭. 重金属镉对沉水植物毒性效应的研究[J].西南大学学报( 自然科学版), 2008, 30(4): 128-134.
[66] 施国新, 谢凯彬, 杜开和, 等. Cr6+、As+3污染对黑藻叶细胞伤害的超微结构研究[J]. 南京师范大学学报, 2001, 24(4): 93-97.
[67] 徐勤松, 施国新, 杜开和, 等. Zn诱导的菹草叶抗氧化酶活性的变化和超微结构损伤[J]. 植物研究, 2001, 21(4):569-573.
[68] 张小兰, 施国新, 徐楠, 等. Hg2+、Cd2+对轮藻部分生理生化指标的影响[J]. 南京师范大学学报, 2002, 25(1):38-43.
[69] 陈愚, 任久长, 蔡晓明. 镉对沉水植物硝酸还原酶和超氧化物歧化酶活性的影响[J]. 环境科学学报, 1998, 18(3):313-317.
[70] PIETRINI F, PASQUALINI S, LANNELLI M A, et al. Interaction o f Cadmium with glutathione and photosynthesis in developing leaves and chloroplasts of Phragmites australis Trin. ex Steudel[J]. Plant Physiology, 2003, 133(2): 829-837.
[71] GUPTA M, CHANDRA P. Bioaccumulation and toxicity of mercury in rooted-submerged macrophyte Vallisneria spiralis[J]. Environmental Pollution, 1998, 103(2): 327-332.
[72] 吴振斌, 马剑敏, 赵强, 等. Hg2+、Cd2+及其复合胁迫对伊乐藻的毒害[J]. 中国环境科学, 25(3): 262-266.
[73] NAM J J, THOMAS G O, JAWARD F M, et al. PAHs in background soils from Western Europe: Influence of atmospheric deposition and soil organic matter[J]. Chemosphere, 2008 (70): 1596-1602.
[74] 陈景文, 全胤. 环境化学[M]. 大连: 大连理工大学, 2009.
[75] 吴晓霞, 吴进才, 金银根. 除草剂对水生植物的生理生态效应[J]. 生态学报, 2004, 9(24): 2037-2042.
[76] 刘建武, 林逢凯, 王郁. 多环芳烃(萘)污染对水生植物生理指标的影响[J]. 华东理工大学学报, 2002, 5(28):520-536.
Research progress in the effect of sediment resuspension on the photosynthesis and growth of submerged macrophytes
GU Jiao1, NING Xiaoyu1, JIN Hui1,2, HE Hu1, ZHU Xiaolong1,2, TAN Bingchang1, LI Kuanyi1*
1. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography & Limnology, Chinese Academy of Sciences, Nanjing 210008, China
2. Jiangnan University, Wuxi 214122, China
As an important primary producer, submerged macrophytes, whose growth and distribution are influenced by various environmental factors, plays a critical role in aquatic ecosystem. The research progress was reviewed on the effect of the sediment resuspension on the submerged macrophytes, including impact on the photosynthesis, growth and reproduction of submerged macrophytes. It discusses the problems existing in the present study and proposes the perspectives on the future research.
sediment resuspension; submerged macrophytes; photosynthesis; growth
10.14108/j.cnki.1008-8873.2016.01.031
Q178.1
A
1008-8873(2016)01-200-09
2015-01-22;
2015-03-13
国家水专项(2012ZX07101013); 国家自然科学基金(41571086; 31370477)以及中科院重点项目(KFZD-SW-302-02)联合支持。
谷娇(1988—), 女, 山西阳泉人, 在读博士, 主要从事湖泊生物与生态学研究, E-mail: 704749506@qq.com
*通信作者:李宽意(1971—), 男, 博士, 研究员, 主要从事湖泊生态学及恢复生态学研究, E-mail: kyli@ niglas. ac.cn
谷娇, 宁晓雨, 靳辉, 等. 沉积物再悬浮对浅水湖泊沉水植物光合作用及生长影响的研究进展[J]. 生态科学, 2016, 35(1):200-208.
GU Jiao, NING Xiaoyu, JIN Hui, et al. Research progress in the effect of sediment resuspension on the photosynthesis and growth of submerged macrophytes[J]. Ecological Science, 2016, 35(1): 200-208.
