干旱胁迫下冠菌素(COR)对花生幼苗叶片抗氧化酶活性及细胞膜透性的影响
2016-06-05史普想刘盈茹张晓军王月福王铭伦
史普想,秦 欣,刘盈茹,张晓军,王月福,王铭伦*
(1.青岛农业大学/山东省旱作农业技术重点实验室,山东 青岛266109;2.辽宁省风沙地改良利用研究所,辽宁 阜新 123000)
干旱胁迫下冠菌素(COR)对花生幼苗叶片抗氧化酶活性及细胞膜透性的影响
史普想1,2,秦 欣1,刘盈茹1,张晓军1,王月福1,王铭伦1*
(1.青岛农业大学/山东省旱作农业技术重点实验室,山东 青岛266109;2.辽宁省风沙地改良利用研究所,辽宁 阜新 123000)
在玻璃日光温室条件下,以花生品种鲁花11号为供试材料,系统研究了PEG-6000模拟干旱胁迫条件下COR对花生幼苗叶片抗氧化酶活性及细胞膜透性的影响。结果表明,正常水分条件下,0.01μmol·L-1COR浸种对花生幼苗叶片相对含水量(RWC)、游离氨基酸含量、保护酶活性和细胞膜相对透性无明显影响;PEG-6000模拟干旱胁迫条件下,COR浸种可显著提高SOD、POD、CAT活性,增加游离氨基酸含量,降低细胞膜相对透性,提高幼苗叶片RWC,从而降低干旱胁迫对花生幼苗造成的伤害。
冠菌素;花生;幼苗叶片;干旱胁迫;抗氧化酶;细胞膜相对透性
花生是我国重要的油料作物和经济作物,是重要的植物油脂和蛋白质来源,在农业和国民经济中的地位日益显著[1-2]。我国北方花生大多分布在半湿润易旱地区,经常出现春季播种“十年九旱”的现象,这一问题一直困扰着我国花生栽培水平的提高[3]。由于干旱造成的花生减产占全国总产的20%以上,同时导致籽仁品质下降,降低花生植株的固氮能力[2,4-5]。提高花生抗旱性对花生增产和品质提高具有重要意义。
冠菌素(COR)是一种新型植物生长调节剂,其结构和生理作用与茉莉酸(JAs)相似,具有调控生长、抑制衰老和提高植物抗逆性等生理功能[6-7]。Sakai等用COR处理豌豆的胚芽鞘发现原生质体流动受到抑制,细胞的质壁分离能力下降[8-9]。1μmol·L-1的COR能增大蚕豆和多花黑麦草气孔开度,可能因为气孔周围细胞内代谢物增多,导致水势降低,保卫细胞吸水[10]。闫芝芬等表明COR具有明显提高高粱幼苗抗干旱胁迫的作用[11-12]。一定浓度的冠菌素可提高玉米、水稻、黄瓜、小麦等CAT、SOD活性,增加游离脯氨酸含量,并控制叶片蒸腾速率,调节叶片含水量[13-15]。PEG模拟干旱胁迫下,较低浓度(0.01 μmol·L-1)COR处理玉米幼苗时,叶片RWC提高,可溶性糖、游离脯氨酸等含量提高,耐干旱胁迫能力较强;当COR浓度较高(1.0μmol·L-1)时,上述指标的变化趋势则相反,耐干旱胁迫的能力下降,与ABA的作用类似[12]。
有关COR与花生抗旱性关系的研究鲜见报道,本文研究了干旱胁迫下COR对花生幼苗叶片抗氧化酶系统及细胞膜透性的影响,为探讨COR与花生幼苗抗旱性的关系及抗旱机理,并为其在花生生产中合理施用提供依据。
1 材料与方法
1.1 试验材料
试验在青岛农业大学旱作实验室玻璃日光温室内进行,供试花生品种为鲁花11号,冠菌素(COR)由中国农业大学作物激素生理与化学控制研究中心提供。
1.2 试验设计
设4个处理:① CK:蒸馏水浸种;② PEG:蒸馏水浸种,主茎第3叶展开当天浇灌25%(W/V)的PEG-6000溶液;③ COR:0.01μmol·L-1COR浸种;④ COR+PEG:0.01μmol·L-1COR浸种,主茎第3叶展开当天浇灌25%(W/V)的PEG-6000溶液。每处理种植6盒,各处理随机排列。
1.3 试验方法
挑选饱满、大小均匀一致的花生种子(粒重为0.90~0.95g),用0.1%的NaClO溶液消毒,然后用蒸馏水多次冲洗干净,立刻用吸水纸吸干种子表面的水分,将种子分别置于蒸馏水和COR溶液中浸泡4.5h,水温25℃。浸种后的种子分别播于装有砂性土壤的塑料盒中(50cm×35cm×30cm),播种深度为5 cm,播种后置于玻璃日光温室内,温度15~20℃(20:00~7:30)、20~35℃(7:30~20:00),出苗后每盒均匀留苗20株,定时定量补水。各处理均在主茎第3叶展开次日(干旱胁迫后1d)进行第一次取样,以后每隔1d取一次样,共取样5次。
叶片相对含水量测定:每次取10片叶,将小叶剪下,称量鲜重(初始鲜重),后迅速将叶片置入清水中抽气浸泡5h后,从水中取出并吸净叶片表面水分称重(饱和鲜重)。放入105℃烘箱杀青30min,80℃下烘至恒重并称重(干重)。
叶片相对含水量(%)=(初始鲜重-干重)/(饱和鲜重-干重)×100
游离氨基酸含量用茚三酮比色法测定,SOD、POD及CAT活性分别用王爱国法、愈创木酚法和Chance法测定,细胞膜相对透性用电导率仪测定。
1.4 数据处理
数据、图表处理在Excel 2003下进行,统计及差异显著性分析采用DPS数据处理系统。小写字母表示5%的差异水平。
2 结果与分析
2.1 干旱胁迫下冠菌素对花生幼苗叶片相对含水量的影响
叶片相对含水量(RWC)是反映植物水分状况的重要指标。干旱胁迫下,其含量变化可反映组织的抗脱水能力,在充分供水及轻度水分胁迫条件下,叶片含水量基本保持稳定,在严重水分胁迫条件下,叶片含水量迅速下降[16]。图1所示,无干旱胁迫处理(COR和CK)的花生幼苗叶片相对含水量(RWC)差异不显著,随幼苗生长,两处理叶片RWC保持平稳;而干旱胁迫处理(PEG和COR+PEG)的叶片RWC从干旱胁迫1d起较CK和COR处理即显著降低,随处理天数的增加,差异愈明显;干旱胁迫下0.01μmol·L-1COR浸种可显著减少叶片RWC的降低程度,干旱胁迫3、5、7、9d叶片RWC分别为83.57%、76.83%、63.47%和58.80%,较PEG处理的73.50%、8.60%、43.27%和38.60%分别提高了10.1个、8.2个、20.2个和20.2个百分点。
2.2 干旱胁迫下冠菌素对花生幼苗叶片游离氨基酸含量的影响
植物中最常见的渗透调节物质是游离氨基酸,其含量对研究植物在不同条件下及不同生长发育时期氮代谢水平变化有重要意义,如脯氨酸,它是最常见的衡量抗旱性的指标之一[13]。如图2所示,CK和COR浸种的花生幼苗叶片游离氨基酸含量随着幼苗的生长变化较小,两处理间无显著差异。PEG处理显著提高叶片游离氨基酸含量,干旱胁迫1d即较CK达到显著差异,以后差异更加明显。COR+PEG处理的叶片游离氨基酸含量虽较CK明显提高,但显著低于PEG处理的。干旱胁迫1、3、5、7和9d测定,COR+PEG处理的叶片游离氨基酸含量分别为27.63μg/g、30.17μg/g、34.57μg/g、37.47μg/g、41.53μg/g,较PEG处理的29.27μg/g、36.07μg/g、46.23μg/g、51.77μg/g和55.63μg/g分别降低了5.6%、16.4%、25.2%、27.6%和25.3%,较CK分别提高8.5%、17.8%、26.5%、35.9%和47.6%,而PEG处理的则较CK分别提高14.9%、40.9%、69.1%、 87.8%和97.7%(图2)。可以看出,COR+PEG处理较PEG处理可减少叶片中游离氨基酸含量,以缓解干旱胁迫对花生幼苗造成的危害。
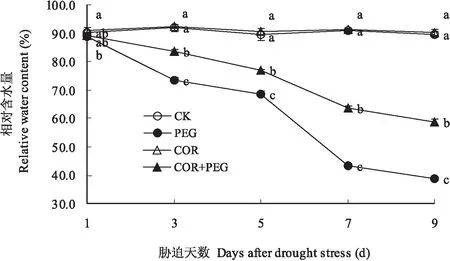
图1 干旱胁迫下冠菌素对花生幼苗叶片相对含水量的影响Fig.1 Effects of the coronatine on relative water content of peanut seedling leaves under drought stress
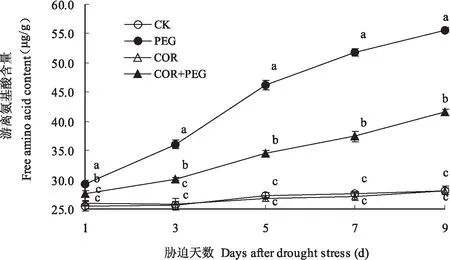
图2 干旱胁迫下冠菌素对花生幼苗叶片游离氨基酸的影响Fig.2 Effects of the coronatine on free animo acid content of peanut seedling leaves under drought stress
2.3 干旱胁迫下冠菌素对花生幼苗叶片保护性酶活性的影响
2.3.1 SOD 花生干旱胁迫前期叶片SOD活性较高,变化较平稳,COR处理基本不影响叶片SOD活性。PEG处理在胁迫3d即显著降低叶片SOD活性,随幼苗生长降低愈加明显;COR+PEG处理的SOD活性虽低于CK,但显著高于PEG处理。干旱胁迫3、5、7和9d各COR+PEG处理的叶片SOD活性分别为510.2、503.6、482.5和400.3μg/(g FW·min),较CK处理的516.2、520.5、511.8和503.2μg/(g FW·min)分别降低1.1%、3.3%、5.7%和20.5%,较PEG处理的496.3、476.3、410.2和250.6μg/(g FW·min)分别提高2.8%、5.7%、17.6%和59.7%(图3-A)。
2.3.2 POD 花生出苗后,随着幼苗的生长叶片POD活性逐渐提高。COR处理表现为提高叶片POD活性的趋势;PEG处理表现为胁迫5d叶片POD活性逐渐提高,5d后显著降低,取样期内POD活性均明显低于CK;COR+PEG处理的叶片POD活性变化与PEG处理的类似,但活性明显高于PEG处理,干旱胁迫前5d与CK相当,5d后较CK降低(图3-B)。干旱胁迫1d、3d、5d、7d和9d测定,COR+PEG处理的叶片POD活性分别为23.57、24.63、26.43、26.37和24.37 μg/(g FW·min),较CK的24.23、25.23、26.57、27.80和28.37μg/(g FW·min)分别降低2.8%、2.4%、0.5%、5.2%和14.1%,较PEG处理的POD活性21.57、22.57、23.97、22.57和17.57 μg/(g FW·min)分别提高9.3%、9.2%、10.3%、16.8%和38.7%。
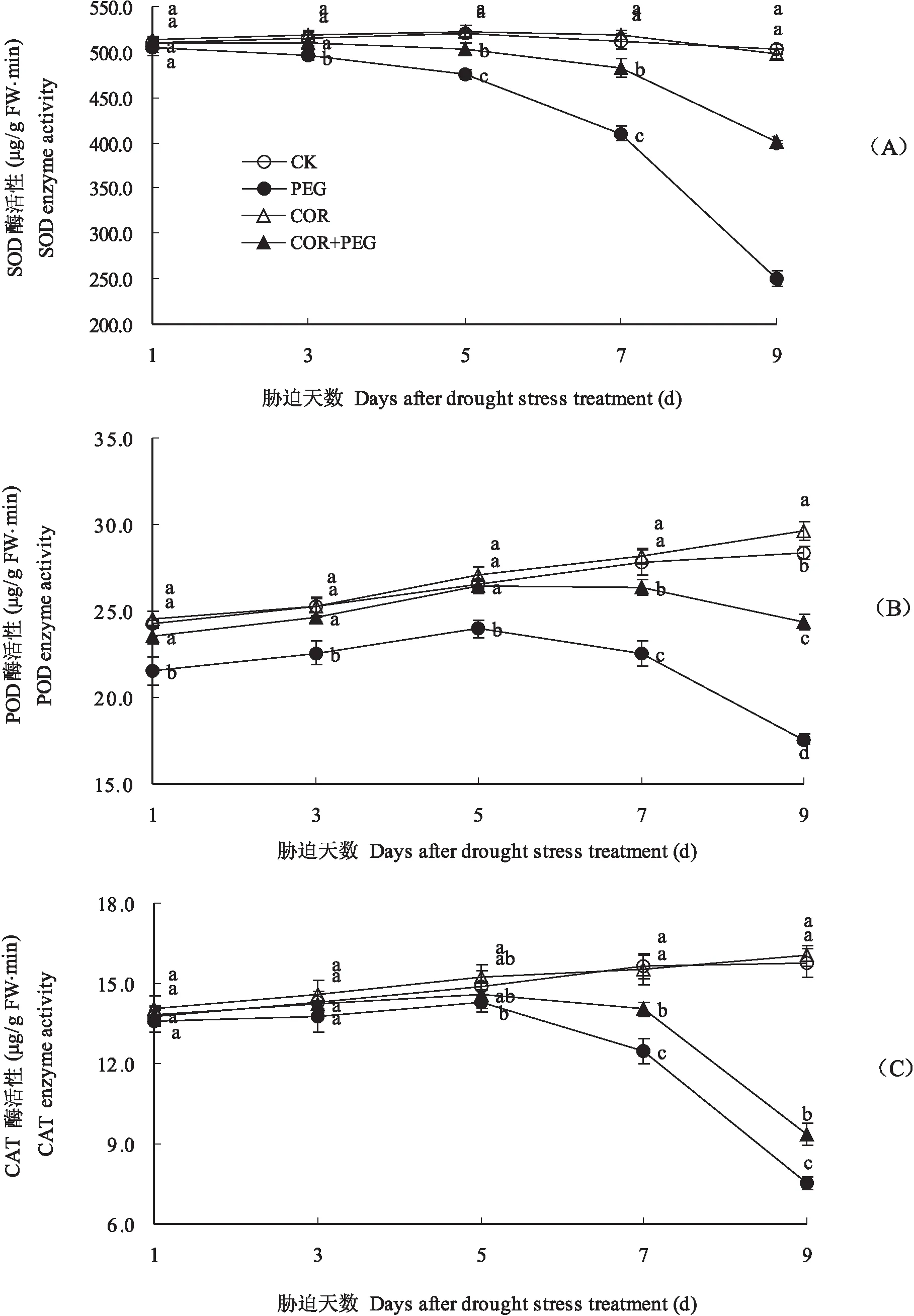
图3 干旱胁迫下冠菌素对花生幼苗叶片保护性酶活性的影响Fig.3 Effects of the coronatine on protective enzyme activity of peanut seedling leaves under drought stress
2.3.3 CAT 图3-C可见,不同处理花生幼苗叶片CAT活性的变化趋势与POD类似。胁迫3、5、7和9d测定,COR+PEG处理的叶片CAT活性较CK分别降低0.2%、2.0%、10.2%和40.8%,较PEG处理分别提高3.4%、2.1%、12.6%和23.9%。
2.4 干旱胁迫下冠菌素对花生幼苗叶片细胞膜相对透性的影响
细胞膜在不断变化的环境中必须保持自身的稳定状态才能生存,它允许一些物质通透,又能降低甚至阻挡另一些物质的通透,所以细胞膜具有选择通透性,细胞膜相对透性是反映细胞膜完整性和植物是否正常生长的重要指标[8]。由图4可见,花生出苗后叶片细胞膜相对透性较低,随幼苗生长变化较小。COR处理的叶片细胞膜相对透性与CK差异不明显;PEG处理的叶片细胞膜相对透性显著增加,胁迫1d较CK增加即达到显著水平,以后增加幅度更大;COR+PEG处理的叶片细胞膜相对透性在胁迫3d以前与CK差异不明显,以后逐渐增加,但较PEG处理的明显偏低。胁迫1、3、5、7和9d COR+PEG处理的叶片细胞膜相对透性分别为13.97、14.33、17.77、18.60和20.67μs/cm,较CK的13.83、13.90、13.53、13.60和13.97μs/cm分别增加13.33%、43.33%、423.33%、500%和670%,较PEG处理的14.17、16.53、19.63、24.23和28.00μs/cm,分别降低1.4%、13.3%、9.5%、23.3%和26.2%。PEG处理显著增加了叶片细胞膜相对透性,提高了细胞膜脂过氧化程度,对花生幼苗叶片造成伤害,COR处理可明显缓解PEG对叶片的伤害,对花生幼苗有保护作用。
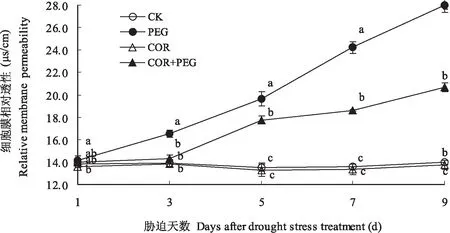
图4 干旱胁迫下冠菌素对花生幼苗叶片细胞膜相对透性的影响Fig.4 Effects of the coronatine on relative membrane permeability of peanut seedling leaves under drought stress
3 讨 论
干旱等逆境条件下植物体内保护酶系统能够清除多余的自由基,其中SOD、POD和CAT是主要的抗氧化酶。SOD作用是歧化超氧阴离子为H2O2和H2O,POD是植物体内清除活性氧的另一个重要酶类,CAT能催化细胞内H2O2分解还原为H2O,防止过氧化[18]。植物通过保护酶系统加强抗氧化作用,从而提高对逆境的抗性,防止自由基对细胞膜系统造成伤害[8-9]。
植物(如金心吊兰)细胞受到轻微干旱胁迫后SOD和POD酶活性会增高,但当干旱胁迫程度过大就会导致SOD和POD酶活性的降低[19-20];水分胁迫下夏玉米SOD、POD、CAT活性显著降低,不抗旱品种更甚[21];汪宝卿用0.01μmol·L-1的COR水培能显著降低干旱胁迫下玉米叶片水势并显著提高叶片RWC和叶片中POD、CAT活性[22];干旱胁迫下不同品种的胡枝子游离氨基酸含量均升高[23],游离氨基酸除作为渗透调节物质外,对于保持膜结构的完整性也具有重要作用[24];在PEG模拟干旱条件下,0.01μmol·L-1COR处理可以维持旱稻(297)较高的叶片RWC,促进幼苗叶片中脯氨酸和可溶性蛋白质的积累,降低质膜透性,维持细胞质膜的完整性[25]。本研究结果表明,正常水分条件下0.01μmol·L-1COR浸种对花生幼苗叶片RWC、游离氨基酸含量、细胞膜相对透性以及保护酶活性等无明显影响,此时花生体内自由基的产生和保护性酶的清除作用处于平衡状态[8],当胁迫达到一定的程度时就会打破这种平衡。在PEG-6000模拟干旱胁迫条件下,花生幼苗叶片RWC降低,游离氨基酸含量提高,保护性酶类SOD、POD和CAT活性降低,细胞膜相对透性增加,幼苗叶片细胞膜系统受到破坏,导致叶片气孔开度变大,蒸腾作用增加[13],植株失水,生长发育受阻。0.01 μmol·L-1COR浸种可通过延缓干旱胁迫下叶片保护性酶类活性下降和游离氨基酸含量的过度增加来降低干旱胁迫带来的伤害,从而保护细胞膜结构的完整性,进而调节叶片含水量、减轻干旱胁迫对植株造成的伤害。COR在抵御花生幼苗受干旱胁迫中的作用与其在其他作物上的抗旱作用相一致。0.01 μmol·L-1COR浸种提高花生幼苗抗旱性的研究结果,为花生生产上特别是干旱地区的花生生产,通过施用植物生长调节剂提高抗旱性提供了新的技术途径。
[1] Jia J Y,Ha L Y,Hu J M.Drought risk analysis of maize under climate change based on natural disaster system theory in Southwest China [J].Acta Ecologica Sinica.,2016,36(5):340-349.
[2] 张佳蕾,郭峰,万书波,等.钙肥对旱地花生生育后期生理特性和产量的影响[J].中国油料作物学报,2016,38(3) :321-327.
[3] Wu L X,Ding X X,Li P W,et al.Aflatoxin contamination of peanuts at harvest in China from 2010 to 2013 and its relationship with climatic conditions[J].Food Control,2016,60(2):117-123.
[4] 高国庆,周汉群,唐荣华.花生品种抗旱性鉴定[J].花生科技,1995(3):7-9.
[5] 顾学花,孙莲强,李向东.施钙对干旱胁迫下花生生理特性及产量的影响[J].花生学报,2013(2):1-8.
[6] 汪宝卿,李召虎,段留生,等.冠菌素及其生理功能[J].植物生理学通讯,2006,43(3):503-510.
[7] Koda Y,Takahashi K,Kikuta Y,et al.Similarities of the biological activities of coronatine and coronafacic acid to those of jasmonic acid [J].Phytochemistry,1996,41:93-96.
[8] Sakai R.Effect of coronatine on some physiological properties of plant cells [J].Annlas of the Phytopathology Society of Japan,1981,47:35-41.
[9] Sakai R,Akima M,Moni Y,et a1.Effect of coronatine on membrane bound adenosine triphosphatase [J].Annals of the Phytopathology Society of Japan,1984,50(5):653-655.
[10] Mino Y,Matsushita Y,Sakai R.Effect of coronatine on stomatal opening in leaves of broadbean and Italian ryegrass [J].Ann Phytopathpl Soc Jpn,1987,53(1):53-55.
[11] 闫芝芬,周燮,马春红,等.冠毒素和茉莉酸甲酯对诱导小麦、黑麦和高羊茅草颖花开放的效应[J].中国农业科学,2001,34(3):334-337.
[12] 秦欣,宋吉英,王铭伦,等.植物生长调节剂冠菌素的研究进展[J].山东农业科学,2008(9):86-89.
[13] Tamogami S,Kodama O.Coronatine elicits phytoalexin production in rice leaves (OryzasativaL.) in the same manner as jasmonic acid [J].Phytochemistry,2000,54 (7):689-94.
[14] Munenori S,Morifumi H,Osamu K,et al.Dihydrocoronatine,promising candidate for a chemical probe to study coronatine-,jasmonoid- and octadecanoid-binding protein [J].Bioscience Biotechnology and Biochemistry,2004,68(7):1617-1620.
[15] 齐付国,李建民,段留生,等.冠菌素和茉莉酸甲酯诱导小麦幼苗低温抗性的研究[J].西北植物学报,2006,26(9):1776 -1780.
[16] 韩瑞宏,田华,高桂娟,等.干旱胁迫下紫花苜蓿叶片水分代谢与两种渗透调节物质的变化[J].华北农学报,2008,23(4):140-144.
[17] 周瑞莲.不同类型沙地植物保护酶系统对干旱和高温胁迫的响应[J].中国沙漠,1999(6):50-54.
[18] 何学利.植物体内的保护酶系统[J].现代农业科技,2010(10):37-38.
[19] Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plant [J].Plant physiology and Biochemistry,2010,48(12):909-930.
[20] 贾学静,董立花,袁明,等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响[J].草业学报,2013,22(5):248-255.
[21] 张立新,李生秀.氮、钾、甜菜碱对水分胁迫下夏玉米叶片膜脂过氧化和保护酶活性的影响[J].作物学报,2007,33(3):482-490.
[22] 汪宝卿,李召虎,段留生.冠菌素对玉米幼苗耐干旱胁迫的诱导效应[J].西北植物学报,2007,27(4):740-746.
[23] 王启明,徐心诚,吴诗光,等.干旱胁迫对不同品种大豆开花期生理生化特性的影响[J].作物杂志,2005(3):16-18.
[24] 杜金友,陈晓阳,胡东南,等.干旱胁迫条件下几种胡枝子渗透物质变化的研究[J].华北农学报,2004,19(增刊):40-45.
[25] 艾琳,李召虎,段留生.植物生长物质冠菌素诱导旱稻、水稻幼苗抗旱性的效应及生理机制[J].中国水稻科学,2008,22(4):443-446.
The Effects of Coronatine on Antioxidant Enzyme Activity and Cell Membrane Permeability of Peanut (ArachishypogaeaL.) Seedling Leaves under Drought Stress
SHI Pu-xiang1,2,QIN Xin1,LIU Ying-ru1,ZHANG Xiao-jun1,WANG Yue-fu1,WANG Ming-lun1*
(1.ShandongProvincialKeyLaboratoryofDrylandFarmingTechnology/QingdaoAgriculturalUniversity,Qingdao266109,China;2.InstituteofImprovementandUtilizationofSandSoilsofLiaoning,Fuxin123000,China)
Under the condition of the glass greenhouse,with the peanut variety of Luhua11 as experimental material,we thoroughly studied the effect of COR on the antioxidant enzyme activity of peanut seedling leaf and the cell membrane permeability under the simulated condition of drought stress of PEG-6000.The results showed,COR had not obvious effect on peanut seedling leaf RWC,free amino acid content,protective enzyme activity and cell membrane relative permeability under non-stress condition.But presoaking with COR under the condition of drought stress with PEG-6000 could significantly improve the activities of SOD,POD and CAT,increase the content of free amino acid,reduce the cell membrane relative permeability,and improve the seedling leaf RWC,thereby reduce the damage of peanut seedling under drought stress.
coronatine; peanut; seedling leaves; drought stress; antioxidant enzyme activity; relative membrane permeability
10.14001/j.issn.1002-4093.2016.04.006
2016-09-20
国家科技支撑计划项目(2014BAD11B04);国家花生产业技术体系建设专项(CARS-14-东北区栽培);山东省高校优秀科研创新团队建设项目(6212n2);山东省花生产业技术体系建设项目
史普想(1983-),男,山东菏泽人,辽宁省风沙地改良利用研究所副研究员,硕士,从事花生栽培生理研究。
*通讯作者:王铭伦(1958-),教授,主要从事花生栽培理论与技术研究。E-mail:mlwang@qau.edu.cn
S565.201
A
