小茴香挥发油对红枣黑斑病菌的抑菌活性及其作用机制的初步研究
2016-06-03马江锋
马江锋,曾 红
(1.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室/塔里木大学 生命科学学院,新疆阿拉尔 843300;2.新疆建设兵团农业技术推广总站,乌鲁木齐 830011 )
小茴香挥发油对红枣黑斑病菌的抑菌活性及其作用机制的初步研究
马江锋1,2,曾红1
(1.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室/塔里木大学 生命科学学院,新疆阿拉尔843300;2.新疆建设兵团农业技术推广总站,乌鲁木齐830011 )
摘要研究小茴香挥发油对红枣黑斑病菌抑菌活性及其初步作用机制,为开发植物源防治红枣黑斑病菌农药提供理论依据。采用微量稀释法测定小茴香挥发油对红枣黑斑病菌的最低抑菌体积分数(MIVF),并研究小茴香挥发油对红枣黑斑病菌离体(菌丝、孢子萌发和生物量抑制作用)和活体的抗菌活性。采用碘化吡啶染色法测定小茴香挥发油对红枣黑斑病菌孢子细胞膜的损坏。结果表明,小茴香挥发油对棉花黄萎病菌的MIVF为0.312 mL/L,小茴香挥发油对红枣黑斑病菌生物量、孢子萌发和菌丝生长有抑制作用且呈体积分数依赖关系。由碘化吡啶染色试验结果可知小茴香挥发油能严重破坏红枣黑斑病菌孢子的细胞膜而达到抑菌作用。
关键词小茴香挥发油;红枣黑斑病菌;抑菌活性;细胞膜
新疆是中国闻名遐迩的瓜果之乡,而南疆(新疆南部)是新疆瓜果之乡的轴心。红枣产业已成为南疆果农致富增收的支柱产业之一。红枣黑斑病是影响红枣产量和质量重要病害之一。许多研究者对红枣黑斑病病原菌存在很大分歧,可能源于不同地区、不同时期、不同生态型枣园分离的病原菌所有差异。而对于南疆红枣黑斑病病原菌不同学者鉴定为链格孢 (Alternariasp.)[1-3]。目前,针对红枣黑斑病的防治主要是使用化学杀菌为主,但化学杀菌剂因残留毒性不但危害人类健康和造成环境污染,而且易使病原菌产生耐药性。因此寻找一种安全、有效、环境友好的杀菌剂是必然趋势。植物源挥发油作为杀菌剂是目前研究热点。国内外研究者发现植物源挥发油是天然抗菌物质之一。研究集中在植物源挥发油抗人体病原菌活性、杀虫活性和抗食品腐败真菌活性方面[4-10]。近些年,不同学者研究发现天然植物源挥发油对植物致病菌有抑制作用,比如Kumar等[11]报道多舌飞蓬挥发油对植物病原菌有抑制作用。Znin等[12]报道植物源挥发油对苹果病原真菌有抑制作用等。小茴香(FoeniculumvulgareMill)属伞形科草本植物,是一种药食两用植物,其挥发油具有降血脂、抗氧化、抗菌等多种生物活性[13-14]。而对小茴香挥发油抗红枣黑斑病菌活性及其作用机制未见相关报道。
本试验主要研究小茴香挥发油抗红枣黑斑病菌活性,观察不同体积分数小茴香挥发油对红枣黑斑病菌菌丝、孢子、生物量的影响,以及挥发油处理对红枣黑斑病菌孢子细胞的影响,为进一步开发植物源抗菌剂和科学评价其作为抗真菌农药的开发奠定基础。
1材料与方法
1.1供试材料与菌株
1.1.1供试材料 小茴香(FoeniculumvulgareMill)挥发油(Essential oil,EO)及其主要成分香芹酮反式茴香脑(Trans-anethole)和蒎烯(Pinene),由塔里木大学胡建伟教授馈赠,保存于塔里木大学生物研究发展中心。
1.1.2供试菌种细极链格孢(Alternariatenuissima)由塔里木盆地生物资源保护利用兵团重点实验室提供,菌种编号为CGMCC3.3935。
1.2方 法
1.2.1培养基和挥发油配制马铃薯琼脂培养基(PDA)和马铃薯液体培养基(PDB)配方见《微生物学实验技术》[15];小茴香挥发油的配制:挥发油用体积分数为0.1%的无菌吐温20配成体积分数为10 mL/L的储备液,分装,4 ℃冰箱保存备用。
1.2.2A.tenuissima菌种的活化及孢子制备将A.tenuissima接种在PDA斜面上28 ℃培养7 d,用质量分数为0.85%的生理盐水将孢子洗下,然后涂布于PDA平板上,同样在25 ℃条件下培养,用直径9 mm打孔器制菌饼,4 ℃储存备用。将A.tenuissima接种在PDB中,振荡培养(25 ℃、160 r/min)4 d,离心(5 000 r/min、 5 min),弃上清液收集沉淀,加无菌水,用血球计数板调整菌液孢子含量为6×106mL-1,4 ℃储存备用。
1.2.3小茴香挥发油对A.tenuissima抑菌活性的测定参阅微量稀释法[16]用96孔板测定小茴香挥发油对A.tenuissima的最低抑菌体积分数(MIVF)。向96孔板中加入100 μL的PDB培养基,再向第1孔加入100 μL挥发油储备液(体积分数为10 mL/L),然后进行倍性稀释,使96孔板从第1至10孔挥发油体积分数为5~0.018 mL/L。再接种100 μLA.tenuissima孢子含量为6×106mL-1的悬浮液,使每孔终体积为200 μL,第11孔只加入200 μL的PDB培养基,作为培养基对照孔,第12孔加入100 μL的PDB培养基和接种100 μL的菌悬液作为生长对照孔,96孔板加盖并密封以减少生长过程中水分的蒸发,置于25 ℃温箱中培养4 d,眼观无菌生长孔所含该挥发油的最低体积分数即为MIVF,重复3次。最低杀菌体积分数(MFVF)的判定:从每个孔无菌生长的孔内取100 μL接种于PDA培养基,再次在25 ℃培养7 d,无菌落形成的孔所对应的体积分数为其MFVF值。
1.2.4小茴香挥发油对A.tenuissima孢子萌发的影响PDB培养基中加入小茴香挥发油,接种A.tenuissima孢子菌悬液(孢子含量为6×106mL-1),使小茴香挥发油体积分数分别为0.156、0.312、0.625、1.25 mL/L,混匀, 25 ℃振荡培养24 h,移液器取20 μL菌液置于显微镜(4×100倍),用血球计数板观察A.tenuissima孢子萌发情况,以长出菌丝为依据。重复3次,取平均值,并按如下公式计算孢子萌发率。孢子萌发率=发芽孢子数/检查孢子总数×100%。
1.2.5小茴香挥发油对A.tenuissima菌丝抑制作用将A.tenuissima接种PDA平板上,25 ℃培养7 d,用直径9 mm的打孔器取边缘菌块作为菌饼。将19 mL PDA培养基和1 mL不同体积分数的挥发油混匀,倒入直径为9 cm无菌培养皿中,使小茴香挥发油终体积分数分别为0.156、0.312、0.625、1.25 mL/L;以不加挥发油组为空白对照,倒入平板中,冷却。将9 mm菌饼反接入平皿中央,25 ℃恒温培养,每天测量菌丝长度,每个浓度平行重复3次。计算公式:抑制菌丝生长百分率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。
1.2.6小茴香挥发油对A.tenuissima生物量的影响在58 mL PDB培养基中加入2 mL不同体积分数的小茴香挥发油,混匀,使挥发油终体积分数分别为0.156、0.312、0.625、1.25 mL/L;以不加挥发油组为空白对照。每瓶接种6块9 mm菌饼,25 ℃振荡培养7 d,过滤,弃上清收集菌丝体,蒸馏水冲洗3次,于60 ℃烘干6 h,然后置于40 ℃过夜。用分析天平准确称量菌丝体的质量,平行重复3次。计算公式:菌丝质量抑制率=(空白对照组质量-挥发油处理组质量)/空白对照组质量×100%。
1.2.7小茴香挥发油对A.tenuissima活体抗菌试验选择新疆种植面积较大的骏枣为研究对象,随机选取红枣置于聚苯乙烯盒(容积为0.9 L),每盒30个红枣,共设5组。第1组:空白对照组;第2组:0.156 mL/L挥发油处理组;第3组:0.312 mL/L挥发油处理组;第4组:0.625 mL/L挥发油处理组;第5组:1.25 mL/L挥发油。骏枣用体积分数70%乙醇浸泡5 min,无菌水冲洗3~5 次,在无菌室,每个骏枣用打孔器打成直径6 mm、深3 mm 的孔,然后接种10 μLA.alternata菌液(孢子含量为6×106mL-1),置于容积为 0.7 L无菌聚苯乙烯盒中,盒子一侧放称量瓶,瓶里盛放不同体积分数小茴香挥发油30 mL,空白对照组加入30 mL无菌水。25 ℃下培养 60 d,测定骏枣红枣腐败真菌感染率,每处理重复10次。
1.2.8小茴香挥发油对A.tenuissima细胞膜通透性的影响将A.tenuissima接种于PDA,25 ℃下培养7 d,用无菌生理盐水洗孢子,血球计数板调整菌悬液浓度(孢子含量为6×106mL-1),备用。
7 mL离心管中加入100 μL挥发油贮备液,再分别向试管中加入3.8 mL PBS-2%(体积分数)葡萄糖,使小茴香挥发油终体积分数分别为0.156、0.312、0.625、1.25 mL/L,接种100 μL孢子悬浮液,以不加小茴香挥发油组为空白对照组。振荡培养24 h(25 ℃,150 r/min),2 000 g离心5 min,收集沉淀,用无菌PBS洗涤2次,A.tenuissima细胞重悬于500 μL PBS中,加入5 μL PI(PI终质量浓度为1 mg/L),25 ℃避光培养30 min,用PBS洗2次,重新悬于500 μL PBS中,于FACSCalibur (BD Biosciences)流式细胞仪检测,激发波长488 nm,发射波长620 nm (FL2通道),侧向角散射光(SSC)表示细胞颗粒度。
1.2.9小茴香挥发油对A.tenuissima细胞膜麦角固醇合成的影响参照文献[17]测定小茴香挥发油对A.tenuissima细胞膜麦角固醇含量的影响。250 mL三角瓶中加入58 mL PDB和1 mL小茴香挥发油储备液,混匀,使其终体积分数分别为0.156、0.312、0.625、1.25 mL/L,以不加挥发油为空白对照组。接种1 mLA.tenuissima菌悬液(孢子含量为6×106mL-1),振荡培养(25 ℃、150 r/min)4 d。5 000 g离心5 min,收集细胞,并称取1 g,加入10 mL 质量分数为25%氢氧化钾乙醇溶液,剧烈震动10 min,然后85 ℃水浴2 h。加入水和正庚烷混合溶液[V(水)∶V(正庚烷)=1∶3]剧烈振荡10 min,室温静置,待分层后,将正庚烷层转移至干净瓶中,于-20 ℃冰箱中放置24 h。分析时将正庚烷层用无水乙醇进行稀释,于全波长紫外可见分光光度计扫描(波长230~300 nm)。麦角固醇和去氢麦角固醇[24(28)DHE,为合成麦角甾醇的中间产物],都在波长281.5 nm处有吸收峰,但去氢麦角固醇在波长230 nm处也有强吸收峰。麦角固醇质量分数计算公式:麦角固醇质量分数=[(A281.5/290-A230/518)×F]/菌丝质量。其中,F为稀释倍数,290和518为常数。
1.2.10小茴香挥发油对A.tenuissima细胞通透性的影响于5 mL离心管中加入挥发油储备液100 μL,再向试管中加入3.8 mL PBS和200 μL菌悬液,使挥发油终体积分数分别为0.156、0.312、0.625、1.25 mL/L,25 ℃、150 r/min振荡培养,分别于2、4、6 h取样,5 000 g离心5 min,测定上清液(上清液用PBS稀释)260 nm处OD值(OD260)。
1.3数据统计分析
用SPSS 13.0中One way ANOVA中Student-Newman-Keuls对所有数据进行分析。
2结果与分析
2.1小茴香挥发油对A.tenuissima孢子的MIVF、MFVF的影响
由表1可知,小茴香挥发油及其主要成分(反式茴香脑和蒎烯)对A.tenuissima具有抑制作用,小茴香挥发油对A.tenuissima的MIVF和MFVF分别为0.312 mL/L和 0.625 mL/L;反式茴香脑对A.tenuissima的MIVF和MFVF分别为0.312 mL/L和 0.625~1.25 mL/L;蒎烯对A.tenuissima的MIVF和MFVF分别为0.625 mL/L和 1.25 mL/L。以上结果说明小茴香挥发油具有抗农业病原真菌活性取决于其主要成分反式茴香脑和蒎烯。

表1 小茴香挥发油、反式茴香脑和蒎烯对A.tenuissima的MIVF和MFVF的影响
2.2小茴香挥发油对A.tenuissima孢子萌发的影响
由图1可知,小茴香挥发油对A.tenuissima孢子萌发有一定抑制作用,当小茴香挥发油体积分数为0.156、0.321、0.625 mL/L时,A.tenuissima孢子萌发率依次为66.31%、48.23%、25.20%;当小茴香挥发油体积分数为1.25 mL/L时,孢子萌发率仅为3.21%,而抑制率达到96.79%。由此说明,小茴香挥发油对A.tenuissima重要繁殖体有影响。
2.3小茴香挥发油对A.tenuissima菌丝的抑制作用
小茴香挥发油对A.tenuissima菌丝有较好的抑制作用(图2),当挥发油体积分数为0.156、0.312、0.625 mL/L时,小茴香挥发油对A.tenuissima的抑制率分别为18.35%、35.50%、80.10%,当小茴香挥发油体积分数为1.25 mL/L 时,抑制率可达100%。

不同字母表示差异显著(P<0.05),下图同。
Bars with different superscripts letters in the bars (a-e) show differ significantly difference (P<0.05),the same as below.
图1小茴香挥发油处理下A.tenuissima
孢子萌发率的变化 (n=3)
Fig.1Changes of different volume fraction EO from
FoeniculumvulgareMill on spore
germination ofA.tenuissima(n=3)

图2 小茴香挥发油处理下A.tenuissima
2.4小茴香挥发油对A.tenuissima生物量的影响
由图3可知,小茴香挥发油对A.tenuissima生物量的形成有抑制作用。A.tenuissima接种于含不同体积分数小茴香挥发油(0.156、0.312、0.625、1.25 mL/L)的PDB中,振荡培养7 d时,对A.tenuissima生物量的抑制率分别为21.54%、48.62%、79.21%、98.01%。

图3 小茴香挥发油处理下A.tenuissima
2.5小茴香挥发油对A.tenuissima活体抗菌试验
小茴香挥发油对A.tenuissima活体抗菌试验如图4所示,由图可知,挥发油对A.tenuissima的生长有明显抑制作用。随着挥发油体积分数的增加,骏枣的腐烂率明显减少,而对照组几乎所有的红枣都腐烂,当挥发油体积分数为1.25 mL/L时,对A.alternata感染的红枣抑制率达到86.77%。

图4 小茴香挥发油对A.tenuissima
2.6小茴香挥发油对A.tenuissima细胞膜通透性的影响
碘化吡啶(PI)是一种荧光染料,可以评价药物对细胞膜完整性的影响,当药物破坏细胞膜结构,PI可以进入细胞与细胞核结合发出红色荧光,本试验用此方法检测小茴香挥发油对A.tenuissima细胞膜的影响,试验结果如图5所示。空白对照组,(3.12±0.42)%的A.tenuissima细胞被PI染色,说明在不加任何药物的情况下,PI几乎无法穿越A.tenuissima细胞膜进入细胞内与DNA结合;当小茴香挥发油体积分数分别为0.156、0.312、0.625 mL/L时PI着色率依次为(20.03±2.14)%、(65.21±3.51)%、(82.63±2.45)%,说明小茴香挥发油对A.tenuissima细胞膜有一定的损伤,且与小茴香挥发油体积分数呈正相关性;当挥发油体积分数为1.25 mL/L时,(98.30±3.56)%的细胞被PI染色,说明该体积分数下小茴香挥发油可对A.tenuissima细胞膜造成较大的损伤或使细胞膜通透性变大,致使PI能够透过膜进入胞内与DNA结合。说明小茴香挥发油可能破坏了A.tenuissima细胞的膜结构,导致其细胞膜失去完整性。

A.空白对照组Control;B、C、D、E.挥发油体积分数分别为0.156、0.312、0.625、1.25 mL/LEO at 0.156,0.312,0.625,1.25 mL/L,respectively
图5小茴香挥发油对A.tenuissima细胞膜损伤的影响
Fig.5Effect of EO fromFoeniculumvulgareMill on lesion of plasma membrane ofA.tenuissima
2.7小茴香挥发油对A.tenuissima细胞膜麦角固醇合成的影响
与空白对照组相比,小茴香挥发油体积分数分别为0.156、0.312、0.625、1.25 mL/L时,对A.tenuissima细胞膜中麦角固醇合成的抑制率分别为(17.21±1.36)%、(35.81±2.35)%、(53.64±3.21)%和(83.26±2.41)%(图6)。说明小茴香挥发油明显地影响麦角固醇的合成,且呈体积分数依赖关系,从而影响细胞膜的完整性。

图6 小茴香挥发油处理下A.tenuissima
2.8小茴香挥发油对A.tenuissima细胞内容物的影响
同一处理时间内不同体积分数的小茴香挥发油(0.156、0.312、0.625、1.25mL/L)OD260值(主要是细胞内核酸物质)依次增大(表2),说明小茴香挥发油活性成分导致A.tenuissimaOD260特征吸收值物质的泄露,细胞内容物与体积分数呈正相关;同一体积分数不同处理时间(2 h、4 h、6 h、8 h)OD260值也依次增大(表2),说明细胞内容物与药物处理时间呈正相关。可见,挥发油处理A.tenuissima后导致细胞内容物泄露,从而导致A.tenuissima死亡。
Table 2Substance effect of EO onA.tenuissima
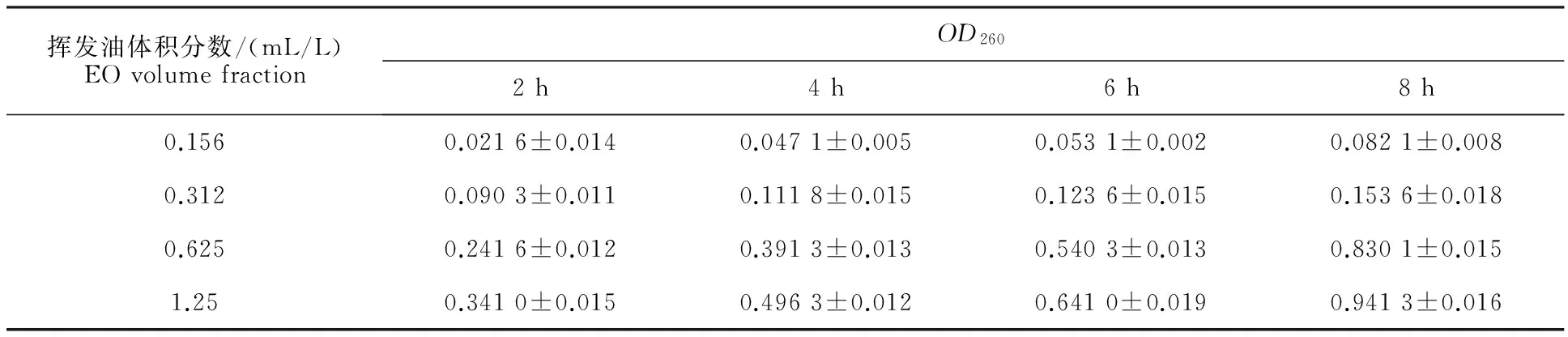
挥发油体积分数/(mL/L)EOvolumefractionOD2602h4h6h8h0.1560.0216±0.0140.0471±0.0050.0531±0.0020.0821±0.0080.3120.0903±0.0110.1118±0.0150.1236±0.0150.1536±0.0180.6250.2416±0.0120.3913±0.0130.5403±0.0130.8301±0.0151.250.3410±0.0150.4963±0.0120.6410±0.0190.9413±0.016
3结论与讨论
据Zeng等[17]报道,反式茴香脑和蒎烯为小茴香挥发油主要成分,本试验采用微量稀释法测得小茴香挥发油及其主要成分反式茴香脑和蒎烯对A.tenuissima最低抑菌体积分数分别为0.312、0.312和0.625 mL/L。从本试验结果可知,小茴香挥发油、反式茴香脑和蒎烯具有抗A.tenuissima活性。小茴香挥发油具有抗A.tenuissima效果主要归结为挥发油中的主要成分反式茴香脑和蒎烯,国外研究者也报道反式茴香脑和蒎烯具有抗微生物活性[18-20]。
综合抗菌试验可知,小茴香挥发油体积分数为1.25 mL/L时对A.tenuissima菌丝生长、孢子萌发和生物量的生成抑制率大于90%。小茴香挥发油对A.tenuissima离外抗菌指标表明小茴香挥发油对A.tenuissima具有较强抑制作用,活体试验结果也表明挥发油对A.tenuissima的生长有抑制作用,挥发油体积分数为1.25 mL/L时,对A.alternata感染的红枣抑制率达到86.77%,在同一体积分数下,体外抗菌试验结果低于活体抗菌试验结果,可能是因为骏枣营养成分高于培养基成分。
细胞膜是细胞的重要结构之一,且其有重要生理功能,比如维持稳定代谢的胞内环境,调节和选择物质进出细胞等。许多学者研究发现[ 21-22]植物挥发油对病原细胞膜有损伤而达到抗菌作用。 本试验通过PI染色试验、麦角固醇合成抑制试验、细胞内容物泄露试验证实小茴香挥发油对A.tenuissima细胞膜损坏而达到抗菌作用,说明细胞膜是其抗菌靶点之一,小茴香挥发油进入A.tenuissima细胞内后,是否影响产生能量的线粒体有待进一步研究。
本试验首次研究小茴香挥发油对红枣黑斑病菌(A.tenuissima)抗菌活性及对其细胞膜的影响,由试验结果可得小茴香挥发油通过破坏A.tenuissima细胞膜而达到抗菌作用。
参考文献Reference:
[1]陈小飞,黄敏,胡守林,等.10种杀菌剂及其混配剂对骏枣黑斑病菌室内毒力测定[J].中国农学通报,2013(4):200-205.
CHEN X F HUANG M,HU SH L,etal.Indoor toxicity test of ten fungicides and their mixtures to jujube black spot pathogen[J].ChineseAgriculturalScienceBulletin,2013(4):200-205(in Chinese with English abstract).
[2]陈小飞,熊仁次,董红强,等.南疆骏枣黑斑病和缩果病空间分布型测定及抽样技术研究[J].新疆农业科学,2013(5):870-874.
CHEN X F,XIONG R C,DONG H Q,etal.Studies on spatial distribution and sampling technique of Jun jujube black spot and fruit shrink disease in southern Xinjiang [J].XinjiangAgriculturalSciences,2013(5):870-874(in Chinese).
[3]向征.新疆南疆两种枣树病害的研究[D].新疆石河子:石河子大学,2013.
XIANG ZH.The research of jujube blackspot disease and jujube root rot disease in the south Xinjiang Basin [D].Shihezi Xinjiang:Shihezi University,2013 (in Chinese with English abstract).
[4]BADAWY M E I,ABDELGALEIL S A M.Composition and antimicrobial activity of essential oils isolated from Egyptian plants against plant pathogenic bacteria and fungi[J].IndustrialCropsandProducts,2014,52:776-782.
[5]COX S D,MANN C M,MARKHAM J L,etal.The mode of antimicrobial action of essential oil ofMelaleucaalternifola(tea tree oil) [J].JournalofAppliedMicrobiology,2000,88:170-175.
[6]CHEN Y C,ZENG H,TIAN Jetal.Antifungal mechanism of essential oil fromAnethumgraveolensseeds againstCandidaalbicans[J].JournalofMedicalMicrobiology,2013,62:1175-1183.
[7]刘海燕.细辛挥发油抗植物病原真菌活性及作用机理研究[D].北京:中国协和医科大学,2006.
LIU H Y.The inhibition of phytopathogenic fungi and mechanism of essential oil extracted fromAsarumheterotropoidesFr.Schmidt var.mandshucrium(Maxim.)Kitag [D].Beijing:Peking Union Medical College and Chinese Academy of Medical Sciences,2006(in Chinese with English abstract).
[8]田俊.莳萝子挥发油抗食品腐败真菌活性、作用机理及天然防腐剂的开发研究[D].武汉:武汉大学,2012.
TIAN J.Studies on antifungal activity,mechanism against food spoilage fungi and development of a natural preservative of essential oil from dill (AnethumgraveolensL.) [D].Wuhan:Wuhan University,2012(in Chinese with English abstract).
[9]班小泉.莳萝子和黄连花提取物抗菌与抗氧化活性研究[D].武汉:华中农业大学,2011.
BAN X Q.Antimicrobial and antioxidant properties of extracts fromAnethumgraveolensseeds andCoptischinensisorescence [D].Wuhan:Huazhong Agricultural University,2011(in Chinese with English abstract).
[10]熊梅.11种常用维吾尔种子药材精油成分及抑菌活性研究[D].乌鲁木齐:新疆大学,2013.
XIONG M.Studies on the chemical composition and antibacterial activities of the 11 common traditional Uygur medicine [D].Urumqi:Xinjiang University,2013(in Chinese with English abstract).
[11]KUMAR V,MATHELA C S,TEWARI G,etal.Chemical composition and antifungal activity of essential oils from three Himalayan Erigeron species[J].FoodScienceTechnol-LEB,2014,56(2):278-283.
[12]ZNINI M,CRISTOFARI G,MAJIDI L,etal.Essential oil composition and antifungal activity ofPulicariamauritanicaCoss.,against postharvest phytopathogenic fungi in apples[J].FoodScienceTechnol-LEB,2013,54(2):564-569.
[13]ROBY M H H,SARHAN M A,SELIM K A H,etal.Antioxidant and antimicrobial activities of essential oil and extracts of fennel (FoeniculumvulgareL.) and chamomile (MatricariachamomillaL.)[J].IndustrialCropsandProducts,2013,44:437-445.
[14]SINGH G,MAURYA S,DE LAMPASONA M P,etal.Chemical constituents,antifungal and antioxidative potential ofFoeniculumvulgarevolatile oil and its acetone extract[J].FoodControl,2006,17(9):745-752.
[15]程丽娟,薛泉宏,来航线,等.微生物学实验技术[M].西安:世界图书出版公司,2000.
CHENG L J,XUE Q H,LAI H X,etal.Microbiological Experiment Technology[M].Xi’an:World Press Company,2000(in Chinese).
[16]CLSI.Reference method for broth dilution antifungal susceptibility testing of filamentous fungi[S].Wayne,PA:Clinical and Laboratory Standards Institute,2008.
[17]ZENG H,CHEN X P,LIANG J N.In vitro antifungal activity and mechanism of essential oil from fennel (FoeniculumvulgareL.) on dermatophyte species[J].JournalofMedicalMicrobiology,2015,64(1):93-103.
[18]DOBRIKOV G M,VALCHEVA V,NIKOLOVA Y,etal.Enantiopure antituberculosis candidates synthesized from (-)-fenchone[J].EuropenJournalofMedicinalChemistry,2014,77:243-247.
[19]FUJITA K I,KUBO I.Potentiation of fungicidal activities of trans-anethole againstSaccharomycescerevisiaeunder hypoxic conditions[J].JournalBiosciBioeng,2004,98:490-492.
[20]NAEINI A,NADERI N J,SHOKRI H.Analysis and in vitro anti-Candidaantifungalactivity ofCuminumcyminumandSalvadorapersicaherbs extracts against pathogenic Candida strains[J].JournaldeMycologieMedicale,2014,24:13-18.
[21]PINTO E,PINA-VAZ C,SALGUEIRO L,etal.Antifungal activity of the essential oil ofThymuspulegioideson Candida,Aspergillus and dermatophyte species [J].JournalofMedicalMicrobiology,2006,55(10):1367-1373.
[22]PINTO E,VALE-SILVA L,CAVALEIRO C,etal.Antifungal activity of the clove essential oil fromSyzygiumaromaticumon Candida,Aspergillus and dermatophyte species[J].JournalofMedicalMicrobiology,2009,58(11):1454-1462.
Received 2015-06-18Returned2015-07-12
Foundation itemProgram of Key Laboratory of Protection and Utilization of Biological Resources(No.BRZD1205).
First authorMA Jiangfeng,male,master.Research area:plant protection.E-mail:30768050@qq.com
(责任编辑:潘学燕Responsible editor:PAN Xueyan)
Antifungal Activity and Preliminary Mechanism of Essential Oil fromFoeniculumvulgareMill onAlternariatenuissima
MA Jiangfeng1,2and ZENG Hong1
(1. Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin of Xinjiang Production&Construction Corps/College of Life Science,Tarim University,Alar Xinjiang843300,China;2.General Station of Agricultural Extension of XJPCC,Urumqi830011,China)
AbstractThe objective of this study is to assess the fennel seeds essential oil (EO) against Alternaria tenuissima and its mechanism of action on A.tenuissima. The microbroth dilution method was used in the minimal inhibitory volume fraction (MIVF).The antifungal efficacy of EO from fennel seeds against A.tenuissima had been proven through in vitro (mycelial growth,spore germination and mycelium mass) and in vivo tests.The results showed EO from fennel was active in vitro against A.tenuissima and MIVF was 0.312 mL/L.Mycelial growth,mycelium biomass and spore germination were inhibited by the EO from fennel in a dose-dependent manner. The results also showed that the treatment of cells with EO from fennel,propidium iodide penetrated A.tenuissima through a lesion in its plasma membrane. Thus,the results indicated that EO from fennel could be potential source of plant-derived fungicides to control certain important A.tenuissima.
Key wordsFoeniculum vulgare Mill; Alternaria tenuissima;Anti-A.tenuissima activity;Plasma membrane
Corresponding authorZENG Hong,female,Ph.D.Research area:patherological microbiology.E-mail:zenghong0705@163.com
中图分类号S435.621
文献标志码A
文章编号1004-1389(2016)03-0450-08
通信作者:曾红,女,博士,研究方向为药用微生物。E-mail:zenghong0705@163.com
基金项目:塔里木盆地生物资源保护利用兵团重点实验室开放课题(BRZD1205)。
收稿日期:2015-06-18修回日期:2015-07-12
网络出版日期:2016-03-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160306.1611.036.html
第一作者:马江锋,男,硕士,研究方向为植物保护。E-mail:30768050@qq.com
