血清磷水平与慢性肾脏病疾病进展的关系
2016-06-01向海燕张丽华刘志红章海涛
向海燕 蒋 松 潘 瑜 张丽华 刘志红 章海涛
血清磷水平与慢性肾脏病疾病进展的关系
向海燕 蒋 松 潘 瑜 张丽华 刘志红 章海涛
目的:分析血清磷水平对糖尿病肾病和非糖尿病肾病患者疾病进展的影响。 方法:回顾性分析成人糖尿病肾病和非糖尿病肾病(IgA肾病和膜性肾病)慢性肾脏病(CKD) 1~4期患者的临床资料,根据患者血清磷水平四分位数将患者分为四组,以等级资料进入模型行多因素COX回归分析血清磷水平与CKD患者预后的关系,再对糖尿病肾病和非糖尿病肾病患者分别进行分析。 结果:在所有入组患者中,单因素分析血清磷上四分位组发生终点事件的风险是下四分位组的5.29倍(P<0.001)。多因素校正后为2.59倍(P<0.001)。在糖尿病肾病中,单因素、多因素分析血清磷上四分位组发生终点事件的风险分别是下四分位组的5.99倍(P<0.001)和2.38倍(P=0.024)。而在非糖尿病肾病中,多因素分析显示血清磷与疾病进展无关。 结论:在糖尿病肾病患者中血清磷是疾病进展的独立危险因素,而非糖尿病肾病患者中血清磷与疾病进展无关。说明血清磷水平与CKD进展的关系在不同病因中存在差异,在分析CKD患者血清磷与预后的研究中必须考虑基础疾病的影响。
慢性肾脏病 血清磷 估算的肾小球滤过率 危险因素
慢性肾脏病(CKD)患病率不断增加,因其预后差、治疗费用高昂,目前已经成为世界性的公共健康问题[1]。早期发现并控制CKD及其进展的危险因素至关重要。除了公认的危险因素如高血压、蛋白尿等,越来越多的证据表明血清磷水平也会影响CKD的进展[2]。
血清磷增加可导致继发性甲状旁腺功能亢进、矿物质和骨代谢紊乱等,与CKD患者心血管疾病发生(包括左心室肥厚和血管钙化)有关,且与患者病死率密切相关,但血清磷在CKD进展中的作用存在争议。目前,有关血清磷与CKD预后关系的研究大部分来源于社区人群或CKD高危人群,CKD的病因不明确,且随访时间较短[2-5]。糖尿病肾病进展较快,部分研究显示糖尿病肾病与非糖尿病肾病钙磷代谢及调节存在差异,但是血清磷与其疾病进展的关系并无明确结论[6-7]。
本项研究利用南京军区南京总医院肾脏科2003年以来的三项CKD队列[8-10],所有患者均有明确的原发病肾活检诊断,其中包括糖尿病肾病和原发性肾小球疾病(IgA肾病和膜性肾病)队列患者,分析血清磷与预后及CKD进展的关系,为早期评估、干预矿物质及骨代谢紊乱,延缓CKD进展提供证据。
对象和方法
研究对象 2003年1月~2013年1月在南京军区南京总医院肾脏科三项队列研究的成人CKD 1~4期患者,肾活检诊断包括糖尿病肾病、IgA肾病和膜性肾病;符合2012年KDIGO关于CKD定义的标准[11]。排除标准:(1)估算的肾小球滤过率(eGFR)<15 ml/(min·1.73m2);3个月内接受肾脏替代治疗(血液透析、腹膜透析或肾移植)的患者;(2)年龄<18岁者;(3)随访时间<1年者;(4)相关检查资料不全者。
相关定义 终点事件:血清肌酐(SCr)倍增、eGFR<15 ml/(min·1.73m2)或接受长期肾脏替代治疗。高磷血症:血清磷≥1.45 mmol/L。高血压:静息状态下收缩压≥140 mmHg和(或)收缩压≥90 mmHg,需2次测量值。糖尿病肾病、IgA肾病和膜性肾病诊断及排除标准见文献[8-10]。
临床及实验室指标 收集患者基线资料,包括一般情况(年龄、性别、原发病、是否伴有糖尿病、高血压病史等);用药情况(血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂、碳酸氢钠、钙剂、活性维生素D、激素、利尿剂、降脂药物等);实验室检查(夜间禁食后进行全血分析包括血红蛋白、血糖、总胆固醇、高密度脂蛋白胆固醇、三酰甘油、低密度脂蛋白胆固醇、尿素、SCr、白蛋白、血清钙、磷,尿常规、尿沉渣、24h尿蛋白定量。收集随访过程中SCr,运用基于SCr的EPI公式计算eGFR[12]。
统计方法 采用SPSS19.0软件进行统计分析。计量资料采用均数±标准差(正态分布)和中位数及第25、75百分位数表示(偏态分布),组间比较采用t检验(正态分布、方差齐性时)或Satterthwaitet检验(正态分布、方差不齐性时)或Wilcoxon秩和检验(非正态分布时),多组比较采用方差分析。分类资料以百分比表示,组间比较采用χ2检验。根据各队列人群各自血清磷水平四分位数将患者分为四组,以等级资料进入模型行多因素COX回归分析血清磷水平与CKD患者预后的关系。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般资料 患者基线时的一般临床资料及实验室检查资料见表1,共观察1 757例患者,中位随访时间65个月。其中糖尿病肾病591例,平均eGFR(73.3±30.6)ml/(min·1.73m2);非糖尿病肾病1 166例(IgA肾病957例,膜性肾病209例),平均eGFR (87.2±31.6)ml/(min·1.73m2)。糖尿病肾病患者年龄较大、高血压发生率较高、eGFR较低。所有患者血磷平均为(1.2±0.2)mmol/L,糖尿病肾病在CKD各期平均血清磷水平较高。高磷血症的发生率随着GFR下降而升高(图1)。糖尿病肾病CKD 1~4期高磷血症的发生率分别为10.8%、16.8%、28.6、41.5%,均高于非糖尿病肾病。
血清磷水平与CKD疾病进展的关系 根据患者血清磷的四分位数1.18(1.05,1.31),将患者分为四组(Quartile 1,2,3,4),分别有426例、451例、430例、450例患者。在随防期间,Quartile 1组中50例(11.7%)发生终点事件,Quartile 2、Quartile 3、Quartile 4组发生率分别为13.7%、24.9%、39.8%。使用Kaplan-Meier分析,肾脏累积生存率在不同血清磷各组间存在显著差异(图2)。

表1 患者入组时一般情况及实验室检查资料

图1 不同肾脏疾病在不同慢性肾脏病(CKD)分期时高磷血症的发生率

图2 不同血清磷水平患者肾脏生存曲线
COX回归分析结果显示,在单因素分析中,Quartile 4组发生终点事件的风险是Quartile 1组的5.29倍(P<0.001)。当分别对年龄、性别、高血压、白蛋白、胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、血清钙、尿酸、尿蛋白定量、基线GFR进行校正后,Quartile 4组发生终点事件的风险是Quartile 1组的2.59倍(P<0.001)(表2)。
血清磷水平与糖尿病肾病及非糖尿病肾病进展的关系 在随访期间内,591例糖尿病肾病患者有208例出现终点事件;1 166例非糖尿病患者有190例出现终点事件。使用Kaplan-Meier分析,两组间肾脏累积生存率存在显著差异(P<0.001)。进一步分析血磷与糖尿病肾病和非糖尿病肾病进展的关系,肾脏累积生存率在血清磷各组间存在显著差异。
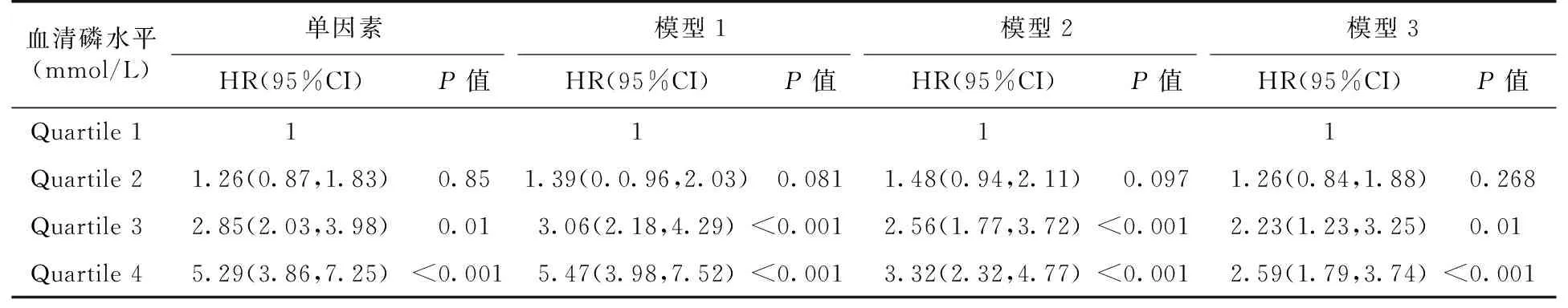
表2 血清磷与所有入组患者疾病进展的COX回归分析
模型1以年龄为连续性变量,性别为二分类变量进入模型;模型2以年龄、白蛋白、胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、血清钙、尿酸、尿蛋白定量以连续变量进入模型;性别、是否患高血压为二分类变量进入模型;模型3在模型2基础上加入估计的肾小球滤过率进入模型
对两组进行COX回归分析结果显示,在糖尿病肾病中,单因素分析Quartile 4组发生终点事件的风险是Quartile 1组的5.99倍(P<0.001)。当加入基线GFR及其他危险因素校正后Quartile 4组发生终点事件的风险是Quartile 1组的2.38倍(P=0.024)。在非糖尿病肾病单因素分析中,Quartile 4组发生终点事件的风险是Quartile 1组的2.56倍(P<0.001)。当加入基线GFR及其他危险因素校正后Quartile 4组发生终点事件的风险是Quartile 1组的1.57倍(表3)。

表3 各疾病四分位血清磷与疾病进展的COX回归分析
多因素以年龄、估计的肾小球滤过率、白蛋白、胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、血清钙、尿 酸、尿蛋白定量以连续变量进入模型,性别、是否患高血压为二分类变量进入模型
讨 论
慢性肾脏病矿物质与骨异常(CKD-MBD)是CKD患者重要的并发症,影响疾病的发展和患者的预后。其中,在CKD各个阶段的血清磷控制是关键因素之一[13]。
既往研究发现高磷血症与CKD的进展、终末期肾病(ESRD)的发生及移植肾功能下降有关[14-16]。但部分研究并未发现血清磷水平和CKD进展、ESRD的相关性[4],由于这些研究的随访时间短,而CKD的发展是慢性迁延过程,因此血清磷与CKD疾病进展的关系还需进一步证实。
目前普遍认为磷的蓄积开始于CKD 3b阶段,直到患者的GFR<40 ml/(min·1.73 m2)时血清磷水平开始上升[17]。但是高血清磷和(或)磷超负荷对健康的不利影响似乎并不限于CKD的后期阶段[2-3]。本研究证实部分患者即使在CKD 1~2期也存在高磷血症,而且糖尿病肾病高磷血症的发生率高于其他疾病。既往研究显示糖尿病肾病患者矿物质代谢异常的发生与非糖尿病肾病有不同之处,糖尿病肾病患者较非糖尿病肾病患者更早出现矿物质代谢紊乱,在CKD 1~2期糖尿病肾病患者就会出现血清磷、成纤维细胞生长因子23(FGF-23)升高,血钙、维生素D水平降低[6,18]。而糖尿病肾病患者尿磷排泄较非糖尿病肾病患者低,血磷水平高[7]。因此糖尿病肾病患者高磷血症发生率高。
导致CKD的疾病很多,在我国最常见的为原发性肾小球疾病和糖尿病肾病,每个疾病的进展情况存在差异,糖尿病肾病进展较快,更容易进展至ESRD[18-19]。在对血清磷与CKD进展的研究中,Bellasi等[20]研究显示在糖尿病肾病中血清磷预测疾病进展的意义较非糖尿病肾病大。而Fliser等[21]在早中期非糖尿病肾病患者中发现FGF-23是疾病进展的独立危险因素,而非血清磷(HR 1.09,P=0.063)。导致各研究结果的差异有可能与入选患者的种族、CKD病因的差异有关。本研究对所有入组患者进行分析发现,血清磷是CKD进展的危险因素。但是把糖尿病肾病与非糖尿病肾病分别进行分析后发现,血清磷仅在糖尿病肾病组患者是CKD疾病进展的独立危险因素,证实了血清磷预测糖尿病肾病ESRD的意义较非糖尿病肾病更大。
血清磷在各个疾病进展之间的差异,机制尚不清楚。糖尿病肾病患者较非糖尿病肾病患者血磷水平高,更早出现高磷血症。在动物模型中已经证实,高磷可导致肾脏结构变化和肾功能的下降[22]。高磷饮食已被证明加速肾功能的恶化,而低磷饮食可延缓CKD进展[23-24]。高血磷可通过Pit-1损伤足细胞及肾小球滤过屏障,导致肾小球硬化[25];磷负荷增加导致全身血管内皮损伤,可促进钙磷沉积在肾小管和肾间质,导致肾小管萎缩,肾间质纤维化,使肾功能进一步下降[26]。因此,糖尿病肾病患者血磷独立于其他危险因素影响疾病进展,与其磷调节激素水平紊乱、高磷血症出现早有关。血磷升高进一步加速肾小管功能受损、炎症反应、肾小球硬化,肾功能进一步下降,而其具体机制还有待进一步研究。
本研究仅初步分析了血磷在不同病因肾脏疾病进展中及与预后的关系,还存在一定不足:首先,回顾性分析无法控制治疗因素对预后的影响;其次,仅在固定的队列研究中进行观察;再次,未检测FGF-23、甲状旁腺激素及维生素D等调节钙磷代谢相关的激素水平。
总之,血清磷与CKD的进展的关系在各个疾病间存在差异,在对CKD患者血清磷与预后的研究中,需考虑CKD基础疾病的因素。血清磷是糖尿病肾病疾病进展的独立危险因素。在糖尿病肾病患者CKD早期,随着血清磷水平的升高,CKD进展的风险也随之增大,需早期干预以延缓疾病进展。
1 Eckardt KU,Coresh J,Devuyst O,et al.Evolving importance of kidney disease:from subspecialty to global health burden.Lancet,2013,382(9887):158-169.
2 Da J,Xie X,Wolf M,et al.Serum Phosphorus and Progression of CKD and Mortality:A Meta-analysis of Cohort Studies.Am J Kidney Dis,2015,66(2):258-265.
3 O′Seaghdha CM,Hwang SJ,Muntner P,et al.Serum phosphorus predicts incident chronic kidney disease and end-stage renal disease.Nephrol Dial Transplant,2011,26(9):2885-2890.
4 Mehrotra R,Peralta CA,Chen SC,et al.No independent association of serum phosphorus with risk for death or progression to end-stage renal disease in a large screen for chronic kidney disease.Kidney Int,2013,84(5):989-997.
5 Schwarz S,Trivedi BK,Kalantar-Zadeh K,et al Association of disorders in mineral metabolism with progression of chronic kidney disease.Clin J Am Soc Nephrol,2006,1(4):825-831.
6 Wahl P,Xie H,Scialla J,et al.Earlier onset and greater severity of disordered mineral metabolism in diabetic patients with chronic kidney disease.Diabetes Care,2012,35(5):994-1001.
7 Chen H,Li X,Yue R,Ren X,et al.The effects of diabetes mellitus and diabetic nephropathy on bone and mineral metabolism in T2DM patients.Diabetes Res Clin Pract, 2013,100(2):272-276.
8 Le W,Liang S,Hu Y,et al.Long-term renal survival and related risk factors in patients with IgA nephropathy:results from a cohort of 1155 cases in a Chinese adult population.Nephrol Dial Transplant,2012,27(4):1479-1485.
9 Zuo K,Wu Y,Li SJ,et al.Long-term outcome and prognostic factors of idiopathic membranous nephropathy in the Chinese population.Clin Nephrol,2013,79(6):445-453.
10 An Y,Xu F,Le W,et al.Renal histologic changes and the outcome in patients with diabetic nephropathy.Nephrol Dial Transplant,2015,30(2):257-266.
11 Stevens PE,Levin A; Kidney Disease:Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members.Evaluation and management of chronic kidney disease:synopsis of the kidney disease:improving global outcomes 2012 clinical practice guideline.Ann Intern Med,2013,158(11):825-830.
12 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
13 Slatopolsky E,Moe S.50 years of research and discovery in chronic kidney disease and mineral & bone disorder:the central role of phosphate.Kidney Int,2011,Suppl (121):S1-2.
14 Norris KC,Greene T,Kopple J,et al.Baseline predictors of renal disease progression in the African American Study of Hypertension and Kidney Disease.J Am Soc Nephrol,2006,17(10):2928-2936.
15 Chue CD,Edwards NC,Davis LJ,et al.Serum phosphate but not pulse wave velocity predicts decline in renal function in patients with early chronic kidney disease.Nephrol Dial Transplant,2011,26(8):2576-2582.
16 Haynes R,Staplin N,Emberson J,et al.Evaluating the contribution of the cause of kidney disease to prognosis in CKD:results from the Study of Heart and Renal Protection (SHARP).Am J Kidney Dis,2014,64(1):40-48.
17 Levin A,Bakris GL,Molitch M,et al.Prevalence of abnormal serum vitamin D,PTH,calcium,and phosphorus in patients with chronic kidney disease:results of the study to evaluate early kidney disease.Kidney Int,2007,71(1):31-38.
18 Ekart R,Ferjuc A,Furman B,et al.Chronic kidney disease progression to end stage renal disease:a single center experience of the role of the underlying kidney disease.Ther Apher Dial,2013,17(4):363-367.
19 Tanaka H,Hamano T,Fujii N,et al.The impact of diabetes mellitus on vitamin D metabolism in predialysis patients.Bone,2009,45(5):949-955.
20 Bellasi A,Mandreoli M,Baldrati L,et al.Chronic kidney disease progression and outcome according to serum phosphorus in mild-to-moderate kidney dysfunction.Clin J Am Soc Nephrol,2011,6(4):883-891.
21 Fliser D,Kollerits B,Neyer U,et al.Fibroblast growth factor 23 (FGF23) predicts progression of chronic kidney disease:the Mild to Moderate Kidney Disease (MMKD) Study.J Am Soc Nephrol,2007,18(9):2600-2608.
22 Neves KR,Graciolli FG,dos Reis LM,et al.Adverse effects of hyperphosphatemia on myocardial hypertrophy,renal function,and bone in rats with renal failure.Kidney Int,2004,66(6):2237-2244.
23 Newsome B,Ix JH,Tighiouart H,et al.Effect of protein restriction on serum and urine phosphate in the modification of diet in renal disease (MDRD) study.Am J Kidney Dis,2013,61(6):1045-1046.
24 Isakova T,Barchi-Chung A,Enfield G,et al.Effects of dietary phosphate restriction and phosphate binders on FGF23 levels in CKD.Clin J Am Soc Nephrol,2013,8(6):1009-1018.
25 Navarro-González JF,Mora-Fernández C,Muros M,et al.Mineral metabolism and inflammation in chronic kidney disease patients:a cross-sectional study.Clin J Am Soc Nephrol,2009,4(10):1646-1654.
26 Kanbay M,Goldsmith D,Akcay A,et al.Phosphate - the silent stealthy cardiorenal culprit in all stages of chronic kidney disease:a systematic review.Blood Purif,2009,27(2):220-230.
(本文编辑 莫 非 凡 心)
Association of serum phosphorus with the progression of chronic kidney disease
XIANGHaiyan,JIANGSong,PANYu,ZHANGLihua,LIUZhihong,ZHANGHaitao
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Correspondingauthor:LIUZhihong(E-mail:liuzhihong@nju.edu.cn),ZHANGHaitao(E-mail:htzhang163@163.com)
T Objective:Whether higher serum phosphorus is associated with the progression of chronic kidney disease (CKD) is not well elucidated. The aim of this study will analyze the effect of serum phosphorus level on the prognosis of diabetic nephropathy and non- diabetic nephropathy. Methodology:One thousand seven hundred fifty seven patients who diagnosed as diabetic nephropathy with an average eGFR 73.3±30.6 ml/min·1.73m2(n=591) and non-diabetic nephropathy with an average eGFR 87.2±31.6 ml/min·1.73m2{n=1 166, IgA nephropathy (n=957), and membranous nephropathy (n=209)} with stage 1~4 CKD were retrospectively investigated. The median follow up time was 65 months. The four cohorts were classified into four groups based on the quartile of serum phosphorus, included as a categorical variable in the multivariate cox regression to evaluate the effects of serum phosphorus level on the prognosis of CKD. Results:In all patients, univariate and multivariate cox regression indicated that the risk of end point was 5.29 (P<0.001) and 2.59 (P<0.001) times higher in the highest quartile of phosphorus than the lowest quartile. In diabetic nephropathy patients, univariate and multivariate cox regression revealed that the risk of end point was 5.99 (P<0.001) and 2.38 (P=0.024) times higher in the highest quartile of phosphorus. While in non- diabetic nephropathy, multivariate cox regression showed no relation between phosphorus level and progression of CKD. Conclusion:The association of serum phosphorus with progression of kidney disease might vary in specific CKD patient subgroups. Hyperphosphatemia is an independent risk factor for ESRD in diabetic nephropathy. Analysis of serum phosphorus level on the prognosis of patients with CKD should consider the effect of the underlying disease.
chronic kidney disease serum phosphorus eGFR risk factors
10.3969/cndt.j.issn.1006-298X.2016.04.002
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学科技专项(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 博士研究生(向海燕) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail: liuzhihong@nju.edu.cn),章海涛(E-mail: htzhang163@163.com)
2016-05-10
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
