免疫检验点阻断:癌症免疫治疗的新希望
2016-05-30隋爱霞赵静郭晓强
隋爱霞 赵静 郭晓强
免疫检验点是T细胞激活的负调节分子,阻断这些分子的活性可提升T细胞对癌细胞的杀伤能力,临床试验显示出良好效果,提示了癌症免疫治疗的一个新方向,也引起了癌症免疫治疗的一场新热潮。
癌症免疫治疗是利用免疫系统特异性识别和杀伤的原理来达到癌症治疗目的。目前,癌症免疫治疗主要有三种策略,即细胞免疫治疗(如树突细胞治疗)、细胞因子治疗(治疗肾细胞癌的白介素-2等)和单克隆抗体治疗。自1997年第一个单克隆抗体利妥昔[rituximab;商品名美罗华(mabthera)]被美国食品药品管理局(FDA)批准用于非霍奇金淋巴瘤的治疗以来,至今已有几十种单克隆抗体应用于癌症临床,在部分类型癌症如乳腺癌等的治疗中取得理想效果,从而开启了癌症免疫治疗的新时代。早期癌症治疗中单克隆抗体针对的靶点主要是癌基因位点突变或者过表达,适应范围较窄,一定程度上出现“瓶颈”。2011年,第一个针对免疫检验点的单克隆抗体获得FDA批准,开创了免疫治疗的新思路。
T细胞激活和免疫检验点
T细胞激活
T细胞是一类重要的免疫细胞,主要介导细胞免疫过程,因在胸腺(thymus)中成熟而得名。T细胞分多种亚型,包括细胞毒性T细胞(Tc)、辅助性T细胞(TH)、调节性T细胞(Treg)和天然杀伤T细胞(NKT)等,它们在介导免疫的过程中发挥不同的作用。以癌症免疫为例,Tc可选择性地识别肿瘤特异性抗原,并启动免疫应答以杀伤癌细胞;TH则有效地整合天然免疫和获得免疫双重机制来实现免疫应答的最大化;而Treg主要抑制其他T细胞对肿瘤抗原的免疫应答,造成癌细胞免疫逃逸,发挥癌细胞保护功能。
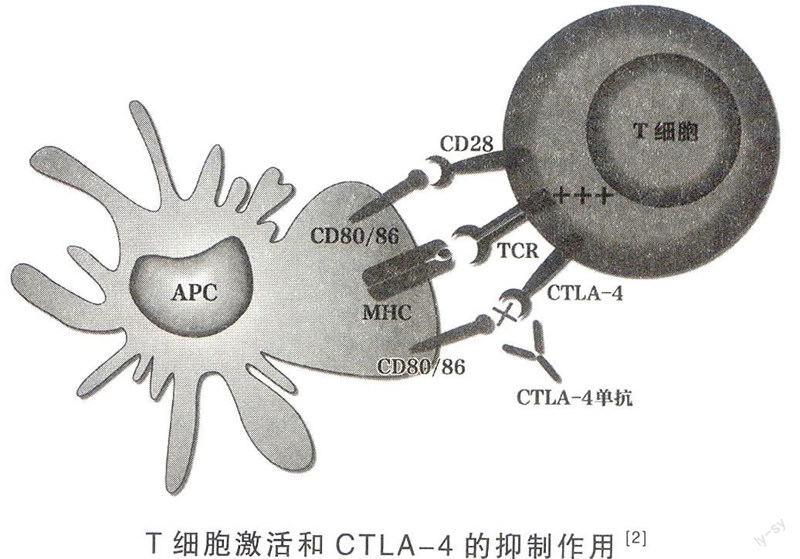
T细胞进入免疫过程的激活机制为:树突细胞(不同于神经元树突)等抗原递呈细胞(APC)表面主要组织相容性复合物(MHC)分子将抗原递呈给T细胞表面的T细胞受体(TCR),形成三元复合物。与此同时,APC表面CD80或CD86分子与T细胞表面共受体CD28结合形成共激活复合物,启动下游信号从而实现激活。
尽管T细胞激活对保证机体免疫应答有重要意义,但是过度或不适当地激活亦可引起针对自身的细胞毒性效应,造成机体损伤,因此T细胞激活必须受到严格精细的调控,以保证在外界病原体入侵和体内组织出现癌变时启动激活程序,实现有效监控和强有力的杀伤,同时防止T细胞过度激活对自身组织的“误伤”。针对T细胞过度激活的“刹车”效应,主要由免疫检验点分子负责。
免疫检验点
免疫检验点(immune checkpoint)是指保持机体自身免疫耐受,调节免疫应答幅度以及产生强度免疫抑制的信号通路。目前已鉴定了多种免疫检验点分子,包括细胞毒性T细胞相关抗原4(CTLA-4)、程序性死亡分子1(PD-1)、程序性死亡配体1(PD-L1)和PD-L2等。有关这些分子的鉴定,拓展了对免疫激活“开关”调控的理解,也为多种疾病如癌症和自身免疫病等的治疗提供了新思路。
关键免疫检验点分子的生物学作用
CTLA-4的生物学作用
1980年代,研究人员发现T细胞表面除T细胞受体(TCR)具有激活效应外,还有一个大的免疫激活分子群存在。1987年,研究人员利用消减cDNA文库法从激活的T细胞中鉴定出第四个分子,命名为CTLA-4。1991年,进一步研究发现CTLA-4在结构上与CD28相似,也与CD80/CD86结合,因此被认为是一种新的共激活受体。然而在1995年,加州大学伯克利分校的艾利森(J.Allison)小组制备成功CTLA-4基因敲除小鼠表型,否定了上述结论。
CTLA-4敲除小鼠并未出现T细胞活性下降,相反出现了T细胞增殖失控与活性增加,以及全身超敏反应样自身免疫病,多器官浸润,小鼠最终死亡,意味着小鼠CTLA-4是一种T细胞激活抑制分子。尽管CTLA-4分子存在于激活的T细胞中,但是只在激活以后出现,在激活起始和休眠时均不表达,因此CTLA-4更可能是一种免疫激活抑制剂,起免疫“刹车器”的作用。激活后的T细胞开始表达CTLA-4,一方面CTLA-4与CD28竞争结合CD80/CD86而减弱激活,另一方面CTLA-4还启动细胞内抑制信号,抑制T细胞激活,避免免疫损伤。
CTLA-4可在Tc、TH和Treg等多种T细胞中表达,但细胞效应迥异。Tc和TH细胞的CTLA-4抑制细胞活性以减弱免疫应答,Treg细胞的CTLA-4却增强细胞活性以强化免疫逃逸,双重效应使免疫系统的杀伤能力显著降低。许多癌症患者存在CTLA-4过表达,这种过表达与预后差成正相关,意味着对CTLA-4的抑制可用于癌症治疗。
PD-1的生物学作用
1992年,日本京都大学研究员本庶佑(T.Honjo)首次在凋亡T细胞杂交瘤中鉴定出PD-1,因其具有促程序性细胞死亡的作用而得名。对基因敲除小鼠的试验表明,PD-1亦是一种免疫抑制分子,但是和CTLA-4具有全身活性不同,PD-1局限于外周组织。
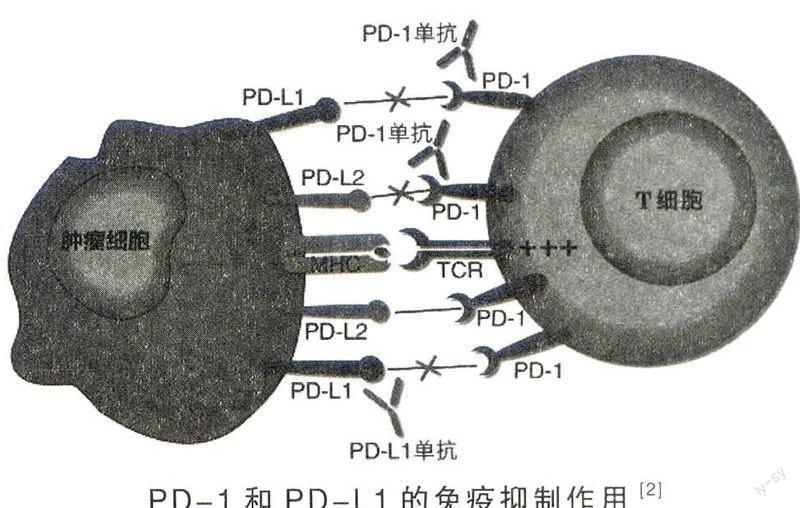
PD-1主要在激活的T细胞、树突细胞和单核细胞等细胞上表达,参与细胞抑制。与CTLA-4类似,PD-l亦增强Treg细胞的免疫抑制作用。由于许多癌症对Treg细胞高度浸润,这种效应可进一步抑制免疫应答。因此,阻断PD-1可消除癌组织内Treg数量或抑制其细胞活性而增强抗癌能力。Tc高表达PD-1可造成细胞毒性功能丧失,包括细胞增殖下降和多种细胞因子如IL-2和TNF-α等的分泌能力减弱,最终使抗癌活性降低。一般认为,CTLA-4主要对早期激活T细胞有抑制,PD-1则在T细胞迁移到肿瘤微环境后减弱应答。PD-1还在肿瘤浸润淋巴细胞(TIL)中表达,可使TIL处于无能或耗竭状态,使抗癌活性减弱,而抑制PD-1可增强免疫系统对癌细胞的杀伤能力。
PD-L1的生物学作用
1999年,梅奥医学中心的陈列平首先发现PD-L1分子;2000年,哈佛大学弗里曼(G.Freeman)等证实PD-L1是PD-1功能配体,第二年发现PD-1的第二配体PD-L2,从而形成PD-1与PD-L1/2的相互作用功能对。PD-L1表达广泛,在全身多个器官包括肾、肝、肺、心等的上皮细胞和内皮细胞中表达;PD-L2的表达具有组织特异性,主要在抗原递呈细胞(APC)中表达。
PD-Ll在黑色素瘤、卵巢癌、肺癌、前列腺癌、膀胱癌和肾癌等多种癌症中过表达,并与癌症的进展及不良预后成正相关。癌症形成过程中的PD-Ll过表达是一种自适应免疫抵抗。癌细胞的PD-L1通过与免疫细胞表面PD-1结合,启动免疫抑制信号而诱发免疫耐受,一方面促进Tc和TH细胞无能、耗竭、反应迟钝和凋亡,另一方面诱导Treg扩展,从而增强对免疫杀伤和凋亡信号的抵抗,最终达到逃脱机体免疫监控的目的。
免疫检验点阻断与肿瘤治疗
免疫检验点单克隆抗体现状
早期认为,免疫系统缺乏特异性识别与杀伤癌细胞的能力,但是在1990年代随着CTLA-4、PD-1和PD-L1等一系列免疫检验点分子的发现及其生理功能的阐明,科学界的认识发生了改变。正常情况下,免疫系统可识别肿瘤抗原(过表达的自身蛋白或突变蛋白)并启动免疫应答,但肿瘤组织通过各种策略激活免疫抑制信号而使T细胞处于静息状态,得以实现免疫逃逸,因此消除免疫抑制是实现癌症免疫治疗的根本策略之一。从临床效果来看,阻断免疫抑制通路比直接激活免疫通路更理想。
最初艾利森提出阻断CTLA-4实现癌症治疗的策略,遭到医学界普遍质疑,一方面在于这种策略缺乏特异性,对肿瘤杀伤力有限,另一方面CTLA-4基因敲除小鼠表现出强烈致死的自身免疫应答,预示着阻断CTLA-4会导致极严重的免疫毒性。然而后续的研究表明,部分阻断CTLA-4活性能在一定程度上解决这一难题,在免疫毒性可耐受前提下实现肿瘤杀伤。肿瘤动物模型显示了肿瘤抑制效果,从而鼓舞了公司和研究人员从事CTLA-4单抗(单克隆抗体)的研发和临床试验热情。美国新泽西州的生物技术小公司Medarex公司敏锐地意识到了这种思路的潜在价值,于1999年率先加入研究行列,先后开发成功CTLA-4单克隆抗体和PD-1单克隆抗体。目前,临床上针对免疫检验点分子的单克隆抗体已有多种,主要针对CTLA-4、PD-1和PD-L1等。
免疫检验点单克隆抗体由于在应用过程中激活免疫系统,容易破坏免疫系统的自身平衡,常导致多个器官或多种组织的炎症,称为免疫相关不良反应。随着免疫抑制分子抗体得到快速开发和应用,对治疗过程中的不良反应采取有效的缓解措施也成为决定治疗成败之关键因素。
CTLA-4单克隆抗体的临床应用
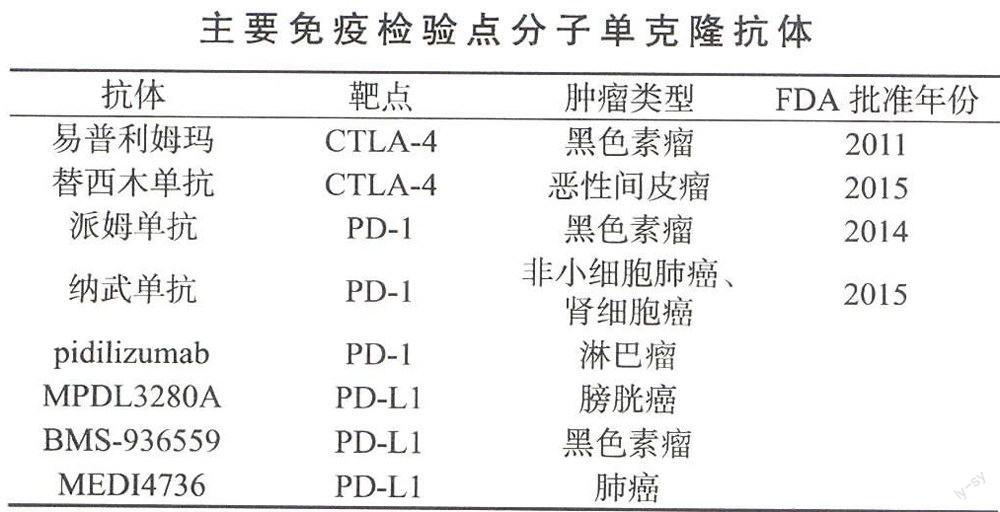
2000年,两种CTLA-4抗体易普利姆玛(ipilimu-mab)和替西木单抗(tremelimumab)进入临床试验。
易普利姆玛应用最为广泛,至今已有两千多名实体瘤患者接受了测试。对无法切除黑色素瘤患者的Ⅲ期临床试验表明易普利姆玛可诱导一个较持续的免疫应答;患者生存期显著延长,3年生存率达20%。欧洲Ⅲ期临床试验表明,易普利姆玛治疗使黑色素瘤中位无复发生存期达26.1个月。临床试验还显示易普利姆玛在治疗中相对安全、可控。易普利姆玛治疗的不良反应与癌症免疫应答成正相关,因此在保证抗癌效果前提下应慎重评价治疗剂量、频率和时间的选择等。目前,易普利姆玛主要用于恶性黑色素瘤、非小细胞肺癌、前列腺癌和胃癌等的Ⅱ/Ⅲ期试验。2011年,美国FDA正式批准易普利姆玛用于治疗无法手术切除或已转移的黑色素瘤。
替西木单抗Ⅱ期黑色素瘤临床治疗显示具有一定耐受性,Ⅲ期临床因未显示更好疗效而终止;但临床试验显示对恶性问皮瘤有一定疗效。2015年,美国FDA批准替西木单抗用于恶性间皮瘤治疗。
PD-1单克隆抗体的临床应用
相对于CTLA-4,PD-1单克隆抗体的研发和应用相对滞后,直到2006年才投入临床测试。两年后发现,5名晚期癌症患者经过治疗后肿瘤显著萎缩,生存期显著延长,从而推动了PD-1抗体的广泛应用。目前,临床应用的PD-1单克隆抗体主要有3种——纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和pidilizumab。
临床试验显示纳武单抗对多种实体瘤均有显著疗效,而且治疗过程中耐受性好,不良反应轻微。目前,纳武单抗应用于非小细胞肺癌、晚期黑色素瘤、肾细胞癌、复发性胶质瘤、难治性或复发性弥漫性大B细胞淋巴瘤、复发性或转移性头颈部肿瘤等的临床试验。2014年,日本批准小野制药株式会社的纳武单抗用于无法手术切除的黑色素瘤治疗。2015年,美国FDA批准该药用于转移性鳞性非小细胞肺癌和晚期转移肾细胞癌的治疗。
对晚期黑色素瘤的派姆单抗临床试验显示效果理想,不良反应轻微;晚期或转移性非小细胞肺癌的临床试验也显示了理想的前景。目前,派姆单抗用于肺癌、黑色素瘤、结肠癌等的临床试验。2014年9月,美国FDA批准派姆单抗用于难治性黑色素瘤的治疗。
pidilizumab对复发滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和恶性黑色素瘤均有一定治疗效果,但尚须进一步评判。
PD-L1单克隆抗体的临床应用
PD-L1单克隆抗体的开发和应用更晚,目前主要集中于Ⅰ/Ⅱ期临床试验,有3种PD-L1单克隆抗体BMS-936559、MPDL3280A和MEDI4736,尚未被FDA正式批准。
BMS-936559对黑色素瘤、非小细胞肺癌、肾细胞癌和卵巢癌等均有一定疗效,且临床不良反较少,须进一步全面评估临床效果。
临床Ⅰ期试验表明MPDL3280A对多种晚期无法治愈的实体瘤如非小细胞肺癌、黑色素瘤和肾细胞癌等的治疗效果较为理想,不良反应温和,大多数无须特殊处理。此外,MPDL3280A对晚期转移性膀胱癌的治疗应答快速、患者反应率高,不良反应轻微,更适合无法耐受放化疗的老年患者。
MEDI4736用于多种实体瘤包括黑色素瘤和非小细胞肺癌等的Ⅰ期临床试验,也显示了一定效果。
免疫检验点单克隆抗体联合治疗
虽然免疫检验点单克隆抗体在癌症治疗上取得了一定突破,但与期望仍有较大距离,一方面须提升单一抗体的治疗效果,另一方面应加强联合应用。
一是免疫检验点分子单克隆抗体问的联合。由于CTLA-4和PD-1/PD-L1发挥免疫抑制作用的机制不同,因此两类抗体联合可增强免疫激活程度和抗肿瘤效果。如PD-1单克隆抗体纳武单抗和CTLA-4单克隆抗体易普利姆玛联合治疗黑色素瘤,可以极大地增加临床效果,使2年生存率超过80%。
二是与其他癌症治疗方式的联合。免疫检验点分子单克隆抗体的治疗原理在于对发生突变的癌症抗原进行特异性识别后加以杀伤,抗原数量越高则杀伤效果越显著,而临床试验证明,放化疗介导的癌细胞死亡有利于癌症抗原释放,增强机体抗癌免疫活性,因此免疫检验点分子单克隆抗体联合放化疗可达到协同治疗目的。Ⅱ期临床试验显示紫杉醇/卡铂化疗后再使用CTLA-4单克隆抗体易普利姆玛治疗晚期非小细胞肺癌,能显著增加化疗效果。易普利姆玛联合达卡巴嗪(dacarbazine)能显著延长晚期黑色素瘤患者的生存期。放疗可显著增加T细胞数量,而免疫检验点阻断可增强肿瘤杀伤效果,因此黑色素瘤患者放疗后辅助CTLA-4或PD-Ll单克隆抗体均可增强放疗效果,并提升免疫治疗强度。
前景与展望
免疫检验点分子单克隆抗体的应用,掀起了一场癌症免疫治疗的新热潮,一定程度上克服了传统单克隆抗体治疗的癌症类型过于单一的缺陷,适应证更加广泛,治疗效果也较放化疗具有明显优势。2013年,以CTLA-4和PD-1单克隆抗体为主的癌症免疫治疗被美国《科学》周刊评为当年十大科学突破之首,凸显其重要价值。目前有多家制药公司投入此新兴领域,必将加快新抗体的研发和临床应用,推动癌症免疫治疗效果达到一个新高度。
同时也应看到,通过免疫检验点阻断治疗癌症,也存在许多亟须解决的问题。首先是抗体的临床应用剂量和治疗方案目前大多基于经验,没有利用进一步的优化治疗来提升效果。其次是缺乏治疗效果和预后评判的分子标志物,当前的评判主要基于临床数据,不利于对特定患者人群开展针对性治疗。最后是尚无标准化的联合治疗原则可用,从而限制了联合疗法的治疗潜力。从大的方面来说,免疫检验点阻断都是利用非特异性地消除免疫抑制的策略来达到癌细胞杀伤目的,靶向性差,具有“双刃剑”效果。如何在整体层面上增强癌症杀伤力的同时,最大限度地减弱副作用,是一个重大挑战。此外,不同患者针对治疗产生巨大免疫应答差异背后的分子机制,也是临床医生和基础研究人员应当紧密合作以共同而对的现实问题。
总之,免疫检验点阻断为癌症免疫治疗提供了新的选择和方向,有望给癌症患者带来重大福音。
关键词:癌症免疫治疗 免疫检验点 CTLA-1 PD-1