应激诱导小鼠杏仁核theta波段下调介导焦虑反应
2016-05-30姜方洁吴桂生杨丽萍林万华罗怀容
姜方洁,付 玉,吴桂生,杨丽萍,4,唐 贺,邓 科,林万华,5,罗怀容
(1.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201;2.中国科学院大学生命科学院,北京100039;3.昆明理工大学基础医学院,云南昆明650093;4.云南省中医中药研究所中药研究室,云南昆明650223;5.广西师范大学生命科学学院,广西桂林541006)
应激诱导小鼠杏仁核theta波段下调介导焦虑反应
姜方洁1,2,付玉3,吴桂生1,杨丽萍1,2,4,唐贺1,2,邓科1,林万华1,5,罗怀容1
(1.中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201;2.中国科学院大学生命科学院,北京100039;3.昆明理工大学基础医学院,云南昆明650093;4.云南省中医中药研究所中药研究室,云南昆明650223;5.广西师范大学生命科学学院,广西桂林541006)
摘要:慢性应激能引发诸多情绪行为的改变,诱导产生广义焦虑症、抑郁症、双极紊乱等情绪障碍性疾病。慢性应激首先引起焦虑情绪处理相关核团前额叶-杏仁核-腹侧海马区神经活动的功能性的改变,然后导致这些核团的结构发生改变。慢性应激造成杏仁核基底外侧核的锥体神经元的树突脊数量增多,谷氨酸能神经元的兴奋性投射增强,γ-氨基丁酸能神经元的抑制性投射减弱,导致焦虑样行为症状。由于慢性应激对于这些参与情绪调控的关键核团的神经活动的功能改变尚不明确,所以我们建立小鼠慢性应激的模型,分别在对照鼠和模型鼠的杏仁核基底外侧核及海马CA3区记录局部场电位,分离局部场电位的alpha、 beta、 delta、 theta、 gamma波段,分析其局部场电位各个波段的绝对功率和相对功率的差异。结果显示:慢性应激造成小鼠杏仁核基底外侧核的局部场电位在5个脑电波段的绝对功率均具有上调趋势,其中delta波段上调显著;进一步分析局部场电位的相对功率发现,慢性应激造成delta波段的相对功率显著上调,而theta波段的相对功率显著下调。
关键词:慢性应激;杏仁核基底外侧核;海马CA3区;局部场电位
随着社会转型,竞争加剧,许多神经精神障碍性疾病如抑郁症、焦虑症、创伤后应激综合症等的发生率逐年增加,神经精神病的比率占据总疾病的17.45%。焦虑症是以持续性焦虑,紧张为主的神经障碍性疾病,常伴有身体紧张及自主神经系统应激反应过强等症状。针对焦虑症发病机制的研究多集中在γ-氨基丁酸(GABA)或5-羟色胺(5-HT)这类神经递质水平的改变[1-2],额叶皮层、边缘皮层及脑干相关核团的脑组织结构和功能的改变[3-4],从而产生焦虑样的行为表型。但是目前对于焦虑症的发病机制仍不完全清楚,特别是对于焦虑情绪处理的边缘皮层相关核团如杏仁核等的神经活性的变化引起焦虑症的机制尚不清楚。
本研究通过建立小鼠慢性应激的广义焦虑症模型,并对焦虑情绪小环路上的关键核团杏仁核基底外侧核(BLA)及海马CA3区神经元集群活动的脑电机制进行研究,旨在找到焦虑状态下,这些脑区神经活动的异常发放,为焦虑症发生机制的研究提供脑电机制方面的参考,同时也为临床上通过脑电图诊断焦虑症状及抗焦虑药物的作用机制研究提供依据。
1材料与方法
1.1实验材料
C57BL/6购买自成都实验动物科学研究所。小鼠体质量18~22 g,6周龄。小鼠4只/笼,饲养条件如下:温度(22±2) ℃,相对湿度50%~60%,每天早上8点开始进行12 h的循环光照,小鼠允许自由进食进水。所有动物实验都严格按照中国科学院昆明植物研究所实验动物保护和使用的相关规定进行。
1.2慢性应激小鼠模型的建立
将小鼠分为2组:一组为对照组,正常饲养不接受应激刺激;另一组为慢性应激模型组,每天给予2~3种不可预知性的应激刺激,连续30 d。
慢性应激模型组接受的刺激有:鼠笼45(°)倾斜12 h;50 mL离心管禁锢2 h;电刺激20次(0.5 mA,每次电击持续20 s);与大鼠相处1 h;潮湿垫料12 h;24 h持续光照;禁食禁水24 h;4 ℃低温环境5 min;异物刺激24 h;摇床180 r/min摇晃2 h;40 ℃热水刺激5 min;噪音环境5 h。动物每天接受2~3种不同的刺激,同一个刺激不连续2 d出现。
1.3植入电极手术
实验小鼠用体积分数为10%的水合氯醛以4 mL/kg的量腹腔注射麻醉,并将其固定于脑立体仪上。剪开头皮,暴露颅骨,以小鼠前囟作为脑立体定位坐标的零点。根据小鼠脑立体定位坐标,分别在杏仁核的BLA区:左边旁开2.80 mm,前卤向下-1.58 mm,皮层下深度4.00 mm;海马CA3区:左边旁开3.0 mm,前卤向下-2.80 mm,皮层下深度3.50 mm颅骨表面钻开一个小孔,植入场电位电极到目标位置。小鼠术后饲养,恢复3~5 d后进行场电位记录。
1.4局部场电位采集及信号处理
植入电极的小鼠术后恢复饲养3~5 d后, 通过电极连线插头连接小鼠头部的电极接口。电极连线的另一端与前置放大器相连,前置放大器与信号处理器相连,完成信号的采集、放大及处理。插好电极头的小鼠放入长40 cm、宽40 cm、高40 cm的屏蔽笼的开放场环境中,允许小鼠自发活动,通过屏蔽笼排除了50 Hz及100 Hz的干扰。局部场电位通过Cerebus多通道信号采集系统采集(美国BLACKROCK公司),选取低通滤波频段为0.5-250 Hz,采样频率为1 000/s (每秒采集1 000个数据点) 。对照小鼠,慢性应激模型小鼠每只分别采集20 min,5 min/次。分析小鼠放入屏蔽笼中前5 min的局部场电位数据,将局部场电位的原始数据导入Matlab 软件中,该程序能够将场电位原始信号进行0-100 Hz的分频,将场电位信号以delta (2-4 Hz)、theta (4-8 Hz)、alpha(8-12 Hz)、beta(12-20 Hz)、gamma(20-100 Hz)5个频段分开,将采样率为1 000/s的数据点以1 024个步长为处理窗进行局部场电位绝对功率的计算。每个频段的局部场电位的绝对功率用如下公式计算:p=∑x2/1 024,x表示程序处理中每个信号频段分割的处理窗的平均功率。相对功率为绝对功率与5个频段总功率之间的比率。
1.5植入电极位置的验证
信号记录完成后的小鼠,过量腹腔注射体积分数为10%的水合氯醛,进入深度麻醉后,用电流刺激器的接头与小鼠头部的电极接口相连,以10 mA的电流强度刺激10 s,对植入电极的脑区进行电流损毁。依次用9 g/L NaCl和体积分数为4%的多聚甲醛(上海生工)进行胸腔灌流。灌流结束后,取出小鼠的脑组织,放入体积分数为4%的多聚甲醛中4 ℃固定过夜。第2天将脑组织转移至含300 g/L蔗糖的PBS溶液中,4 ℃放置3 d脱水。运用OCT包埋剂包埋脑组织,在冰冻切片机中进行冠状冰冻切片,脑片厚度为30 μm。用PBS 洗脑片3次,然后在载玻片上展片,用滤纸将PBS吸干,用DAPI(上海生工)对脑片的细胞核进行染色,闭光染色2 h后,在显微镜下拍照,寻找植入电极的位置,与脑立体定位图谱对比,验证植入电极的位置。
1.6统计学方法
数据统计均采用SPSS软件的独立样本t-test 进行组间比较, 以平均值±标准偏差、P值表示。样本量为7只/组。
2结果
2.1BLA区和CA3区植入电极位置及验证
电极植入的区域分别为BLA区和CA3区。冰冻切片的脑片用DAPI进行细胞核染色,闭光染色2 h后,在显微镜下拍照,寻找植入电极的位置,与脑立体定位图谱对比,验证植入电极的位置与脑立体定位图谱所示位置基本一致。DAPI染色的结果与脑立体定位图谱比较结果如图1所示。
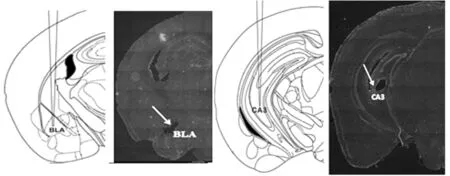
左边为BLA区的验证结果,右边为CA3区的验证结果。图1 BLA区和CA3区植入电极位置验证(DAPI染色验证植入电极的位置与脑立体定位图谱位置的比较)Fig.1 The brain stereotaxic coordinate of the electrode placement in the BLA and CA3, and DAPI staining ofthe histological slices were showed and verified the recording site of the BLA (left) and CA3 (right)
2.2慢性应激模型小鼠BLA区和CA3区脑电功率谱及总功率的变化
在BLA区,与对照小鼠相比,慢性应激的小鼠脑电的功率谱和总功率有上调趋势;而在CA3区变化不明显(图2)。
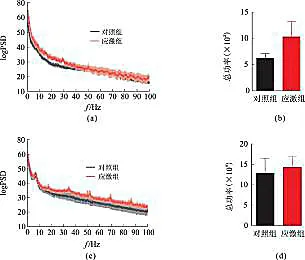
(a)BLA区慢性应激小鼠和对照小鼠运用对数表示的功率谱图;(b)BLA区慢性应激小鼠和对照小鼠脑电总功率的比较;(c)CA3区慢性应激小鼠和对照小鼠运用对数表示的功率谱图;(d)CA3区慢性应激小鼠和对照小鼠脑电总功率的比较。结果以平均值±标准偏差表示,样本量为7只/组。图2 慢性应激模型小鼠BLA区和CA3区脑电功率谱及总功率的变化Fig.2 The mean logarithmic power spectral density and total power of controland stressed group from the BLA and CA3 areas
2.3慢性应激模型小鼠BLA区和CA3区脑电绝对功率的变化
分离BLA区和CA3区脑电功率谱的5个波段:delta (2-4 Hz)、 theta (4-8 Hz)、 alpha (8-12 Hz)、 beta(12-20 Hz)、 gamma (20-100 Hz),分析各个波段的脑电绝对功率的变化,结果显示:在BLA区,与对照小鼠相比,慢性应激模型小鼠delta波段的脑电绝对功率有显著上调(p<0.05),beta波段和gamma波段具有上调的趋势(p=0.153和p=0.052);而在CA3区,各个脑电波段的绝对功率变化不明显(图3)。
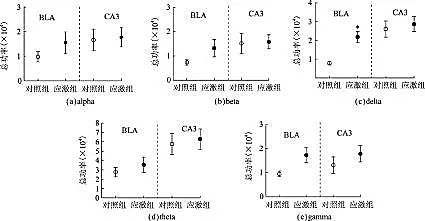
(a-e)分别是对照组和慢性应激模型组小鼠BLA区(左边)和CA3区(右边)的alpha~gamma 5个脑电波段绝对功率的比较。结果以平均值±标准偏差表示,样本量为7只/组,*表示p<0.05。图3 慢性应激模型小鼠BLA区和CA3区脑电绝对功率的变化Fig.3 The absolute power at the five frequency bands of control and stressed mice in the BLA and CA3
2.4慢性应激模型小鼠BLA区和CA3区脑电相对功率的变化
相对功率是各个脑电节律波段的绝对功率与5个波段的总功率的比值,由于绝对功率的样本个体间差异较大,导致每个实验组中的样本偏差较大。相对功率被认为对于各个脑电波段的功率变化的检测较绝对功率而言更为客观和敏感[5]。进一步分析了delta (2-4 Hz)、theta (4-8 Hz)、alpha (8-12 Hz)、beta(12-20 Hz)、gamma (20-100 Hz) 5个波段的脑电相对功率,结果显示:与对照组相比,在BLA区,delta波段的脑电相对功率有显著上调(p<0.05),theta波段的脑电相对功率有显著下调(p<0.05);而在CA3区,各脑电波段的相对功率变化不明显(图4)。
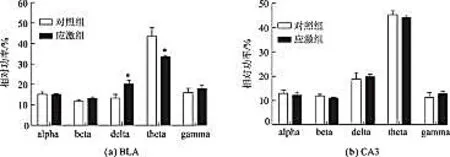
(a)对照组和慢性应激模型组小鼠BLA区5个脑电波段(alpha~gamma)的脑电相对功率的比较。(b)对照组和慢性应激模型组小鼠CA3区5个脑电波段(alpha~gamma)的脑电相对功率的比较。结果以平均值±标准偏差表示,样本量为7只/组,*表示p<0.05。图4 慢性应激模型小鼠BLA区和CA3区脑电相对功率的变化Fig.4 The relative power at the five frequency bands of control and stressed mice in the BLA and CA3
3讨论
在焦虑情绪的抑制和表达过程中,杏仁核基底外侧核(BLA)是前额叶(mPFC)介导top-down情绪调控的主要输入位点,mPFC对BLA的调控在恐惧的识别与消退过程中较为关键[6]。在恐惧刺激存在的状况下,BLA对于恐惧信息的处理增强,负反馈到mPFC,mPFC激活BLA区GABA能抑制性中间神经元,产生恐惧消退作用,调控焦虑情绪处理过程[7]。已有研究表明,慢性不可预知的刺激能够诱导情绪相关小环路前额叶-杏仁核-海马结构的改变[8-9]。长期的慢性应激会导致前额叶和背侧海马神经元的萎缩,而腹侧海马和杏仁核区域表现出神经元过度增大[10]。我们对慢性应激焦虑模型小鼠脑电记录结果显示,与对照组相比BLA区脑电绝对功率在5个波段均有上调趋势,说明慢性应激诱导了小鼠BLA区神经活性的过度激活从而导致了焦虑反应。BLA区神经元集群的活性改变,可能是因为慢性应激造成mPFC对BLA区的负反馈top-down调控下调,BLA区的过度激活,使得杏仁核到脑干蓝斑(LC)、室管外周灰质(PAG)、臂旁核(PBN)等的投射增多,增强了觉醒、僵直、喘息增强等焦虑样行为表型[11];同时也增强了杏仁核边缘区纹状体终端基底核(BNST)对外周去甲肾上腺素系统的激活,引发应激反应的增强[12]。
我们进一步地分析了杏仁核基底外侧核BLA及海马CA3区的局部场电位相对功率,结果显示:慢性应激后的小鼠与对照小鼠相比,CA3区的脑电节律各波段的变化不明显;而BLA区的theta波段的相对功率表现出显著的下调,delta波段表现出显著的上调。研究表明,theta节律的改变通常在情绪处理相关的前额叶-杏仁核-海马小环路上提供前额叶的皮层调控作用[13-14]。因此,theta节律与恐惧的形成及焦虑等情绪行为的表达有关[15]。在BLA区,theta节律与危险评估及应激反应有关,在小鼠从危险状态过度到安全状态,焦虑症状下调,应激反应减小及恐惧消退的过程中,theta波段的节律振荡会有所增加[16]。慢性应激过程诱导了theta波段局部场电位相对功率的显著下调,说明慢性应激造成BLA区的theta波段介导的恐惧消退,应激平复的作用下调,从而增加了恐惧的表达,产生焦虑样行为表型。在应激状态下,腹侧海马区到杏仁核及边缘皮层或者一些情绪处理相关的亚皮层结构的投射增加,参与了情绪反应过程和高级认知功能[17]。delta节律通常与意识及工作记忆的形成有关,慢性应激造成小鼠表现出BLA区delta节律的相对功率的上调,我们推断可能是因为慢性应激增加了海马区到杏仁核区神经元的投射的突触可塑性,上调了小鼠的记忆形成等认知过程,反应出delta节律的上调[18]。
慢性应激诱导了小鼠杏仁核基底外侧核(BLA)神经元集群发放的过度激活,下调了BLA区的theta波段的脑电相对功率,从而增强了杏仁核对起始焦虑样行为反应的脑干相关核团的激活,下调了theta节律介导的BLA区安全识别、恐惧消退的过程,增加了焦虑样的应激反应。本研究对于焦虑症中,情绪处理关键核团杏仁核的神经活性功能异常的研究提供支持,也为焦虑症发病机制的脑电研究提供了参考。
参考文献:
[1]ATACK J R. The benzodiazepine binding site of GABA(A) receptors as a target for the development of novel anxiolytics[J]. Expert Opin Investig Drugs, 2005, 14(5):601-618.
[2]ATACK J R. Anxioselective compounds acting at the GABA(A) receptor benzodiazepine binding site[J]. Curr Drug Targets CNS Neurol Disord, 2003, 2(4):213-232.
[3]DAVIDSON R J. Anxiety and affective style: role of prefrontal cortex and amygdala[J]. Biol Psychiatry, 2002, 51(1):68-80.
[4]GREENBERG T, CARLSON J M, CHA J, et al. Ventromedial prefrontal cortex reactivity is altered in generalized anxiety disorder during fear generalization[J]. Depress Anxiety, 2013, 30(3):242-250.
[5]FU Y, GUO L, ZHANG J, et al. Differential effects of ageing on the EEG during pentobarbital and ketamine anaesthesia[J]. European Journal of Anaesthesiologyl, 2008, 25(10):826-833.
[6]CERQUEIRA J J, MAILLIET F, ALMEIDA O F, et al. The prefrontal cortex as a key target of the maladaptive response to stress[J]. The Journal of Neuroscience, 2007, 27(11):2781-2787.
[7]TRUITT W A, JOHNSON P L, DIETRICH A D, et al. Anxiety-like behavior is modulated by a discrete subpopulation of interneurons in the basolateral amygdala[J]. Neuroscience, 2009, 160(2):284-294.
[8]VYAS A, MITRA R, SHANKARANARAYANA RAO B S, et al. Chronic stress induces contrasting patterns of dendritic remodeling in hippocampal and amygdaloid neurons[J]. The Journal of Neuroscience, 2002, 22(15): 6810-6818.
[9]徐晓东,刘昌. 视觉恐惧加工的神经通路[J]. 心理科学,2008,31(3):609-613.
[10]SOUSA N, ALMEIDA O F. Disconnection and reconnection: the morphological basis of (mal)adaptation to stress[J]. Trends in Neurosciences, 2012, 35(12): 742-751.
[11]VIANNA D M, LANDEIRA-FERNANDEZ J, BRANDAO M L. Dorsolateral and ventral regions of the periaqueductal gray matter are involved in distinct types of fear[J]. Neurosci Biobehav Rev, 2001, 25(7/8): 711-719.
[12]TANAKA M, YOSHIDA M, EMOTO H, et al. Noradrenaline systems in the hypothalamus, amygdala and locus coeruleus are involved in the provocation of anxiety: basic studies[J]. Eur J Pharmacol, 2000, 405(1/2/3): 397-406.
[13]LESTING J, NARAYANAN R T, KLUGE C, et al. Patterns of coupled theta activity in amygdala-hippocampal-prefrontal cortical circuits during fear extinction[J]. PLoS One, 2011, 6(6): e21714.
[14]ADHIKARI A, TOPIWALA M A, GORDON J A. Synchronized activity between the ventral hippocampus and the medial prefrontal cortex during anxiety[J]. Neuron, 2010, 65(2): 257-269.
[15]PAPE H C, NARAYANAN R T, SMID J, et al. Theta activity in neurons and networks of the amygdala related to long-term fear memory[J]. Hippocampus, 2005, 15(7): 874-880.
[16]LIKHTIK E, STUJENSKE J M, TOPIWALA M A, et al. Prefrontal entrainment of amygdala activity signals safety in learned fear and innate anxiety[J]. Nat Neurosci, 2014, 17(1): 106-113.
[17]MCLAUGHLIN K J, GOMEZ J L, BARAN S E, et al. The effects of chronic stress on hippocampal morphology and function: an evaluation of chronic restraint paradigms[J]. Brain Res, 2007(1161):56-64.
[18]ZHENG C, ZHANG T. Synaptic plasticity-related neural oscillations on hippocampus-prefrontal cortex pathway in depression[J]. Neuroscience, 2015, 292:170-180. http://dx.doi.org/10.1016/j.
(责任编辑马殷华)
Chronic Stress Affects the Theta Activity in BLA to Induce the Stress Response in Mice
JIANGFangjie1, 2, FU Yu3, WU Guisheng1, YANG Liping1, 2, 4,TANG He1, 2, DENG Ke1, LIN Wanhua1,5, LUO Huairong1
(1.State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany,Chinese Academy of Sciences, Kunming Yunnan 650201,China;2.University of Chinese Academy of Sciences,Beijing 100039,China;3.Kunming University of Science and Technology, Kunming Yunnan 650093,China;4.Yunnan Institute of Traditional Chinese Medicine and Materia Medica, Kunming Yunnan 650223,China;5. College of Life Science,Guangxi Normal University, Guilin Guangxi 541006, China)
Abstract:Chronic exposure to stress triggered many dysfunctional emotional behaviors, like generalized anxiety disorder, depression and bipolar disorder. Prolonged stress led to structural changes in the prefrontal cortex-amygdala-ventral hippocampus emotional circuit and thus exerted anxiety behavioral phenotypes. But the alteration of neural activity for those nucleus that involved in emotional regulation is not clear. So chronic stress model in mice was established local field potential (LFP) were recorded from the basolateral amygdala (BLA) and hippocampal CA3 respectively in freely exploring mouse and separated the signals into alpha, beta, and delta, theta, gamma frequency bands. In contrast to the control groups, in BLA, stress induced a trend of increase of LFP absolute power at these five bands, the increase at delta band was significant. Through further analysis of the LFP relative power, it showed that there was a distinct increase at delta band and a significant decrease at theta band in stressed mice.
Keywords:chronic stress,;BLA; CA3;local field potential
中图分类号:R338.8
文献标志码:A
文章编号:1001-6600(2016)01-0162-06
基金项目:国家自然科学基金资助项目(81370453);云南省自然科学基金资助项目(2012FB181);云南省重点新产品开发计划项目基金资助(2014BC011)
收稿日期:2015-05-05
doi:10.16088/j.issn.1001-6600.2016.01.026
通信联系人:罗怀容(1975—),女,四川泸县人,中国科学院昆明植物研究所研究员,博士。E-mail:luohuairong@mail.kib.ac.cn
