TNF-α与ERK1/2在心脏毒素诱导的肌损伤再生修复中的作用研究
2016-05-24陈睿佘燕玲周珊瑶史华彩黎程
陈睿 佘燕玲 周珊瑶 史华彩 黎程
510317 广州,广东省传统医学与运动伤害康复研究所,广东省第二人民医院
TNF-α与ERK1/2在心脏毒素诱导的肌损伤再生修复中的作用研究
陈睿佘燕玲周珊瑶史华彩黎程
510317 广州,广东省传统医学与运动伤害康复研究所,广东省第二人民医院
【摘要】目的探讨TNF-α与细胞外信号调节激酶 1/2 (ERK1/2)在骨骼肌损伤修复过程中的作用。方法将雄性C57BL6小鼠72只随机分为6组,正常组(1个组)和损伤修复组(5个组),于损伤修复组右侧胫骨前肌注射心脏毒素(10 μM、100 μl),分别于注射药物后1、3、5、7、14 d处死5个损伤修复组,分离其胫骨前肌。用苏木素-伊红染色观察胫骨前肌损伤修复情况,测定肌纤维横切面积,用蛋白免疫印迹检测肌组织蛋白中TNF-α、总ERK1/2、磷酸化ERK1/2、肌生成调节因子MyoD表达水平的变化。结果注射心脏毒素1 d后可观察到胫骨前肌溶解、断裂,14 d后损伤得到修复,后者与正常组的肌纤维横切面积比较差异无统计学意义[(1 658.5±118.3)μm2vs.(1 625.2±151.7) μm2,P>0.05)]。蛋白免疫印迹检测结果显示,TNF-α和MyoD在损伤第1日及第3日表达水平上升,磷酸化ERK1/2于第5日表达水平上升。结论TNF-α与磷酸化ERK1/2可能分别于骨骼肌损伤修复的初期与后期发挥调节作用。
【关键词】骨骼肌;损伤修复;肿瘤坏死因子-α;细胞外信号调节激酶1/2
Extracellular regulated kinase1/2
TNF-α主要由单核细胞和巨噬细胞产生,是启动抗菌炎症反应的关键细胞因子,被认为是运动损伤、挫伤、肌肉减少症、多肌炎、恶性肌萎缩等骨骼肌疾病的关键调节因子[1]。随着对TNF-α研究的不断深入,近年来有学者认为TNF-α可能通过不同信号途径影响肌肉再生过程,但机制尚未明确[2-3]。细胞外信号调节激酶1/2(ERK1/2)作为TNF-α下游因子,可参与细胞的增殖、分化[4]。本研究采用心脏毒素诱导骨骼肌损伤,通过观察骨骼肌损伤修复过程中TNF-α、总ERK1/2 、磷酸化ERK1/2及肌生成调节因子MyoD的表达,研究TNF-α及ERK1/2在骨骼肌损伤修复中的作用,探讨其可能的作用机制。
材料与方法
一、实验动物
6~8周龄雄性C57BL6小鼠72只,SPF级,体质量18~22 g,购买并饲养于广州中医药大学实验中心。将72只小鼠随机分为6组,每组12只。本研究对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。
二、主要试剂
心脏毒素(Cardiotoxin,中鑫东泰纳米基因生物技术有限公司),苏木素、伊红(广州市凯秀贸易有限公司),ERK1/2抗体 (1∶1 000,美国CST公司),磷酸化ERK1/2抗体 (1∶1 000,美国CST公司),TNF-α(1∶500,美国CST公司),成肌分化抗原抗体(1∶500,德国默克密理博),α微管蛋白(α-Tubulin,1∶1 000,美国Abclonal公司),辣根过氧化物酶标记山羊抗兔(1∶5 000,美国Abclonal公司),全蛋白提取试剂盒(江苏凯基生物技术股份有限公司),增强化学发光法(ECL)发光试剂盒(江苏凯基生物技术股份有限公司)。
三、方法
1. 动物造模
6组小鼠分为正常组(1个组)及损伤修复组(5个组)。损伤修复组采用戊巴比妥钠腹腔注射麻醉后,分别于小鼠右侧胫骨前肌局部注射100 μl的10 μM心脏毒素[5]。心脏毒素可选择性地破坏细胞膜,药物注射到胫骨前肌后,若观察到小鼠该侧后肢五爪提起呈弯曲勾状,则判断为造模成功。造模后5组损伤修复组分别于1、3、5、7、14 d麻醉取材后处死,每组12只小鼠中6只用于形态学观察、6只用于蛋白免疫印迹检测,5组损伤修复组分别标为D1、D3、D5、D7、D14组。
2. 取材
麻醉小鼠,仰位固定其四肢。分离小鼠小腿上部紧贴胫骨外侧面肌肉,即为胫骨前肌,用生理盐水冲洗胫骨前肌残留的血液后将其迅速投入液氮,转入-80℃冰箱保存或置于10%中性福尔马林固定液中。
3. 苏木素-伊红(HE)染色
样本于10%中性福尔马林固定液中固定48 h后进行组织修块、常规脱水,石蜡包埋。将包埋好的蜡块固定于切片机上横切,切片厚度为5 μm。用二甲苯脱蜡,再使用高浓度到低浓度乙醇脱去二甲苯,最后经过蒸馏水。用苏木素染色3 min,再用1%盐酸乙醇分化数秒。用自来水冲洗至细胞核呈蓝色。用0.5%伊红染细胞浆,常规脱水,中性树脂封片[6]。最后在光学显微镜下进行组织学观察。
4. 肌纤维横切面积测定
样本经HE染色后,将4组置于200倍放大倍数镜下采集3张图像,所得图像用Image J分析软件分析,测量每个样本各视野肌纤维的面积,每个样本大约选取200个肌纤维进行测量,边缘不完整的肌纤维不纳入统计。汇总每组6只小鼠肌纤维横切面积测量值,计算均数和标准差[7]。由于心脏毒素注射后第1、3 日,肌纤维溶解、断裂,结构不清,故仅分析正常组、注射后第5、7、14 日4组肌纤维横切面积。
5. 蛋白提取定量
将组织从-80℃冰箱取出后,置于预冷的研钵中,边加液氮边进行研磨,直至将其研磨成粉末状。随后转入预冷的裂解液中,使用电动匀浆器进一步匀浆,使其裂解完全。12 000 rpm、4℃离心10 min,提取上清液,使用二喹啉甲酸(BCA)法进行定量,置于100℃变性5 min。
6. 蛋白免疫印迹检测
取40 μg蛋白样本加入十二烷基磺酸钠-聚丙烯酰氨凝胶(SDS-PAGF)上样孔中进行电泳。60 V下样本跑进分离胶后转100 V至溴酚蓝到达分离胶底部。制备转印夹层,用220 mA恒流转膜100 min。用5%脱脂牛奶-磷酸盐缓冲液将样本置于室温封闭1 h后加入一抗anti-ERK1/2 (1∶1 000)、anti-磷酸化ERK1/2 (1∶1 000)、anti-TNF-α(1∶500)、anti-MyoD (1∶500)、微管蛋白抗体(anti-Tubulin) (1∶1 000),于4℃孵育过夜。用磷酸盐缓冲液洗膜2次,1% 脱脂牛奶-磷酸盐缓冲液洗膜3次,每次5 min。室温孵育二抗(辣根过氧化物酶标记山羊抗兔,1∶5 000),用1%脱脂牛奶-磷酸盐缓冲液清洗2次,磷酸盐缓冲液清洗3次,每次5 min。用ECL化学发光液显色,Tanon天能系列全自动化学发光成像分析系统扫描成像。以α-Tubulin作为内参,各目的蛋白条带与内参比较作为阳性条带的相对表达值[8]。
四、统计学处理
结果
一、病理学观察
HE染色后于光学显微镜下观察各组病理学改变。结果显示:正常组肌细胞形态正常,结构清晰,肌丝排列有序,间质未见炎症细胞、充血等病理学改变;D1组可见大量骨骼肌纤维溶解、断裂,部分肌纤维横纹消失,出现凝固性坏死,空泡变性,间质见炎症细胞浸润,以中性粒细胞为主;D3组可见大量骨骼肌纤维溶解,结构不清,肌纤维横纹排列紊乱或消失,部分出现凝固性坏死,空泡变性;D5组可见不同程度的细胞活化增生,仍可见少部分细胞坏死,间质炎症细胞浸润,血管扩张充血;D7组细胞增生较D5组更加明显,新增生的细胞与原有骨骼肌出现较好融合,部分出现肌纤维横纹;D14组新增生的细胞逐渐和原有骨骼肌出现较好的融合,肌细胞形态清楚,结构正常,肌纤维横纹排列整齐,间质未见炎症细胞浸润,血管未见扩张充血(图1)。
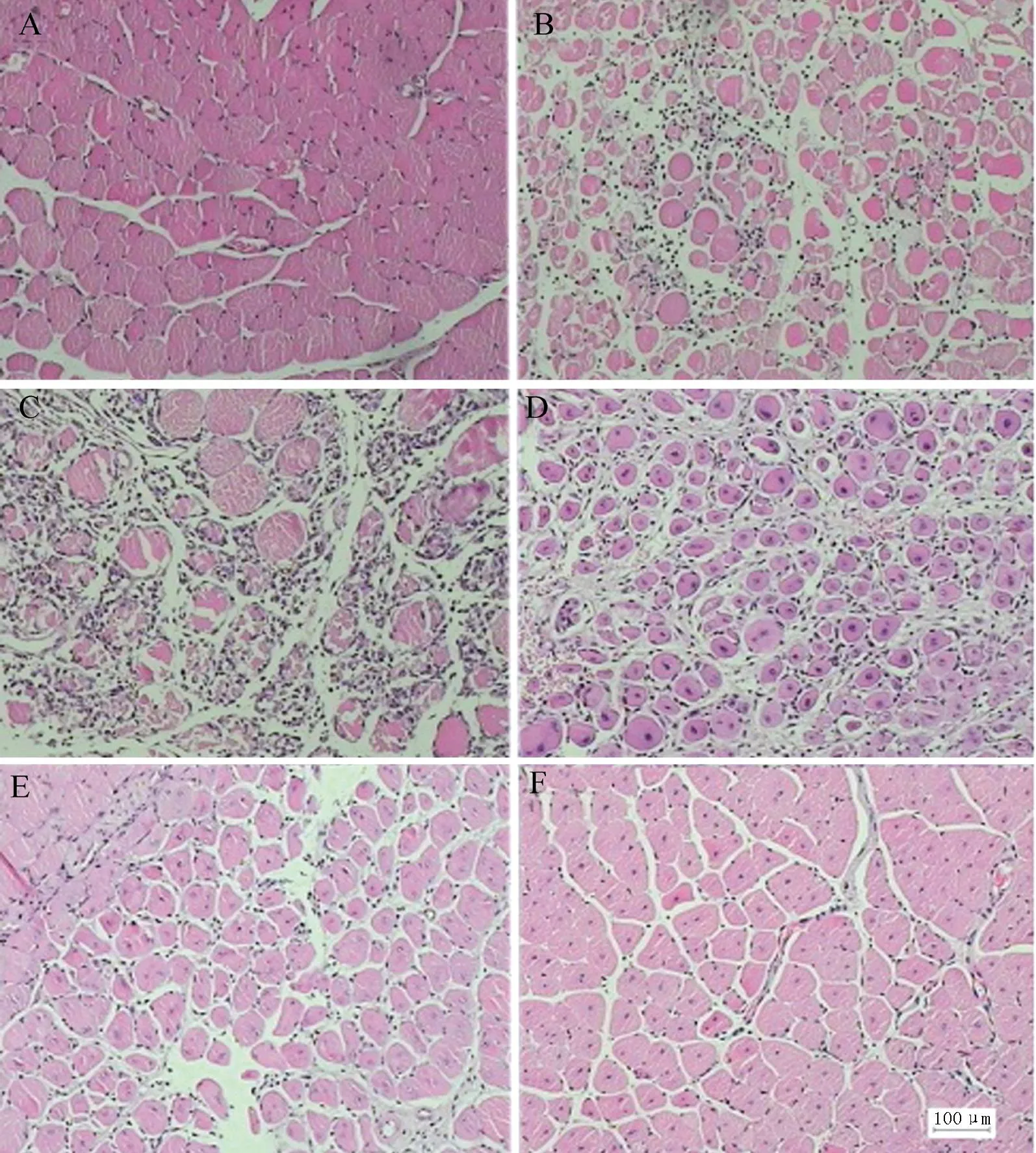
图1 各组胫骨前肌病理学观察 (HE染色,×200)
二、肌纤维横切面积测定结果
D5组及D7组肌纤维横切面积明显低于正常组,差异有统计学意义(P均<0.05)。恢复14 d后的D14组肌纤维横切面积增加,与正常组比较差异无统计学意义(P>0.05),见表1、2。
表1
各组肌纤维横切面积比较±s) μm2
注:总体比较F=177.565、P=0.922>0.05;与正常组比较,aP<0.05;与D14组比较,bP<0.05;与正常组比较,cP>0.05
表2

正常组与D14组大小肌纤维分布比例比较[中位数(下,上四分位数))]
注:2组各6只
三、蛋白免疫印迹检测结果
注射心脏毒素后肌组织蛋白中TNF-α表达水平上升,于第5日开始下降。磷酸化ERK1/2在第5日表达水平上升。MyoD在正常组中不表达,注射心脏毒素后其表达水平先上升后下降,见图2。
讨论
本研究采用心脏毒素肌肉局部注射的方法建立肌损伤模型。心脏毒素是从眼镜蛇毒腺中提取的一种毒素,有文献报道,心脏毒素注入小鼠骨骼肌后30 min 即可引起肌肉组织的坏死,可见损伤区域浆膜断裂,肌纤维挛缩,线粒体损害等病理改变,24 h 后即可见肌细胞胞质中仅包含有残存的肌纤维和肿胀的线粒体[9]。骨骼肌受损及修复包含一系列过程,首先出现炎症细胞应答,随后静止的肌卫星细胞被激活并表达成肌调节因子重新进入细胞循环,在肌源性前体细胞阶段开始增殖分化形成肌管,肌管相互间融合形成新的肌纤维,新的肌纤维成熟伴随肌肉功能恢复[10]。本研究组明显观察到胫骨前肌注入心脏毒素 1 d后出现肌纤维溶解、断裂及凝固性坏死的现象,注射心脏毒素后3 d仍有大量的坏死肌纤维,注射后5 d可观察到再生肌纤维,注射后7 d再生肌纤维取代大部分的坏死肌纤维,部分出现肌纤维横纹,注射后14 d新增生的细胞和原有骨骼肌出现较好的融合,与正常组比较无明显差异,且随着损伤修复时间的延长,肌纤维横截面积增加,注射心脏毒素后14 d肌纤维横截面积与正常组比较差异无统计学意义。
近些年有学者认为TNF-α能通过不同信号途径影响肌细胞凋亡及再生修复过程,对骨骼肌的损伤和修复可能起重要的调节作用。TNF-α在遗传性及退化性骨骼肌患者血清中长时间表达水平上升,动物研究亦认为高水平TNF-α抑制肌分化融合,与肌萎缩关系密切[11]。Velders等[12]在大鼠右侧腓肠肌注射虎蛇毒素24 h后观察到其TNF-α mRNA及蛋白表达水平上升,而MyoD调节因子mRNA水平在3 d后急剧上升。体外研究显示,在低浓度血清分化液中,原代骨骼肌细胞及C2C12小鼠成肌细胞系里,TNF-α表达水平上升。本研究结果显示,在注射心脏毒素后,炎症因子TNF-α与MyoD同步上升,随后下降,提示TNF-α可能对生肌调节因子MyoD表达有一定的调节作用。
ERK、c-Jun氨基端激酶(JNK)、P38为有丝分裂原活化蛋白激酶(MAPKs)家族成员,MAPKs信号转导通路存在于大多数细胞内,在将细胞外刺激信号转导至细胞及其核内,并引起细胞生物学反应(如细胞增殖、分化、转化及凋亡等)的过程中具有至关重要的作用。抑制ERK1/2磷酸化的表达可减少生肌素Myogenin的表达,减少单核成肌细胞融合形成为多核的肌纤维,敲除ERK2可使成肌细胞系C2C12失去肌融合能力[13]。高浓度TNF-α可抑制细胞分化融合,某些微小RNA可通过MAPK/ERK通路减少TNF-α对肌融合负调节作用[13-14]。体外实验证明:在C2C12骨骼肌早期分化过程中,TNF-α和IGF-1经过MAPK/ERK信号通路调节特定的功能性微小RNA,如hsa-微小RNA-155、微小RNA-351、微小RNA-450b-5p、mmu-微小RNA-133b-3p,增加肌细胞融合指数[14]。本研究的结果显示:正常组及损伤初期,肌卫星细胞激活及增殖过程中表达少量的磷酸化ERK1/2,在小鼠损伤恢复第5日,磷酸化ERK1/2表达水平明显上升。结合形态学结果,损伤后第5日时新形成的肌管逐渐开始融合,形成肌纤维,我们推测磷酸化ERK1/2 可能对肌细胞融合起促进作用。
综上所述,在骨骼肌损伤初期,静止的肌卫星细胞被激活,生肌调节因子MyoD表达增加,可能与炎症因子TNF-α在骨骼肌损伤初期表达水平上升有关。随着损伤修复进程的发展,TNF-α表达水平减少,其下游因子磷酸化ERK1/2表达水平上升。我们推测TNF-α浓度降低可能促使磷酸化ERK1/2表达来介导肌管融合,促进新的肌纤维形成,但两者间的相互作用需行进一步研究确定。
参考文献
[1]Han AA, Currie HN, Loos MS, Vrana JA, Fabyanic EB, Prediger MS, Boyd JW. Spatiotemporal phosphoprotein distribution and associated cytokine response of a traumatic injury. Cytokine, 2015, 79:12-22.
[2]Bhatnagar S, Panguluri SK, Gupta SK, Dahiya S, Lundy RF, Kumar A.Tumor necrosis factor-α regulates distinct molecular pathways and gene networks in cultured skeletal muscle cells.PLoS One,2010,5(10):e13262.
[3]Motohashi N, Alexander MS, Shimizu-Motohashi Y, Myers JA, Kawahara G, Kunkel LM. Regulation of IRS1/Akt insulin signaling by microRNA-128a during myogenesis.J Cell Sci,2013,126(12): 2678-2691.
[4]Plaisance I, Morandi C, Murigande C, Brink M.TNF-α increases protein content in C2C12 and primary myotubes by enhancing protein translation via the TNF-R1, PI3K, and MEK.Am J Physiol Endocrinol Metab, 2008,294(2):E241-E250.
[5]Al-Sajee D, Nissar AA, Coleman SK, Rebalka IA, Chiang A, Wathra R, van der Ven PF, Orfanos Z, Hawke TJ.Xin-deficient mice display myopathy, impaired contractility, attenuated muscle repair and altered satellite cell functionality. Acta Physiol, 2015, 214:248-260.
[6]Nguyen TH, Bertrand MJ, Sterpin C, Achouri Y, De Backer OR. Maged1, a new regulator of skeletal myogenic differentiation and muscle regeneration.BMC Cell Biol, 2010, 11:57.
[7]White JP, Baltgalvis KA, Sato S, Wilson LB, Carson JA.. Effect of nandrolone decanoate administration on recovery from bupivacaine-induced muscle injury. J Appl Physiol, 2009, 107:1420-1430.
[8]Bobadilla M, Sáinz N, Rodriguez JA, Abizanda G, Orbe J, de Martino A, García Verdugo JM, Páramo JA, Prósper F, Pérez-Ruiz A.MMP-10 is required for efficient muscle regeneration in mouse models of injury and muscular dystrophy. Stem Cells, 2014,32(2):447-461.
[9]李小雷,黄厚今,杨志明, 周光前, 解慧琪, 邓力. c-Met在骨骼肌损伤组织肌卫星细胞中的表达. 解剖学报,2009,40(5):780-784.
[10]于美娟,张雅妮,冯善伟,王淑辉,熊符,张成. Micro-dystrophin基因修饰的 MSCs在mdx小鼠体内分化为肌卫星细胞的研究. 新医学,2010,41(7):442-444.
[11]Fogagnolo Mauricio A, Minatel E, Santo Neto H, Marques MJ. Effects of fish oil containing eicosapentaenoic acid and docosahexaenoic acid on dystrophic mdx mice. Clin Nutr, 2013, 4:636-642.
[12]Velders M, Schleipen B, Fritzemeier KH, Zierau O, Diel P. Selective estrogen receptor-β activation stimulates skeletal muscle growth and regeneration. FASEB J, 2012,26(5):1909-1920.
[13]Paroo Z, Ye X, Chen S, Liu Q. Phosphorylation of the human microRNA-generating complex mediates MAPK/Erk signaling. Cell, 2009,139(1):112-122.
[14]Meyer SU, Thirion C, Polesskaya A, Bauersachs S4, Kaiser S, Krause S, Pfaffl MW.TNF-α and IGF1 modify the microRNA signature in skeletal muscle cell differentiation. Cell Commun Signal, 2015, 13:4.
(本文编辑:洪悦民)

Effect of TNF-α and ERK 1/2 on regeneration and repair of cardiotoxin-induced skeletal muscle injury
ChenRui,SheYanling,ZhouShanyao,ShiHuacai,LiCheng.
TraditionalMedicineandSportsInjuryRehabilitationInstituteofGuangdongProvince,GuangdongNo.2ProvincialPeople’sHospital,Guangzhou510317,China
【Abstract】ObjectiveTo investigate the role of tumor necrosis factor (TNF)-α and extracellular regulated kinase (ERK)1/2 in repairing the cardiotoxin-induced skeletal muscle injury. MethodsSeventy two C57BL6 male mice were randomly assigned into the normal group and five injury regeneration groups. The mice in the injury regeneration groups were administered with 100 μl of 10 μM cardiotoxin via the tibialis anterior. The tibialis anterior tissue was isolated at 1-, 3-, 5-, 7- and 14-d after cardiotoxin injection. The repair of skeletal muscle injury was observed and the cross-sectional area of muscle fiber was measured under hematoxylin and eosin staining. The expression levels of TNF-α, ERK1/2, phospho-ERK1/2 and MyoD in the muscle tissues were detected by western blot. ResultsThe signs of tibialis anterior myolysis and rupture were noted at 1 d after cardiotoxin injection, which were repaired at 14 d post-injection. The cross-sectional area did not significantly differ between the 14 d post-injection group and normal group,(1 658.5±118.3)μm2vs. (1 625.2±151.7) μm2,P>0.05. The expression of TNF-α and MyoD was up-regulated at 1 and 3 d after injection, and the level of phospho-ERK1/2 was raised at 5 d. ConclusionTNF-α level may play a role in the initial phase of muscle injury repair, whereas phospho-ERK1/2 probably exerts a regulatory effect during the advanced phase.
【Key words】Skeletal muscle; Injury regeneration; Tumor necrosis factor-α;
(收稿日期:2015-12-27)
Corresponding author,Chen Rui
通讯作者,陈睿
DOI:10.3969/j.issn.0253-9802.2016.04.007
·基础研究论著·
