Cd2+、Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响
2016-05-23简敏菲汪斯琛余厚平李玲玉简美锋余冠军
简敏菲, 汪斯琛, 余厚平, 李玲玉, 简美锋, 余冠军
1 江西师范大学,鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022 2 江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室, 南昌 330022 3 江西鄱阳湖南矶山湿地国家级自然保护区管理局, 南昌 330009
Cd2+、Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响
简敏菲1,2,*, 汪斯琛2, 余厚平1, 李玲玉2, 简美锋2, 余冠军3
1 江西师范大学,鄱阳湖湿地与流域研究教育部重点实验室, 南昌3300222 江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室, 南昌3300223 江西鄱阳湖南矶山湿地国家级自然保护区管理局, 南昌330009
摘要:以黑藻(Hydrilla verticillata )为供试材料,采用Cd2+和Cu2+等两种重金属分别在5个浓度梯度水平下的河砂水培方法,研究Cd2+或Cu2+不同浓度胁迫对黑藻株高、生物量、成活率和叶绿素含量的影响,以及对黑藻叶片最小荧光(Fo)、最大荧光(Fm),PSⅡ最大量子产率(QYmax,)、稳态下的PSⅡ反应中心关闭程度(1-Qp_Lss)、稳态下的非光化学淬灭(NPQ_Lss)等光合荧光参数及其荧光成像的影响,探讨各个参数分别随镉、铜浓度递增的变化规律。研究结果表明,Cd2+胁迫下黑藻的株高显著下降,说明Cd2+可能对黑藻叶片的维管束结构产生伤害作用;Cd2+和Cu2+胁迫对黑藻鲜重均无显著影响,说明与水生植物自由水含量存在一定关系;Cd2+和Cu2+胁迫均使黑藻干重显著下降,其中Cu2+胁迫对黑藻干重的影响更显著,说明Cu2+胁迫对黑藻累积生物量的影响远大于Cd2+;Cd2+和Cu2+胁迫下叶绿素各值均呈下降趋势,而Cu2+胁迫对叶绿素的影响更大,说明Cu2+对黑藻叶绿体的毒害比Cd2+更大。随着Cd2+或Cu2+胁迫浓度梯度的增加,黑藻的叶绿素荧光参数(Fo、Fm、QYmax)呈显著下降趋势,(1-Qp_Lss)呈上升趋势,而NPQ_Lss先上升后下降。黑藻在不同重金属胁迫下的生理指标、荧光参数及成像特征等方面所表现出的变化差异性,反映出同等浓度下黑藻受重金属胁迫的影响程度为:Cd2+胁迫>Cu2+胁迫;黑藻可以在Cu2+浓度低于1 mg/L的环境下具有正常的光合活性,可推测将黑藻用于低浓度Cu污染水域的修复;在Cu2+浓度达3 mg/L以上环境下黑藻即无法长时间生存,可推测黑藻可以作为Cd污染水环境的指示种。
关键词:黑藻; 重金属胁迫; 生长活性; 叶绿素含量; 光合荧光参数; 荧光成像
全球工业化引起的重金属污染,已成为人们关注的环境与社会突出问题[1- 2];水体中的重金属污染问题也随着冶炼、电镀、采矿等各种工业废水和固体废物渗滤液的直接排入而日益突出[3]。重金属污染物因不能自然降解或被微生物分解,易沉积到水域底部或在水中被水生生物吸收,一方面通过食物链积累而损害动物和人类健康[4],另一方面可影响植物的生长和植物体内活性氧代谢系统的平衡,导致一系列有害的生理生化变化[5]。镉、铜均为水体重金属污染物中最典型的污染元素[6],会对水生植物细胞造成极大破坏[7],极低浓度即可使细胞核仁解体、线粒体和叶绿体空泡化、高尔基体和内质网解体等,甚至导致植物无法正常生长[8]。沉水植物作为水生生态系统中最主要的初级生产者之一,不仅可以去除N、P等营养物质和有机污染负荷,对重金属也具有一定的吸附和积累能力[9],对Cd和Cu等均具较强的富集作用,可用来去除水中的Cd、Cu[10],沉水植物的这种对重金属的吸附、转移或者将其固定在体内的富集特性可被运用于重金属污染水域的治理[11],沉水植物在湖泊污染治理中的应用已日趋广泛[12- 14]。近年来,国内外学者对于重金属污染下沉水植物的生态毒理效应进行过研究,主要集中在植物对重金属的富集作用[15- 18]、生理生化的伤害反应[19]、细胞内部亚显微结构变化[20]等方面,但对于重金属胁迫下黑藻等沉水植物的光合荧光和荧光成像等影响变化的研究尚较缺乏。研究镉、铜对黑藻生理特性和光合荧光特性,可直接获得镉、铜污染胁迫下黑藻活体光合作用的变化,进而探究其耐受程度和胁迫机理,为水体重金属污染的治理、恢复和重建水生植物群落提供实践指导,对于研究沉水植物作为重金属等各种污染物的指示生物等具有重要意义。
叶绿素荧光测定技术是一种简便、快捷、可靠、无损伤的光合作用研究方法。自Kautsky和Hirsch[21]首次发现光合作用与叶绿素荧光间的联系后[22],叶绿素荧光在植物的光合作用、胁迫生理学、水生生物学、海洋学和遥感等方面已得到广泛的应用[23- 24]。脉冲幅度调制方式(PAM, Pulse Amplitude Modulation)下测量Kautsky效应,可以非常详细地调查植物光合作用从暗适应状态到光适应状态,然后又到暗适应状态的转变。叶绿素荧光成像技术是1987年由Omasa等人开发[25],PAM技术于1996年由光子系统仪器首次介绍到叶绿素荧光成像[26],当实验对象受到胁迫后(如受重金属侵害),其荧光发射具有明显异质性,事实证明采用叶绿素荧光成像技术已是必不可少[27]。目前,叶绿素荧光成像技术不仅用于光合作用的研究,还用于病毒和其他病原体局部监测(在可见症状出现之前)以及重金属胁迫等方面[28]。叶绿素荧光成像可呈现出植物受到胁迫的荧光状态,能更全面地了解植物的光合作用状态,为诠释其生长和耐受机制提供新的、直观可见的手段。
黑藻(Hydrillaverticillata)是多年生大型淡水沉水植物,具有生长范围广、耐污能力和适应性强等特点,在国内外富营养化水体治理和生态修复中已得到广泛应用,并对重金属具有较强的吸收积累能力[29],可作为重金属污染环境修复植物和水体污染的指示植物[30- 31]。黑藻对Cd、Cu两种重金属污染物均具有比较敏感的反应[32],超过一定浓度的Cd、Cu会抑制和伤害黑藻的生长。本文将通过不同浓度镉、铜胁迫对黑藻株高、生物量、成活率和叶绿素含量的影响,以及对黑藻叶片光合荧光参数及其荧光成像的影响,结合前人的研究探讨黑藻受胁迫后的生长和光合生理状态,以及黑藻耐受和调节光能利用效率的内在机制,为修复和指示重金属污染的生态环境、重建水生植物群落及修复湖泊生态系统提供科学依据。
1材料与方法
根据徐勤松等学者的研究结果,黑藻对Cd、Cu等两种重金属污染物具有比较敏感的反应,且Cd、Cu是重金属污染水体中极常见的两种元素,Cd、Cu对黑藻的毒害较大,致死浓度分别为0.5—1 mg/L和1—2 mg/L[7]。分别选取Cd、Cu等两种重金属元素作为水体重金属胁迫污染物,选择沉水植物黑藻(H.verticillata)作为供试植物材料,材料采自江西师范大学校园内湖水域。选取长势相似的黑藻植株,截取生长状况相似的10cm顶尖作为实验材料[32]。
1.1材料培养与处理
2013年11月初将采回的黑藻放入盛有未经曝气的自来水盆中(为防止绿藻滋生而严重影响黑藻生长,自来水不能曝气),在室内驯养3—4 d后,采用培养盆(49 cm×36.5 cm×19 cm),在盆底铺上洗净的河砂约3.5 cm厚,加入等体积1/40 Hoagland植物培养液,每个培养盆内加培养液30 L,盆内水深15 cm,河沙约3.5 cm,将截取的顶尖10 cm的黑藻扦插于培养盆中,每个盆中扦插35株,2 d后分别于11月12日和28日8:00在培养盆中分别加入不同浓度的CdCl2溶液和CuSO4溶液进行处理,分别设置Cd2+和Cu2+的浓度梯度依次为0.5、1、3 mg/L和5 mg/L 等4个,另外设置0 mg/L Cd2+或Cu2+的对照培养组,相当于每种重金属浓度梯度共有5个,每个浓度下分别设置3个重复组。培养盆均放置室内,采用空调控温18—21 ℃,并采用LED灯补光,实际功率红光∶蓝光=3∶1(光照强度约为5000 lx),光周期为14 h∶10 h,水温为17 ℃左右,第7天8:00 分别取植株进行分析。
1.2光照强度和温度的测定
采用TES-1339专业照度计测定水面光照强度。自8:00到22:00每隔2h分别采用温度计和水温计测定1次空气温度和水温。
1.3株高、生物量和成活率的测定
每组样品加入不同浓度重金属溶液培养7 d后,记录每个培养盆中活体黑藻的株数,计算成活率;用直尺(精确到0.1 cm)测量15个培养盆中活体黑藻的株高;每个培养盆中取出10株黑藻,晾干表面水分,将用来垫着植物的两层滤纸完全浸湿后,称量其鲜重,于空气中自然风干15 d后称量其干重。
1.4植物叶绿素含量的测定
随机选取培养盆中黑藻测量,获得3个以上的平行数据。用100%二甲基亚砜(DMSO)分光光度法[33- 34]测定黑藻叶片的叶绿素含量,用DMSO在研钵中研磨植物叶片萃取,根据所得溶液在645 nm和663 nm的吸光值,运用Arnon公式[35]计算叶片的叶绿素总量(Ct)、叶绿素a (Ca)、叶绿素b (Cb)和Ca/Cb值。
Ca=12.7 A663- 2.69A645
(1)
Cb=22.9A645- 4.68A663
(2)
Ct=Ca+Cb= 8.02A645+ 20.21A663
(3)
1.5植株活体光合荧光参数的测定
每个培养盆中随机选取黑藻测量,获得3个以上的平行数据。运用FluorCam叶绿素荧光成像仪测定黑藻的荧光参数和活体荧光成像。取黑藻装入广口瓶中,包裹锡箔纸暗处理20 min,设定快门Shutter=0,敏感度Sensitivity=20,光照Act2=100,Act1=100,Super=70,测定荧光参数,包括暗适应状态下的最小荧光(Fo)、暗适应状态的最大荧光(Fm)、潜在光合活性(Fv/Fo,Potential photosynthetic activity)、最大PSⅡ量子产率(QYmax)、稳态下PSⅡ反应中心关闭程度(1-Qp_Lss)、稳态下的非光化学淬灭(NPQ_Lss)等指标及对应的植物荧光成像。
1.6数据统计分析方法
实验结果均为3次以上平行数据的平均值和标准差,实验数据采用统计软件SPSS进行单因素方差分析(One-way, ANOVA)和最小显著差异法(LSD),Pearson相关关系分析, 采用多重方差法分析显著性,对黑藻在不同镉、铜浓度下反应数据进行差异性比较;采用Origin 8.0进行作图。
2结果与分析
2.1Cd2+、Cu2+胁迫对黑藻生长的影响
根据Cd2+或Cu2+污染胁迫中所设置的5个不同浓度梯度,测定黑藻生长中的株高、鲜重、干重以及成活率等数据,分别统计其变化特征及其相关显著性,结果如图1所示。

图1 不同浓度重金属胁迫下黑藻成活率、生物量和株高的变化及其相关显著性Fig.1 Varieties and correlations of survival rate, biomass and plant heights of Hydrilla verticillata under the stress of different heavy metal concentrations图中不同小写字母表示不同处理之间达到Sig<0. 05水平的显著差异,不同大写字母表示不同处理之间达到Sig<0. 01水平的极显著差异
图1显示,采用CdCl2和CuSO4溶液处理过的各培养组,Cd2+胁迫对株高的影响表现出显著下降趋势,浓度为3 mg/L 的Cd2+处理后的黑藻株高平均值最低,比对照组的降低6.72%,Cu2+胁迫对黑藻的株高无显著影响。Cd2+和Cu2+胁迫对鲜重均无显著影响,这可能与水生植物的自由水含量有关[36]。Cd2+和Cu2+胁迫对干重的影响均表现出显著下降趋势,其中Cu2+胁迫的影响更突出;浓度为5 mg/L 的Cu2+或Cd2+处理后的黑藻干重分别达到最低值,分别比对照组的干重降低41.31%和14.9%。0.5 mg/L Cd2+和Cu2+胁迫对成活率的影响均未表现出显著差异,说明低浓度的Cd2+或Cu2+胁迫对黑藻的成活率影响不明显,1 mg/L Cd2+胁迫下黑藻的成活率首先表现出显著下降,不同Cd2+浓度梯度处理后黑藻的成活率分别比对照组的降低了2.02%、5.72%、16.16%和3.70%,而3 mg/L和5 mg/L Cu2+胁迫下黑藻的成活率急剧下降,不同Cu2+浓度梯度处理后黑藻的成活率分别比对照组的降低了0.97%、3.88%、67.96%和26.21%(图1)。
2.2Cd2+、Cu2+胁迫对黑藻叶绿素的影响
根据Cd2+或Cu2+5个不同浓度梯度胁迫下黑藻的各种叶绿素含量测定数据,分别统计叶绿素总量(Ct)、叶绿素a(Ca)量、叶绿素b(Cb)量、叶绿素a/b(Ca/Cb)及其显著相关性,结果如图2所示。
图2显示,不同浓度Cu2+处理下的黑藻叶绿素各值均显著下降,且同浓度的Cu2+处理比Cd2+处理后黑藻的叶绿素各值下降更明显。Cu2+溶液处理过的培养组中,0.5 mg/L Cu2+处理下的叶绿素总量、叶绿素a、b等值均达到最低值,与对照组相比分别下降了48.7%、52.2%、39.4%;3 mg/L Cu2+处理后的黑藻Ca/Cb达到最低值,与对照组相比下降了45.2%。而不同浓度Cd2+处理过的培养组中,Cd2+浓度为5 mg/L处理下的黑藻叶绿素总量、叶绿素a、b、Ca/Cb等各值指标达最低值,与对照组相比分别下降24.1%、29.9%、5.5%、26.5%。0.5—3 mg/L浓度Cd2+胁迫下的黑藻叶绿素b呈现逐渐上升趋势,但Cd2+浓度为5 mg/L胁迫下黑藻的叶绿素b呈现下降(图2)。
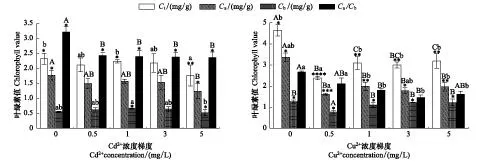
图2 不同浓度重金属胁迫下黑藻叶绿素总量(Tc),叶绿素a(Ca),叶绿素b(Cb)和Ca/Cb及其相关性Fig.2 Varieties and correlations of total chlorophyll (Tc), chlorophyll a (Ca), chlorophyll b (Cb) and Ca/Cb of Hydrilla verticillata under the stress of different heavy metal concentrations图中不同小写字母表示不同处理之间达到Sig<0. 05水平的显著差异,不同大写字母表示不同处理之间达到Sig<0. 01水平的极显著差异
2.3Cd2+、Cu2+胁迫对黑藻叶绿素荧光参数的影响
分别测定上述5个不同浓度梯度Cd2+或Cu2+胁迫处理一周后黑藻的各种荧光参数:暗适应状态的最小荧光Fo和最大荧光Fm、潜在光合活性FV/Fo、最大PSⅡ量子产率QYmax、稳态下PSⅡ反应中心关闭程度(1-Qp_Lss)、稳态下的非光化学淬灭NPQ_Lss等指标,分析不同浓度重金属胁迫对黑藻叶绿素荧光各参数的影响,结果如图3或表1所示。
图3结果显示,Cd2+或Cu2+胁迫处理后,黑藻的Fo、Fm、QYmax和Fv/Fo均呈下降趋势。Cd2+胁迫对黑藻叶片的Fo有显著影响,而Cu2+胁迫则无显著影响。在浓度为0.5 mg/L,Cd2+或Cu2+胁迫处理后黑藻的Fm分别显著下降43.0%和17.9%,Cd2+胁迫后黑藻的Fm下降更突出(图3)。Cd2+或Cu2+胁迫下黑藻叶片的Fv/Fo均呈显著下降,受Cd2+胁迫后的效果相对非常突出,5 mg/L Cd2+胁迫下黑藻叶片的Fv/Fo最低,比对照组下降了90.4%,而5 mg/L Cu2+胁迫下黑藻叶片的Fv/Fo也最低,但比其对照组只下降24.5%。同样,Cd2+或Cu2+处理后黑藻叶片的QYmax均呈显著下降,5 mg/L Cd2+胁迫下黑藻叶片的QYmax最低,下降25.2%,而5 mg/L Cu2+胁迫下黑藻叶片的QYmax也最低,下降8.5%(图3)。黑藻叶片QYmax和Fv/Fo值的下降表明,重金属离子使PSⅡ反应中心受损,抑制光合作用的原初反应,阻碍光合电子的传递过程。图3中Cd、Cu对黑藻叶片荧光参数的影响均是先显著降低,之后随着重金属浓度的增加有少量回升,最后呈现较平稳趋势。反映出重金属对黑藻的胁迫较明显,且随着重金属浓度的上升而上升,而黑藻体内光合机制的改变,使得黑藻能在重金属环境下仍然保持光合活性。
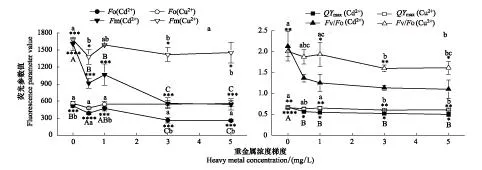
图3 不同浓度重金属胁迫对黑藻叶绿素荧光参数的影响Fig.3 Influences on chlorophyll fluorescence parameters of Hydrilla verticillata under the stress of different heavy metal concentrations不同小写字母表示不同处理之间达到Sig<0.05水平的显著差异,不同大写字母表示不同处理之间达到Sig<0.01水平的极显著差异
表1显示,与空白对照组相比,Cd2+或Cu2+胁迫后的黑藻叶片稳态下PSⅡ反应中心关闭程度(1-Qp_Lss)、非光化学淬灭系数(NPQ_Lss)上升,表明Cd2+或Cu2+胁迫改变了黑藻叶片的光能利用分配。
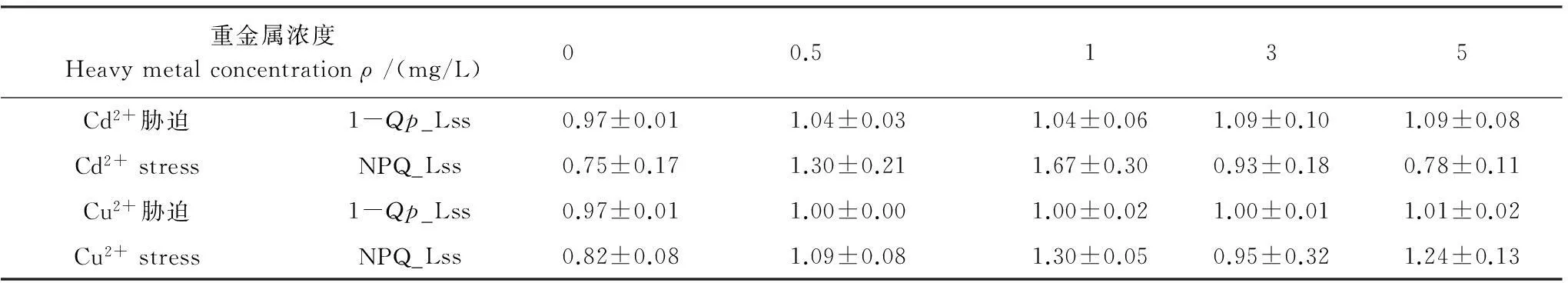
表1 不同浓度重金属胁迫对黑藻(1-Qp_Lss)和NPQ_Lss的影响
2.4Cd2+、Cu2+胁迫对黑藻荧光成像的影响
Cd2+或Cu2+不同浓度梯度胁迫处理后的黑藻叶片PSⅡ最大量子产率时的荧光成像分别如图4。结果显示,Cd2+胁迫下的黑藻叶片荧光成像强度由高变低,浓度在3 mg/L及以上的Cd2+胁迫处理后,黑藻叶片大部分失去光合作用活性,只有茎秆(黑藻叶片中间为少量茎秆横截面)附近的少量区域有光合活性(图4)。而浓度为0.5 mg/L和1 mg/L的Cu2+胁迫对黑藻叶片光合活性的影响并不显著,但随着Cu浓度的再升高呈显著下降趋势(图4)。另一方面,Cd2+或Cu2+对照组中的黑藻能运用整个叶面进行光合作用,而受Cd2+、Cu2+胁迫后的黑藻叶片光合活性降低,且较高的光合活性位于茎秆处和叶脉处,Cd2+、Cu2+胁迫对黑藻叶片光合活性的伤害从叶片边缘开始达到最严重,而茎秆和叶脉处最轻,这可能与茎和叶脉的维管束结构有一定关联性。

图4 不同浓度重金属胁迫对黑藻叶绿素荧光(QY_max)成像的影响Fig.4 Varieties of chlorophyll fluorescence (QY_max) imagings under the stress of different heavy metal concentrations
3结论与讨论
叶绿素是与植物光合作用最密切相关的一种色素,Cd2+、Cu2+胁迫分区均造成黑藻叶绿素含量下降,黑藻在Cu2+胁迫下的叶绿素含量比Cd2+胁迫下的减少更多,说明Cu2+胁迫比Cd2+胁迫对叶绿体的毒害作用更大,可能原因是Cu2+胁迫对内膜、类囊体片层和光合色素等的损害更严重[32]。当用0.5—3 mg/L Cd2+浓度胁迫处理黑藻时,叶绿素总量下降并不十分明显,当Cd2+浓度达到5 mg/L时叶绿素总量下降最多,但是在0.5 mg/L Cd2+胁迫下的叶绿素a/b(Ca/Cb)会立刻显著下降,后随着Cd2+浓度的升高并未产生显著下降。黑藻的叶绿素b在Cd2+浓度为0.5—3 mg/L间的胁迫下有所上升,而Cd2+浓度为5 mg/L时出现下降,有研究认为叶绿素b含量的减少会影响到光系统的稳定性,最终导致整个光合机构的不稳定,具体表现在对逆境的耐受性降低[37- 38]。反之推测,Cd2+胁迫下黑藻叶绿素b含量增加,可能是黑藻对Cd2+胁迫耐受能力的增强,Cu2+胁迫下黑藻叶绿素b也在0.5 mg/L下降到最低后上升,与黑藻对这两种金属的耐受机制有关。以上说明在Cd2+胁迫导致黑藻叶绿素含量减少的情况下,黑藻通过调整叶绿素Ca/Cb的比值以适应逆境[39],具体机制尚需进一步探究。
叶绿素a荧光动力学在植物生理领域得到广泛应用,QYmax反映了 PSⅡ反应中心光能转化效率,可作为植物对不良环境耐受性等方面的重要指标[40]。Cd2+胁迫的黑藻Fm比Cu胁迫下降得明显更多,Fo下降的差别较小,因此,Cd2+胁迫下的QYmax值也比Cu2+胁迫下的降低得更多,说明黑藻光合活性能力对重金属的耐受能力:Cu2+耐受>Cd2+耐受。研究表明在对黑藻细胞的损害中,Cd2+对叶绿体的破坏较小[8],但Cd2+胁迫下黑藻的潜在光合活性(Fv/Fo表示PSⅡ的潜在活性)比受Cu2+胁迫后下降得更多,反映出Cd2+对黑藻内部光合作用结构的破坏比Cu2+更彻底,并且Cd2+、Cu2+胁迫对黑藻光合活性的伤害是不可逆的[8,10]。1-Qp_Lss是 PSⅡ反应中心关闭的程度,在一定程度上反映 QA的氧化还原状态,1-Qp_Lss越大,PSⅡ反应活性越小。与对照组相比,Cd、Cu胁迫后的黑藻叶片1-Qp_Lss 增加表明电子由PSⅡ的氧化侧向PSⅡ反应中心的传递受阻,改变了黑藻叶片的光光能利用分配,将原本用来获得量子产量的部分光能热耗散等用于增强自我保护,这有可能是造成非光化学淬灭系数(NPQ_Lss)上升和PSⅡ最大量子产率(QYmax)下降的原因,之后非光化学淬灭减小的原因可能在于PSⅡ的部分失活,黑藻的正常生理功能被严重破坏。
Govindjee和Nedbal用“百闻不如一见”来表达并强调叶绿素荧光成像如何获得科学实验的信念[27]。QYmax表示植物PSⅡ最大量子产率,其叶绿素荧光成像最能反映重金属胁迫对光系统Ⅱ的损害,荧光成像表明Cd2+、Cu2+重金属胁迫使黑藻叶片PSⅡ反应中心受到严重损害,光合活性减弱。Cd2+、Cu2+对黑藻叶片的损害都是从边缘开始的,黑藻叶片是由单层细胞组成,Cd2+、Cu2+对黑藻的毒害是对植物细胞的膜结构和非膜结构、生理活动和生化反应的整体伤害[8,10],但是叶脉、茎和叶片结构不同,因此推测维管束结构更难被Cd2+、Cu2+破坏。
从植物形态上可以判断植物的生长和受胁迫情况,Cd2+胁迫下黑藻株高比Cu2+胁迫下的下降率更高,说明Cd2+胁迫对黑藻株高的影响大于Cu2+胁迫对黑藻株高的影响;3 mg/L 的Cu2+胁迫对黑藻的成活率影响最大,随着浓度的升高,黑藻的成活率反而有所上升,Cd2+胁迫的下降率更低;Cu2+胁迫下黑藻干重比Cd2+胁迫下降率更高。在3 mg/L Cu2+胁迫下,黑藻成活率、Ca/Cb、QYmax最低;5 mg/L Cu2+胁迫下株高、鲜重、干重最低,表明5 mg/L Cu2+胁迫下黑藻长势差,有机物和无机物含量减少,叶绿素增加,Ca增加而Cb减少了。图2中可以看出,Cu2+胁迫下叶绿素b只在0.5 mg/L时下降显著,其他浓度的胁迫和对照组都没有显著差异,说明Cu2+胁迫对黑藻叶绿素a的影响比叶绿素b大,可能的原因有:Cu2+促进叶绿素的生物合成[41],或者破坏叶绿素酶活性,使叶绿素降解减少[42],叶绿素a的主要功能是吸收和传递光能,加强黑藻的光合作用能力,因此最大量子产率(QYmax)也增加,光合作用的增强对黑藻的成活率有较大的影响。图2中5 mg/L Cd2+胁迫下与3 mg/L Cd2+胁迫下相比可以看出,黑藻的叶绿素a和叶绿素b均呈显著下降,但是光合能力指标Ca/Cb并无显著差异,说明光合作用能力并未下降,图3中的量子最大产率QYmax无显著差异也印证了这一点。光合作用无明显差异的情况下,有机物和无机物的累积也无明显变化,干重无显著差异。而5 mg/L Cd2+胁迫下与3 mg/L Cd2+胁迫下相比,表1中NPQ_Lss的降低说明黑藻的光保护能力下降,图4可以看出,黑藻叶片的成活面积变小,活体细胞大多集中于中间叶脉部分,光合作用得到的有机物用来维持活体细胞的生长,即很大一部分用于叶脉的生长,叶脉的生长使得株高增加,而由于叶脉比叶片更难被Cd2+破坏,因此成活率得以上升。
Cd2+是黑藻的非必须营养元素,研究表明,Cd2+使黑藻体内活性氧减少、影响细胞壁的形成、破坏细胞器和细胞、损伤类囊体[8],Cd2+胁迫下黑藻光合活性显著下降,3 mg/L及以上浓度的Cd2+对黑藻的伤害极大,黑藻因此会失去大部分光合能力,无法长时间生存,表明黑藻可作为Cd污染水环境的指示种。Cu2+是黑藻生长必须的微量营养元素,所以一定浓度的Cu2+对黑藻的生长是有利的,但是超过一定范围就会造成黑藻细胞核消解、线粒体空泡化、类囊体片层排列混乱甚至溶解、叶绿体膨胀成球形然后解体、蛋白质和脂类失活等损害[32]。本研究中,浓度为0.5和1 mg/L 的Cu2+胁迫对黑藻光合活性的抑制不显著,表明在低浓度的Cu2+环境中黑藻可以进行比较正常的生理活动,可推测将黑藻用于低浓度Cu2+污染水域的修复与水生生态系统的沉水植物重建。本研究得出的结论能否用于实践,尚需要更多研究来确定其可靠性和实用性。
参考文献(References):
[1]Khan K S, Huang C Y. Effects of heavy metal pollution on soil microbial biomass. Journal of Environmental Sciences, 1999, 11(1): 40- 47.
[2]Yang X, Römheld V, Marschner H, Chaney R L. Application of chelator-buffered nutrient solution technique in studies on zinc nutrition in rice plant (OryzasativaL.). Plant and Soil, 1994, 163(1): 85- 94.
[3]刁维萍, 倪吾钟, 倪天华, 杨肖娥. 水体重金属污染的生态效应与防治对策. 广东微量元素科学, 2003, 10(3): 1- 5.
[4]黄永杰, 刘登义, 王友保, 王兴明, 李晶. 八种水生植物对重金属富集能力的比较研究. 生态学杂志, 2006, 25(5): 541- 545.
[5]颜昌宙, 曾阿妍. 沉水植物对重金属Cu2+的生物吸附及其生理反应. 农业环境科学学报, 2009, 28(2): 366- 370.
[6]杨艳华, 陈国祥, 刘少华, 王娜, 吴国荣, 施国新. 镉对黑藻叶光化学及硝酸还原酶特性的影响. 南京师大学报: 自然科学版, 2002, 25(1): 28- 32.
[7]徐勤松, 施国新, 周耀明, 吴国荣, 王学. 镉在黑藻叶细胞中的亚显微定位分布及毒害效应分析. 实验生物学报, 2004, 37(6): 461- 468.
[8]施国新, 杜开和, 解凯彬, 丁小余, 常福辰, 陈国祥. 汞、镉污染对黑藻叶细胞伤害的超微结构研究. 植物学报, 2000, 42(4): 373- 378.
[9]马剑敏, 靳萍, 吴振斌. 沉水植物对重金属的吸收净化和受害机理研究进展. 植物学通报, 2007, 24(2): 232- 239.
[10]徐勤松, 施国新, 许丙军, 吴国荣, 胡金朝. Cu、Zn在黑藻叶片中的富集及其毒理学分析. 水生生物学报, 2007, 31(1): 1- 8.
[11]贺锋, 吴振斌. 水生植物在污水处理和水质改善中的应用. 植物学通报, 2003, 20(6): 641- 647.
[12]Qiu D R, Wu Z B, Liu B Y, Deng J Q, Fu G P, He F. The restoration of aquatic macrophytes for improving water quality in a hypertrophic shallow lake in Hubei Province, China. Ecological Engineering, 2001, 18(2): 147- 156.
[13]Wang G X, Zhang L M, Chua H, Li X D, Xia M F, Pu P M. A mosaic community of macrophytes for the ecological remediation of eutrophic shallow lakes. Ecological Engineering, 2009, 35(4): 582- 590.
[14]Chojnacka K, Chojnacki A, Górecka H. Biosorption of Cr3+, Cd2+and Cu2+ions by blue-green algaeSpirulinasp.: kinetics, equilibrium and the mechanism of the process. Chemosphere, 2005, 59(1): 75- 84.
[15]潘义宏, 王宏镔, 谷兆萍, 熊国焕, 易锋. 大型水生植物对重金属的富集与转移. 生态学报, 2010, 30(23): 6430- 6441.
[16]Visoottiviseth P, Francesconi K, Sridokchan W. The potential of Thai indigenous plant species for the phytoremediation of arsenic contaminated land. Environmental Pollution, 2002, 118(3): 453- 461.
[17]Zhao F J, Ma J F, Meharg A A, McGrath S P. Arsenic uptake and metabolism in plants. New Phytologist, 2008, 181(4): 777- 794.
[18]周守标, 王春景, 杨海军, 毕德, 李金花, 王影. 菰和菖蒲对重金属的胁迫反应及其富集能力. 生态学报, 2007, 27(1): 281- 287.
[19]闵海丽, 蔡三娟, 徐勤松, 施国新. 外源钙对黑藻抗镉胁迫能力的影响. 生态学报, 2012, 32(1): 256- 264.
[20]Aravind P, Prasad M N V. Modulation of cadmium-induced oxidative stress inCeratophyllumdemersumby zinc involves ascorbate -glutathione cycle and glutathione metabolism. Plant Physiology and Biochemistry, 2005, 43(2): 107- 116.
[21]Kautsky H, Hirsch A. Neue versuche zur Kohlensäureassimilation. Naturwissenschaften, 1931, 19(48): 964- 964.
[22]Lin S Q, Xu C H, Zhang Q D, Xu L, Mao D Z, Kuang T Y. Some application of chlorophyll fluorescence kinetics to plants plant stress physiologyphy to ecology and agricultural modernization. Chinese Bulletin of Botany, 1992, 9(1): 1- 16.
[23]Krause G H, Wei E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313- 349.
[24]Fracheboud Y, Haldimann P, Leipner J, Stamp P. Chlorophyll fluorescence as a selection tool for cold tolerance of photosynthesis in maize (ZeamaysL.). Journal of Experimental Botany, 1999, 50(338): 1533- 1540.
[25]Omasa K, Shimazaki K I, Aiga I, Larcher W, Onoe M. Image analysis of chlorophyll fluorescence transients for diagnosing the photosynthetic system of attached leaves. Plant Physiology, 1987, 84(3): 748- 752.
[26]Nedbal L, Soukupova J, Kaftan D, Whitmarsh J, Trtilek M. Kinetic imaging of chlorophyll fluorescence using modulated light. Photosynthesis Research, 2000, 66(1/2): 3- 12.
[27]Govindjee N L. Seeing is believing. Photosynthetica, 2000, 38(4): 481- 482.
[28]Balachandran S, Osmond C B, Daley P F. Diagnosis of the earliest strain-specific interactions between tobacco mosaic virus and chloroplasts of tobacco leaves in vivo by means of chlorophyll fluorescence imaging. Plant Physiology, 1994, 104(3): 1059- 1065.
[29]黄亮, 李伟, 吴莹, 张经, 周菊珍. 长江中游若干湖泊中水生植物体内重金属分布. 环境科学研究, 2002, 15(6): 1- 4.
[30]Wang C, Zhang S H, Wang P F, Li W, Lu J. Effects of ammonium on the antioxidative response inHydrillaverticillata(L. f.) Royle plants. Ecotoxicology and Environmental Safety, 2010, 73(2): 189- 195.
[31]Yan S, Zhou Q X. Toxic effects ofHydrillaverticillataexposed to toluene, ethylbenzene and xylene and safety assessment for protecting aquatic macrophytes. Chemosphere, 2011, 85(6): 1088- 1094.
[32]徐勤松, 施国新, 王学, 吴国荣. 镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究. 水生生物学报, 2006, 30(1): 107- 112.
[33]陈振德, 傅以彬, 邹琦, 程炳嵩, 梁作勤. 二甲亚砜和丙酮混合法测定叶绿素含量. 山东农业大学学报, 1989, (2): 31- 35.
[34]陈元, 赵洋甬, 潘双叶, 徐运, 蒋蕾蕾. Phyto-PAM对浮游植物中叶绿素的分类测定. 现代科学仪器, 2009, (4): 100- 103.
[35]叶济宇. 关于叶绿素含量测定中的Arnon计算公式. 植物生理学通讯, 1985, (6): 69- 69.
[36]肖志华, 张义贤, 张喜文, 李萍. 外源铅、铜胁迫对不同基因型谷子幼苗生理生态特性的影响. 生态学报, 2012, 32(3): 889- 897.
[37]Chu H A, Nguyen A P, Debus R J. Site-directed photosystem Ⅱ mutants with perturbed oxygen-evolving properties. 1. instability or inefficient assembly of the manganese clusters in vivo. Biochemistry, 1994, 33(20): 6137- 6149.
[38]Havaux M, Tardy F. Thermostability and photostability of photosystem Ⅱ in leaves of the Chlorina-f2 barley mutant deficient in light-harvesting chlorophyll a/b protein complexes. Plant Physiology, 1997, 113(3): 913- 923.
[39]Rüdiger W. Biosynthesis of chlorophyllband the chlorophyll cycle. Photosynthesis Research, 2002, 74(2): 187- 193.
[40]张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444- 448.
[41]孙赛初, 王焕校, 李启任. 水生维管束植物受镉污染后的生理变化及受害机制初探. 植物生理学报, 1985, 11(2): 113- 121.
[42]杨丹慧. 重金属离子对高等植物光合膜结构与功能的影响. 植物学通报, 1991, 8(3): 26- 29.
InfluenceofCd2+orCu2+stressonthegrowthandphotosyntheticfluorescencecharacteristicsofHydrilla verticillata
JIANMinfei1,2,*,WANGSichen2,YUHouping1,LILingyu2,JIANMeifeng2,YUGuanjun3
1 Key Laboratory of Poyang Lake Wetland and Watershed Research ,Ministry of Education, Jiangxi Normal University, Nanchang 330022, China 2 College of Life Sciences, Jiangxi Normal University, Jiangxi Provincial Key Laboratory of Protection and Utilization of Subtropical Plant Resources, Nanchang 330022, China 3JiangxiNanjiWetlandNationalNatureReserveBureau,Nanchang330009,China
Abstract:In this study, we selected the aquatic plant Hydrilla verticillata as our specimen and cultured it in clean river sand and water in order to study the influence of five separate concentration levels of Cd2+or Cu2+on the plant. Effects of the stress on the plant were identified, and we recorded parameters such as height, biomass, chlorophyll content, and survival ratios of H. verticillata, as well as the effects of fluorescence parameters such as minimal fluorescence (Fo), maximal fluorescence (Fm), PS II maximum quantum yield (QYmax), degree of PSⅡ reaction centers closed under stable state (1-Qp_Lss), non-photochemical quenching under stable state (NPQ_Lss), and fluorescence images of H. verticillata leaves. We also separately studied the variation characteristics of each parameter of H. verticillata under the stress of increasing Cd2+or Cu2+concentrations. We found that the height of H. verticillata decreased significantly under the different levels of pollution stress by the heavy metal Cd2+. This indicated that Cd2+pollution may damage the bundle structure of H. verticillata. There were no significant effects on the fresh weight of H. verticillata under the stress of either Cd2+or Cu2+pollution, and this may be related to the high content of free water in aquatic plants. Dry weight of H. verticillata decreased significantly when the plants were exposed to Cd2+or Cu2+pollution. Effect of Cu2+pollution on the dry weight of H. verticillata was far more prominent than that of Cd2+pollution. All chlorophyll values decreased significantly when the plants were subjected to Cd2+or Cu2+pollution, and we found that the effect of Cu2+pollution was greater than that of Cd2+pollution. This suggested that the toxicity of Cu2+against H. verticillata chloroplasts is greater than that of Cd2+. The chlorophyll fluorescence parameters (Fo, Fm, and QYmax) of H. verticillata under Cd2+or Cd2+stress were significantly lower than those of the control groups; however, the values of (1-Qp_Lss) increased, and the values of NPQ_Lss first increased and then decreased as the concentrations of the heavy metals increased. The different values for the physiological parameters, fluorescence parameters, and imaging characteristics indicated that the influence of Cd2+on H. verticillata was greater than that of Cu2+when the same concentrations of the two different heavy metals were used. When Cu2+concentration was lower than 1 mg/L in the water environment, photosynthetic activities of H. verticillata under Cu2+stress were almost normal. This means that H. verticillata could be used to restore a water environment with a low Cu2+concentration. H. verticillata cannot survive for a long time in a water environment contaminated with Cd2+or if Cu2+concentrations reach or exceed 3 mg/L. This means that H. verticillata could be used as an indicator species for water contaminated with Cd2+.
Key Words:Hydrilla verticillata; heavy metal stress; growth activity; chlorophyll content; photosynthetic fluorescence parameters; fluorescence imaging
DOI:10.5846/stxb201408081588
*通讯作者
Corresponding author.E-mail: jianminfei0914@163.com
收稿日期:2014- 08- 08; 网络出版日期:2015- 05- 20
基金项目:国家自然科学基金资助项目(41161035, 41461042);国家科技部“十二五”科技支撑计划资助项目(2011BAC13B02); 江西省重大生态安全问题监控协同创新中心资助项目(JXS-EW-03); 江西省科技支撑计划项目(20133BBG70005); 江西省亚热带植物资源保护与利用重点实验室开放基金资助项目(YRD201314)
简敏菲, 汪斯琛, 余厚平, 李玲玉, 简美锋, 余冠军.Cd2+、Cu2+胁迫对黑藻(Hydrillaverticillata)的生长及光合荧光特性的影响.生态学报,2016,36(6):1719- 1727.
Jian M F, Wang S C, Yu H P, Li L Y, Jian M F, Yu G J.Influence of Cd2+or Cu2+stress on the growth and photosynthetic fluorescence characteristics ofHydrillaverticillata.ActaEcologicaSinica,2016,36(6):1719- 1727.
