速溶普洱茶对红茶菌饮料发酵的影响
2016-05-23王桥美杨瑞娟普洱茶研究院微生物实验室云南普洱665000吉林大学生命科学学院吉林长春3002
王桥美, 杨瑞娟, 严 亮*,2, 刘 丽, 林 珊(.普洱茶研究院微生物实验室,云南普洱665000,2.吉林大学生命科学学院,吉林长春3002)
速溶普洱茶对红茶菌饮料发酵的影响
王桥美1,杨瑞娟1,严亮*1,2,刘丽1,林珊1
(1.普洱茶研究院微生物实验室,云南普洱665000,2.吉林大学生命科学学院,吉林长春130012)
摘要:对红茶菌发酵工艺进行了优化,以发酵液pH值和感官评分为衡量指标,得到红茶菌发酵最佳工艺条件是发酵基质中加入红糖,速溶普洱茶∶水=0.8 g∶1 000 mL,红糖添加量为5.5 g时,红茶菌发酵液pH值为3.7,红茶菌饮料呈橙红色,香气好,口味酸甜适中,且产膜效率高,优化工艺的微生物鉴定结果表明,红茶菌是酵母菌、醋酸菌和乳酸菌的共生体,而且发现没有报道过的微生物种类,这些微生物有利于红茶菌的发酵且对人体有益。
关键词:红茶菌;速溶普洱茶;发酵;鉴定
红茶菌又名“海宝”、“胃宝”,由木醋酸菌、酵母菌及乳酸菌共生而成的复合菌[1],它在适宜温度的糖茶水中可较好地生长,并能将蔗糖转化为果糖和葡萄糖,进一步转化为麴酸、葡萄糖酸、醋酸、2—酮葡萄糖酸及酮醋酸等,使糖茶水生成一种酸甜可口的饮料[2]。红茶菌是一种纯天然微生物发酵饮料[3-4],能调节人体某些生理机能,对许多疾病具有一定防治功效[5-6]。
红茶菌以糖茶水为原料,经过酵母菌、醋酸菌、乳酸菌等多种微生物共同发酵而成。在红茶菌中的菌种主要是醋酸菌和酵母菌,有些红茶菌中有少量的乳酸菌。到目前为止[7],从红茶菌中分离出的醋酸菌有木醋杆菌(Acetobacter xylinum),拟木醋杆菌(A.xylinoides),葡萄糖酸杆菌(Bacterium gluconicum),产酮醋杆菌(A.ketogenum),弱氧化醋酸菌(A.suboxydans),葡萄糖醋酸菌(Gluconobacter liquefaciens),醋化醋杆菌(A.aceti),和巴氏醋杆菌(A.pasteurianus),其中最主要的是木醋杆菌(A. xylinum),酵母菌有酿酒酵母(Saccharomyces cerevisiae),不显酵母(S.inconspicus),路德类酵母(S. ludwigii),粟酒裂殖酵母(Schizosaccharo-myces pombe),热带假丝酵母(Candida tropicans),克鲁斯假丝酵母(C.crusei),汉逊德巴利酵母(Debarymyceshansenii),拜尔结合酵母(Zygosaccharomyces bailii)等。乳酸菌在某些红茶菌中存在,但不是必需菌种,主要有保加利亚乳杆菌(Lactobacillus bulagricum),嗜热链球(Strepococcusthermop hilus),植物乳杆菌(L. plantarum)等[8-11]。
普洱茶不仅具有降脂保健功效[12-16],而且据国内外的诸多专家研究表明,普洱茶还具有降血糖、抗动脉硬化[17-20]等多种生理功能和药效,云南普洱茶由大叶种晒青毛茶发酵得到,其中没食子酸的含量也很高[20],因此也同样具有抗突变、抗肿瘤、抗菌以及消炎等诸多生物学功效。
红茶菌是有着悠久历史的一种民间传统酸性饮料,目前国内外对这样一种保健饮品的研制方法也是方兴未艾,特别是根据不同人的保健需求或口味要求进行改进或调整的制备方法,更是备受关注[21]。越来越多的新奇而又简单的制作工艺纷纷被研制开发,其中以最为简单的家庭培养方法最为引人注目。但是,由于家庭培养受到家庭中接种条件及培养温度等条件的影响,容易受到杂菌污染,很难控制产品的质量。因此探求一种简单的制备方法和有效的菌种分离方法,是进一步深入研究红茶菌的前提。作者用速溶普洱茶代替普洱茶汤来发酵红茶菌饮料,既方便又省时,相比以往红茶菌的发酵方法,这将是一种新兴的发酵技术。将速溶普洱茶、蔗糖、水与红茶菌种进行混合发酵,并对发酵液体中的微生物进行分离鉴定,探索速溶普洱茶对红茶菌发酵的影响。结合对红茶菌成分的单独分析及其功能成分作用机理研究,旨在为下一步开发普洱茶相关的醋酸饮料的研究奠定基础。
1 材料与方法
1.1材料与试剂
红茶菌种:普洱茶研究院;速溶普洱茶:云南天士力生物茶科技有限公司;红糖:市售食品级;白糖:市售食品级。
LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L、琼脂18 g/L。
YEPD培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂18 g/L。
1.2仪器与设备
PB-21型酸度计;温度计;LDZX-50KB型立式压力蒸汽灭菌锅;DHP-9162型电热恒温培养箱;相机;苏净安泰SW-CJ-2F型洁净工作台;376000型漩涡振荡仪;威泰克掌上离心机;BS-30KA型电子天平;XS204型电子天平;9700型PCR仪;EM-308EB1型微波炉;dyy-6C型电泳仪;SYNGENE GBOX型凝胶成像系统;MDF-382E(N)超低温冰箱;BCD-218SDA型冰箱;LGJ-1冷冻干燥机。
1.3方法
容器消毒:将培养罐、纱布、镊子等先用洗洁精去除污渍,再用清水洗干净,最后用煮沸的开水浸泡消毒,操作的环境尽量隔离,保证所用器具不能有污渍及霉菌孢子等的污染[22];温度的测定:每天早上十点与下午四点测温度,算出每天平均值;酸度的测量:PB-21型酸度计;膜质量的测量:纱布过滤后放在铺有已消毒的自封袋型电子天平上称量;菌液色香味、膜况采用直接观察,菌液味符合发酵的正常味道,菌膜应为透明胶状膜,沉淀较少,菌液较清,呈现淡红色或棕红色。
红茶菌冻干粉复苏[23]:将冻干粉用无菌水稀释,放入液体培养基中,能变浑浊即说明菌种已复苏。
1.4发酵过程中菌种的分离和鉴定
1.4.1菌种的分离和纯化从发酵罐中取出1 mL发酵液体装入1.5 mL灭菌离心管中,用无菌水稀释为10-4、10-5两个梯度的菌悬液涂布到LB培养基、YEPD培养基上,置于28℃恒温培养72 h后对菌种进行拍照、计数、描述。挑取典型微生物单菌落进行划线纯化培养,并进行测序鉴定和菌种保存。
1.4.2菌种的鉴定将纯化的真菌制成菌悬液[24],真菌聚合酶链式反应(Polymerase Chain Reaction简称PCR)体系(50 μL)如下:2×PCR缓冲液(buffer)(KOD DNA polymerase简称KOD FX)25 μL、2 mm脱氧核糖核苷三磷酸(deoxy -ribonucleoside triphosphate简称dNTP)10 μL、KOD酶(1.0 U/μL)1 μL、上游引物(10 μmol/L)2 μL、下游引物(10 μmol/L)2 μL、菌悬液1.5 μL、水8.5 μL;PCR反应条件:1)预变性94℃5 min;2)变性98℃10s;3)复性(退火)50℃30 s;4)延伸68℃2 min,步骤(2~4)循环45次;5)4℃保温;上游引物NL1F:5′GCATATCAATAAGCGGAGGAAAAG 3′;下游引物LS2R:5′ATTCCCAAACAACTCGACTC 3′。
将纯化的细菌制成菌悬液[25],细菌聚合酶链式反应(Polymerase Chain Reaction简称PCR)体系(50 μL)如下:10×Taq缓冲液(buffer)5 μL、2 mm脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate简称dNTP)5 μL、Taq聚合酶(Taq polymerase简称Taq酶)(5.0 U/μL)1 μL、上游引物(10 μmol/L)2 μL、下游引物(10 μmol/L)2 μL、菌悬液2 μL、水33 μL;PCR反应条件:1)预变性94℃5 min;2)变性96℃30 s;3)复性(退火)52℃30 s;4)延伸72℃50 s,步骤(2~4)循环35次;5)72℃延伸10 min;6)4℃保温;上游引物R1492:5′TACGGYTACCTTGTT ACGACTT 3′;下游引物F27:5′AGAGTTTGATCMT GGCTCAG 3′。
将PCR扩增产物送至广州华大基因测序,根据测序结果,用每个菌株的ITS1基因作为靶序列,在GenBank数据库中用在BLAST(Basic Local Alignmen Search Tool)程序来搜索同源序列,挑选与靶系列最相近的参考菌株系列,查出相应微生物,完成菌种鉴定。
2 结果与分析
2.1不同添加量的速溶普洱茶对红茶菌发酵中pH值、成膜情况及品质的影响
2.1.1发酵过程中红茶菌液的pH变化纯净水加热至100℃,奇数罐加入5.5 g/dL的红糖,偶数罐加入6.5 g/dL的白糖,10-1,10-3,10-5,10-7,10-9和10-2,10-4,10-6,10-8,10-10罐速溶普洱茶添加量分别为0、0.05、0.08、0.18、0.35 g/dL。把发酵室温度控制在24~28℃,测量每个发酵罐的pH值,测量周期为8 d,随着时间不同pH的变化见图1—2。
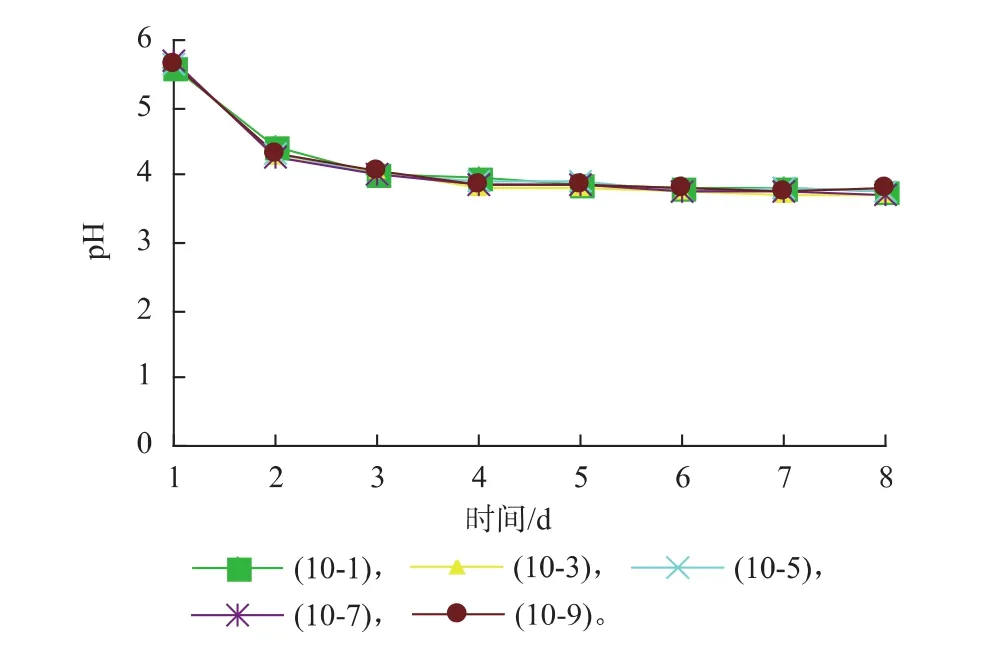
图1 速溶普洱茶、红糖对红茶菌发酵pH值的影响Fig. 1 Effect of brown sugar,instant pu-erh tea content on pH value of kombucha
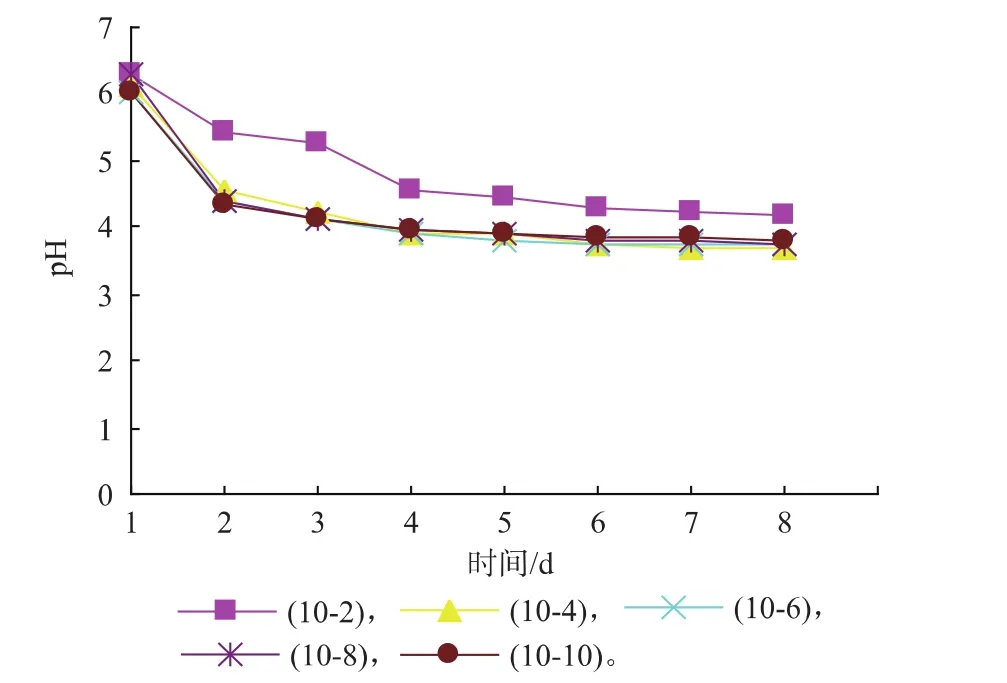
图2 速溶普洱茶、白糖对红茶菌发酵pH值的影响Fig. 2 Effect of white sugar,instant pu-erh tea content on pH value of kombucha
图1和图2的变化趋势大致相同,不同添加量的速溶普洱茶对红茶菌发酵液中pH的影响也不太明显,变化趋势基本一致,发酵1~2 d左右pH值下降迅速,4 d以后趋于平稳,pH值为3.7左右。说明速溶普洱茶添加量对pH值的影响较小,加入红糖的发酵罐起始pH较接近最适值,说明加入红糖的pH更利于红茶菌的发酵。
2.1.2不同添加量的速溶普洱茶对口味及成膜的影响纯净水加热至100℃,奇数罐加入5.5 g/dL的红糖,偶数罐加入6.5 g/dL的白糖,10-1,10-3,10-5,10-7,10-9和10-2,10-4,10-6,10-8,10-10罐速溶普洱茶添加质量分数分别为0%、0.05%、0.08%、0.18%、0.35%,培养周期一个月,结果见表1—2。
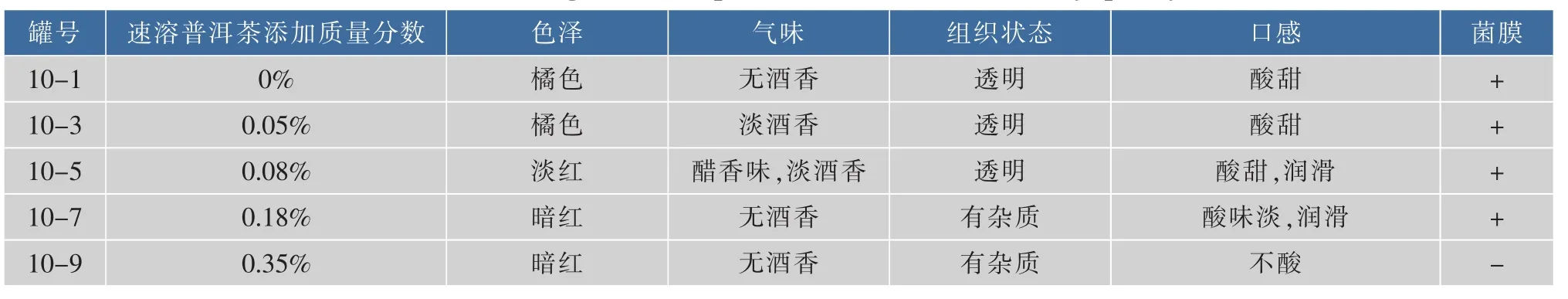
表1 速溶普洱茶、红糖对红茶菌饮料感官品质的影响Table 1 Effect of brown sugar,instant pu-erh tea content on sensory quality of kombucha
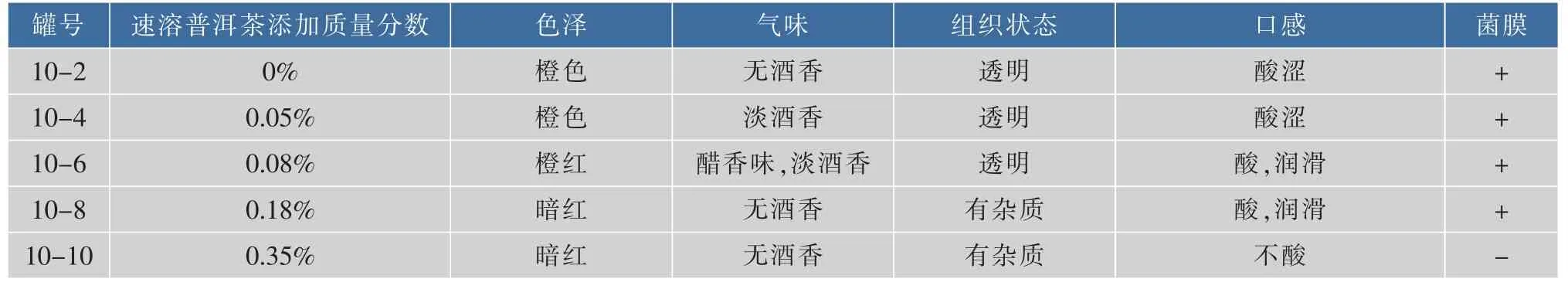
表2 速溶普洱茶、白糖对红茶菌饮料感官品质的影响Table 2 Effect of white sugar,instant pu-erh tea content on sensory quality of kombucha
由上可知,10-9,10-10两罐速溶普洱茶的添加质量分数均为0.35%,这两罐都没有形成菌膜,说明速溶普洱茶加入到一定量会抑制菌膜的形成,这与加入糖的种类无关。10-5,10-6两罐加入的速溶普洱茶量均为0.08%,这两罐的色泽、气味、组织状态、口感等各个指标都比较好,说明加入质量分数0.08%的速溶普洱茶最适合红茶菌的发酵。对比红糖、白糖对红茶菌饮料的色泽及口感的影响可以看出,加入红糖发酵的红茶菌饮料口感较好,说明红糖更适合红茶菌饮料的发酵。
2.1.3不同发酵条件对红茶菌膜生长的影响10-1,10-5罐为红糖培养的红茶菌,10-2,10-6罐为白糖培养的红茶菌,10-1,10-2罐的速溶普洱茶质量分数为0%、10-5,10-6罐的速溶普洱茶质量分数为0.08%。以10-1,10-2为空白对照,对膜质量的变化进行比较,旨在得到产率较高的发酵条件,初始加入菌膜质量均为300 g,发酵一个月后,红茶菌膜质量变化见表3。
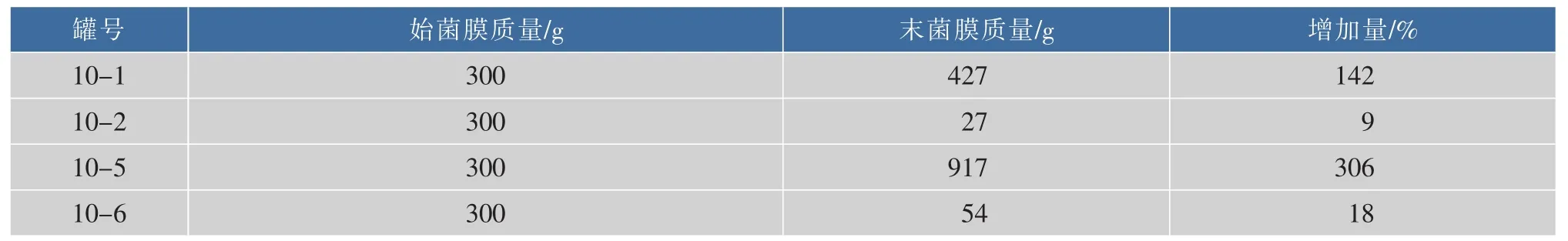
表3 不同发酵条件对红茶菌膜生长的影响Table 3 Effect of different fermentation conditions on kombucha membrane
由表3可知,10-2和10-6的质量远远小于10-1和10-5的质量,说明红糖培养红茶菌的产膜量比白糖培养的高;10-5的膜质量远比10-1的膜质量高,说明加入速溶普洱茶更有利于膜的生长。从而得到最适合红茶菌生长的条件为:5.5 g/dL红糖,0.08 g/dL的速溶普洱茶。
2.2红茶菌液中的微生物分离鉴定结果
2.2.1用速溶普洱茶发酵的红茶菌液中的微生物分离鉴定由表4可知,通过分子测序鉴定出的菌株主要归属于酵母菌、醋酸菌、乳酸菌三类菌,除此之外,还鉴定出了部分菌种是红茶菌发酵中未见报道的,如:Bacillus flexus,Kocuria rosea,Leclercia adecarboxylatan,Enterobacter sp.,Streptomyces albiaxialis,Bacilluscereus,Bacillusnealsonii,Burgellaflavoparmeliae,SpHingomonas sp.还有一些是对身体极为有益的,如Bacillus flexus可以产生碱性淀粉酶;Rhodotorula mucilaginosa粘质红酵母,可以产生脂肪,丙氨酸、谷氨酸、蛋氨酸等多种氨基酸;Leuconostoc mesenteroides是一种乳酸杆菌,广泛应用于食品饮料及酒产业中。Phingomonas sp.鞘氨醇单胞菌属,是一类丰富的新型微生物资源,可用于芳香化合物的生物降解。
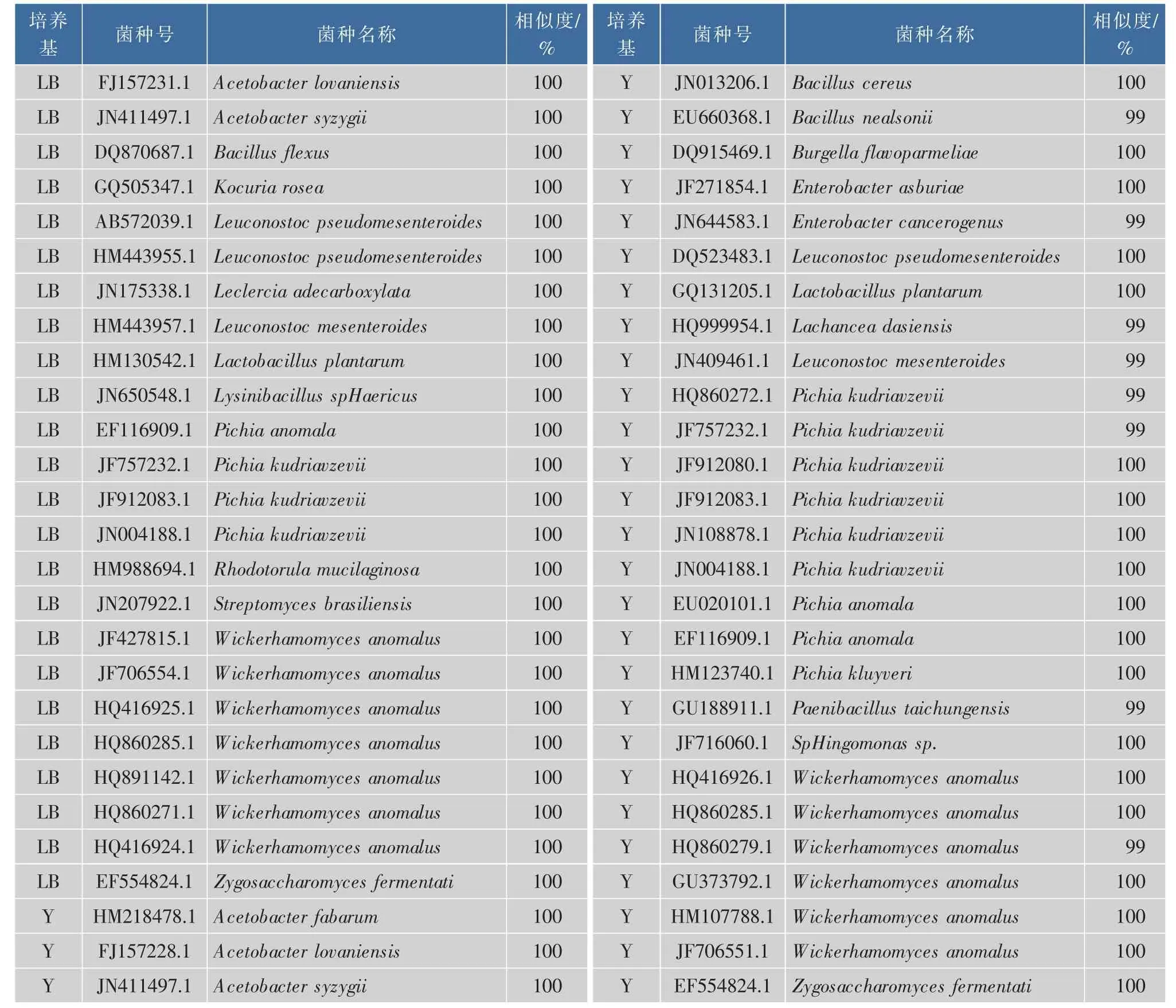
表4 速溶普洱茶发酵的红茶菌液中的微生物Table 4 Composing of microorganisms during kombucha fermentation
2.2.2红茶菌表层絮状物微生物鉴定结果在添加速溶普洱茶红茶菌发酵过程中,红茶菌膜的表层有一层白色絮状物,是一般红茶菌发酵过程中不存在的,初步分析是发酵过快导致,对其中的微生物做鉴定,结果见表。
由表5可知,表层絮状物里含有的微生物有Acetobacter fabarum,Enterobacter aerogenes,Pichia kudriavzevii,Pichia kluyveri,Wickerhamomyces anomalus等,主要是酵母和醋酸杆菌及产气肠杆菌,不存在对人体有害的微生物。亦可以发现,白糖发酵表层絮状物里只发现了Pichia kluyveri,Wicker -hamomyces anomalus两种酵母,而红糖发酵表层絮状物里还发现了Acetobacter fabarum,Enterobacter aerogenes,Pichia kudriavzevii等微生物,种类要比白糖发酵得到的多,得知红糖更利于红茶菌的发酵。
2.2.3红茶菌冻干粉复苏后的微生物种类将冻干的红茶菌膜复苏后,对其中微生物的分离鉴定结果见表6。
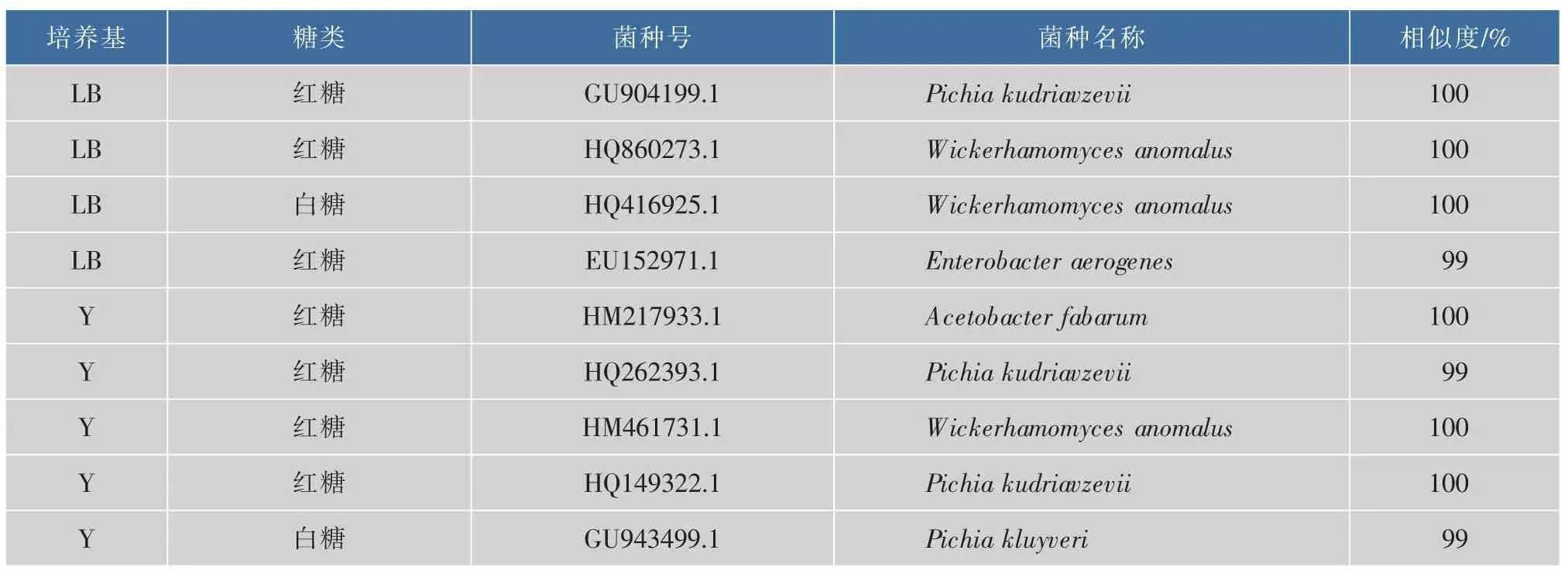
表5 速溶普洱茶发酵红茶菌表层絮状物微生物Table 5 Composing of microorganisms on surface of kombucha floc
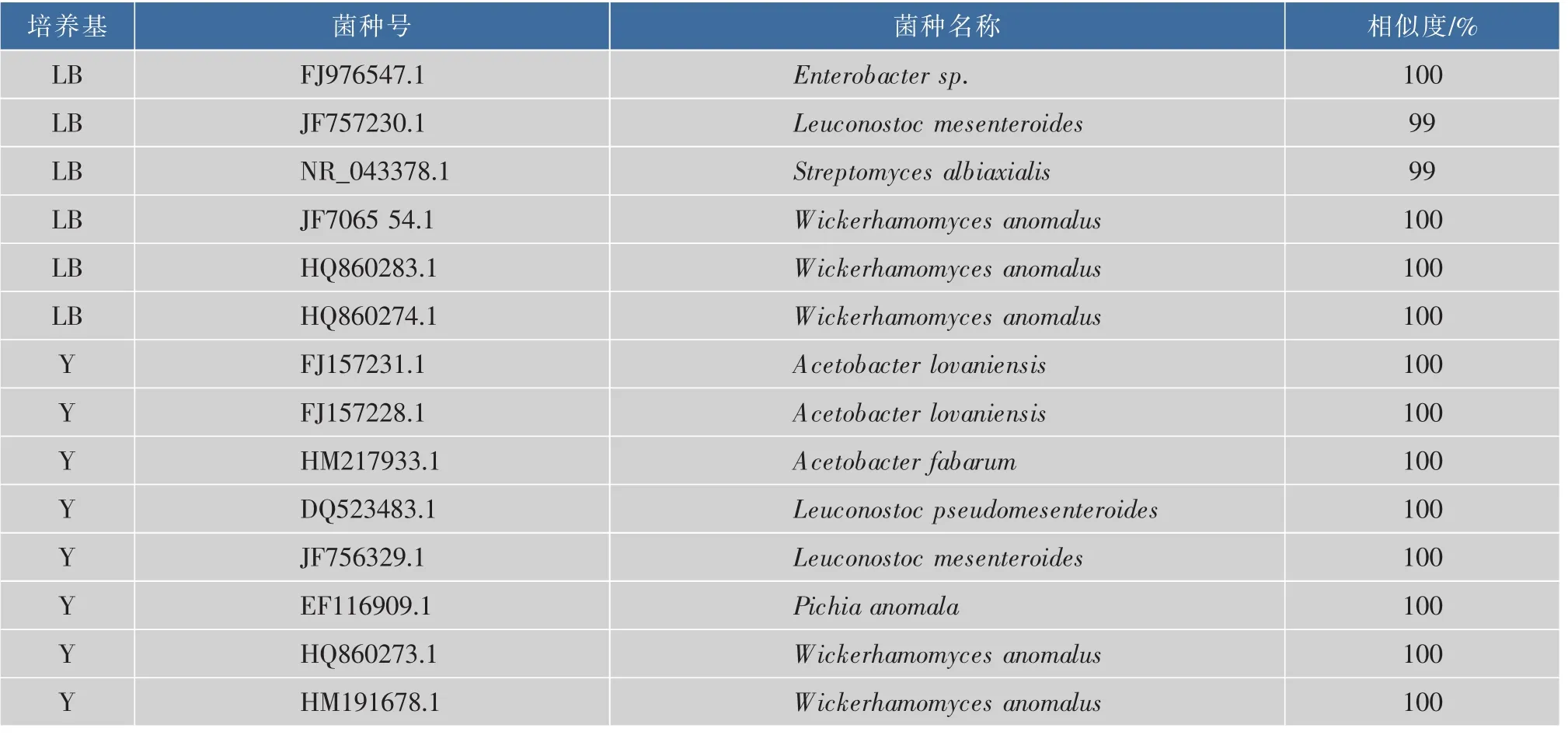
表6 红茶菌冻干粉中的微生物Table 6 Composing of microorganisms in lyophilized powder of Kombucha
由表6可知,红茶菌膜里含有的微生物主要是酵母和醋酸杆菌类,另外还分离到Enterobacter sp. 和Streptomyces albiaxialis两类特殊的菌株,结果与冻干前红茶菌膜中的微生物一致。
3 结语
本研究结果表明:红茶菌的发酵pH降到3.7左右基本趋于恒定,且不同添加质量分数的速溶普洱茶对红茶菌发酵液中pH的影响差别都不太明显。此结果与蒋立文[26]的研究结果一致;加入红糖的培养基中膜的产量要比加入白糖的产量高,且相同培养条件和培养时间下,口味较好,外观较透明,这可能与红糖内含有较多的葡萄糖(比白糖要多20~30倍),较丰富的铁质(比白糖多一倍),还含有白糖所没有的胡萝卜素、核黄素、烟酸等有关系。不同添加量的速溶普洱茶对红茶菌的成膜速度及品质有一定的影响,速溶普洱茶加入到一定量以后会抑制菌膜的形成,但与加入糖的种类无关。当发酵罐中红糖∶速溶普洱茶∶水为5.5 g∶0.8 g∶1 000 mL时,发酵得到橙红、醋香、酒香、透明、润滑的红茶菌饮料,而且产膜效率也最高。此结果说明,加入速溶普洱茶和糖的种类不同都会影响红茶菌发酵。通过对比白糖与红糖种类的不同和速溶普洱茶添加量的不同,得到了最适合普洱茶红茶菌发酵的条件,因此可以考虑生产红糖普洱茶制作的红茶菌饮品。
发酵过程中对发酵液的微生物分离鉴定结果表明,用速溶普洱茶与红糖或白糖发酵红茶菌产生的微生物除了酵母菌、醋酸菌、乳酸菌三类外,还分离鉴定出了其他多种菌种,有部分菌种是红茶菌发酵中未见报道的,比如:Bacillus flexus,Kocuria rosea,Leclercia adecarboxylata,Enterobacter sp.,Streptomyces albiaxialis,Bacillus cereus,Bacillus nealsonii,Burgella flavoparmeliae,SpHingomonas sp.还有一些是对身体极为有益的,如Bacillus flexus可以产生碱性淀粉酶;Rhodotorula mucilaginosa粘质红酵母,可以产生脂肪和丙氨酸、谷氨酸、蛋氨酸等多种氨基酸;Leuconostoc mesenteroides是一种乳酸杆菌,广泛应用于食品饮料及酒产业中。pHingomonas sp.鞘氨醇单胞菌属,是一类丰富的新型微生物资源,可用于芳香化合物的生物降解。
作者证实了红茶菌是酵母菌、醋酸菌和乳酸菌的共生体,并用速溶普洱茶代替普洱茶汤发酵红茶菌饮料,既方便又省时,在红茶菌的发酵过程中加入普洱速溶普洱茶,更利于红茶菌的发酵且对人体更有益;还对比了红糖与白糖对红茶菌发酵的影响,证明了红糖更利于红茶菌的发酵;通过传统微生物培养和分子生物学结合的方法,鉴定得到了多种未在红茶菌发酵中报道过的微生物[22],为进一步对红茶菌中微生物的研究奠定了基础。
参考文献:
[ 1 ]段葆兰.红茶菌[M].北京:科学普及出版社,1982.
[ 2 ]杜青平,袁保红.红枣红茶菌复合保健饮料的研制[J].食品科技,2002(8):43-44. DU Qingping,YUAN Baohong. Preparation of healthy beverage from jujube juice and fungus[J]. Food Science and Technology,2002(8):43-44.(in Chinese)
[ 3 ]过慈妹,方世辉.不同茶类茶汤对红茶菌生长及品质的影响[J].茶业通报,2007,29(3):129-131. GUO Cimei,FANG Shihui. Effects of different kinds of tea on the growth and quality of Kombucha[J]. Journal of Tea Business,2007,29(3):129-131.(in Chinese)
[ 4 ]赵平,范铁男,邹积宏.红茶菌的研究概况[J].黑龙江医药,2011,24(3):367-370. ZHAO Ping,FAN Tienan,ZOU Jihong. A survey of Kombuchas' study[J]. Hei long jiang Medicine Journal,2011,24(3):367-370.(in Chinese)
[ 5 ]袁洪业.保健饮料—海宝茶菌[M].北京:中国轻工业出版社,1981.
[ 6 ]刘士清.民间红茶菌的医疗保健作用[J].中国民族民间医药杂志,1996,20:19-21. LIUShiqing.Protectionactionsof kombuchaonmedicalandhealth[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,1996,20:19-21.(in Chinese)
[ 7 ]冯林,杨坚,黄友谊.红茶菌研究进展[J].福建茶业,2011,1:18-21. FENG Lin,YANG Jian,HUANG Youyi. Research progress of Kombucha[J]. Tea in Fujian,2011,1:18-21.(in Chinese)
[ 8 ] Biljana B P,Lidija P T. Mineral and water soluble vitamin content in the Kombucha drink [J]. International Journal of Food Science and Technology,2000(35):201-205.
[ 9 ]吴薇,盖宝川,籍保平.红茶菌混合菌的分离和鉴定[J].食品科学,2004,25(4):55-58. WU Wei,GAI Baochuan,JI Baoping. Study on the isolation and identifiation of microbes of Kombucha [J]. Food Science,2004,25(4):55-58.(in Chinese)
[10]吴薇,盖宝川.红茶菌国内外研究应用概况[J].食品科技,2003(12):9-11. WU Wei,GAI Baochuan. A survey of kombucha's study and application in the world [J]. Food Science and Technology,2003 (12):9-11.(in Chinese)
[11]吕爱军,尹建美,胡秀彩,等.红茶菌形态及抑菌作用的研究[J].徐州师范大学报,2004,22(1):73-75. LV Aijun,YIN Jianmei,HU Xiucai,et al. A study on morphology of tea fungus and inhibition effect of its culture fluid[J]. Journal of Xuzhou Normal Univ:Natural Science Edition,2004,22(1):73-75.(in Chinese)
[12]吴文华.晒青毛茶、普洱茶降血脂功能比较[J].福建茶叶,2004,4:30.WU Wenhua. Comparison of sun dried tea and Pu'er tea in reducing blood lipids[J]. Tea in Fujian,2004,4:30.(in Chinese)
[13]吴文华,吴文俊.普洱茶多糖血脂功能量效关系[J].福建茶叶,2006,2:42-43. WU Wenhua,WU Wenjun. The dose effect relationship of Pu'er tea polysaccharide reducing blood lipids [J]. Tea in Fujian,2006,2:42-43.(in Chinese)
[14]吴文华,吴镇洲,吴文俊.普洱茶中茶多糖和茶多酚降血脂功能比较[J].福建茶叶,2007,3:42-43. WU Wenhua,WU Zhenzhou,WU Wenjun. Comparison of polysaccharide and polyphenols in reducing blood lipids in Pu'er tea [J]. Tea in Fujian,2007,3:42-43.(in Chinese)
[15]张冬英,刘仲华.高通量筛选法对普洱茶降血糖血脂作用的研究[J].茶叶科学,2005,26(1):49-53. ZHANG Dongying,LIU Zhonghua. Study on blood glucose-depressing and blood lipid-depressing function of Pu'er tea by high throughput screening method[J]. Journal of Tea Science,2005,26(1):49-53.(in Chinese)
[16]谢春生,谢知音.普洱茶中降血脂的有效成分他汀类化合物的新发现[J].河北医学,2006,12:1326-1327. XIE Chunsheng,XIE Zhiyin. The new discovery of effective hypolipidemic components Statins in Pu'er tea[J]. Hebei Medicine,2006,12:1326-1327.(in Chinese)
[17] Wang L S H,Lin L C,Chen N T,et al. Hypolipidemic effect and antiatherogenic potential of Pu-Erh tea[J]. ACS SympSer,2003 (11):87-103.
[18] Kuo K L,Weng M S,Chiang C T,et al. Comparative studies on the hypolipidemic and growth suppressive effeets of oolong,black,Pu-eth,and green tea leaves in rats[J]. J Agric Food Chem,2005,53:480-489.
[19] Lin L C,Chang H C L,Wang L S H. The hypolipidemic and antioxidative effects of pu-erh tea[J]. Atherosclerosis,1998,136(增1):44.
[20] Shao W,Powellc,Clifford M N. The analysis by HPLC of green,black and Puer teas produced in Yunnan [J]. J Sci Food Agric,1995,69:535-540.
[21]张虎成,张征田,辛秀兰.红茶菌中微生物的分离与初步鉴定[J].北京联合大学学报:自然科学版,2011,25(2):42-46. ZHANG Hucheng,ZHANG Zhengtian,XIN Xiulan. Isolation and identification of microorganisms from Kombucha fungus culture[J]. Journal of Beijing Union University:Natural Sciences,2011,25(2):42-46.(in Chinese)
[22]王冬梅,郭书贤,王庆洁,等.芦荟红茶菌复合发酵饮料工艺研究[J].中国酿造,2008,1:82-85. WANG Dongmei,GUO Shuxian,WANG Qingjie,et al. Research on fermentation technology of aloe-tea fungus compound beverage[J]. China Brewing,2008,1:82-85.(in Chinese)
[23]陈丽湘.冻干菌种复活、保藏方法探讨[J].蛇志,2007,19(1):84. CHEN Lixiang. Discussion on the resurrection and preservation methods of freeze-dried microorganisms [J]. Journal of Snake,2007,19(1):84.(in Chinese)
[24]杨瑞娟,吕杰,严亮,等.普洱茶渥堆发酵中嗜热真菌的分离和鉴定[J].茶叶科学,2011,31(4):371-378. YANG Ruijuan,LV Jie,YAN Liang,et al. Isolation and identification of thermophilic fungi during the fermentation of puer tea [J]. Journal of Tea Science,2011,31(4):371-378.(in Chinese)
[25]李晨晨,吕杰,杨瑞娟,等.普洱茶渥堆发酵过程中嗜热细菌的分离和鉴定[J].北京化工大学学报:自然科学版,2012,39(2):74-78. LI Chenchen,LV Jie,YANG Ruijuan,et al. Isolation and identification of thermophilic bacteria during the pile-fermentation of Pu'er tea[J]. Journal of Beijing University of Chemical Technology:Natural Science,2012,39(2):74-78.(in Chinese)
[26]蒋立文,刘德华,唐道方,等.不同条件对红茶菌发酵酸度和成膜影响的初步研究[J].食品科学,2006,27(9):96-99. JIANG Liwen,LIU Dehua,TANG Daofang,et al. Studing on effects of acidityand cellulosic pelliclein tea fungus fermentation[J]. Food Science,2006,27(9):96-99.(in Chinese)
Effect of Instant Pu'er Tea Content on Kombucha Fermentation
WANG Qiaomei1,YANG Ruijuan1,YAN Liang*1,2,LIU Li1,LIN Shan1
(1. Microbiology Laboratory,Pu'er Institute of Pu'er Tea,Pu'er 665000,China;2. College of Life Science,Jilin University,Changchun 130012,China)
Abstract:Kombucha Fermentation conditions wereoptimized by pH value and sensory scores.,The fermentation substrates werebrown sugar,and the instant pu-erh tea:water was at 0.8 g∶1 000 mL. when brown sugar content was at 5.5 g and the pH value was at 3.7,the Kombucha beverage was orange,Pleasant aroma,moderate sweet and sour taste,also showed high membrane yield. The microbial results in optimization technique showed that Kombucha was composed of yeast,acetic acid bacteria and lactic acid bacteria. This study discovered new microorganisms which werebeneficial for Kombucha fermentation and human health.
Keywords:kombucha,instant pu-erh tea,fermentation,identification
*通信作者:严亮(1983—),男,吉林长春人,理学博士,助理研究员,主要从事细胞生物学方面的研究。E-mail:jacky_4680@163.com
作者简介:王桥美(1985—),女,云南寻甸人,农学硕士,助理研究员,主要从事食品微生物方面的研究。E-mail:wangqiaomei114@163.com
基金项目:云南省科技创新强省计划项目(2008QA028)。
收稿日期:2014-07-04
中图分类号:TS 272
文献标志码:A
文章编号:1673—1689(2016)02—0197—08
