MINE方案治疗32例复发或难治性中高危非霍奇金淋巴瘤的疗效观察
2016-05-14李路路陈剑张鼎儒
李路路 陈剑 张鼎儒
[摘要] 目的 观察MINE方案作为复发或难治性中高危非霍奇金淋巴瘤(NHL)的疗效和安全性。 方法 选取我院2012年1月~2015年10月收治的32例复发或难治性中高危NHL患者,使用MINE方案作为解救方案进行化疗;观察患者的近期疗效和毒副反应。 结果 32例患者分别接受了2~6个周期的MINE方案化疗,总有效率为53.1%,完全缓解率为18.8%;主要毒副反应为骨髓抑制,可以耐受。 结论 MINE方案为复发或难治性中高危NHL的安全有效的解救方案之一。
[关键词] 非霍奇金淋巴瘤;解救治疗;MINE方案
[中图分类号] R733.4 [文献标识码] B [文章编号] 1673-9701(2016)08-0066-03
非霍奇金淋巴瘤(non-hodgkin's lymphoma,NHL)的治疗是以化学治疗为主的综合治疗,CHOP方案是目前治疗恶性NHL的标准一线治疗方案,但是在治疗开始或治疗过程中表现出放化疗抗拒或治疗后复发的中高度恶性NHL患者约有55%~65%,对于这些患者,大多都需要接受进一步的解救治疗[1]。目前对于复发或难治性恶性NHL尚无标准的治疗手段,国内外已有多种解救方案用于此类患者,主要药物有异环磷酰胺、米托蒽醌、依托泊甙、顺铂等,均有一定的疗效[2]。本文总结了我院2012年1月~2015年10月用MIT、IFO、VP16组成的MINE方案治疗复发或难治性恶性NHL患者32例疗效情况,现报道如下。
1 资料与方法
1.1 一般资料
筛选本院2012年1月~2015年10月收治的复发或难治性NHL患者32例,所有病例均有病理学诊断,具有可评价的病灶,其中男19例,女13例,年龄17~72岁,中位年龄53岁。按Ann Arbor分期,Ⅰ期2例,Ⅱ期6例,Ⅲ期15例,Ⅳ期9例。Karnofsky评分:70分以上的患者11例,50~70分的患者21例。病理类型:T细胞来源淋巴瘤7例,B细胞来源淋巴瘤25例。根据患者的分期、年龄、体能状态、结外病变数、LDH等5个方面的因素依照国际淋巴瘤临床预后危险性指数(international prognostic index,IPI)[3]进行评价,每个因素为1分,高危4、5分,中高危为3分,低中危为2分,低危为0、1分。本组高危3例,中高危16例,低中危9例,低危4例。复发性NHL 25例,难治性NHL 7例。
1.2 纳入及排除标准
纳入标准:①所有入组病例均接受过至少2个周期以上的CHOP方案或CHOP样方案(如ECHOP、BCHOP等)化疗后病情进展或复发;②接受本方案化疗前白细胞≥3.5×109/L,血红蛋白≥90 g/L,血小板≥100×109/L,查肝肾功能、心电图等大致正常,未见明显化疗禁忌证。③至少有一个可测量的病灶。④患者及其家属同意接受本方案治疗,签署知情同意书,并上报医院医学伦理委员会批准。排除标准:①合并有其他疾患,不能耐受化疗者;②患者及其家属不接受治疗者;③初治NHL患者。
1.3 治疗方案
MINE方案:IFO 1.33 g/m2静脉注射d1~d3、VP-16 65 mg/m2静脉注射d1~d3、MIT 8 mg/m2 d1;21 d为1个治疗周期,每位患者根据治疗反应及对毒副作用的耐受程度最多给予6个周期的化疗。在化疗期间同时予水化利尿、止吐、美斯纳解毒等对症支持治疗,如患者肿瘤负荷较大,则给予水化、碱化尿液及保护肾功能等治疗;如化疗后患者外周血中性粒细胞计数低于2.0×109/L者,则皮下注射重组人粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF);如患者外周血血小板低于50×109/L者,则皮下注射重组人白细胞介素-11(recombinant human interleukin-11,rhIL-11);如患者在治疗期间出现Ⅳ度骨髓抑制,则在下个周期化疗时,酌情降低15%~25%的化疗药物剂量。
1.4 疗效及不良反应评价
每2个周期化疗后行病变部位CT检查,结合体格检查,评价治疗效果。参照WHO实体瘤疗效评价标准进行疗效评价[4]:①完全缓解(CR),症状和病灶完全消失;②部分缓解(PR),临床症状明显好转,病灶缩小≥50%;③病情稳定(SD),临床症状有所缓解,病灶缩小<50%;④疾病进展(PD),临床症状无明显改善甚至加重,病灶增大或出现新病灶。总有效率(RR)=(完全缓解+部分缓解)/总例数×100%。不良反应情况参照WHO抗肿瘤药物毒副反应评价标准进行评定[5],化疗1个周期以后即可对药物毒副反应进行评价。
1.5 统计学处理
采用SPSS17.0软件进行统计学分析,计数资料进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
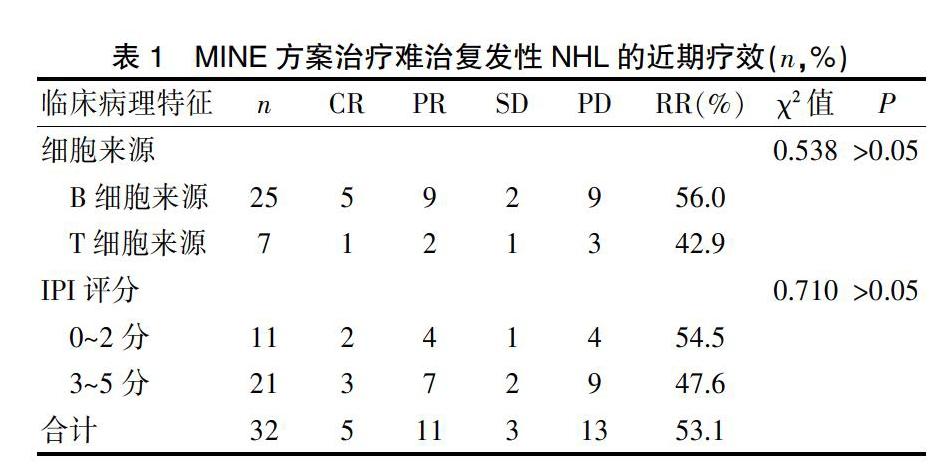
所有入组患者分别接受了2~6周期(共146周期)的MINE方案化疗,所有患者均化疗2周期后进行评价疗效,其中CR 5例(15.6%),PR 11例(34.4%),RR为53.1%;B细胞和T细胞来源NHL的RR分别为56.0%(14/25)和42.9%(3/7),CR分别为5例(20.0%)和1例(14.2%),两者相比差异无统计学意义(P>0.05)。IPI评分中高危者(3~5分)与低中危者(0~2分)的RR分别为47.6%(10/21)和54.5%(6/11),差异无统计学意义(P>0.05)。其中如果化疗2个周期或4个周期后病情进展可更改治疗方案继续治疗。见表1。
2.2 毒副反应
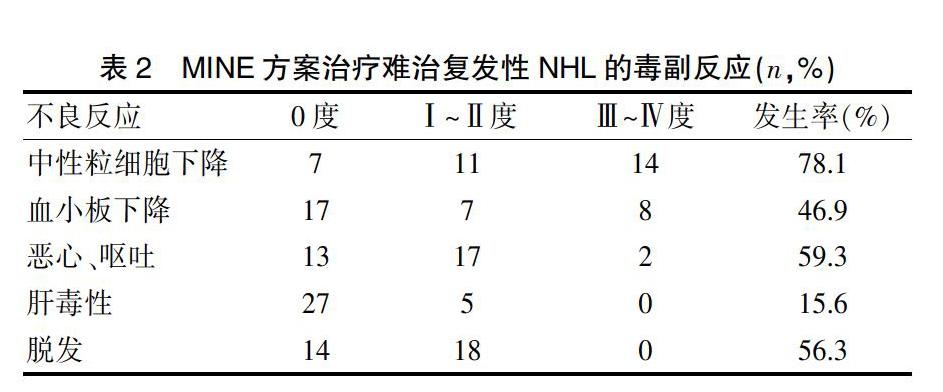
所有入组患者均可对其毒副反应进行评价,最为常见的毒副反应主要是骨髓抑制,其他的毒副反应主要为消化道反应、肝功能损害、脱发等;Ⅰ~Ⅱ度粒细胞和血小板下降多见,分别为34.3%(11/32)和21.9%(7/32),而Ⅲ~Ⅳ度发生率分别为43.8%(14/32)和25.0%(8/32),骨髓抑制大多发生于化疗后的7~14 d。8例发生感染(呼吸道感染5例,肠道感染2例,肛周组织感染1例),经抗生素和对症处理后均好转。Ⅰ~Ⅱ度和Ⅲ~Ⅳ度恶心呕吐发生率分别为53.1%(17/32)和6.3%(2/32);Ⅰ~Ⅱ度肝毒性发生率为15.6%(5/32);Ⅰ~Ⅱ度脱发发生率为56.3%(18/32)。未见Ⅲ~Ⅳ度出血性膀胱炎、心脏毒性及肾毒性的发生,亦无治疗相关性死亡的发生。见表2。
3 讨论
难治性NHL是指一线化疗方案失败,或缓解后1~3个月病情再次进展,或对既往有效的药物不再敏感,反复更换化疗方案均未能获得完全缓解的NHL;复发性NHL是指初次化疗获得CR后复发的NHL[6]。对于采用以CHOP或类CHOP方案作为一线化疗方案治疗无效的NHL患者,绝大部分是因疾病复发进展或原发耐药而最终治疗无效死亡[1,7],目前尚缺乏标准的解救治疗方案。虽然造血干细胞移植,G-CSF支持下的大剂量化疗和放疗以及靶向治疗等方法可有效克服耐药,提高疗效,但由于经济、医疗条件、适应证等各方面的原因限制了其在临床上的应用。
目前淋巴瘤临床上常用的二线解救方案和药物比较多,但解救治疗应尽量选择与一线方案CHOP无交叉耐药的方案或药物,且对NHL单一药物有效者[8],常用的方案有MINE、ICE、DHAP、DICE、EPOCH等,其有效率为60%~87%[9,10]。1995年,Rodriguez等[11]研究表明用MINE方案治疗48例复发和耐药的NHL患者,CR率21%,有效率48%。郝杰等[12]研究发现化疗后MINE组KPS评分显著高于ICE组,表明MINE方案可调节患者机体的免疫功能,减轻疼痛,提高生活质量。Emmanouilides等[13]研究结果发现MINE方案与利妥昔单抗联合治疗复发难治性淋巴瘤,具有纯化干细胞的作用,可以提高干细胞移植的效果。
本研究纳入32例复发或难治性中高危NHL患者给予MINE方案进行解救治疗,RR为53.1%,CR为15.6%,与国内一些学者的研究结果相似[8,10,14];B细胞和T细胞来源NHL的RR分别为56.0%和42.9%,完全缓解率分别为20.0%和14.2%,提示无论B细胞来源还是T细胞来源治疗效果大致相同;胡东霞等[15]研究表明IPI评分≥3分者解救治疗效果较差,本研究显示IPI 0~2分者与3~5分者的RR分别为54.5%(6/11)和47.6%(10/21),但差异无统计学意义;本研究常见的毒副反应主要是骨髓抑制,Ⅰ~Ⅱ度粒细胞减少和血小板下降是最为常见的,分别为21.9%和34.3%,而Ⅲ~Ⅳ度发生率分别为43.8%和25.0%,8例发生感染;其他常见毒副反应为消化道反应、肝功能损害、脱发等,发生率分别为53.1%、15.6%、56.3%。所有不良反应经积极对症治疗后,症状均能够相应的缓解或好转,所有毒副反应经相应处理后,均能逆转或耐受,未有治疗相关性死亡的发生。
本研究结果显示,MINE方案是CHOP一线化疗失败复发或难治性NHL的有效解救方案,其不良反应能够耐受,价格低廉,且操作简便,符合中国基本国情,有利于在基层医院推广使用。如果能够联合靶向药物或造血干细胞移植,患者的治疗效果可能会更佳。
[参考文献]
[1] Messori A,Vaiani M,Trippoli S,et al. Survival in patients with intermediate or high grade non-Hodgkin's lymphoma:Meta-analysis of randomized studies comparing third generation regimens with CHOP[J]. Br J Cancer,2001, 84(3):303-307.
[2] Shah R,Jonnalagadda S. The GIST of a stromal tumor[J]. Gastroenterology,2005,128(7):2170-2172.
[3] A predictive model for aggressive non-Hodgkin's lymphoma. The international non-Hodgkin's lyphoma prognostic factors project[J]. N Engl J Med,1993,329(14):987-994.
[4] Shanbhogue AK,Karnad AB,Prasad SR. Tumor respones evaluation in oncology:Current update[J]. J Comput Assist Tomogr,2010,34(4):479-484.
[5] 孙燕,石远凯. 临床肿瘤内科手册[M]. 第5版. 北京:人民卫生出版社,2008:142-145.
[6] 张明智,臧卫平,宋敏,等. DACE方案治疗难治复发性非霍奇金淋巴瘤的临床疗效[J]. 癌症,2008,279(4):435-437.
[7] Multani P,White CA,Grillo-Lopez A. Non-Hodgkin's lymphoma:Review of conventional treatments[J]. Curr Pharm Biotechnol,2001,2(4):279-291.
[8] 杨升,卢辉山,郑知文,等. MINE方案治疗难治性与复发性中、高度恶性非霍奇金淋巴瘤的临床观察[J]. 中国癌症杂志,2009,19(8):641.
[9] 石远凯,孙燕. 临床肿瘤内科手册[M]. 第6版. 北京:人民卫生出版社,2015:289-301.
[10] 罗盛,陈怡,俞康,等. MINE方案治疗难治性侵袭性非霍奇淋巴瘤的临床研究[J]. 中国热带医学,2007,7(3):367.
[11] Rodriguez MA,Cabanillas FC,Hagemeister FB,et al. A phase Ⅱ trial of mesna/ifosfamide,mitoxantrone and etoposide for refractory lymphomas[J]. Ann Oncol,1995,6(6):609-611.
[12] 郝杰,李雪莲,李良群,等. MINE与ICE方案治疗复发难治性淋巴瘤的疗效比较[J]. 实用癌症杂志,2012,27(1):61-63.
[13] Emmanouilides C,Lill M,Telatar M,et al. Mitoxantrone/ifosfamide/etoposide salvage regimen with rituximab for in vivo purging in patients with relapsed lymphoma[J]. Clin Lymphoma,2002,3(2):111-116.
[14] 范云,黄志煜,罗吕宏,等. MINE方案治疗复发或耐药的侵袭性淋巴瘤临床观察[J]. 癌症,2005,24(12):1503-1506.
[15] 胡东霞,霍丹,陈应利,等. MINE方案解救治疗复发或难治性非霍奇金淋巴瘤近期疗效观察[J]. 山东医药,2008,48(45):90-91.
(收稿日期:2015-12-31)
