枣果霉烂病病原鉴定(一)
——引起新疆枣果霉烂病的几种曲霉菌的分离鉴定
2016-05-12沙娜瓦尔色买提玉山江买买提郭庆元白剑宇
沙娜瓦尔·色买提,玉山江·买买提,郭庆元,白剑宇
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院植物保护研究所,乌鲁木齐 830091)
枣果霉烂病病原鉴定(一)
——引起新疆枣果霉烂病的几种曲霉菌的分离鉴定
沙娜瓦尔·色买提1,玉山江·买买提2,郭庆元1,白剑宇1
(1.新疆农业大学农学院,乌鲁木齐830052;2.新疆农业科学院植物保护研究所,乌鲁木齐830091)
摘要:【目的】枣果霉烂病是枣果产后的重要病害,曲霉菌是枣果霉烂最重要的致病菌。目前,国内外对引起枣果霉烂病的病原种类报道甚少。明确新疆枣果霉烂病的病原种类及优势致病种群,有效防控该病的发生和危害。【方法】通过广泛采样、组织分离和回接证病对大量病样进行系统分离;对几种致病曲霉菌进行形态鉴定、分子验证及致病性比较。【结果】曲霉属真菌为枣果霉烂病的最主要病原;分离得到的大多数曲霉属的单孢分离菌株对枣果具有明显的致病性;致病的214个曲霉属单孢菌株分属于5个种,分别为黑曲霉、黄曲霉、赤曲霉、赭曲霉和聚多曲霉;其中黑曲霉的分离频率最高,致病性最强。【结论】引起新疆枣果霉烂病的曲霉有5种,其中黑曲霉为优势致病种。
关键词:枣;果实霉烂病;曲霉;病原鉴定
0引 言
【研究意义】我国是世界上主要的枣生产国家,有几千年的栽培历史,拥有全世界99%以上的枣种质资源[l]。枣果因其味甜、肉质厚并且含有丰富的营养物质和具有较高的营养价值及食疗功能等优良品质而受到消费者的喜爱,是国内外市场知名的果产品[2]。近年来,在大力发展林果业的政策带动下,新疆林果业有了突飞猛进的发展,新疆红枣目前种植面积已达35×104hm2(525万亩),居全国第三位,产量62×104t[3]。但是,目前新疆枣制干方法仍沿用自然晾干等原始方式,因此极易受污染,出现酸甜失衡、营养价值下降等问题;在枣果储运过程中很容易发生霉变引起枣果霉烂等贮藏期病害,最终导致市场价值降低[4]。在引起枣果霉烂病的致病菌中,曲霉菌是主要的病原菌之一[5]。因此,明确枣果霉烂病的病原种类及优势致病种群对有效防控该病的发生和危害有重要意义。【前人研究进展】根据已有报道,枣果霉烂病在每年都有大量发生,有的年份甚至造成 90%以上的损失[5]。枣果霉烂病包括轮纹烂果病、红粉病、软腐病、曲霉病、青霉病和木霉病等多种[5]。根据对新疆枣干果中的霉烂果的初步观察,曲霉菌是最常出现的病原。曲霉侵入枣果后,病斑表面产生初期灰白色、渐变为褐色或黑色的“大头针”状霉状物,湿度高时果面长出霉层[5]。【本研究切入点】目前,国内外对引起枣果霉烂病致病曲霉种类的相应报道很少,对新疆枣果霉烂病病原的研究更未见报道。针对枣果霉烂病危害普遍、其病原菌种类缺少准确鉴定、防治上没有适当措施的现状,研究拟对引起枣果霉烂病的曲霉菌进行大量分离,应用形态鉴定和分子鉴定相结合的方法对引起枣果霉烂的曲霉菌进行准确鉴定,并对多种致病曲霉进行致病性比较。【拟解决的关键问题】通过大量的采样和严格的分离鉴定,明确由曲霉引起的枣果霉烂病(即曲霉病)的致病菌种类和优势致病种群,为该病的有效防控提供依据。
1材料与方法
1.1材 料
1.1.1 枣果品种
2014至2015年,先后于阿克苏地区(市郊、阿瓦提县、沙雅县),和田地区(皮山县、策勒县、于田县、洛浦县),喀什地区(沙车县)等主要枣产区及乌鲁木齐华凌干果批发市场和乌鲁木齐东环路干果批发市场收集病果,从中挑选典型病果进行分离。用于分离的主要枣果品种有骏枣、灰枣和哈密大枣等。
1.1.2 培养基
PDA培养基:马铃薯200 g,蔗糖20 g,琼脂15~20 g,用水定容至1 L。
查氏琼脂培养基(Czapek):蔗糖30 g,NaNO31 g,K2HPO41 g,KCI 0.5 g,MgSO40.5 g,FeSO40.01 g,琼脂15~20 g,用水定容至1 L,pH 自然。
水琼脂培养基(WA):琼脂15 g,蒸馏水1 000 mL。
1.2方 法
1.2.1病原菌的分离
采用组织分离法:将新鲜病果表面清洗干净,用70%酒精棉球擦拭枣果表面,用解剖刀削去大部分病部组织,用镊子夹取病健交界处果肉置于PDA平板培养基上,25℃恒温箱中培养。
保湿诱发分离法:选取典型病果,置入加滤纸的保湿培养皿内,待菌落长出后,从菌落上选择较为单纯的曲霉菌转接到查氏平板培养基上,25℃恒温培养5 d后检查菌落。
1.2.2 病原真菌的纯化、回接及形态鉴定
对各分离物采用单胞分离法进行纯化,将病原菌培养5 d后,用接种环刮取少量孢子,置于100 μL灭菌水中,用接种环蘸取少量孢子液后在WA平板培养基上划线,待萌发形成菌落后自较末端划线上挑取最小的单一菌落进行培养;上述操作重复三次,以得到真正的单孢菌株。将获得的单孢菌株保存在PDA 斜面上[6]。
完成所有分离物的单孢分离后,采用离体果针刺接种法将各菌株接种到新鲜、成熟、健康、无伤的红枣果实上,观察其致病与否,由此筛选致病菌株。
将各致病菌株分别接种到查氏平板培养基上,经培养后进行体视显微观察及制作切片镜检,观察描述其产孢方式及分生孢子梗、产孢细胞和分生孢子的形态特征,结合培养特性,作为鉴定菌种依据。参照《真菌鉴定手册》[7]及《中国真菌志》曲霉属分册[8],主要以Raper和Fennell(1965)的系统为依据对各致病菌株进行形态鉴定。
1.2.3病原菌分子鉴定1.2.3.1基因组DNA的提取
采用液体静置培养方法收集菌丝体,用液氮充分研磨菌至干粉后装入1.5 mL离心管中,参照试剂盒使用说明,用真菌 DNA 提取试剂盒(北京天根生物科技有限公司)提取。
1.2.3.2rDNA-ITS的扩增与测序
引物:上游引物ITS1(5′-GTAGTCATATGCTTGTCTC-3′)
下游引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)
PCR扩增25 μL的反应体系,包括Taq(1U/μL) 0.5 μL,10×PCR Buffer 2.5 μL,Mg2+Plus 2.5 μL,dNTP Mixture 3 μL,ITS1 1 μL,ITS4 1 μL,模板DNA 各2 μL,ddH2O 13 μL。
PCR反应条件为预变性95℃3 min;变性,95℃1 min,退火52℃40 s,延伸72℃2 min,35个循环;补平72℃10 min。
扩增产物用1%琼脂糖凝胶,在1×TAE电泳缓冲液中电泳,以凝胶成像系统检测并记录扩增产物在琼脂糖凝胶上的图谱。用PCR产物切胶、PMD18-T载体纯化和连接产物转化方法将扩增产物纯化后送博士德生物公司测序部进行测序。
1.2.3.3BLAST比对与同源性分析
将测得的菌株序列在GenBank中进行BLAST比对,根据待测菌株与已知种的同源性验证形态鉴定结果。
1.2.4病原菌的致病性比较
为比较各种曲霉菌在鲜果和干果上的致病力大小,致病性实验采用鲜果接种和干果接种两种方法。
1.2.4.1鲜果接种
采集白熟期新鲜健康枣果,用浸泡在70%酒精中的棉球对枣果表面消毒,无菌水冲洗3次,晾干后切成果片并置于保湿培养皿内;将各单孢菌株制成直径4 mm的菌饼作为接种体,贴于枣果片切面上,每果片接种3个位点;每个单孢菌株接种3个果片(三次重复)并置于同一保湿皿中;以果片上放无菌的PDA培养基饼作为对照。接种后在25℃温箱中保湿培养,每天观察记录果实发病情况,10 d后分别统计发病率。
1.2.4.2干果接种
选健康干果,用70%酒精棉球作表面消毒后,用无菌水浸泡吸胀,晾干后切成果片并置于保湿培养皿内;用与鲜果相同的接种和培养方法观察记录果实发病情况。
2结果与分析
2.1自然发病枣果的典型症状
该类型病果主要为害近储藏期的果实,一般在采后晾晒期(10月中、下旬)大量发生。曲霉菌侵入枣果后,受害部位引起病果变软果肉变呈淡褐色至褐色腐烂;病斑表面产生灰白色、黑色、绿色的“大头针”状霉状物,即病原菌的分生孢子梗及分生孢子,腐烂果实有霉酸味。
2.2枣果霉烂病病原菌分离结果
通过组织分离法,从60个典型病果,约300个组织块上分离获得175个曲霉属(Aspergillusspp.)分离物;通过保湿分离,从15个典型病果上获得44个曲霉属分离物;合计从75个病果上分离到219个曲毒属分离物,经单孢分离得到657个单孢菌株(3个/每分离物);从219个分离物中各选一个单孢菌株进行回接,筛选出214个致病的单孢菌株。这些致病菌株均能侵染枣果,引起果实表面或内部发病,长出褐色或黑色霉层,最后导致烂果,并从发病果实上可重新看得到与所接菌株相同的培养性状,说明分离得到的病原菌是引起枣果霉烂病的致病菌。表1
2.3 曲霉种的形态鉴定
将来自214个分离物的214个致病单孢菌株,通过对各单孢菌株在查氏培养基上的培养形状及孢子和产孢细胞的形态、大小等特征观察,鉴定出214个曲霉属菌株分属于5个种,分别为黑曲霉(A.nigerTiegh)、黄曲霉(A.flatusLink)、赤曲霉(A.ruberSamon & Gams)、赭曲霉(A.ochraceusWilh)和聚多曲霉(A.sydowiiThom&Church);黑曲霉的出现频率最高,为74.76%,黄曲霉次之,为17.29%,其余三种曲霉的出现频率分别为3.37%、2.34%和1.87%。此外,从两种分离方法得到的结果来看,经组织分离法得到的曲霉菌菌株多,而经保湿分离法得到的曲霉菌菌株数较少;但从组织分离法得到的171个菌株中,只鉴定出黑曲霉、黄曲霉和赤曲霉三种,且以黑曲霉的菌株占约大多数,而保湿分离得到的39个菌株中鉴定出了上述所有5个种,仍以黑曲霉的菌株为多。多项分离结果均显示,黑曲霉在所有曲霉中菌株出现频率最高,为枣果霉烂病的优势病原菌种。表1
2.4各致病曲霉菌的培养性状及形态特征
2.4.1黑曲霉Aniger
菌落在查氏培养基上生长迅速,25℃,培养7d后,直径为40 ~ 60 mm;菌落中心稍凸起,有规则的辐射状沟纹;质地丝绒状;分生孢子结构大量,表面呈暗褐黑色至炭黑色;菌落反面呈黄褐色。分生孢子头初为球形至辐射形,直径150 ~ 450 μm;分生孢子梗发生于基质,孢梗茎,(800)950 ~ 2 700(4 000)μm×10 ~ 20 μm,壁平滑;顶囊球形,直径(30)40 ~ 75(80)μm,全部表面可育;产孢结构双层:梗基,(10)15 ~ 35(70)μm×(3)3.5 ~ 12(14) μm;瓶梗,(7)8 ~ 11(12)μm×(2)2.5 ~ 3 μm;分生孢子近球形,直径3 ~ 5.4 μm,壁明显粗糙。
2.4.2黄曲霉A.flavus
菌落在查氏培养基上生长迅速,25℃,培养7d后,直径36 ~ 52 mm;质地主要为致密丝绒状,中央部分呈絮状,平坦;分生孢子结构多,颜色为黄绿至草绿色,初期较淡,老后稍深;菌落反面淡褐色;分生孢子头初为球形,后呈辐射形,直径(80)125 ~ 500(800)μm;分生孢子梗大多生自基质,孢梗茎,(200)400 ~ 1 000(3 000)μm×(4)8 ~15(20)μm,壁厚,无色,粗糙;顶囊近球形至烧瓶状,直径(9)22.5 ~ 48(65)μm,大部表面可育;产孢结构双层:梗基(6.2)7 ~ 11(19)μm×(3.2)4 ~ 6 μm;瓶梗(6.2)8.5 ~ 10(12) μm×(2.4)3 ~ 3.5(4) μm;分生孢子多为球形,(2.4)3.6 ~ 4.8(6.4)μm,壁稍粗糙。
2.4.3赭曲霉A.ochraceus
菌落在查氏培养基上,25℃ ,培养7 d后,直径为(25)28 ~ 30(35) mm ,10 ~ 14天后直径35 ~ 53(55) mm;质地丝绒状,平坦;分生孢子结构较稀疏,黄赭色;菌丝体白色;菌落反面为紫褐色;分生孢子头初为球形(75)90 ~ 200 μm,老后可达350 ~ 500 μm;分生孢子梗生自基质,孢梗茎一般(500)900 ~ 1 250(1 500) μm×(6)7 ~ 15 μm,壁厚(0.7)0.8 ~ 1.5 μm,粗糙;顶囊球形或近球形,直径(20)25 ~ 45(55)μm,全部表面可育;产孢结构双层:梗基(7)14 ~ 25 μm×(2.5)3 ~ 6 μm;瓶梗7 ~ 12(13) μm×1.5 ~ 2.5(3) μm;分生孢子多球形或近球形,(2)2.5 ~ 3.5(4)μm,壁近于光滑。

注:A,B,C,D,E分别代表黑曲霉、黄曲霉、赭曲霉、聚多曲霉、赤曲霉。1,2,3分别代表5种曲霉菌的分生孢子穗、分生孢子梗及分生孢子形态
Note:A,B,C,D,E respectively representA.niger,A.flatus,A.ochraceus,A.sydowii,A.sydowii;1,2,3 respectively represent the conidial head,conidiophores and conidia of 5 species ofAspergillus
图1五种曲霉菌的主要形态
Fig.1The main morphological characteristics of 5 species ofAspergillus
表1214个曲霉属菌株所属的种及其出现频率
Table 1Frequence of 214Aspergillusspp
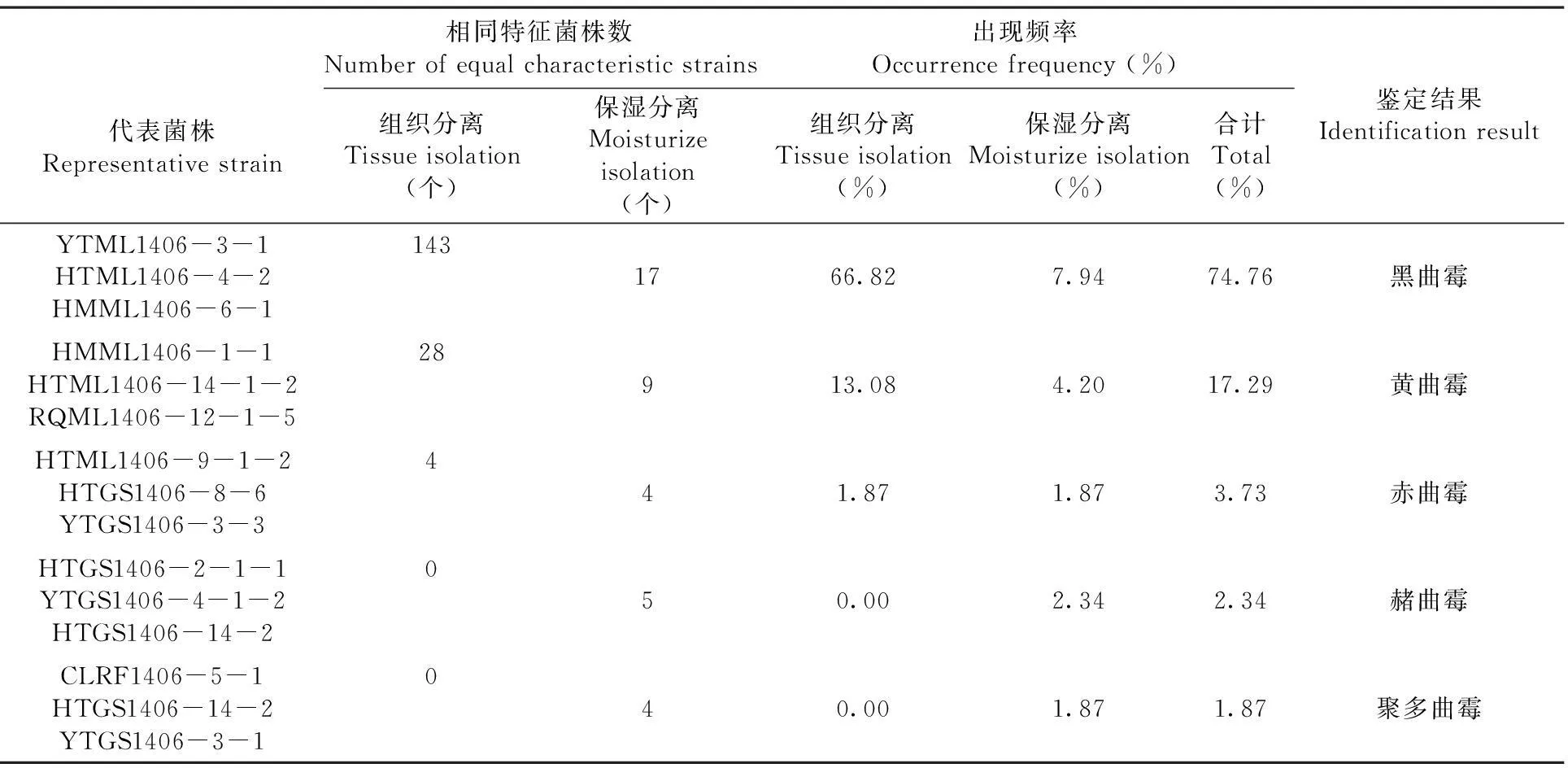
代表菌株Representativestrain相同特征菌株数Numberofequalcharacteristicstrains出现频率Occurrencefrequency(%)组织分离Tissueisolation(个)保湿分离Moisturizeisolation(个)组织分离Tissueisolation(%)保湿分离Moisturizeisolation(%)合计Total(%)鉴定结果IdentificationresultYTML1406-3-1HTML1406-4-2HMML1406-6-11431766.827.9474.76黑曲霉HMML1406-1-1HTML1406-14-1-2RQML1406-12-1-528913.084.2017.29黄曲霉HTML1406-9-1-2HTGS1406-8-6YTGS1406-3-3441.871.873.73赤曲霉HTGS1406-2-1-1YTGS1406-4-1-2HTGS1406-14-2050.002.342.34赭曲霉CLRF1406-5-1HTGS1406-14-2YTGS1406-3-1040.001.871.87聚多曲霉
2.4.4聚多曲霉A.sydowii
菌落在查氏培养基上,25℃ ,培养7 d后,直径为25 mm左右;质地为丝绒状;颜色呈不同程度的灰蓝色至暗蓝色;菌落反面呈淡褐色。分生孢子头球形至辐射状,直径达(52)62.5 ~ 87.5(125)μm;分生孢子梗生于基质,孢梗茎长度为110 ~ 200(500) μm×3.5 ~ 7(8) μm,壁光滑,较厚;顶囊较小,近球形,直径为(8)10 ~ 20 μm,全部表面可育;产孢结构双层:梗基一般(4.2)6 ~ 9(10.4) μm×(2)3~ 3.5(4) μm;瓶梗(4.2)5 ~ 9(10) μm×2 ~ 3 μm;分生孢子球形,直径2.5 ~ 3.5(5)μm,壁明显粗糙,具小刺。
2.4.5赤曲霉(A.ruber,有性型:赤散囊菌E.rubrum)
菌落在查氏培养基上生长缓慢,25℃,12 d直径5 ~ 12 mm;平坦;分生孢子较少,灰绿色;分生孢子头球形,直径100 ~ 250 μm;分生孢子梗茎150 ~ 300 μm×8 ~ 15 μm,壁光滑;顶囊烧瓶形,直径17 ~ 40 μm,大部分表面可育;产孢结构单层:瓶梗6 ~ 12.5 μm×3 ~ 5 μm;分生孢子球形5 ~ 6 μm。闭囊壳较多,黄色;菌落反面黄褐色。闭囊壳球形,(70)88 ~ 180(200) μm;子囊近球形,9 ~ 19(22) μm;子囊孢子双凸镜形,5 ~ 6.5 μm×4 ~ 5(5.6) μm。
2.5致病菌 rDNA- ITS 序列分析
从几种曲霉菌中各选一个致病的单孢菌株,以各菌株的 DNA 作为模板,用通用引物扩增,得到约 600 bp 左右的 rDNA- ITS 序列。
将上述扩增产物测序后,将各自的 rDNA- ITS 序列在GenBank 中分别与已有的一些曲霉菌序列进行比对分析,结果表明所测病原菌分属于半知菌类曲霉属中的5个种。经形态鉴定的各种曲霉菌与GenBank 中登录的同种曲霉菌的rDNA- ITS序列同源性比对结果表明:黑曲霉菌株(HTML1406-4-2)的ITS序列与A.niger(KF031027,JQ867382,KR149643等)多个菌株的ITS序列同源性均达100%;黄曲霉菌株(HMML1406-1-1)的ITS 序列与A.flatus(GU172440,LN482520,KP329664等)多个菌株的ITS序列同源性均达99%;赤曲霉菌株(HTGS1406-8-6)的ITS 序列与A.ruber(NR131286,AY37389,HE801343)等多个菌株的ITS序列同源性均达100%;赭曲霉菌株(YTGS1406-4-1-2)的ITS 序列与A.ochraceus(NR077150,FR329836,EF661419等)多个菌株的ITS序列同源性高达99%~100%;聚多曲霉菌株(CLRF1406-5-1)的ITS 序列与A.sydowii(JX518253,KP329836,KP329835等)多个菌株的ITS序列同源性高达100%。其分析结果与形态鉴定结果一致,再次证明,引起新疆枣果霉烂病的曲霉菌确为上述5种。图2
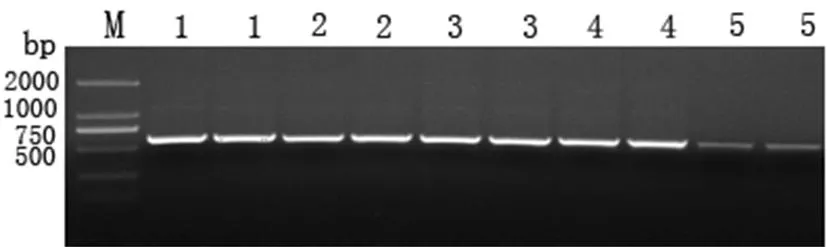
注:M:DNA marker DL2000;1:黑曲霉(HTML1406-4-2);2:黄曲霉(HMML1406-1-1);3:赤曲霉(HTGS1406-8-6);
4:赭曲霉(YTGS1406-4-1-2);5:聚多曲霉(CLRF1406-5-1).
Note:M:DNA marker DL2000;1:A.niger(HTML1406-4-2);2:A.flatus(HMML1406-1-1);3:A.ruber(HTGS1406-8-6);4:A.ochraceus(YTGS1406-4-1-2);5:A.sydowii(CLRF1406-5-1).
图2五种曲霉的单孢菌株的rDNA ITS-PCR产物
Fig.2rDNA ITS-PCR products of single spore isolates of 5 species Aspergillus
2.6 五种曲霉菌的致病性比较
研究表明,5种曲霉菌对枣果的致病力存在明显的差异,同一种曲霉菌对鲜果和干果的致病力亦有较大差异。黑曲霉、黄曲霉和赭曲霉对枣鲜果致病能力最强(接种发病率为100%~ 96.29%),其中黑曲霉对干果的致病力最强(接种发病率为55.55%),而黄曲霉的最弱(接种发病率为7.41%);聚多曲霉对枣鲜果和干果的致病能力均最弱(接种发病率为鲜果70.36%,干果7.41%);赤曲霉对枣鲜果和干果致病能力较强(接种发病率为鲜果88.88%,干果51.84%);同时,同一种曲霉菌的不同菌株间的致病力亦有明显差异。表2
表2五种曲霉菌对枣鲜果及枣干果的致病性比较
Table 2 The comparison of pathogenicity test ofAspergillusfungus to jujube fresh fruit and dried fruit
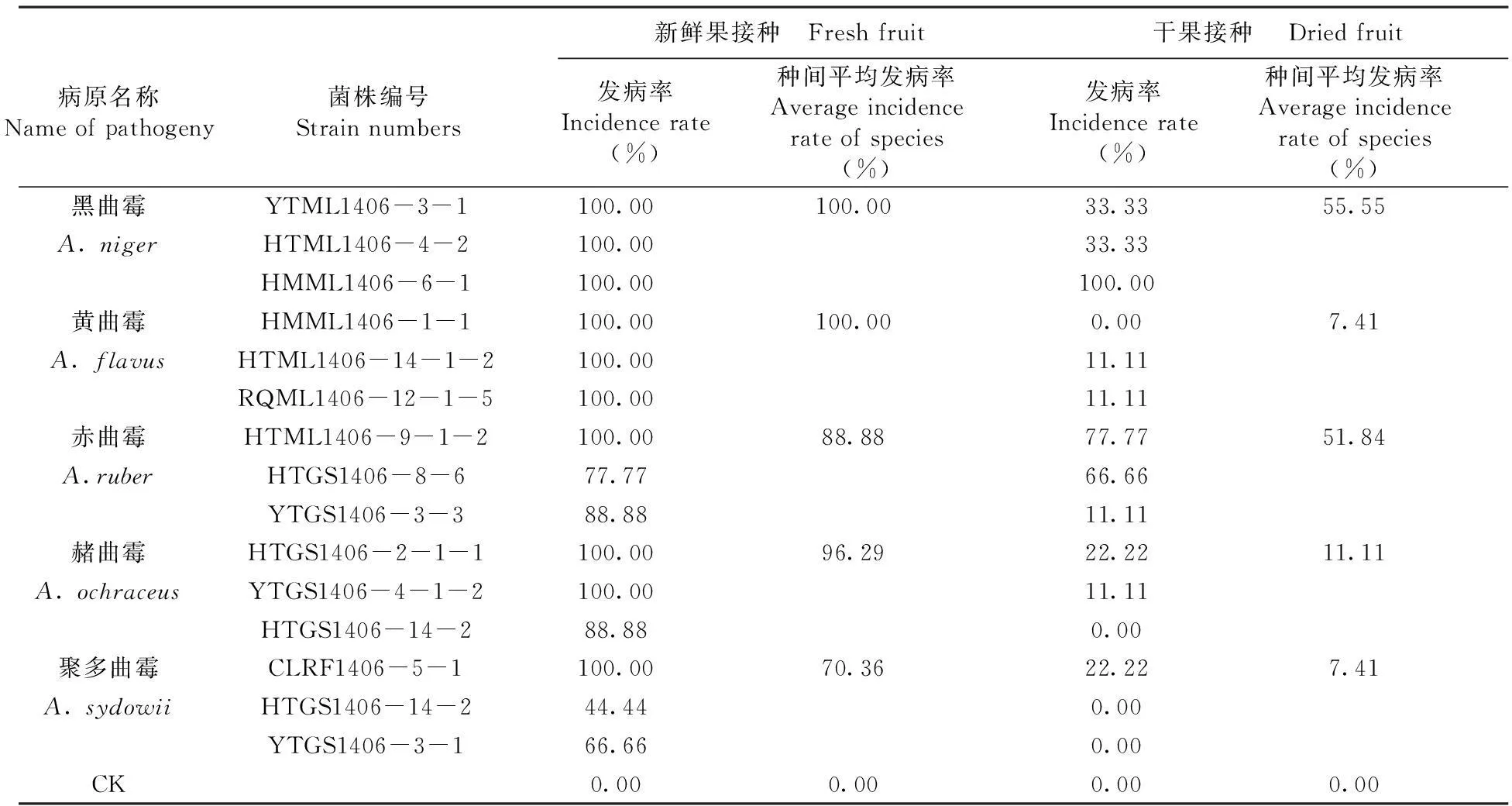
病原名称Nameofpathogeny菌株编号Strainnumbers新鲜果接种 Freshfruit干果接种 Driedfruit发病率Incidencerate(%)种间平均发病率Averageincidencerateofspecies(%)发病率Incidencerate(%)种间平均发病率Averageincidencerateofspecies(%)黑曲霉YTML1406-3-1100.00100.0033.3355.55A.nigerHTML1406-4-2100.0033.33HMML1406-6-1100.00100.00黄曲霉HMML1406-1-1100.00100.000.007.41A.flavusHTML1406-14-1-2100.0011.11RQML1406-12-1-5100.0011.11赤曲霉HTML1406-9-1-2100.0088.8877.7751.84A.ruberHTGS1406-8-677.7766.66YTGS1406-3-388.8811.11赭曲霉HTGS1406-2-1-1100.0096.2922.2211.11A.ochraceusYTGS1406-4-1-2100.0011.11HTGS1406-14-288.880.00聚多曲霉CLRF1406-5-1100.0070.3622.227.41A.sydowiiHTGS1406-14-244.440.00YTGS1406-3-166.660.00CK0.000.000.000.00
3讨 论
3.1枣果在贮藏期由于病原菌的侵染而导致的霉烂变质,大大降低了枣果的市场价值。因此,对枣果霉烂病进行病原菌的分离与鉴定,明确其致病菌种类,进而了解其生物学特性,研究其控制方法,对今后枣果的贮藏保鲜具有重要意义。
3.2对枣果霉烂病病原菌的分离频率及致病性分析结果初步表明,曲霉属真菌是引起枣果霉烂的主要病原菌;在研究中鉴定出的5种曲霉菌中,黑曲霉为优势菌种,其分离频率最高,致病性也很强;同时黑曲霉和赤曲霉为5种曲霉菌中致病性最强的种,对鲜果和干果的致病率均很高;但需要说明的是,由于每种曲霉菌仅选用了3个代表菌株,且菌株间的致病性差异很大,因而5种曲霉菌的致病性比较会在一定程度上受到菌株选择的影响,为更准确的得出该5种曲霉菌在对枣果的致病性差异上的结果,需要进一步选择更多的菌株并设置更多的重复进行比较。
3.3曲霉在不同的培养基上的菌落外观及颜色均有差异,因此研究中均统一在查氏培养基上培养。通过在一致条件下培养的培养性状即可大体区分为黑色组、黄绿组、烟色组等不同组;为准确鉴定,还要参考前人研究的培养条件,尽量与其保持一致,只有这样才更有可比性[9]。
3.4魏天军,魏象廷在“中国枣果实病害研究进展”中介绍了枣曲霉病的病原为黑曲霉。研究中通过组织分离和保湿分离,鉴定出5种曲霉对枣鲜果和干果具有致病性(或称致霉性),同时得到黑曲霉为优势致病种的结果。两者有较好的一致性。除黑曲霉外,研究中还鉴定出黄曲霉、赤曲霉、赭曲霉等4种曲霉对枣果具有致病性。这一差异可能与地域不同,采样的多少及分布有关,也与研究中采用了保湿分离法有关,在保湿分离过程中可能使一些并非造成果实最初感染而是在保湿环境中次生感染的,同时又具有一定致病性的曲霉菌成为鉴定结果的一部分。一般而言,严格的组织分离能更好地得到初始感染或真实感染到组织中病原菌,而保湿分离能简单地得到更多种类的分离物及致病菌。由于枣果采后制干、贮运环境复杂,接触各种致病菌的可能性很大,因此,研究中两种分离方法并用,能更大范围地分析枣果上的致病菌及可能的致病菌。如果研究中的组织分离方法足够严格和无疏漏的话,可以认为组织分离的结果体现了初始感染或真实感染到组织中病原菌,即黑曲霉、黄曲霉和赤曲霉为引起枣果霉烂病的真正的致病菌种,而仅在保湿分离中出现的赭曲霉和聚多曲霉为分离环境中存在的可致病菌种。这一推论结果有待通过分子检测方法对大量样果的实际检测来证实。
4结 论
引起新疆枣果霉烂病的曲霉菌有黑曲霉、黄曲霉、赤曲霉、赭曲霉和聚多曲霉5种。其中黑曲霉的分离频率最高,致病性最强,是曲霉菌中的优势菌种。
参考文献(References)
[1] 郗荣庭,刘孟军,王文江.干果研究进展[M].北京:中国农业科学技术出版社,2011:22-23.
XI Rong-ting,LIU Meng-jun,WANG Wen-jiang.(2011).Researchprogressofdriedfruits[M].Beijing:China Agriculture Sciences and Technology Press:22-23.(in Chinese)
[2] 魏天军.枣果采后生理特性与保鲜贮藏技术研究进展[J].宁夏农业科技,2005,(4):29.
WEI Tian-jun.(2005).Advances of Research on Postharvest Physiology and Storage Technology of J Zizyphus jujube Fruits [J].NingxiaAgriculturalSciencesandTechnology,(4):29.(in Chinese)
[3] 张昭豹.新疆红枣消费市场调查研究- 以上海市为例[D].乌鲁木齐:新疆农业大学硕士学位论文,2014.
ZHANG Zhao-bao.(2014).ResearchonMarketofXinjiangJujubeConsumption-TakingShanghaiforExample[D].Master Dissertation.Xinjiang Agricultural University, Urumai.(in Chinese)
[4] 侯倩.干制与贮藏方法对枣果品质的影响[D].保定:河北农业大学硕士学位论文,2012.
HUO Qian.(2012).InfluencesofdifferentdryingandstoragemethodsonqualityofChinesejujubefruits[D].Master Dissertation.Agricultural University of Hebei,Baoding.(in Chinese)
[5] 秦文,柴全喜.枣烂果病的综合防治[J].果农之友,2014,(8):26.
QIN Wen,CHAI Quan-xi.(2006).Zizyphus jujube Fruits mildew pathogen and prevention [J].FruitGrowers`Friend,(8):26.(in Chinese)
[6] 方中达.植病研究方法[M].(第三版)北京:中国农业出版社,1998.
FANG Zhong-da.(1998).ResearchMethodofPlantPatholigy[M].(3rd Ed.)Beijing:China Agriculture Press.(in Chinese)
[7] 魏景超.真菌鉴定手册[K].上海:上海科学技术出版社,1979:501-512.
WEI Jing-chao.(1979).ManualfortheIdentificationofFungus[K].Shanghai:Shanghai Science Technology Press.(in Chinese)
[8] 齐祖同.中国真菌志.第五卷.曲霉属及其相关有性型属[M].北京:科学出版社,1997,(10).
QI Zu-tong.(1997).FloraFungorumSinicorumAspergillusetTeleomorphiCognativol.5 [M]. Beijing: Science Press,(10).(in Chinese)
[9] 张勇.耐热真菌多样性及分子系统研究[D].泰安:山东农业大学 博士毕业论文,2012.
ZHANG Yong.(2007).ThermotolerantFungiDiversityandMolecularPhylogeny[D].PhD Dissertation. Shandong Agriculture University,Taian.(in Chinese)
Identification of the Pathogen Causing Jujube Fruit Mildew (Part I)-Isolation and Identification ofAspergillusfungusCausing Jujube Fruit Mildew
Shanawaer Semaiti1,Yushanjiang Maimaiti2,GUO Qing-yuan1,BAI Jian-yu1
(1.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052China;2.ResearchInstituteofPlantProtection,XinjiangAcademyofAgriculturalSciences,Urumqi830091China;)
Abstract:【Objective】 The Jujube fruit mildew is the major disease of postharvest jujube fruits,and Aspergillus fungus is the most important pathogenic fungus of jujube fruits mildew.At present,there is no substantial report within or outside the country about the pathogen species causing jujube fruits mildew.Clarifying pathogen species and advantaged species of jujube fruits mildew in Xinjiang is significantly important to control the occurrence and damage of this diseases.【Method】Widely sampling,tissue isolation and tie-back method were used in systematic isolation for large number of disease samples.At the same time,morphological analysis,molecular analysis and pathogenicity comparison were used for identification of some pathogenic Aspergillus fungus.【Result】The isolation results showed that Aspergillus spp. fungus is the major pathogen which causes jujube fruits mildew.Separation with the majority single spore isolates of Aspergillus spp. have got pathogenicity to jujube fruit. 214 single spore isolates of Aspergillus spp. which have pathogenicity belong to 5 species,they are A. niger,A. flatus,A. rubrum,A. ochraceus and A. sydowii,among which, A. niger had the highest isolate rate and the strongest pathogenicity.【Conclusion】There are 5 species of Aspergillus that cuase jujube fruits mildew in Xinjiang,among which, the advantaged pathogenetic species is A. niger.
Key words:jujube;fruits mildew;Aspergillus;pathogen identification
中图分类号:S436.65
文献标识码:A
文章编号:1001-4330(2016)03-0502-08
作者简介:沙娜瓦尔·色买提(1990-),女,新疆和田人,硕士研究生,研究方向为植物病理学,(E-mail)senever352@163.com通讯作者:郭庆元(1962-),男,四川人,教授,博士生导师,研究方向为植物病理学,(E-mail)guoqingyuan3009@sina.com
基金项目:新疆维吾尔自治区科技计划项目“新疆特色果树高效安全生产关键技术研究集成与示范”(201130102)
收稿日期:2015-11-13
doi:10.6048/j.issn.1001-4330.2016.03.016
Fund project:Supported by science and technology planning projects of Xinjiang Uygur Autonomous Region "integration and demonstration of the key technology of high efficiency and safety production of Xinjiang featured fruit tress" (201130102)
