黑曲霉固态发酵产柚苷酶培养基的优化
2016-05-09黄元杰王先锋高乾坤魏胜华安徽工程大学生物与化学工程学院安徽芜湖24000安徽工程大学微生物发酵安徽省工程研究中心安徽芜湖24000
钱 伟,黄元杰,王先锋,高乾坤,孟 娜,魏胜华,2*(.安徽工程大学生物与化学工程学院,安徽芜湖 24000;2.安徽工程大学微生物发酵安徽省工程研究中心,安徽芜湖 24000)
黑曲霉固态发酵产柚苷酶培养基的优化
钱 伟1,黄元杰1,王先锋1,高乾坤1,孟 娜1,魏胜华1,2*
(1.安徽工程大学生物与化学工程学院,安徽芜湖 241000;2.安徽工程大学微生物发酵安徽省工程研究中心,安徽芜湖 241000)
摘要:以黑曲霉(Aspergillus niger)为柚苷酶生产菌株,进行固态发酵生产柚苷酶.首先采用单因素实验对发酵培养基的固液比、氮源、无机盐及诱导底物柚皮粉的加入量进行初步优化,再通过正交试验确定了黑曲霉固态发酵产柚苷酶最优培养基的组成.实验结果表明:在500mL三角瓶中,麸皮与柚皮粉加入总质量为5.5g,其中,柚皮粉的加入量为2.0g,培养基固液比为1∶2.5,(NH4)2SO4加入量为0.5g,MgSO4加入量为0.03g.通过优化后的培养基进行固态发酵产柚苷酶的研究,发酵144h酶活达到最大为1248.0U/g,比优化前的基础培养基(377.6U/g)提高了2.3倍.
关 键 词:黑曲霉;柚苷酶;固态发酵;培养基优化
通迅作者:魏胜华(1972-),男,安徽无为人,副教授,硕导.
柚苷酶是一种通常由黑曲霉或青霉产生的可水解柚皮苷的糖苷酶[1-2].柚皮苷是多数柑橘类水果中的主要苦味物质,其存在影响了此类果汁饮料的口感,采用柚苷酶脱苦是一种简便而高效的方法[3].研究表明,柚苷酶是由α-L-鼠李糖苷酶(E.C.3.2.1.40)和β-D-葡萄糖苷酶(E.C.3.2.1.21)组成的多酶复合体[4],该酶水解柚皮苷主要是通过α-L-鼠李糖苷酶将柚皮苷先水解成鼠李糖和普鲁宁,而后利用β-D-葡萄糖苷酶将普鲁宁进一步水解成柚皮素和D-葡萄糖[5].柚苷酶不仅在食品行业中应用于果汁脱苦、葡萄酒增香,而且在α-L-鼠李糖和普鲁宁的制备、黄酮类中药加工及甾体转化[6-8]等方面具有重要的应用价值.柚苷酶的广泛用途引发了人们对它的兴趣.
在酶制剂的制备过程中,通常采用深层液态发酵(Submerged Fermentation,SMF)和固态发酵(Solid State Fermentation,SSF)两种方法.在柚苷酶的制备过程中,多数研究涉及液态发酵.固态发酵是指在培养基呈固态,尽管含水丰富,但是没有或者几乎没有自由流动水的状态下进行的一种或者多种微生物发酵过程.相比较液态发酵,固态发酵具有培养基自由水含量少,废水、废渣少,容易处理;培养基原料多为天然基质或废渣,来源广泛,价格低廉;可以减少农副产品废弃物对环境的污染;产物浓度较高,后处理方便等优点[9].目前,在固态发酵产柚苷酶方面的研究不多,蒋树海[10]等以豆粉、米糠、甘蔗渣、麦麸和橘皮等作为原料,培养黑曲霉产柚苷酶.倪辉[11]等应用棘孢曲霉以柚皮粉和豆饼粉为培养基,采用生料发酵,柚苷酶活力达到5.81IU/gds.由于具有以上优点,固态发酵在发酵生产酶制剂方面受到广泛关注,在纤维素酶[12]、单宁酶[13]、鼠李糖苷酶[14]等酶的制备方面都有成功应用.尽管柚苷酶用途较广,但国内在工业生产中却鲜有利用柚苷酶的报道,其主要原因是商品柚苷酶制剂价格高昂,限制了柚苷酶的开发应用.因此,探索并建立高产柚苷酶的发酵生产技术具有重要的实用价值,采用黑曲霉固态发酵生产柚苷酶,对发酵生产柚苷酶的固态基础培养基进行优化,以获得最佳产柚苷酶固态培养基,为固态发酵产柚苷酶提供了依据.
1 材料与方法
1.1 菌株、试剂与仪器
黑曲霉(Aspergillus niger),由微生物发酵安徽省工程研究中心提供;柚皮苷标准品购自Sigma公司,纯度≥99%;蔗糖、硝酸钠、氯化钾、磷酸氢二钾、硫酸镁、硫酸亚铁、乙酸、乙酸钠、葡萄糖、氯化钙、氢氧化钠、一缩二乙二醇均为分析纯,购自国药集团化学试剂有限公司.
HH-6恒温水浴锅(金坛市杰瑞尔电器有限公司);HYG-3恒温摇床(金坛市杰瑞尔电器有限公司);TD5Z台式低速离心机(昆明诺金科技有限公司);SW-GJ-2FD净化工作台(上海新苗医疗器械制造有限公司);723型可见光分光光度计(上海菁华科技仪器有限公司).
1.2 培养基
PDA斜面培养基(g/L):马铃薯200g,蔗糖20g,琼脂20g,水1000mL,自然pH值.固体基础培养基:麸皮5.0g,柚皮粉0.5g,水适量,pH 6.0.
1.3 单孢子菌悬液的制备
将在4℃贮藏的斜面菌种接种于斜面培养基上,30℃恒温培养4~6d后得到成熟孢子.用无菌生理盐水清洗孢子,并放入装有无菌玻璃珠和50mL无菌生理盐水的锥形瓶中,充分振荡打散孢子,即得到单孢子菌悬液.
1.4 固态发酵产酶
在500mL的三角瓶中加入配好的固态培养基,121℃,1.01×105Pa灭菌30min.冷却后接入孢子悬液,在恒温箱中培养6d.
1.5 粗酶液的制备
发酵结束以后,在三角瓶中加入120mL、pH 4.0的乙酸-乙酸钠的缓冲溶液,30℃、200r/min恒温摇床震荡2h后,用4层纱布过滤得粗酶液.将粗酶液于4 000r/min离心10min,取上清液置于4℃冰箱中保存待测.
1.6 酶活测定方法
酶活的测定釆用改良Davis法[15],将粗酶液用pH 4.0醋酸缓冲液稀释,在试管中依次加入0.4g/L柚皮苷标准液2mL,0.2mol/L的pH 4.0醋酸缓冲液2mL,置于40℃恒温水浴锅中预热5min后,加入已稀释的发酵液1mL,在40℃恒温水浴锅中反应30min.反应结束后,取1mL酶解液依次加入90%的一缩二乙二醇5mL、4mol/L NaOH溶液0.1mL及蒸馏水3.9mL,并以1mL蒸馏水做空白对照,于40℃恒温水浴10min,在420nm处测吸光度值.酶活力单位定义为:在40℃、pH 4.0条件下,每毫升酶液每分钟水解1μg柚皮苷所需的酶量定义为1个酶活力单位(U).
1.7 实验设计
首先采用单因素实验优化固态发酵培养基,即在初始培养条件下对影响黑曲霉固态发酵产柚苷酶过程中的培养基固液比、氮源、无机盐、诱导物加入量进行单因素优化试验.在单因素的基础上,以培养基固液比、氮源加入量、无机盐加入量、诱导物柚皮粉的加入量为影响因素,以柚苷酶酶活为指标,设计4因素3水平L9(34)正交试验.
2 结果与讨论
2.1 固液比对黑曲霉固态发酵产柚苷酶的影响
由于固态发酵最大特点就是没有游离水,因而底物含水量的变化对微生物生长代谢及产酶都有着重要的影响.以固态基础培养基为基础,保持其他发酵条件不变,按不同固液比配制不同的培养基,其中固液比分别为1∶1、1∶1.5、1∶2、1∶2.5、1∶3和1∶3.5,将灭过菌后冷却到室温的培养基接入制备好的黑曲霉孢子悬液,置于30℃恒温培养箱中培养6d,测定柚苷酶酶活,比较不同固液比对黑曲霉固态发酵产柚苷酶的影响,结果如图1所示.从图1可以看出,培养基的固液比对黑曲霉产柚苷酶有很大影响,当固液比为1∶2.5时,黑曲霉表现出最高的酶活,最高酶活力为1021.5U/g.在固液比较高时,随着固液比的降低,黑曲霉产柚苷酶的能力逐渐增强.当固液比达到1∶2.5时,此时继续减小固液比,黑曲霉产柚苷酶的酶活开始有所降低.这是由于固液比的大小影响着菌种的生长,固液比较高时,黑曲霉的生长过程中缺乏水分,过早的产生孢子使菌体产酶较少,从而总体酶活较低.固液比过低则会使得黑曲霉与空气之间的传质能力降低,导致菌种的生长较慢从而不利于产酶.因此,黑曲霉固态发酵产柚苷酶的最佳固液比为1∶2.5.
2.2 不同氮源对黑曲霉产柚苷酶的影响
为研究不同氮源对黑曲霉产柚苷酶的影响,以固态基础培养基为基础,保持其他发酵条件不变,分别以0.5g(NH4)2SO4、0.5g NaNO3、0.5g NH4Cl、0.5g NH4NO3以及0.5g蛋白胨为氮源配制不同的培养基.将配好的培养基接入制备好的黑曲霉孢子悬液,置于30℃恒温培养箱中培养6d,测定柚苷酶酶活,结果如图2所示.从图2可以看出,氮源的选择对菌株的生长有很大的影响,其中以(NH4)2SO4为氮源时菌株产柚苷酶的酶活达到最大值,最大酶活为1047.0U/g.微生物的培养过程中理想的氮源一般为蛋白类物质,例如牛肉膏、蛋白胨,但以蛋白胨为氮源获得柚苷酶的酶活只有756.7U/g,其主要是因为固体培养时水的加入量非常少,在水分湿润固体基质的过程中,极易使蛋白胨发生粘结成团从而导致黑曲霉与蛋白胨的接触面降低,造成黑曲霉对蛋白胨的利用率下降,黑曲霉的生长受到相对抑制,从而导致黑曲霉产柚苷酶的酶活降低.因此,实验过程中选择无机氮源(NH4)2SO4作为固态发酵氮源更为适合.
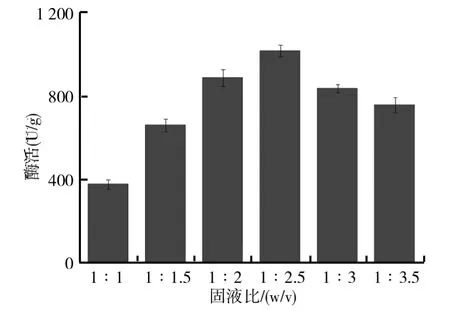
图1 固液比对黑曲霉固态发酵产柚苷酶的影响
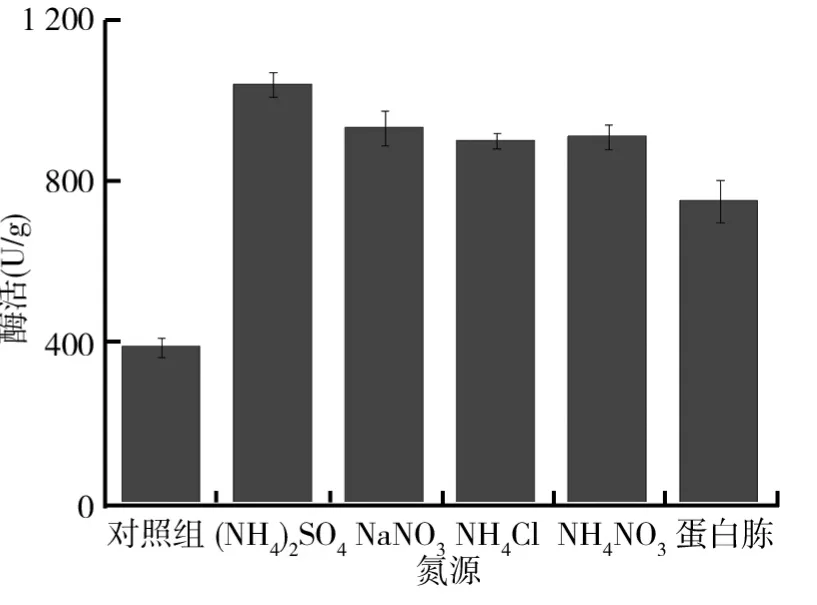
图2 不同氮源对黑曲霉产柚苷酶的影响
2.3 不同无机盐对黑曲霉产柚苷酶的影响
无机盐在细胞组成及酶的激活方面有着重要的作用.以固态基础培养基为基础,保持其他发酵条件不变,分别以0.02g FeSO4、0.02g K2HPO4、0.02g NaCl、0.02g MgSO4以及0.02g CaCl2为无机盐配制不同的培养基.将配好的培养基接入制备好的黑曲霉孢子悬液,置于30℃恒温培养箱中培养6d,测定柚苷酶酶活,比较不同无机盐对黑曲霉产柚苷酶的影响,结果如图3所示.由图3可以看出,无机盐对黑曲霉的生长有着不可或缺的作用,在培养基中添加一些必要的无机盐可促进黑曲霉的生长,而且一些无机盐的加入还可起到缓冲作用,特别是像Mg2+、PO3-4、Na+这类离子,在细胞代谢以及某些酶的合成中也起着重要作用.实验中选取的各种无机盐对黑曲霉产柚苷酶作用大小依次为MgSO4>K2HPO4>CaCl2>FeSO4>NaCl,其中以MgSO4作为固态发酵培养基的无机盐时,所产柚苷酶酶活可达到1 080.5U/g.因此,选择MgSO4作为黑曲霉固态发酵培养基的无机盐可明显提高黑曲霉的产酶能力.
2.4 诱导物加入量对黑曲霉产柚苷酶的影响
保持麸皮与诱导物柚皮粉总质量为5.5g,其他发酵条件不变,研究了诱导物柚皮粉的加入量对黑曲霉固态发酵产柚苷酶的影响,结果如图4所示.从图4可以看出,黑曲霉固态发酵产柚苷酶过程中,培养基中诱导物柚皮粉的加入量对柚苷酶产生有重要的影响,当柚皮粉的加入量为2.0g时,黑曲霉产柚苷酶酶活力最高,达到1146.3U/g.可能是柚苷酶作为一种诱导酶,柚皮粉中的柚皮苷是其作用底物,一定量柚皮粉的加入不仅可以诱导黑曲霉产柚苷酶,而且可以作为黑曲霉生长的碳源,提高产柚苷酶的能力.但是,当柚皮粉加入量过多时,导致麸皮加入量过少不利于固体培养基的透气,从而影响菌体的生长;而柚皮粉加入量过少时,导致麸皮加入量过多,麸皮中易被黑曲霉利用的碳源含量较低,也不利于菌体生长.因此,选择柚皮粉加入量为2.0g时,黑曲霉固态发酵产柚苷酶的效果最优.
2.5 最佳培养基的筛选
在以上单因素实验的基础上,设计了L9(34)正交试验因素水平表,考察黑曲霉固态发酵产柚苷酶的最佳条件,正交试验因素与水平如表1所示,正交试验结果与分析如表2所示.由表2可以看出,对黑曲霉产柚苷酶酶活的影响由极差大小确定:D>A>B>C,即对固态发酵产柚苷酶酶活影响大小的因素依次为:柚皮粉的加入量>固液比>氮源(NH4)2SO4加入量>无机盐MgSO4加入量.因此,培养基的最优因素水平组合为:A2B2C3D2,即培养基固液比为1∶2.5,(NH4)2SO4加入量为0.5g,MgSO4加入量为0.03g,柚皮粉的加入量为2.0g.
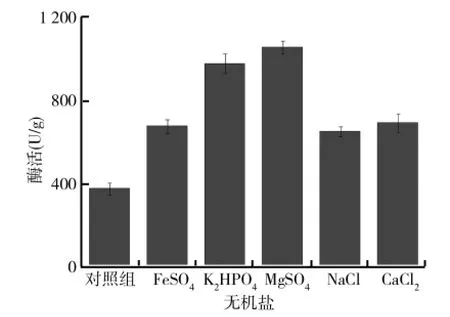
图3 不同无机盐对黑曲霉产柚苷酶的影响
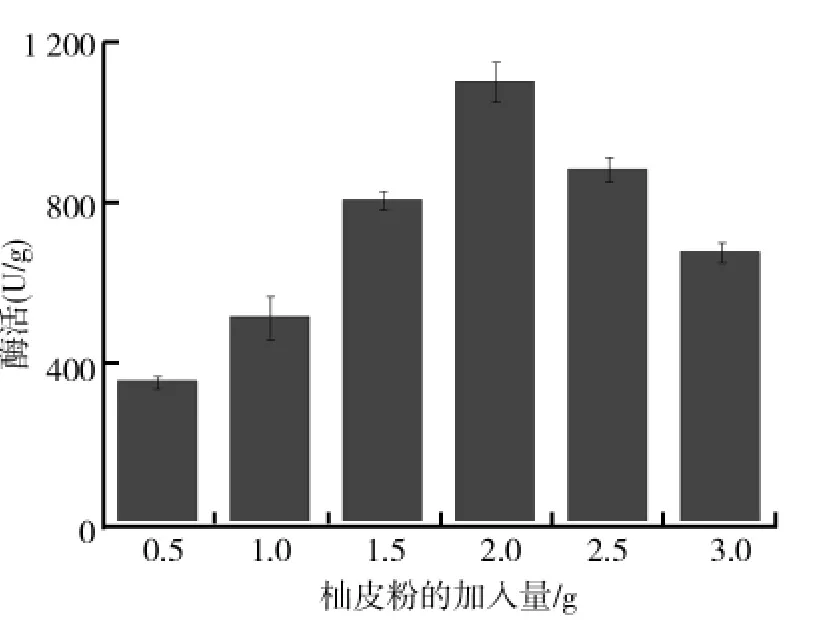
图4 柚皮粉的加入量对黑曲霉固态发酵产柚苷酶的影响
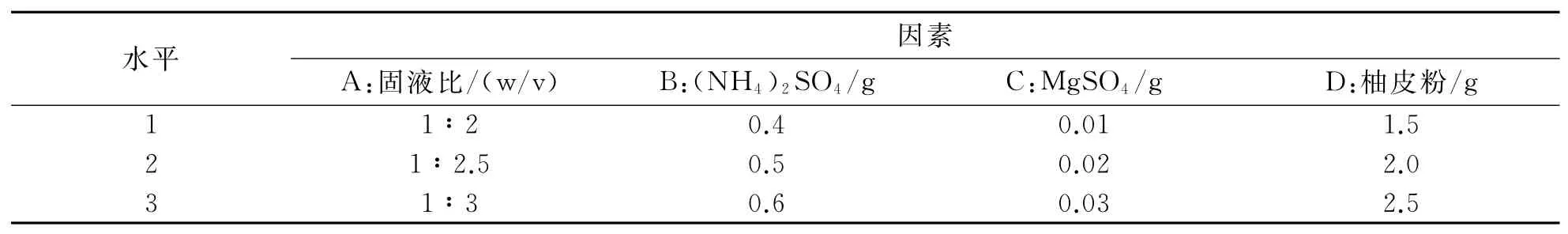
表1 正交试验因素水平表
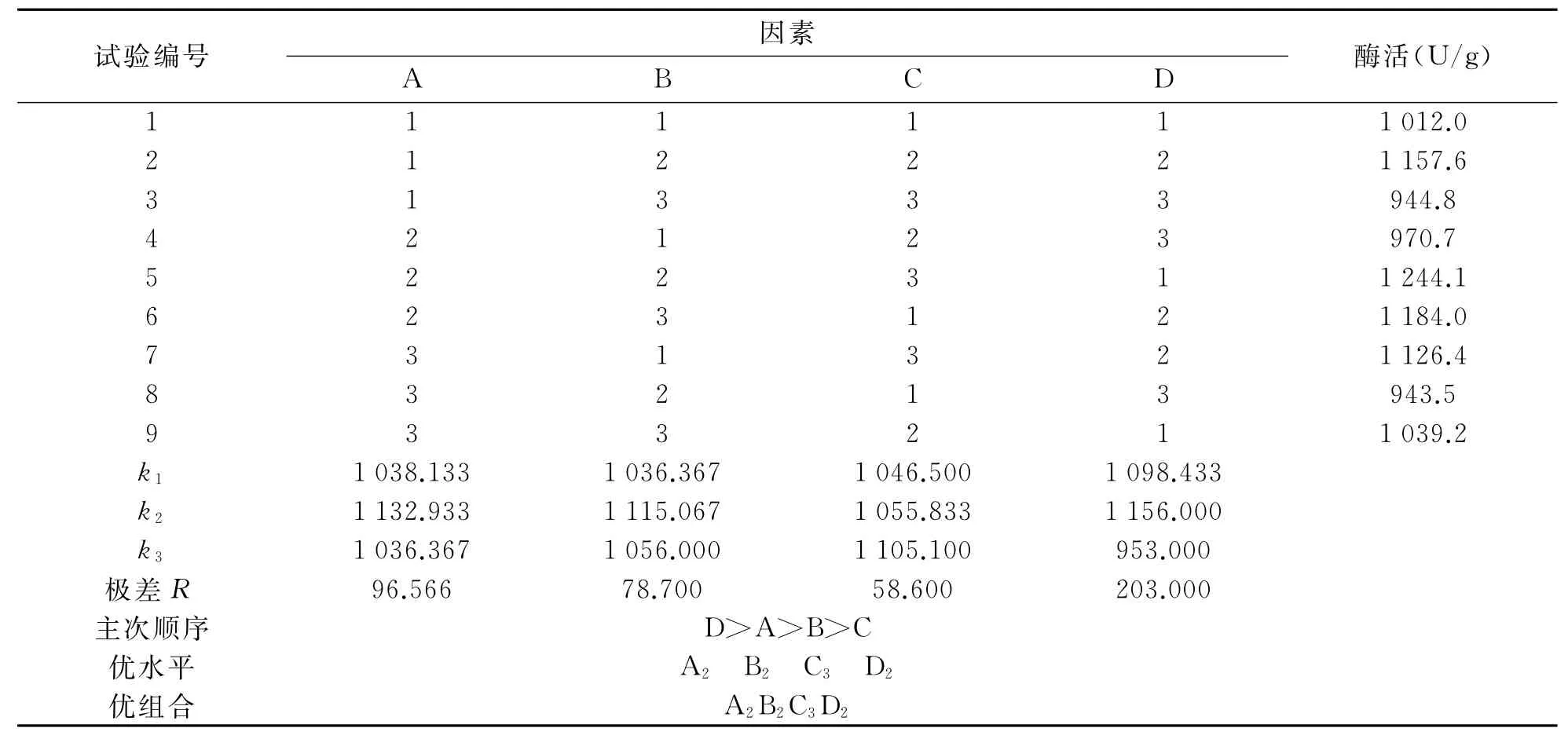
表2 试验结果分析
2.6 固态发酵产酶曲线
采用上述优化的固态培养基进行黑曲霉固态发酵产柚苷酶的研究,测定不同发酵时间黑曲霉产柚苷酶的酶活,得到了黑曲霉固态发酵产酶曲线,结果如图5所示.从图5可以看出,黑曲霉固态发酵产柚苷酶在发酵开始阶段随着菌体的不断生长,柚苷酶酶活不断增加,在144h达到最高,且最高酶活为1248.0U/g.达到最高酶活之后,随着发酵过程中营养物质的消耗及代谢产物的积累,菌体生长受到抑制以及部分酶被降解,导致了柚苷酶酶活性的下降.
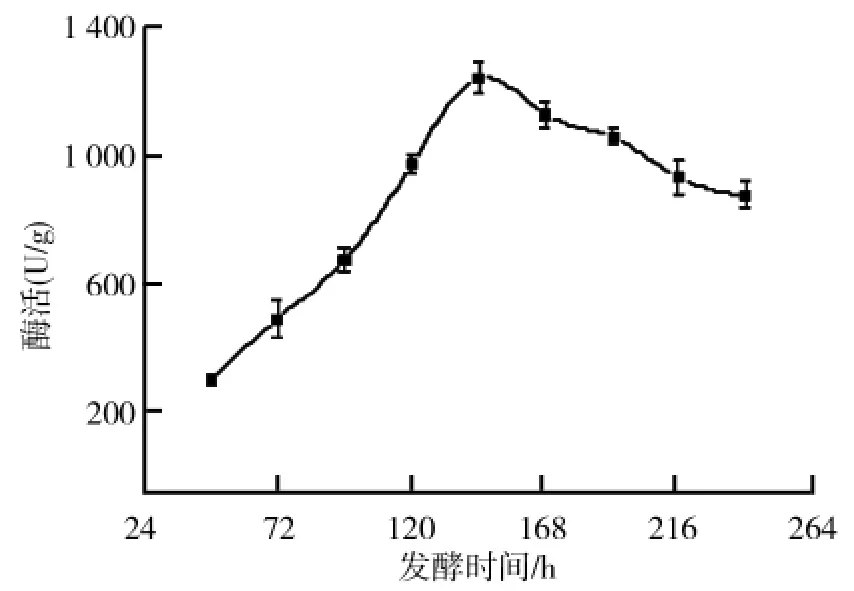
图5 黑曲霉固态发酵产酶曲线
3 结论
实验以固态基础培养基为发酵初始培养基,采用黑曲霉固态发酵法生产柚苷酶.首先,通过单因素实验确定了影响黑曲霉固态发酵产柚苷酶的主要培养基组成.再通过正交试验初步确定了黑曲霉固态发酵产柚苷酶最优培养基组成为:在500mL三角瓶中,麸皮与柚皮粉的加入总质量为5.5g,其中,柚皮粉的加入量为2.0g,培养基固液比为1∶2.5,(NH4)2SO4加入量为0.5g,MgSO4加入量为0.03g.通过优化后的培养基进行固态产柚苷酶发酵曲线的研究,在发酵144h时酶活达到最大为1248.0U/g,比优化前的基础培养基(377.6U/g)提高了2.3倍.该结果为工业固态发酵产柚苷酶提供了依据.
参考文献:
[1] M Ono,T Tosa,I Chibata.Preparation and properties of immobilized naringinase using tannin aminohexyl cellulose[J].Agricultural and Biological Chemistry,1978,42(10):1 847-1 851.
[2] M Puri,U C Banerjee.Production,purification and characterization of the debittering enzyme naringinase[J].Biotechnology Advances,2000,18(3):207-217.
[3] 白卫东,刘晓艳.柑桔汁脱苦方法研究进展[J].食品工业科技,2006,27(9):202-206.
[4] Gulten,Sekeroglu.Immobilization and characterization of naringinase for the hydrolysis of naringin[J].European Food Research and Technology,2006,224(1):55-60.
[5] D Norouzian,A Hosseinzadeh,D N Inanlou,et al.Production and partial purification of naringinase by penicillium decumbens PTCC 5248[J].World J Microbiol Biotechnol,2000,16(5):471-473.
[6] 张晨,刘志伟,郑彦彤.产柚苷酶菌株B04的分离及产酶特性研究[J].工业微生物,2007,37(5):38-41.
[7] 张红城,董捷,李春阳,等.β-葡萄糖苷酶酶解蜂胶黄酮苷的研究[J].食品科学,2008,29(11):332-336.
[8] 王鸿飞,李和生,董明敏,等.柚皮苷酶对柑橘类果汁脱苦效果的研究[J].农业工程学报,2005,20(6):174-177.
[9] A Pandey,P Selvakumar,C R Soccol,et al.Solid state fermentation for the production of industrial enzymes[J].Current Science,1999,77(1):149-163.
[10]蒋树海,孙君社,卢华,等.Aspergillus niger S-05产柚苷酶液态发酵条件的优化[J].食品研究与开发,2009,30(3):13-17.
[11]陈红,倪辉,李利君,等.棘孢曲霉固态发酵柚皮产柚苷酶及其在柑橘果汁脱苦中的应用[J].菌物学报,2013,32(6):1 034-1 045.
[12]王仪明,张宗舟,蔺海明,等.绿色木霉固态发酵产纤维素酶活力的研究[J].草业科学,2009,26(5):123-127.
[13]金伟,聂光军,王丽,等.黑曲霉固态发酵生产单宁酶的条件优化[J].生物加工过程,2013,11(3):7-12.
[14]陈华根,倪辉,李利君,等.黑曲霉α-鼠李糖苷酶高产菌株的选育[J].微生物学通报,2009,36(7):1 008-1 012.
[15]钟世安,李维先.分光光度法测定柚皮中黄酮类化合物[J].光谱实验室,2007,24(4):597-601.
Medium optimization of naringinase production by Aspergillus niger in solid state fermentation
QIAN Wei1,HUANG Yuan-jie1,WANG Xian-feng1,GAO Qian-kun1,MENG Na1,2,WEI Sheng-hua1,2*
(1.College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China;2.Anhui Engineering Technology Research Center of Microbial Fermentation,Anhui Polytechnic University,Wuhu 241000,China)
Abstract:Naringinase was produced by solid fermentation of Aspergillus niger and the fermentation medium was optimized by single factor experiments and orthogonal test as follows:in 500mL erlenmeyer flask,total 5.5g of bran and pomelo peel powder was used,the amount of pomelo peel powder was 2.0g,the ratio of solid and liquid was 1∶2.5,0.5g of ammonium sulphate was used as the best nitrogen source,and 0.03g of magnesium sulphate was used as the best inorganic salt.Under the optimized conditions,the fermentation activity of naringinase reached maximum 1248.0U/g at 144h,which increased by 230%compared with the initial level(377.6U/g).
Key words:Aspergillus niger;naringinase;solid-state fermentation;optimization of the fermentation medium
基金项目:国家级大学生创新创业训练计划基金资助项目(201310363075)
作者简介:钱 伟(1989-),男,安徽无为人,硕士研究生.
收稿日期:2016-01-10
文章编号:1672-2477(2016)01-0016-05
中图分类号:Q815
文献标识码:A
