巨紫荆花瓣内含物及保鲜剂对切枝生理代谢的影响1)
2016-05-06罗永亚邱娜菲王瑞琪魏子涵陈茜陈颖
罗永亚 邱娜菲 王瑞琪 魏子涵 陈茜 陈颖
(南京林业大学南方现代林业协同创新中心,南京,210037)
巨紫荆花瓣内含物及保鲜剂对切枝生理代谢的影响1)
罗永亚邱娜菲王瑞琪魏子涵陈茜陈颖
(南京林业大学南方现代林业协同创新中心,南京,210037)
摘要以巨紫荆为试验材料,研究其开花过程中花瓣内含物的变化及蔗糖等保鲜剂对花瓣抗氧化性的影响。结果表明:初生代谢物可溶性蛋白质及可溶性糖质量分数均呈先升后降的趋势,且均在盛花期为最大值,可溶性淀粉质量分数在初花期显著增加;次生代谢物类黄酮质量分数呈上升趋势,而花色素苷质量分数在盛花期为最大值。说明在生长发育阶段(花蕾期至盛花期)主要积累初生代谢物用于生长需要,衰老阶段(盛花期至凋花后期)主要积累次生代谢物有利于延缓衰老。不同保鲜剂处理对花瓣生长没有显著差异(p<0.05);两个蔗糖和50 mg·L(-1)6-BA处理均增加了SOD活性,但与对照相比不存在显著差异(p<0.05),MDA质量摩尔浓度呈下降趋势,MDA质量摩尔浓度与SOD活性呈负相关性;2%蔗糖能够显著提高CAT活性,与对照相比增加了86.0%,POD活性与CAT活性互为补充。总之,抗氧化酶(SOD、POD、CAT)之间协调作用共同清除活性氧(ROS),延缓衰老;巨紫荆内含物形成的最佳时期是盛花期;保鲜剂2%蔗糖处理巨紫荆切枝,花瓣直径大,花径较长,花瓣内的保护酶活性增强,对延缓巨紫荆花期效果最有效。
关键词巨紫荆;花期;花瓣内含物;保鲜剂;抗氧化酶
分类号Q946.92
Petals Composition and Effect of Antistaling Agents on Metabolism of Cutting Branches inCercisgigantean
Luo Yongya, Qiu Nafei, Wang Ruiqi, Wei Zihan, Chen Qian, Chen Ying
(Co-innovation Center for the Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, P. R. China)//Journal of Northeast Forestry University,2016,44(3):77-81.
We investigated the change of petals composition and different antistaling agents on oxidation resistance of cuttings inCercisgigantea. The content of soluble protein and sugar increased at first then decreased, and reached maximum at full bloom period. Soluble starch content increased significantly at early flowering period. The content of flavonoids increased gradually in whole flowering period, while the flower pigment content reached peak point at full bloom period. The accumulation of primary metabolites was beneficial to the petals growth, on the other hand the accumulation of secondary metabolites was useful for flower development and could delay the flower senescence. The growth of petals had no significant difference between treatments when the cutting branches were immersed indifferent antistaling agent solutions. The SOD enzyme activity and MDA content showed a negative correlation. The SOD enzyme activity increased under two sugar concentration and 50 mg·L-16-BA treatments, but there was no significant difference compared to the control. While the content of MDA was declined under these treatments. The CAT activity was singnificantly improved, and increased by 86.0% compared to the control at 2% sucrose treatment. The POD activity increased signifficantly under 50 mg·L-16-BA treatment. The changes of petals composition were mainly accumulated at full bloom period, and the best antistaling agent was 2% sucrose treatment.
KeywordsCercis gigantean; Flowering phase; Petal inclusion; Antistaling agent; Antioxidant enzymes
巨紫荆(Cercisgigantea)属豆科苏木亚科植物,与普通紫荆相比,因其巨大而得名,胸径可达40 cm、高达15 m。是我国的乡土树种,具有栽培历史长、花量资源丰富、速生、寿命长等特点。据《中药大辞典》[1]记载,紫荆花具有清热凉血、去风解毒的功效。
花瓣内含物使植物花瓣具有不同的颜色、气味及分泌物等。初生代谢物可溶性蛋白、可溶性糖质量分数在不同植物中存在差异,袁祖丽等[2]发现5个不同品种樱桃花瓣中可溶性固形物种间及种内均存在差异,牡丹花可溶性糖质量分数在盛花期达最大值[3]。次生代谢物黄酮类物质广泛存在植物中,研究表明,广玉兰花中总黄酮质量分数明显高于叶片[4],花青素是一种广泛存在于植物中的天然色素,花色与花瓣类黄酮[5]质量分数的高低关系密切。内含物之间存在相关性,聂庆娟等[6]研究表明,美国红栌红色叶片中的可溶性糖和蛋白质质量分数高于其他颜色的叶片,黄酮类化合物与花色素苷之间显著相关[7-8]。花色素还具有清除活性氧(ROS)、减缓花瓣衰老等作用[9],因此,研究花瓣内含物对植物花期的应用具有重要意义。近年来,园艺上的切花保鲜日益受到欢迎[10],保鲜剂中蔗糖是较为理想的碳水化合物,适宜浓度的蔗糖可以减少花瓣中可溶性糖的降低[11],6-苄基嘌呤(6-BA)能降低细胞水分亏缺、减小膜透性等,适量的6-BA有利于百合保鲜[12]。目前,切花保鲜主要集中在草本或小灌木上,如百合、菊花、月季等,而灌木及高大乔木研究较少,大量研究表明,木本植物切枝保鲜时间较短,2 000 mg·L-1维生素处理8 d有利于腊梅切花观赏[13],200 mg·L-18-HQ、1.0%蔗糖、15.0%蛇床子3个处理均有利于栀子花的保鲜,但最佳保鲜期也仅为8d[14],偏酸保鲜剂(pH值5.5)处理10 d利于红花碧桃离体花枝保鲜[15]。而有关巨紫荆花内含物及切枝保鲜的研究未见报道。本研究以南京林业大学校园内巨紫荆为研究材料,对不同花期花瓣的内含物进行测定;另外,利用蔗糖等保鲜剂对巨紫荆初花期(3月26日)花枝进行保鲜处理,测定其花瓣抗氧化性,研究巨紫荆花瓣不同花期内含物的变化情况及不同保鲜剂对花瓣抗氧能力的影响,为巨紫荆花的开发利用提供一定的理论和实践基础。
1材料与方法
供试材料为巨紫荆,于2014年3月下旬到4月上旬采自南京林业大学校园内,选取3棵生长环境相同、长势一致、无病虫害、花蕾数相近的巨紫荆,在离地面5 m的高度处用高枝剪取下长势相似的花枝,将开花的不同时期分别命名为花蕾期(3月23日)、初花期(3月26日)、盛花前期(3月29日)、盛花期(4月1日)、盛花后期(4月4日)、凋花前期(4月7日)、凋花后期(4月10日)。于每个时期分别摘取枝条上开放程度一致、无病虫害、长势一致的巨紫荆花朵放入冰盒并带回实验室,将花瓣小心掰下并称质量,一部分烘干测其含水量,一部分直接放于冰箱-70 ℃保存备用。
取初花期(3月26日)的巨紫荆花枝,切枝长度(约40 cm)和基部粗度(约1 cm)一致,并用保鲜膜包裹基部带回实验室,分别在蒸馏水(CK)、2%蔗糖(T1)、3%蔗糖(T2)、50 mg·L-16-BA(细胞分裂素)(T3)、100 mg·L-16-BA(T4)、2%蔗糖+50 mg·L-16-BA混合液(T5)中离体培养,切枝吸水端浸入液面高15 cm的插瓶(1 000 mL插瓶内放600 mL保鲜剂溶液)中,每瓶5枝枝条,实验室培养温度(20±5)℃,散射光下进行,相对湿度约75%,每天换一次保鲜液,保鲜剂处理6 d后(4月1日)取样,统一取离顶端5~15 cm的花瓣,待测量花瓣的花茎长和花瓣长后置于冰箱中-70 ℃保存,用于生理指标的测定。
生理指标的测定:含水量,可溶性蛋白、可溶性糖、可溶性淀粉质量分数测定参照李合生[16]的方法;花色素苷、类黄酮质量分数的测定采用紫外吸收法;超氧化物酶(SOD)活性采用淡蓝四唑(NBT)比色法测定[17];过氧化物酶(POD)活性采用愈创木酚法测定[18]72-73;过氧化氢酶(CAT)活性参照陈建勋[18]72-73的方法测定;丙二醛(MDA)质量摩尔浓度的测定采用硫代巴比妥法[18]74;保鲜剂处理6 d后对每个花枝上花瓣的长度及花径进行测定。
数据处理:试验设置3次重复,取其平均值。采用Excel 2013对数据进行处理,通过SPSS19.0软件进行差异显著性分析(Duncan检验)。
2结果与分析
2.1巨紫荆开花的特性
通过2014年3月下旬到4月上旬连续观察发现巨紫荆的花期大约为20 d,在3月20日出现花芽,3月23日形成明显的花蕾,3月26日整个枝条有10%花开放为初花期,3月29日30%花开放为盛花前期,4月1日60%花开放为盛花期,4月4日90%花开放为盛花后期,此时花瓣大而艳丽,达最大花径,形成明显的假蝶型花冠,4月7日30%花出现衰老症状,花瓣失去紧张度形成凋花早期,4月11日80%花明显衰老,花瓣出现脱落、萎焉卷缩等症状,失去观赏价值形成凋花后期(图1)。
2.2巨紫荆不同花期花瓣内含物的变化
随着巨紫荆花的开放,花瓣内的含水量呈缓慢上升的趋势,在花接近凋谢时含水量略微下降,在盛花期(4月1日)明显增加(表1)。可溶性蛋白质量分数呈现先升后降的趋势,在盛花期(4月1日)达最大值,与其他时期相比增加显著,到凋花后期(4月10日)因为花瓣生活力降低,可溶性蛋白质量分数明显降低(p<0.05)(表1)。随着巨紫荆花的开放,可溶性糖质量分数也呈现先上升后下降的趋势,初花期(3月26日)出现显著增加,在盛花期(4月1日)可溶性糖质量分数达到最大值,与花蕾期(3月23)相比增加110.2%,从凋花前期(4月7日)显著下降,到凋花后期(4月10日)为最小值(表1)。可溶性淀粉质量分数变化与可溶性糖质量分数变化不同,只在初花期(3月26日)质量分数最高,从盛花期(4月1日)开始下降,到凋花期和凋花后期(4月7日—4月10日)下降幅度加大(p<0.05)(表1)。

A.花蕾期;B.初花期;C.盛花期;D.凋花期。

花期含水量/%可溶性蛋白质量分数/μg·g-1可溶性糖质量分数/mg·g-1可溶性淀粉质量分数/μg·g-1类黄酮质量分数/mg·g-1花色素苷质量分数/mg·g-13月23日(66.99±0.45)d(224.02±10.04)c(0.78±0.08d (331.04±25.14)bc(2.34±0.06)c(27.61±4.02)bcd3月26日(76.96±1.95)c(228.21±15.63)c(1.09±0.06)c(566.25±31.13)a(2.28±0.06)c(28.65±3.42)bcd3月29日(84.35±0.19)b(320.01±46.51)b(1.42±0.08)ab(366.21±20.20)b(2.28±0.06)c(44.97±3.33)a4月1日(87.48±0.21)a(397.57±31.86)a(1.64±0.02)a(303.86±14.75)cd(2.62±0.22)bc(22.93±1.80)d4月4日(88.08±0.51)a(394.28±28.14)a(1.55±0.03)a(295.09±33.41)cd(2.84±0.41)b(26.20±6.80)cd4月7日(85.86±0.25)ab(351.66±11.77)b(1.11±0.03)c(221.11±18.40)d(3.57±0.12)a(35.32±5.28)abc4月10日(84.15±0.93)b(260.40±23.09)c(0.62±0.02)e(264.23±46.04)de(3.63±0.08)a(37.41±5.15)ab
注:表中数据根据鲜质量测得;数据为平均值±标准差;表中同列数字后不同字母表示差异显著(p<0.05)。
黄酮化合物是紫荆花中的一个重要成分,从表1中类黄酮质量分数可以看出,巨紫荆花初期类黄酮质量分数较少,而随着开花时间的延长,类黄酮质量分数不断积累,到盛花期(4月1日)出现显著增加,在凋花后期(4月10日)质量分数达到最大值(3.63 mg·g-1)(p<0.05)。花色素苷质量分数及种类直接影响着花瓣的颜色,即将进入盛花前期(3月29日)时,巨紫荆花瓣的花色素苷质量分数达到最大值,而在盛花期(4月1日)显著降低,其质量分数比盛花前期(3月29号)下降49.0%,盛花后期(4月4日)又开始有所增加(表1)。
2.3保鲜剂对巨紫荆切枝花生理代谢的影响
2.3.1保鲜剂对巨紫荆花长及花径的影响
经不同保鲜剂处理的巨紫荆花枝,其花瓣及花径长度出现差异。从表2中可以看出,保鲜剂处理都能增加花瓣和花径长度,经2%蔗糖(T1)和50 mg·L-16-BA(T3)处理的花瓣长度和花茎增加显著,其中花瓣长比对照分别增加59.5%和53.5%(表2),花径长比对照分别提高72.6%和62.3%(表2),可以看出,2%蔗糖和50 mg·L-16-BA对巨紫荆花瓣处理效果最好(p<0.05)。
2.3.2保鲜剂处理对巨紫荆花瓣抗氧化酶活性的影响
经不同保鲜剂处理下,巨紫荆花瓣的抗氧化酶产生不同的反应,经两个蔗糖(T1、T2)和50 mg·L-16-BA(T3)处理都增加了SOD活性,但与对照相比没有明显差异;经100 mg·L-16-BA(T4)和2%蔗糖+50 mg·L-16-BA混合液(T5)处理的SOD活性均低于对照,与对照相比分别下降51.5%、46.3%,这可能是由于蔗糖和细胞分裂素两者混合浓度不太适宜造成的(表2)。
经不同保鲜剂处理都能够促进巨紫荆花枝花瓣POD酶活性,特别是经50 mg·L-16-BA(T3)和2%蔗糖+50 mg·L-16-BA(T5)处理的增加显著,分别是对照的3.98倍和2.98倍,而经蔗糖处理的POD活性尽管也增加但没有经50 mg·L-16-BA(T3)处理的明显,100 mg·L-16-BA(T4)对POD活性影响也不及经50 mg·L-16-BA(T3)处理的,说明适宜质量浓度6-BA会显著提高巨紫荆花瓣中POD活性(表2)。
不同保鲜剂处理后巨紫荆花瓣中的CAT活性变化与POD活性不同,经2%蔗糖(T1)处理的能够显著提高CAT的活性,与对照相比增加86.0%,经3%蔗糖(T2)处理的与对照没有显著差异,而经T3、T4、T5处理的CAT活性都高于对照,但与对照没有明显的差异(p>0.05)(表2)。
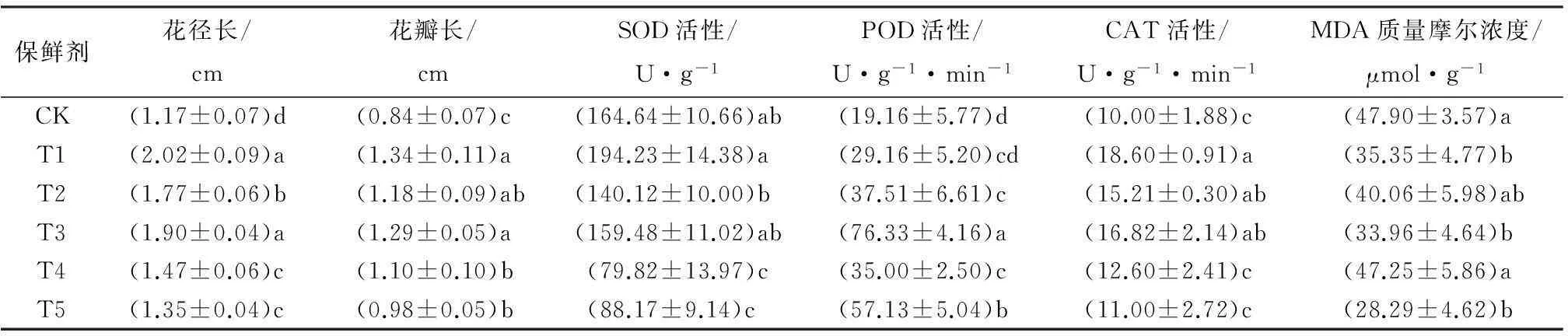
表2 不同保鲜剂对巨紫荆花茎长、花瓣长及抗氧化酶活性的影响
注:表中数据根据鲜质量测得;数据为平均值±标准差;表中同列数字后不同字母表示差异显著(p<0.05)。
从表2中可以看出,经2%蔗糖(T1)处理的MDA质量摩尔浓度与对照组相比显著下降,而经此处理的SOD、CAT酶活性都处于最高水平,说明2%蔗糖能够提高抗氧化酶活性,降低膜质过氧化水平,减轻氧化胁迫,有利于巨紫荆花的保鲜,延缓花瓣衰老。
3结论与讨论
植物花瓣内含物的研究对花瓣内含物的开发利用具有重要的意义。本研究中可溶性蛋白与可溶性糖在不同花期均表现先升高后降低的趋势,都在盛花期(4月1日)质量分数达最高,表明此时期是二者积累的最佳时期,与史国安等[19]研究基本吻合,而可溶性淀粉可以被分解为可溶性糖,所以二者在花瓣内的质量分数整体出现互补的现象。花瓣内类黄酮质量分数在不同花期存在差异[20-21],本研究中前期(花蕾期至盛花期)类黄酮化合物积累量很少,而后期(盛花后期至凋花后期)类黄酮化合物积累急剧增加,表明巨紫荆开花后期是提取利用类黄酮物质的最佳时期。花色素苷对决定花瓣的颜色起着重要的作用,Deguchi et al.[22]研究表明,黄酮合酶Ⅱ影响大丽花颜色的形成;Ono et al.[23]研究结香花、海桐花及紫藤花在盛花期花色素积累明显,文中研究表明,在盛花前期(3月29)花色素苷显著增加随后又急剧下降,在衰败期(凋花前期至凋花后期)增加量少,说明在盛花前期花色素苷的大量积累主要使花瓣呈深紫色,而衰败期花色素苷用于清除ROS延缓细胞衰老。巨紫荆花瓣内各种内含物变化有一定的联系,在生长发育阶段(花蕾期和初花期)需要大量的营养物质促进生长发育,可溶性蛋白质、可溶性糖、类黄酮物质及花色苷积累量均较少,只有可溶性淀粉质量分数较高;盛花阶段(盛花前期、盛花期及盛花后期)除可溶性淀粉和类黄酮积累较少外,其余内含物均达最大值,说明此阶段是巨紫荆花瓣内含物积累的最佳时期;在衰老阶段(盛花后期至凋花后期)除了类黄酮(清除ROS)积累大量增加外,其余各内含物均较少,是因为在衰老阶段大量内含物不断被分解。通过对巨紫荆不同花期内含物的测定分析可知,盛花期是内含物形成的最佳时期。
保鲜剂作为延长花期的重要手段,对现代园艺上切花保鲜具有重要的意义。Hashemabadi et al.[24]研究8-羟基硫酸喹啉(8-HQS)能延长玫瑰切花保鲜寿命,一定量的乙烯对切花保存有利[25];Lv et al.[26]研究腊梅花存在天然保护剂;Yoon et al.[27]研究抗氧化剂能减少玉兰花衰老。蔗糖和6-BA是切花常用的保鲜剂,李敏等[28]研究表明,8-HQ和蔗糖预处理延长‘索邦’百合切花寿命,提高切花鲜质量,15 g·L-1蔗糖瓶插液能有效延长月季切花寿命[29]。本研究中保鲜剂对巨紫荆切枝有促进作用,保鲜剂处理6d后(4月1日),巨紫荆花的长势如花色、花朵直径、花朵开放速率、花瓣长度、花径长度等都优于外界盛花期(4月1日)巨紫荆的花,但试验处理9 d后(4月4日),经保鲜剂处理的巨紫荆长势开始比外界盛花后期(4月4日)差,这可能是由于紫荆切枝是硬木结构,切枝离体时间过长,木质部导管吸水力下降;另外室温下,没有重新剪切吸水切口,可能会有微生物分泌物堵塞导管,造成吸水状态不佳,花瓣由于失水大于吸水而出现萎蔫。因此,其室内外的差异可能是由多因子造成的,如木质化严重、导管切口堵塞、微生物分泌物等,这说明在短时间(≤6 d)内保鲜剂利于巨紫荆花的保鲜,但长时间(≥9 d)则保鲜效果降低,这主要是受木本植物枝条木质化程度高的影响。尽管如此,在6 d内,各保鲜剂处理的花瓣和花径长度均比对照有所增加,如2%蔗糖处理的花瓣长和花径长分别比对照增加了59.5%和72.6%,说明这些保鲜剂能促进巨紫荆开花;SOD酶活性除了2%蔗糖处理升高外,其余的处理均下降,这与MDA质量摩尔浓度变化存在一定的联系,说明SOD能够清除ROS防止细胞膜过氧化;50 mg·L-16-BA处理显著地提高了POD酶的活性,与2%的蔗糖处理存在显著的差异,这可能是由于6-BA处理主要是刺激了花细胞的分裂,而糖的作用首先是提供能量所致,也即糖和6-BA延缓植物衰老的机制不同;另外,本研究中6-BA与蔗糖的混合处理并没有显著提高巨紫荆花瓣的抗氧化性,这可能是由于质量浓度配合不适宜引起的。通过几种抗氧化酶的分析及花瓣生长情况的测定可以看出,2%蔗糖最有利于巨紫荆的切花保鲜,50 mg·L-16-BA次之。
参考文献
[1]江苏新医院.中药大辞典[M].上海:上海科学技术出版社,1997:2364.
[2]袁祖丽,李华鑫,孙晓楠,等.不同樱桃品种花和果实性状及其内含物含量的比较研究[J].河南农业大学学报,2008,42(6):618-620.
[3]刘帅,丰震,徐艳,等.牡丹不同品种花期差异的生理机理研究[J].北方园艺,2012(3):67-71.
[4]蒋新龙.广玉兰叶、花总黄酮提取方法与含量比较[J].浙江农业科学,2010(3):649-664.
[5]MISHIO T, TAKEDA K, IWASHINA T. Anthocyanins and other flavonoids as flower pigments from elevenCentaureaspecies[J]. Natural Product Communications,2015,10(3):447-450.
[6]聂庆娟,史宝胜,孟朝,等.不同叶色红栌叶片中色素含量、酶活性及内含物差异的研究[J].植物研究,2008,28(5):600-602.
[7]UEMATSU C, KATAYAMA H, MAKINO I, et al. Peace, a MYB-like transcription factor, regulates petal pigmentation in flowering peach ‘Genpei’ bearing variegated and fully pigmented flowers[J]. Journal of Experimental Botany,2014,65(4):1082-1094.
[8]MORITA Y, TAKAGI K, FUKUCHI-MIZUTANI M, et al. A chalconeisomerase-like protein enhances flavonoid production and flower pigmentation[J]. The Plant Journal,2014,78(2):294-304.
[9]周丹蓉,方智振,廖汝玉,等.李果皮花色素苷、类黄酮和类胡萝卜素含量及抗氧化性研究[J].营养学报,2013,35(6):571-576.
[10]LIM J H, SHIM M S, SEO J Y, et al. Conjoint analysis of the korean floriculture market for the main cut flowers to predict the demand for floriculture plants[J]. Journal Korean Journal of Horticultural Science & Technology,2014,3(4):5-6.
[11]张延恒,钱丽华,傅巧娟.月季切花采后生理及保鲜技术研究进展[J].浙江农业科学,2001,1(6):295-298.
[12]蒋倩.6-BA对百合切花保鲜效果的影响[J].甘肃科技,2009,25(11):148-150.
[13]章志红,朱凤娟.不同保鲜剂对素心腊梅切花品质的影响[J].安徽农业科学,2011,39(15):9110-9111.
[14]夏晶晖,李振东.不同保鲜剂对栀子花保鲜的影响[J].安徽农业科学,2008,36(31):13842-13843.
[15]倪林箭,张斌斌,蔡志翔,等.不同酸度保鲜剂对红花碧桃离体枝条花瓣生理特性的影响[J].江西农业学报,2012,24(5):56-58.
[16]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:167-169.
[17]郝建军,康宗利,于洋.植物生理学实验技术[M],北京:化学工业出版社,2007.
[18]陈建勋,王小峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006.
[19]史国安,郭香凤,张国海,等.牡丹开花和衰老期间花瓣糖代谢的研究[J].园艺学报,2009,36(8):1184-1190.
[20]GOUVEIA-FIGUEIRA S C, CASTILHO P C. Phenolic screening by HPLC-DAD-ESI/MSn and antioxidant capacity of leaves, flowers and berries ofRubusgrandifoliusLowe[J]. Industrial Crops and Products,2015,73:28-40.
[21]JIANG H L, WANG R, LI J Y, et al. A new highly oxygenated daphnane diterpene esters from the flower buds of Daph-ne genkwa[J]. Natural product research,2015,29(20):1878-1883.
[22]DEGUCHI A, TATSUZAWA F, HOSOKAWA M, et al. Tobacco streak virus (strain dahlia) suppresses post-transcriptional gene silencing of flavone synthase II in black dahlia cultivars and causes a drastic flower color change[J]. Planta,2015,242(3):663-675.
[23]ONO M, IWASHINA T. Quantitative flavonoid variation accompanied by change of flower colors inEdgeworthiachrysantha,PittosporumtobiraandWisteriafloribunda[J]. Natural Product Communications,2015,10(3):413-416.
[24]HASHEMABADI D, TORKASHVAND A M, KAVIANI B, et al. Effect ofMenthapulegiumextract and 8-hydroxyquinoline sulphate to extend the quality and vase life of rose (Rosahybrid) cut flower[J]. Journal of Environmental Biology,2015,36(1):215-220.
[25]SCARIOT V, PARADISO R, ROGERS H, et al. Ethylene control in cut flowers: classical and innovative approaches[J]. Postharvest Biology and Technology,2014,97:83-92.
[26]LV J S, ZHANG L L, CHU X Z, et al. Chemical composition, antioxidant and antimicrobial activity of the extracts of the flowers of the Chinese plantChimonanthuspraecox[J]. Natural Product Research,2012,26(14):1363-1367.
[27]YOON H. Effects of aging on the phenolic content and antioxidant activities of magnolia (Magnoliadenudata) flower extracts[J]. Food Science and Biotechnology,2014,23(5):1715-1718.
[28]李敏,耿兴敏,刘俊.ABA和蔗糖预处理对‘索邦’百合切花保鲜效果影响[J].林业科技开发,2012,26(2):41-44.
[29]张林青.蔗糖对切花月季保鲜效果的影响[J].北方园艺,2013(4):146-148.
收稿日期:2015年9月26日。
第一作者简介:罗永亚,女,1990年7月生,南京林业大学南方现代林业协同创新中心、南京林业大学生物与环境学院,硕士研究生。E-mail:2322652130@qq.com。通信作者:陈颖,南京林业大学南方现代林业协同创新中心、南京林业大学生物与环境学院,副教授。E-mail:chynjfu@163.com。
1)国家林业局“948”项目(2014-4-61)、“十二五”国家科技支撑计划项目(2012BAD21B05)、江苏省高校优势学科建设工程资助项目(PAPD)。
责任编辑:任俐。
