籼稻93-11辐射诱变突变体库的创建及其筛选
2016-04-29龙湍安保光李新鹏张维李京琳杨瑶华曾翔吴永忠黄培劲
龙湍 安保光 李新鹏 张维 李京琳 杨瑶华 曾翔 吴永忠黄培劲
(1海南波莲水稻基因科技有限公司,海口 570125; 2海南神农大丰种业科技股份有限公司,海口 570125;*通讯联系人,E-mail:bolianrgt2015@aliyun.com)
籼稻93-11辐射诱变突变体库的创建及其筛选
龙湍1,2安保光1,2李新鹏1,2张维1,2李京琳1,2杨瑶华1,2曾翔1,2吴永忠1,2黄培劲1,2,*
(1海南波莲水稻基因科技有限公司,海口 570125;2海南神农大丰种业科技股份有限公司,海口 570125;*通讯联系人,E-mail:bolianrgt2015@aliyun.com)
龙湍, 安保光, 李新鹏, 等. 籼稻93-11辐射诱变突变体库的创建及其筛选. 中国水稻科学, 2016, 30(1): 44-52.
摘要:人工诱变突变体库是植物种质资源创新和基因组功能分析的有力工具。本研究以具有优异农艺性状且已完成基因组测序的籼稻常规品种93-11(O. sativa ssp. indica cv. 93-11)为材料,创建了一个包含3617个家系的辐射诱变突变体库。通过在M2和M3代各生育期的筛选,从该突变体库中获得308个表型稳定的突变体。这些突变体的表型可以分成15类,包括株高、分蘖数、株型、穗型、小穗结构、育性、叶色、叶型、抽穗期、苯达松抗性等,突变频率为0.03%~2.74%。使用反向遗传学策略,鉴定出了2个雄性不育突变体和2个苯达松敏感突变体中的基因突变位点。其中,2个雄性不育突变体的突变表型是由于CYP704B2分别在第3和第4外显子发生碱基替换和片段缺失造成的,而2个苯达松敏感突变体的突变表型是由于CYP81A6中第1和第2外显子分别缺失了一个7 bp和一个23 bp的片段造成的。4个突变体家系中野生型和突变体植株的分离比均符合3∶1,属单基因隐性突变。这一籼稻突变体库将有助于籼稻基因组的功能分析,并且为水稻遗传改良提供了有价值的材料。
关键词:籼稻; 辐射诱变; 突变体库; 雄性不育; 苯达松敏感
水稻(Oryzasativa)是世界上最重要的粮食作物之一,也是我国粮食生产和消费中占主导地位的口粮作物。同时,水稻还以其较小的基因组、高效的遗传转化体系、丰富的遗传资源以及与其他禾本科作物较高的基因组共线性被选为禾本科作物基因组研究的模式植物,并成为第一个完成基因组测序的农作物[1-3]。以粳稻品种日本晴(O.sativassp.japonicacv. Nipponbare)为参考,水稻基因组大小约为389 Mb,编码超过50,000个基因,其中蛋白编码基因超过39,000个[4-5]。译解水稻基因组编码的全部基因的功能不仅能阐明调控水稻生长发育的分子机制,也将为水稻的遗传改良提供理论基础。
突变体是承载和表达遗传变异的载体,通过创建突变体库可以对水稻基因组进行系统的功能分析。创建水稻突变体库的方法主要有插入突变以及物理和化学诱变两类。插入突变是利用T-DNA、Ac/Ds、En/Spm、Tos17、nDART/aDART等水稻内外源插入元件插入到基因组中,通过敲除或激活基因功能来创制突变体[6]。插入突变最大的优势在于插入元件的序列已知,可以便捷地通过分离和分析插入元件的侧翼序列来确定插入位点和突变基因。目前,国内外研究者已使用不同插入元件创建了多个水稻插入突变体库[7-13]。这些突变体库包含了约675,000个突变株系,从这些株系中76.9%的水稻蛋白编码基因可以通过检索侧翼序列找到相应突变体[14]。然而,由于插入突变体的产生一般要经过组织培养和转基因过程,现有主要插入突变体库都选择了粳稻品种建库。因为组织培养造成了大量体细胞变异,真正由插入元件造成的突变只占到5%~10%,这降低了后续基因鉴定工作的效率[6, 14]。此外,大部分插入突变体因包含外源转基因元件而涉及转基因品种商业化问题,无法直接用作育种材料。
物理诱变主要是用快中子、γ射线、离子束照射植物干种子诱导突变;化学诱变则是用甲基磺酸乙酯(EMS)、N-甲基-N-亚硝基脲(MNU)、双环氧丁烷(DEB)、叠氮化钠(SA)等化学试剂浸泡植物种子诱导突变。物理和化学诱变都能在植物基因组中产生单碱基突变、DNA片段插入缺失、染色体重排等变异。用物理和化学诱变创建水稻突变体库有两大优点:一是不需要转基因步骤,操作简便,不受籼粳基因型限制;二是能在基因组中造成随机分布的多个突变,只需较小的群体就能完成基因组饱和突变。过去,利用物理和化学诱变突变体鉴定基因需要用费时费力的图位克隆方法,极大限制了物理和化学诱变突变体的使用效率。但随着定向诱导基因组局部突变(TILLING)、MutMap、MutMap+等高通量基因型鉴定技术的出现,这一限制已被有效解除[15-18]。目前已有多家研究单位建立起了物理和化学诱变突变体库,并且突变体数量还在继续增长[6, 14-16, 19]。但总体而言理化诱变突变体数量依然远少于插入突变体,并且其中籼稻基因型的比例依然较低[14]。
在本研究中,我们使用了一个在我国具有广泛适应性且已完成基因组测序的优良籼稻品种93-11(O.sativassp.indicacv. 93-11)来产生辐射诱变突变体库[3]。通过对3617个突变家系的筛选共获得了308个表型稳定的突变体。我们进一步对其中的隐性核雄性不育突变体和苯达松敏感突变体进行了分子鉴定。该突变体库为水稻基因组的功能分析和遗传改良提供了有价值的籼稻突变体资源。
1材料与方法
1.1突变群体的产生和种植
2013年6月在湖南省农业科学院用钴60对10 kg 93-11(O.sativassp.indicacv. 93-11)干种子进行辐射,辐射剂量250 GY。辐射后的种子于2013年7月播种获得M1植株。M1分单株收种获得M2。每个M2家系种植50株,随机挑选6株分单株收种获得M3。所有诱变材料均按正常大田条件种植于海南神农大丰种业科技股份有限公司海南临高育制种基地,单本插,株行距16.3 cm×19.8 cm。93-11干种子由湖南省水稻研究所提供。
1.2突变体筛选
在M2代全生育期目测筛选具有明显表型变异的突变体。对其中可能的雄性不育突变体取成熟小穗用碘-碘化钾溶液(0.6% KI,0.3% I2)进行花粉染色并镜检以确定花粉育性。随机挑选1326个M2编号,取每个编号收获的M3种子等量混合播种,种植100株,在苗期按100 mL/m2喷施1 g/L的苯达松溶液(常州精度生物科技有限公司)至叶片表面筛选苯达松敏感突变体。种植苯达松敏感突变体后代,在分蘖期按450 mL/m2喷施1 g/L的苯达松溶液至叶片表面对苯达松敏感表型进行验证。
1.3DNA抽提和保存
DNA抽提参照CTAB法[20],有所改动:取3 cm长的水稻叶片,在800 μL抽提缓冲液[15 g/L CTAB,1.05 mol/L NaCl,75 mmol/L Tris-HCl(pH 8.0),15 mmol/L EDTA(pH 8.0)]中磨碎,收集到一个1.5 mL离心管中。65℃水浴30 min,其间颠倒混匀。加入800 μL氯仿与异戊醇的混合液(V氯仿∶V异戊醇为24∶1),颠倒混匀15 min。1 2000 r/min、室温下离心10 min。吸上清450 μL,转移到一个新的1.5 mL离心管中,加入2倍体积95%乙醇,混匀后-20℃下沉淀30 min。1 2000 r/min下离心15 min。倒掉95%乙醇,用75%乙醇洗沉淀。倒掉75%乙醇,干燥后加100 μL灭菌ddH2O溶解DNA。DNA溶解后编号装入96孔板于-20 ℃下保存备用。
1.4CYP704B2和CYP81A6的测序与分析
根据CYP704B2(GenBank:NM_001055627.2)和CYP81A6(GenBank:DQ341412.1)的基因组序列设计PCR引物(表1),并分别用来扩增无花粉型不育突变体、苯达松敏感突变体和野生型对照中的相应基因。PCR反应体系为2 ×Taq酶反应母液(Sinobio)25 μL,10 μmol/L引物各2 μL,模板DNA 40 ng,补ddH2O至50 μL。PCR程序如下:94℃下预变性10 min;94℃下变性30 s,57℃下退火30 s,72℃下延伸90 s,42个循环; 72℃下延伸10 min,16℃下10 min。PCR产物直接送深圳华大基因科技有限公司测序。序列返回后用DNAman 6.0进行分析。
1.5 CYP704B2和CYP81A6突变位点基因型检测
在CYP704B2和CYP81A6突变位点两侧根据基因组序列设计引物(表1)用来鉴定相应基因在野生型和突变体中的基因型。PCR反应体系为10 × 反应缓冲液1 μL,10 mmol/L dNTP 0.25 μL,10 μmol/L引物各0.25 μL,5 U/μLTaq酶(中科瑞泰)0.1 μL,模板DNA 40 ng,补ddH2O至10 μL。PCR程序为94℃下预变性3 min;94℃下变性20 s,55℃下退火20 s,72℃下延伸30 s,35个循环; 72℃下延伸7 min,16℃下10 min。CYP704B2和CYP81A6扩增产物分别在12%和6%的聚丙烯酰胺凝胶上进行电泳检测。
2结果与分析
2.1突变体库的创建和筛选
10 kg 93-11种子经钴60辐射后大田种植,共获得M1植株8947株。M1植株成熟后分单株收种,从中选取有100粒以上种子的材料3617份种成M2株系,共种植约18万株。从每个M2株系中随机选取6个单株,分单株取叶片抽提DNA并收种,分别作为辐射诱变突变体库的DNA池和种质资源长期保存。
表1本研究使用的引物
Table 1. Primers used in this study.

引物Primer序列(5'-3')Sequence(5'-3')目的基因Targetlocus704B2-1FCAAAGATTGTCTCAAGGTTGGTAGCYP704B2704B2-1RGGTATTAGGCAAGGAATTCAGTTG704B2-2FTCGAAGGACAGGACGGTGACCYP704B2704B2-2RTTTGAGCAAGAGAGGAAGGATC704B2-3FGCAAGAACTAACCAAAATTCAGGCYP704B2704B2-3RGGTCAGACGGAGGTGGAGA81A6-F1CAAACTTCCAACTTTCCCGTCYP81A681A6-R1CTGACGCCTGAAACGCAG81A6-F2GCAACGGAGTGAGTAGAAGTAATCCYP81A681A6-R2CAGAAAGGTAAAACAGCAGAAGA81A6-F3GGGCGAGAAGAAGAGCATGCYP81A681A6-R3GGCACGACCTTGGGGAT81A6-F4GGTGCGACGGCAATCTCCYP81A681A6-R4GAGCAGAAAGCCCTTCCTC1907_FAGGTCGGGTTTGGGGTT1907株系中CYP704B2的突变位点1907_RGATGTTGGCAGCGTCGAACYP704B2intheline19072245_FAGCTTCGGGGACGACAAGA2245株系中CYP704B2的突变位点2245_RTGCGTCATCGCCATGTACGTCYP704B2intheline22453522-FATGAAATCTTAGTTCCACCCTCTTGCCG3522株系中CYP81A6的突变位点3522-RCTCCCTGACGATGCACTGGAGGTCYP81A6intheline35223622-FTGTTCGAGGTCTCCCTCAGCGTG3622株系中CYP81A6的突变位点3622-RCCTGCTTAAACTCCTGGGCTTCCACYP81A6intheline3622

A-单分蘖; B-矮化; C-迟抽穗; D-小穗变形; E-假病斑。左边为突变体,右边为野生型。
A, Monoculm; B, Dwarfism; C, Late heading; D, Malformed spikelet; E, Lesion mimic. Mutant plants or samples are on the left, and wild type plants or samples are on the right.
图1M2家系中不同类型的突变体
Fig. 1. Different mutant phenotypes in M2families.
在M2代对突变体材料的株高、株型、分蘖数、穗型、小穗结构、育性、叶色、叶型、抽穗期等性状进行全生育期观察筛选,在M3代对突变体材料的苯达松抗性进行筛选。结果共选中包括分蘖减少(图1-A)、矮化(图1-B)、迟抽穗(图1-C)、小穗变形(图1-D)、假病斑(图1-E)等在内的15种类型共308个突变家系,占被观察家系总数的8.52%(表2)。如表2所示,育性相关突变出现的频率最高,为2.74%(99个),株型紧凑和早衰突变出现的频率最低,均为0.03%(各1个)。其他类型突变出现的频率除矮化和分蘖少高于1.00%以外,其余均低于1.00%(表2)。
2.2不育突变体的分子鉴定
为了进一步了解本突变体库的质量及其在水稻基因功能分析中的效用,我们以不育突变体和苯达松敏感突变体作材料开展了基因鉴定工作。水稻CYP704B2编码一个细胞色素P450家族的蛋白,该基因缺失后导致水稻不能产生成熟花粉[21]。我们从99个育性突变体中挑选出11个无花粉型雄性不育突变体,用基因特异引物分别扩增这些无花粉型雄性不育突变体中的CYP704B2,将PCR产物测序后与野生型CYP704B2的基因组序列做比对。结果表明在1907(图2-A,B)和2245(图2-C,D)两个家系的无花粉型雄性不育突变体(图2-B,D)中,CYP704B2的基因组序列均发生了改变(图2-E)。其中1907的突变体(1907m)在CYP704B2编码区第794个碱基后的GGG被替换为T,造成了移码突变和翻译提前终止,导致野生型CYP704B2蛋白C端339个氨基酸被Tyr-Ala-Val-Thr所取代。而2245的突变体(2245m)在CYP704B2编码区第1267个碱基后的GG发生缺失,也造成了移码突变和翻译提前终止,导致CYP704B2蛋白C端的220个氨基酸被丙氨酸(Ala)取代。
表2M2和M3家系中突变表型统计
Table 2. Summery of mutant phenotypes in M2and M3families.
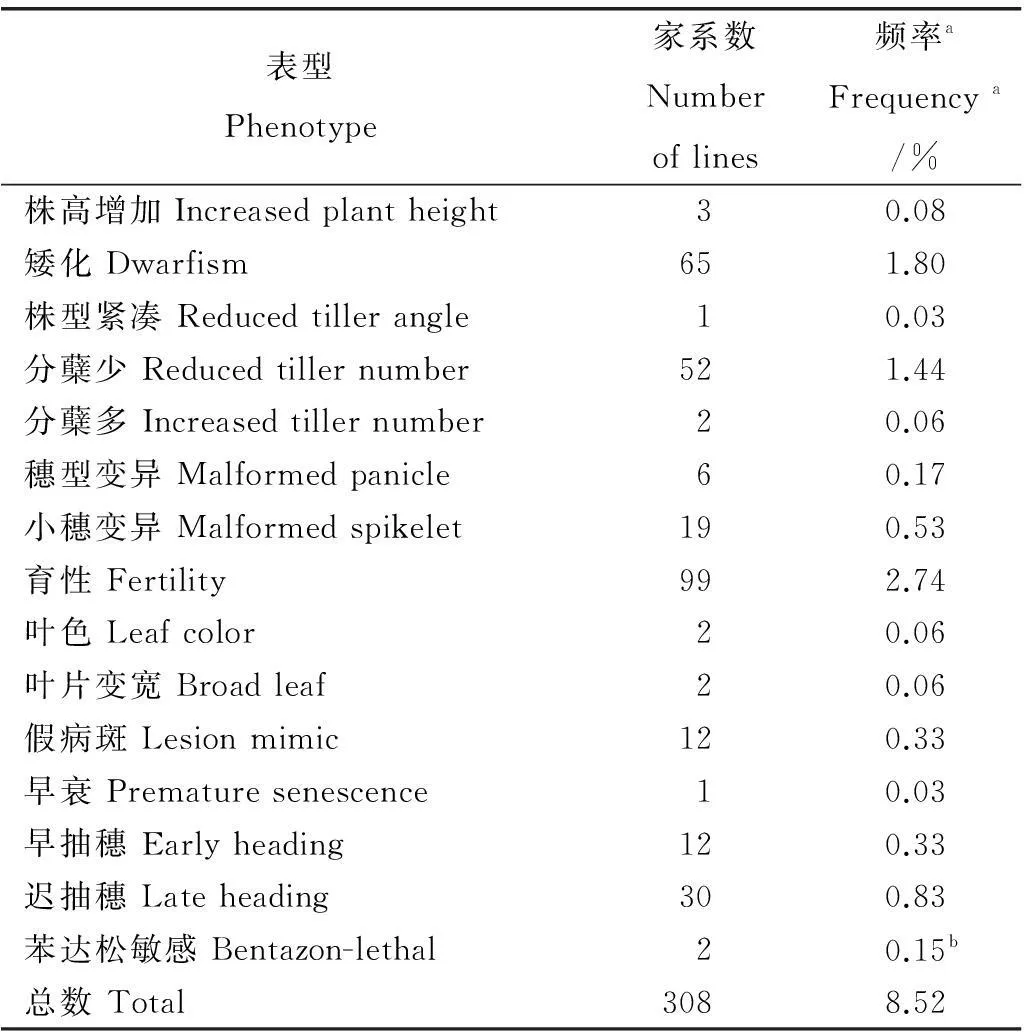
表型Phenotype家系数Numberoflines频率aFrequencya/%株高增加Increasedplantheight30.08矮化Dwarfism651.80株型紧凑Reducedtillerangle10.03分蘖少Reducedtillernumber521.44分蘖多Increasedtillernumber20.06穗型变异Malformedpanicle60.17小穗变异Malformedspikelet190.53育性Fertility992.74叶色Leafcolor20.06叶片变宽Broadleaf20.06假病斑Lesionmimic120.33早衰Prematuresenescence10.03早抽穗Earlyheading120.33迟抽穗Lateheading300.83苯达松敏感Bentazon-lethal20.15b总数Total3088.52
a突变家系在被筛选的3617个家系中出现的频率;b苯达松敏感家系在被筛选的1326个家系中出现的频率。
aMutation frequency in 3617 lines;bMutation frequency in 1326 lines.
为了进一步证实CYP704B2突变和表型的关系,我们分别根据1907m和2245m中的突变位点设计引物鉴定其M2家系植株的基因型。结果表明1907(图2-F)和2245(图2-G)家系的植株都可以分为3种基因型,其中野生基因型和突变基因型分别只能扩增出一条带,并且前者大于后者,杂合基因型可以扩增出两条带,并且大小分别与野生基因型和突变基因型一致。育性调查表明所有野生和杂合基因型的植株都能正常结实,而所有突变基因型的植株均不育,即不育表型和突变基因型共分离。这表明两个家系中的不育表型均由CYP704B2的突变造成。
对1907家系中CYP704B2突变位点杂合植株后代的遗传分析表明,可育与不育株分别为94株和29株,符合3∶1分离(χ2= 0.07,P> 0.05)。2245家系中CYP704B2突变位点杂合植株后代中可育与不育株分别为110株和34株,也符合3∶1分离(χ2= 0.08,P> 0.05)。这说明两个家系中的不育性状仅由CYP704B2位点控制。
2.3苯达松敏感突变体的分子鉴定
CYP81A6编码一个细胞色素P450家族的蛋白,该基因突变后导致水稻对苯达松敏感[22]。我们用特异引物分别扩增3522(图3-A)和3622(图3-B)两个家系中苯达松敏感突变体(3522m和3622m)的CYP81A6,PCR产物经测序后与野生型CYP81A6的基因组序列进行比对。结果表明在3522m和3622m中,CYP81A6编码区分别在第1747 bp和第586 bp后发生了23 bp和7 bp的碱基缺失(图3-C),两种缺失都造成了移码突变,导致翻译提前终止。
为了验证苯达松敏感表型是否由CYP81A6的突变造成,我们分别根据3522m和3622m中的突变位点设计引物鉴定两家系M3植株的基因型。如图3-D和3-E所示,3522和3622家系的植株都能分成野生、突变和杂合3种基因型,其中野生和突变基因型各有一条带且前者大于后者,杂合基因型有两条带并分别与野生和突变基因型的带一致。在3522和3622家系中所有野生和杂合基因型的植株都对苯达松不敏感,而所有突变基因型的植株均敏感,说明苯达松敏感表型与突变基因型共分离,表明苯达松敏感表型确是由CYP81A6的突变造成的。
挑选3522家系中CYP81A6突变位点杂合单株的后代进行遗传分析,苯达松不敏感与敏感株分别为222株和79株,符合3∶1分离(χ2= 0.19,P> 0.05)。3622家系中CYP81A6突变位点杂合植株后代中苯达松不敏感与敏感株分别为233株和84株,也符合3∶1分离(χ2= 0.30,P> 0.05)。这说明两个家系中的苯达松敏感表型仅由CYP81A6单基因控制。
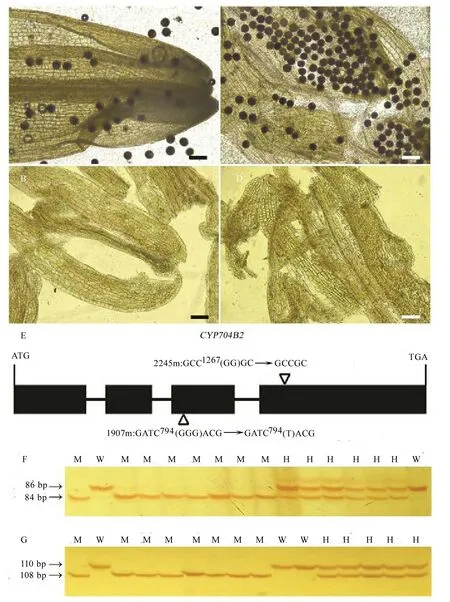
A和B-1907家系中野生型(A)和无花粉型不育突变体(B)的花粉碘染,比例尺=100 μm;C和D-2245家系中野生型(C)和无花粉型不育突变体(D)的花粉碘染,比例尺=100 μm;E-CYP704B2的基因结构。黑框代表编码区;线条代表内含子;三角指向突变位点,其中1907家系突变体(1907m)中CYP704B2第794个碱基之后的“GGG”被替换为“T”,而2245家系突变体(2245m)中CYP704B2第1267个碱基之后的“GG”缺失;F和G-1907(F)和2245(G)家系M2单株中CYP704B2突变位点的基因型检测。图片左边显示PCR产物大小。W-野生型;H-杂合型;M-突变型。
A and B, I2-KI staining of pollen grains of a wild type plant (A) and a mutant (B) in the line 1907, bar = 100 μm; C and D, I2-KI staining of pollen grains of a wild type plant (C) and a mutant (D) in the line 2245, bar = 100 μm; E, The structure ofCYP704B2. Black boxes represent the coding region; Lines represent introns; Triangles point to the mutation loci. “GGG” following the 794th nucleotide ofCYP704B2 is substituted by “T” in mutants of the line 1907 (1907m), and “GG” following the 1267th nucleotide ofCYP704B2 is deleted in mutants of the line 2245 (2245m); F and G, Genotyping of theCYP704B2 loci in the lines 1907 (F) and 2245 (G). The sizes (bp) of the PCR products are shown on the left. W, Wild type; H, Heterozygote; M, Mutant.
图2无花粉型雄性不育突变体及其分子鉴定
Fig. 2. Phenotypic and molecular characterization of two male-sterile mutants without pollen grains.
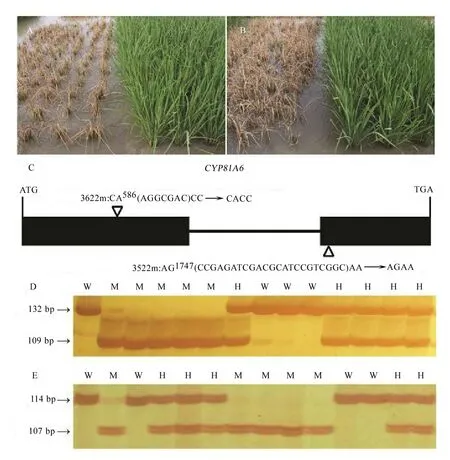
A和B-3522(A)和3622(B)家系中苯达松敏感突变体(左边)和野生型(右边)植株分蘖期喷施苯达松后的表型; C-CYP81A6的基因结构。黑框代表编码区;线条代表内含子;三角指向突变位点,其中3522家系突变体(3522m)中CYP81A6编码区第1747 bp后发生了23 bp缺失,而3622家系突变体(3622m)中CYP81A6编码区第586 bp后发生了7 bp缺失;D和E-3522(D)和3622(E)家系M3单株中CYP81A6突变位点的基因型检测。图片左边显示PCR产物大小。W-野生型;H-杂合型;M-突变型。
A and B, Phenotypes of the bentazon-lethal mutants (left) and wild type (right) plants in the lines 3522 (A) and 3622 (B) after bentazon spraying at tillering stage; C, The structure ofCYP81A6. Black boxes represent the coding region; Lines represent introns; Triangles point to the mutation loci. A 23-bp deletion is found following the 1747th bp of the coding region ofCYP81A6 in mutants of the line 3522 (3522m), and a 7-bp deletion is found following the 586th bp of the coding region ofCYP81A6 in mutants of the line 3622 (3622m); D and E, Genotyping of theCYP81A6 loci in the lines 3522 (D) and 3622 (E). The sizes (bp) of the PCR products are shown on the left. W, Wild type; H, Heterozygote; M, Mutant.
图3 苯达松敏感突变体及其分子鉴定
Fig. 3. Phenotypic and molecular characterization of two bentazon-lethal mutants.
3讨论
目前国内外创建的水稻突变体库大多数是粳稻遗传背景,并多用转基因方法产生[6, 14]。本研究利用辐射诱变创建了一个包含3617个家系的籼稻品种93-11的突变体库。从该库中共筛选到308个突变家系,总突变频率为8.52%。这些突变体可以分为包括育性和苯达松敏感在内的15种类型,不同类型出现的频率为0.03%~2.74%。我们从1326个家系中筛选到2个CYP81A6突变体,从3617个家系中筛选到2个CYP704B2突变体,提示在本突变体库中筛选到单个目标基因突变体的概率应该不低于0.055%~0.15%。造成CYP704B2和CYP81A6突变的原因是小片段缺失和核苷酸替换,这也是辐射诱变典型的突变类型[19]。我们的93-11突变体库突变频率高,突变类型丰富,增加了籼稻突变体资源并将促进籼稻基因组功能的解析。此外,93-11基因组序列已经公布[3],且其在我国水稻生产中表现出优质、高产、广适等特性,这有利于本突变体资源在水稻育种和生产中的直接利用。
雄性不育是水稻杂种优势利用的基础,受到复杂分子网络的调控[23-24]。隐性核雄性不育是雄性不育的一种,可用于第三代杂交水稻技术和轮回育种群体改良技术[25-27]。CYP704B2突变后会产生无花粉型隐性核雄性不育突变体[21],在上述两个技术中均具有重大应用潜力。目前已报道过的CYP704B2突变体是用粳稻品种9522经钴60辐射获得。在该突变体中,一段包括CYP704B2大部及其上游基因一部在内的3102 bp长的片段发生了缺失[21]。由于CYP704B2上游基因序列的删除可能造成潜在的非目标性状变异,这为其利用带来不利影响。本研究鉴定了两个新的CYP704B2突变体1907m和2245m。在这两个突变体中CYP704B2的第3和第4外显子分别比其野生型短2 bp,这不但避免了上下游其他基因变异可能造成的附加效应,还能很容易地设计共显性分子标记进行检测,极大地方便了突变体的利用。
苯达松是一种苯并噻二唑类内吸性稻田除草剂,能够通过干扰光合作用中的希尔反应杀死多种阔叶类和莎草科杂草。水稻可以通过CYP81A6编码的细胞色素P450蛋白将苯达松羟基化而不受毒害[22]。水稻CYP81A6突变体对苯达松敏感,在杂交水稻的除杂保纯和混植法制种中均具有极大的应用潜力。农林8号m和8077S是目前为止报道过的两个CYP81A6突变体,其中籼稻来源的8077S对苯达松的敏感性不高,粳稻来源的农林8号m的敏感程度明显高于8077S。农林8号m和8077S分别在CYP81A6的ATG起第507碱基缺失一个C和在第2058碱基缺失一个G[22]。由于上述两个突变体中的CYP81A6都只有1 bp的缺失,因此难以用普通PCR和电泳方法进行检测。本研究新鉴定了3622m和3522m两个对苯达松高度敏感的突变体。在这两个突变体中CYP81A6的第1和第2个外显子分别缺失了一个7 bp和一个23 bp的片段,用普通的聚丙烯酰胺凝胶甚至琼脂糖凝胶电泳就能检测CYP81A6突变基因。此外,3622m和3522m与农林8号m及8077S遗传背景不同,为杂交水稻育种和生产提供了新的种质资源。
谢辞:感谢冯玉涛、王露露、李秀琴、欧阳超、陈思兰、王会进在突变体筛选方面给予的帮助。
参考文献:
[1]Zhang Q, Li J, Xue Y, et al. Rice 2020: A call for an international coordinated effort in rice functional genomics.MolPlant, 2008, 1(5): 715-719.
[2]Goff S A, Ricke D, Lan T H, et al. A draft sequence of the rice genome (OryzasativaL. ssp.japonica).Science, 2002, 296(5565): 92-100.
[3]Yu J, Hu S, Wang J, et al. A draft sequence of the rice genome (OryzasativaL. ssp.indica).Science, 2002, 296(5565): 79-92.
[4]Kawahara Y, de la Bastide M, Hamilton J P, et al. Improvement of theOryzasativaNipponbare reference genome using next generation sequence and optical map data.Rice, 2013, 6(1): 4.
[5]IRGSP. The map-based sequence of the rice genome.Nature, 2005, 436(7052): 793-800.
[6]Wang N, Long T, Yao W, et al. Mutant resources for the functional analysis of the rice genome.MolPlant, 2013, 6(3): 596-604.
[7]Jeong D H, An S, Kang H G, et al. T-DNA insertional mutagenesis for activation tagging in rice.PlantPhysiol, 2002, 130: 1636-1644.
[8]Miyao A, Tanaka K, Murata K, et al. Target site specificity of theTos17 retrotransposon shows a preference for insertion within genes and against insertion in retrotransposon-rich regions of the genome.PlantCell, 2003, 15: 1771-1780.
[9]Wu C, Li X, Yuan W, et al. Development of enhancer trap lines for functional analysis of the rice genome.PlantJ, 2003, 35(3): 418-427.
[10]Kolesnik T, Szeverenyi I, Bachmann D, et al. Establishing an efficientAc/Dstagging system in rice: Large-scale analysis ofDsflanking sequences.PlantJ, 2004, 37(2): 301-314.
[11]Sallaud C, Gay C, Larmande P, et al. High throughput T-DNA insertion mutagenesis in rice: A first step towardsinsilicoreverse genetics.PlantJ, 2004, 39: 450-464.
[12]Hsing Y I, Chern C G, Fan M J, et al. A rice gene activation/knockout mutant resource for high throughput functional genomics.PlantMolBiol, 2007, 63: 351-364.
[13]Fu F F, Ye R, Xu S P, et al. Studies on rice seed quality through analysis of a large-scale T-DNA insertion population.CellRes, 2009, 19(3): 380-391.
[14]Wei F J, Droc G, Guiderdoni E, et al. International consortium of rice mutagenesis: Resources and beyond.Rice, 2013, 6(1): 39.
[15]Till B J, Cooper J, Tai T H, et al. Discovery of chemically induced mutations in rice by TILLING.BMCPlantBiol, 2007, 7: 19-30.
[16]Suzuki T, Eiguchi M, Kumamaru T, et al. MNU-induced mutant pools and high performance TILLING enable finding of any gene mutation in rice.MolGenetGenom, 2008, 279(3): 213-223.
[17]Abe A, Kosugi S, Yoshida K, et al. Genome sequencing reveals agronomically important loci in rice using MutMap.NatBiotechnol, 2012, 30(2): 174-178.
[18]Fekih R, Takagi H, Tamiru M, et al. MutMap+: Genetic mapping and mutant identification without crossing in rice.PLoSOne, 2013, 8(7): e68529.
[19]Wu J L, Wu C, Lei C, et al. Chemical- and irradiation-induced mutants of indica rice IR64 for forward and reverse genetics.PlantMolBiol, 2005, 59(1): 85-97.
[20]Rogers S O, Bendich A J. Extraction of DNA from milligram amounts of fresh, herbarium and mummified plant tissues.PlantMolBiol, 1985, 5(2): 69-76.
[21]Li H, Pinot F, Sauveplane V, et al. Cytochrome P450 family member CYP704B2 catalyzes the ω-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice.PlantCell, 2010, 22(1): 173-190.
[22]张集文. 水稻苯达松敏感突变研究进展. 中国水稻科学, 2010, 24(5): 551-558.
Zhang J W. Progress on the study of the bentazon sensitive mutants in rice.ChinJRiceSci, 2010, 24(5): 551-558. (in Chinese with English abstract)
[23]Liu L, Fan X D. Tapetum: Regulation and role in sporopollenin biosynthesis inArabidopsis.PlantMolBiol, 2013, 83(3): 165-175.
[24]马西青, 方才臣, 邓联武, 等. 水稻隐性核雄性不育基因研究进展及育种应用探讨. 中国水稻科学, 2012, 26(5): 511-520.
Ma X Q, Fang C C, Deng L W, et al. Research progress and breeding application of recessive genic male sterility genes in rice.ChinJRiceSci, 2012, 26(5): 511-520. (in Chinese with English abstract)
[25]邓兴旺, 王海洋, 唐晓艳, 等. 杂交水稻育种将迎来新时代. 中国科学:生命科学, 2013, 43(10): 864-868.
Deng X W, Wang H Y, Tang X Y, et al. Hybrid rice breeding welcomes a new era of molecular crop design.SciSinVitae, 2013, 43(10): 864-868. (in Chinese with English abstract)
[26]汪旭东, 周开达, 李仕贵, 等. 利用隐性核不育性进行水稻轮回育种初步研究. 西南农业学报, 2001, 14(3): 102-106.
Wang X D, Zhou K D, Li S G, et al. A preliminary study on rice recurrent breeding using recessive sterile material.SouthwestChinJAgriSci, 2001, 14(3): 102-106. (in Chinese with English abstract)
[27]Wu Y, Fox T W, Trimnell M R, et al. Development of a novel recessive genetic male sterility system for hybrid seed production in maize and other cross-pollinating crops.PlantBiotechnolJ, 2015, doi: 10.1111/pbi.12477.
Construction and Screening of an Irradiation-induced Mutant Library of indica Rice 93-11
LONG Tuan1,2, AN Bao-guang1,2, LI Xin-peng1,2, ZHANG Wei1,2, LI Jing-lin1,2, YANG Yao-hua1,2,ZENG Xiang1,2, WU Yong-zhong1,2, HUANG Pei-jin1,2,*
(1Hainan Bolian Rice Gene Technology Co., Ltd., Haikou 570125, China;2Grand Agriseeds Technology, Inc., Haikou 570125, China;*Corresponding author, E-mail: bolianrgt2015@aliyun.com)
LONG Tuan, AN Baoguang, LI Xinpeng, et al. Construction and screening of an irradiation-induced mutant library of indica rice 93-11. Chin J Rice Sci, 2016, 30(1): 44-52.
Abstract:Mutant libraries are powerful tools for plant germplasm creation and functional analysis of genome. Using 93-11 (O. sativa ssp. indica cv. 93-11), an elite variety with complete genome sequences available, we established an irradiation-induced mutant library containing 3617 lines. Three hundred and eight mutant lines were obtained from M2 and M3 generations and classfied into 15 types of mutation, including plant height, tiller number, plant architecture, inflorescence architecture, spikelet architecture, fertility, leaf color, leaf shape, heading date, and bentazon resistance. The mutation frequencies ranged from 0.03% to 2.74%. Using reverse genetics approach, we found that CYP704B2 is the causal gene for two male sterile mutants and CYP81A6 is responsible for two bentazon-lethal mutations. For the two male sterile mutants, nucleotide substitution and deletion were detected in the third and fourth exons of CYP704B2, respectively. For the two bentazon-lethal mutants, a 7-bp and a 23-bp deletion were detected in the first and second exons of CYP81A6, respectively. Genetic studies revealed that wild-type plants and mutant plants segregated at 3∶1 ratio, suggesting that these mutant traits were controlled by single recessive genes. Our study showed that this mutant library is a useful resource for rice genome functional analysis and rice genetic improvement.
Key words:indica; mutagenesis by irradiation; mutant library; male sterility; bentazon-lethal
文章编号:1001-7216(2016)01-0044-09
中图分类号:Q343.5; S511.0352
文献标识码:A
基金项目:海南省重大科技项目(ZDZX2013010)。
收稿日期:2015-08-18; 修改稿收到日期: 2015-10-27。
