注射用头孢他美钠在大鼠体内的药代动力学及组织分布
2016-04-22孙文霞卞其龙
孙文霞, 田 媛, 卞其龙, 程 强
(成都大学 四川抗菌素工业研究所, 四川 成都 610052)
注射用头孢他美钠在大鼠体内的药代动力学及组织分布
孙文霞, 田媛, 卞其龙, 程强
(成都大学 四川抗菌素工业研究所, 四川 成都610052)
摘要:为了研究注射用头孢他美钠在大鼠体内的药代动力学及组织分布特点,将180只SD大鼠随机分为36组,分别静脉注射50、100、1 000 mg·kg(-1)头孢他美钠,于不同时间点采血,分离血清;另将36只大鼠随机分成3组,分别静脉注射100 mg·kg(-1)头孢他美钠,于不同时间点取各组织制成匀浆.采用HPLC法测定血清及各组织中头孢他美的浓度,用3p97软件计算药代动力学参数.头孢他美在SD大鼠血清中的药代动力学特征符合二室模型,低、中、高剂量下的主要药动学参数:C(max)为(66.70±21.59)、(216.90±43.22)和(1 972.70±125.54)μg·mL(-1),t(1/2β)为(1.49±0.20)、(1.36±0.20)和(1.27±0.16)h,AUC((0~12))为(139.05±27.93)、(293.01±65.55)和(2 627.32±134.92)μg·h·mL(-1);静脉注射头孢他美钠1 h时大鼠组织中头孢他美浓度最高,此时头孢他美在各组织中的浓度从高到低依次为肾、肝、肺、胃、心、骨骼肌、脾、小肠、脂肪、脑、卵巢和睾丸.结果表明,静脉注射头孢他美在大鼠血清和部分组织中浓度较高,无蓄积.
关键词:头孢他美钠;药动学;组织分布;HPLC
0引言
头孢他美酯为半合成第三代口服头孢菌素,口服后经肠壁酯酶作用水解成为有抗菌活性的头孢他美而发挥药效.研究发现,头孢他美对多数革兰氏阴性菌及部分革兰氏阳性菌表现出良好的抗菌活性[1-3],对β-内酰胺酶稳定,对产β-内酰胺酶菌株仍有杀菌作用[4-5],其不良反应少,在体内无蓄积,临床应用广,主要用于治疗敏感菌所致的肺炎、急性支气管炎、咽喉炎、扁桃体炎等感染.头孢他美钠是对头孢他美酯进行结构修饰而改成的注射剂,能够快速发挥药效,而且耐药性大幅下降,具有较好的开发应用价值.本研究利用HPLC-UV方法,测定大鼠血清中头孢他美含量及在各组织中的分布,获得了头孢他美钠的药代动力学参数,为临床合理用药及进一步研究提供了参考依据.
1材料与方法
1.1试药、仪器与动物
1.1.1试药.
实验所用的试药包括:注射用头孢他美钠(规格,2 g,批号,150101)、头孢他美钠对照品(含量,90.9%)、头孢唑啉钠对照品(含量,95.2%),四川抗菌素工业研究所;乙腈(色谱纯),Fisher公司;双蒸水,本实验室自制;灭菌注射用水,天津药业焦作有限公司.
1.1.2仪器.
实验所用仪器包括:LC-10A型高效液相色谱仪系统,日本岛津公司;N2000色谱工作站,浙江大学智达信息工程有限公司;TGL-16B型台式高速离心沉淀器,上海安亭科学仪器厂;XW-80型旋涡混合器,上海医科大学实验仪器厂;低温冰箱,日本索尼公司.
1.1.3实验动物.
实验所用动物为健康合格SD大鼠216只,SPF级,体重185~225 g,雌雄各半,由成都达硕生物科技有限公司提供.
1.2方法与结果
1.2.1色谱条件.
实验的色谱条件为:Hypersil C18色谱柱(200 mm×4.6 mm id,5 μm,柱号E1514928);流动相为乙腈-4 mmol·L-1高氯酸(15∶85,V/V); 检测波长265 nm;柱温35 ℃;流速1 mL·min-1;内标为头孢唑啉钠.
1.2.2溶液的配制.
取30.0 mg头孢他美钠对照品,精密称定,置于10 mL容量瓶中,用蒸馏水配制成浓度为3.0 mg·mL-1的对照品储备液.临用时,用蒸馏水稀释成系列浓度的头孢他美对照品工作溶液.精密称取25.0 mg头孢唑啉钠对照品,置于25 mL容量瓶中,用蒸馏水配制成浓度为1.0 mg·mL-1的内标溶液.
1.2.3样品采集.
180只SD大鼠,雌雄各半,随机分为3个剂量组,每剂量组60只,分12个采血时间点,每个时间点5只.实验前禁食12 h,自由饮水,各剂量组分别尾静脉注射50、100、1000 mg·kg-1注射用头孢他美钠,于0.083、0.17、0.33、0.66、1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0 h时分别心脏采血3 mL,离心分离血清,置-20 ℃冰箱保存,待测.
取健康SD大鼠36只,雌雄各半,随机均分成3组,每组12只.实验前禁食12 h,自由饮水,分别尾静脉注射100 mg·kg-1头孢他美钠,于1.0、2.0、6.0 h时各取一组大鼠断髓处死,分别取心、肝、脾、肺、肾、胃、小肠、脂肪、骨骼肌、脑及生殖腺(睾丸或卵巢),用滤纸吸干水分后称重.取适量,用生理盐水清洗后置匀浆器中并加入2 mL生理盐水匀浆、离心,取上清液,置-20 ℃冰箱保存,待测.
1.2.4样品预处理.
取血清或组织匀浆1.0 mL,加入内标溶液10 μL,漩涡混匀,加入0.5 mol·L-1高氯酸0.4 mL,旋涡沉淀蛋白1 min,15 000 r·min-1离心10 min,血清取上清液进样20 μL,组织匀浆取上清液进样80 μL.
1.2.5专属性.
在“1.2.1”项色谱条件下,头孢他美的保留时间为6.6 min左右,内标的保留时间为5.5 min左右,二者能够分离完全,峰形良好,无内源性物质干扰,结果见图1.结果表明,本实验专属性良好.
1.2.6线性关系及范围.
取空白基质1.0 mL,加入头孢他美对照品工作液10 μL,制成系列浓度的血清及组织匀浆样品,按“1.2.4”项下方法测定.以头孢他美浓度为Y、头孢他美与内标峰面积比为X,用加权最小二乘法进行线性回归,标准曲线见表1.结果显示,头孢他美在不同基质中的定量限为0.05~0.29 μg·mL-1.
1.2.7精密度与方法回收率.
取空白基质1.0 mL,按“1.2.2”项下方法,加入适量头孢他美对照品工作液10 μL,制成高、中、低3个浓度的血清及组织样品,按“1.2.4”项下方法测定,结果见表2.数据表明,各基质的批内和批间精密度RSD均小于13%,本方法回收率在93%~112%之间,符合生物样本测定要求.
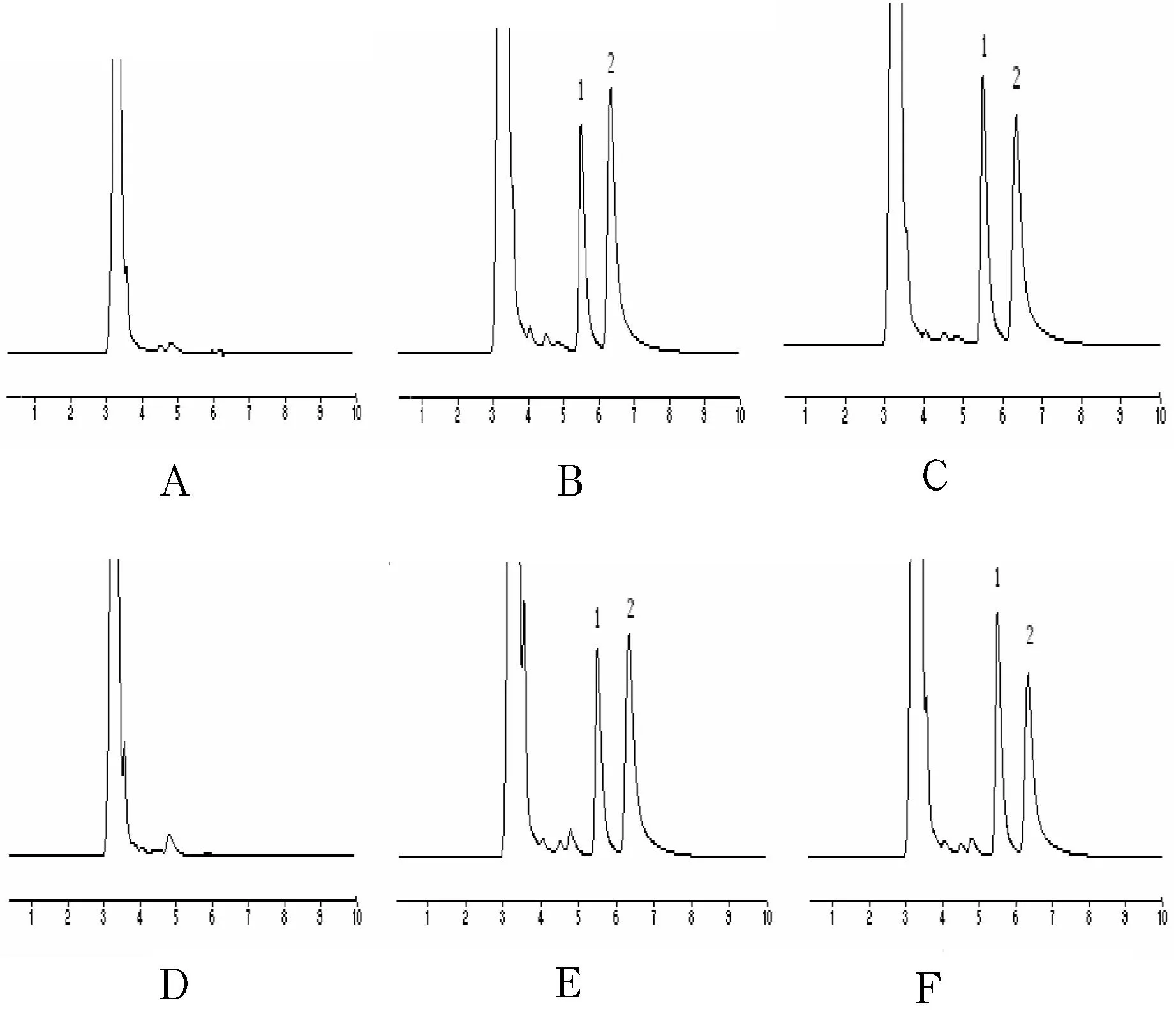
1:内标,2:头孢他美
A.空白血清;B.空白血清+头孢他美+内标;C.给药后血清+内标;D.空白肾组织匀浆;E.空白肾组织匀浆+头孢他美+内标;F.给药后肾组织匀浆+内标

图1 血清与组织样品色谱图
1.2.8药代动力学参数.
将大鼠血清药浓度—时间数据经3p97程序拟合计算,得药代动力学参数(见图2、表3).结果显示,头孢他美药代动力学特征符合二室模型.
1.2.9药物的组织分布.
给大鼠静脉注射100 mg·kg-1头孢他美钠1 h时,组织中头孢他美浓度最高,2 h时次之,6 h最低.1 h时头孢他美在各组织中的浓度从高到低依次为肾、肝、肺、胃、心、骨骼肌、脾、小肠、脂肪、脑、睾丸和卵巢(见图3).

表2 各组织及血清样品的批内、批间精密度和回收率(n=5)
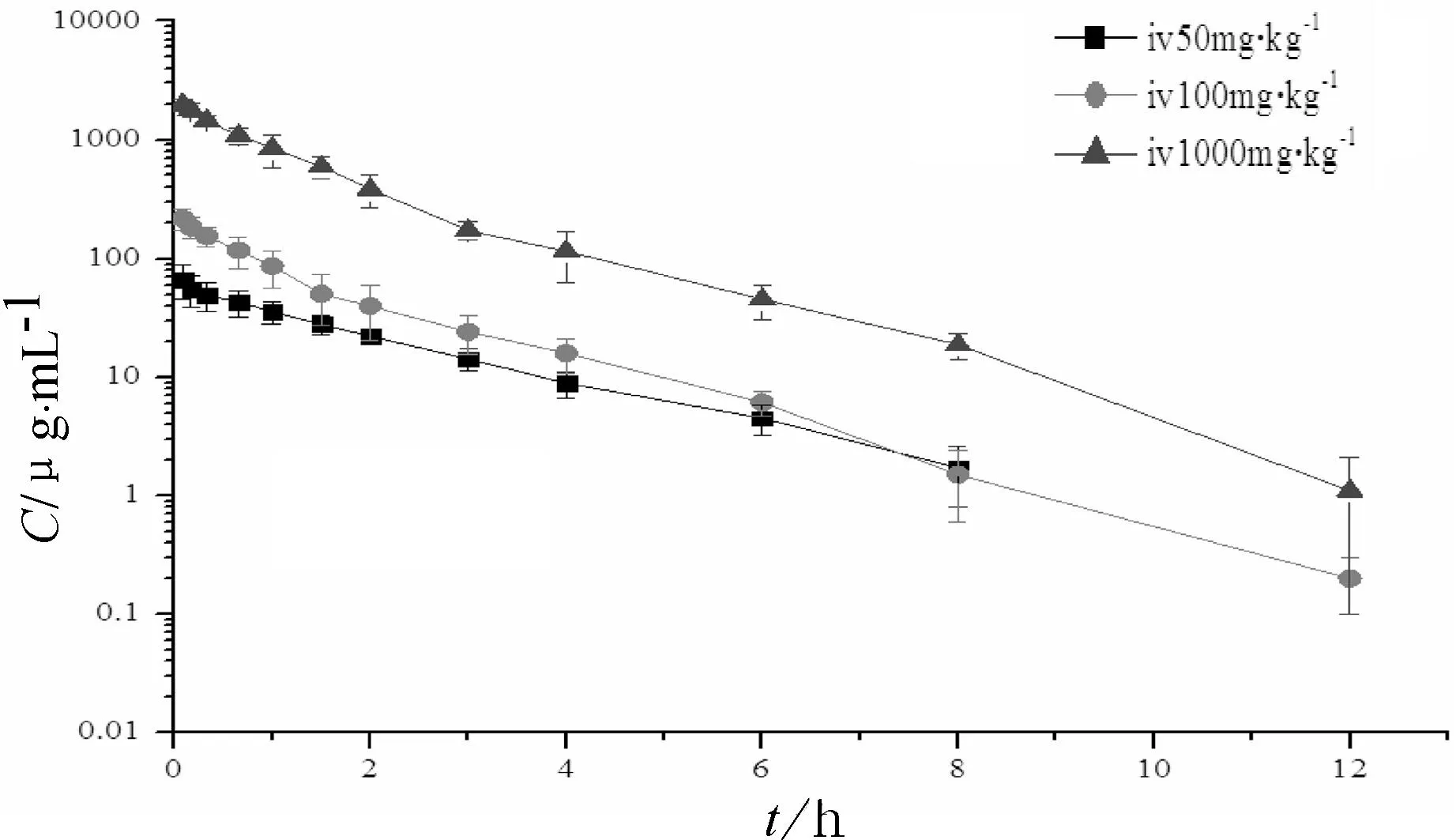
图2 大鼠静脉注射不同剂量头孢他美钠后的

参 数剂 量/mg·kg-1501001000Cmax/μg·mL-166.70±21.59216.90±43.221972.70±125.54V/L·kg-10.61±0.380.45±0.100.47±0.03CL/F/L·kg-1·h-10.41±0.080.41±0.100.40±0.02t1/2β/h1.49±0.201.36±0.201.27±0.16AUC(0~12)/μg·h·mL-1139.05±27.93293.01±65.552627.32±134.92AUC(0~∞)/μg·h·mL-1139.28±27.95293.33±65.392629.57±135.19
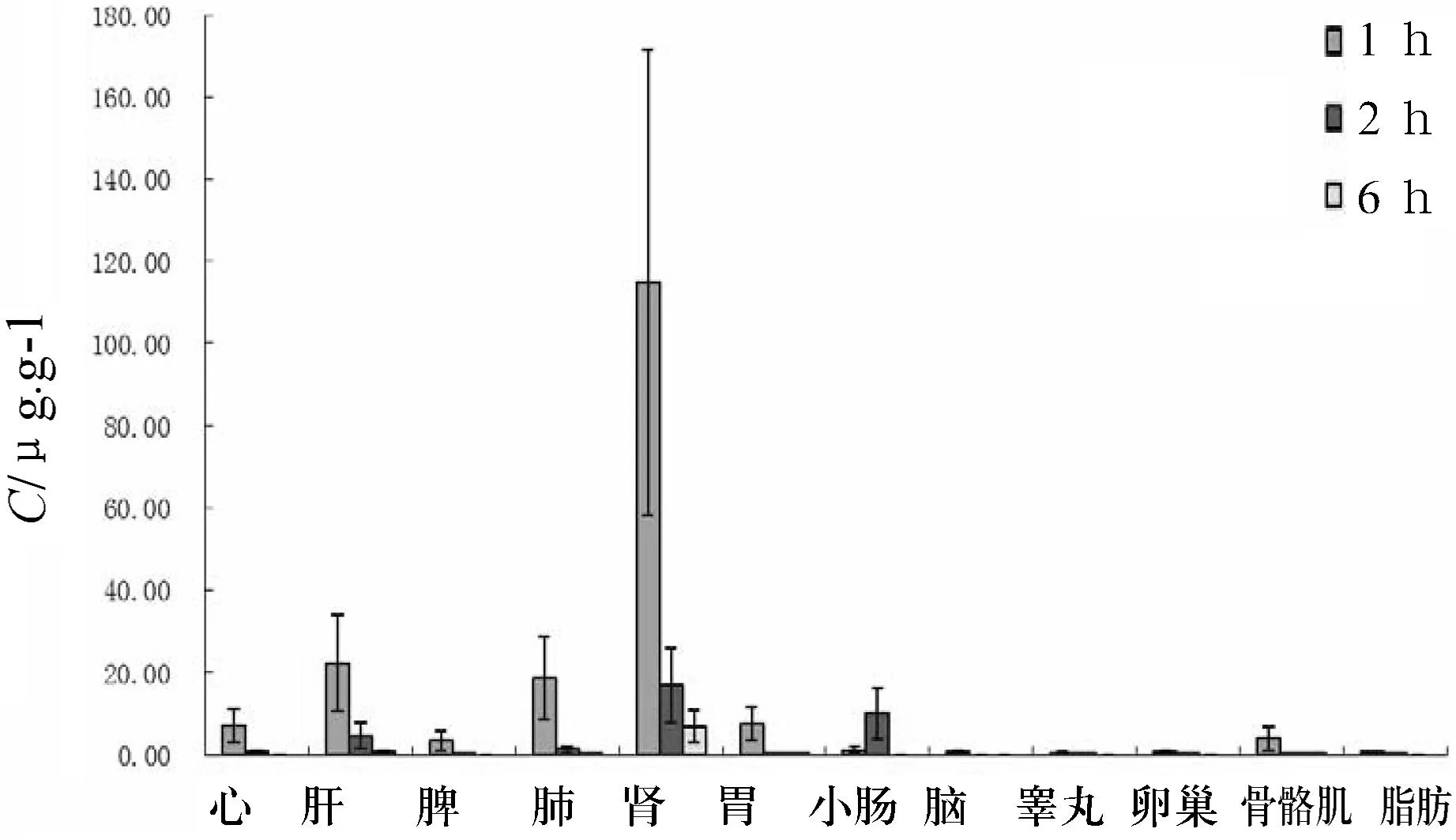
图3大鼠静脉注射100 mg·kg-1头孢他美钠后的
组织分布(n=6,x±s)
2讨论
根据相关文献报道,口服盐酸头孢他美酯后,药物经肠道吸收并很快被肠壁的酯酶水解为头孢他美而显示出抗菌活性[6],在体内90%的头孢他美以原形从尿中排出,并于24 h内排出完毕,头孢他美的血清蛋白结合率为22%[7].
本实验中,大鼠静脉注射50 mg·kg-1与100 mg·kg-1的Cmax与剂量不呈线性关系,这可能与第一个取血点的操作时间有关.大鼠静脉注射50、100、1 000 mg·kg-1注射用头孢他美钠,在50、100 mg·kg-1剂量下呈线性关系,分别相当于人体拟用剂量10、20 mg·kg-1.静脉注射起效较快,血清浓度水平远远高于口服盐酸头孢他美酯;大鼠静脉注射100 mg·kg-1头孢他美钠1 h时,各组织中的浓度从高到低依次为肾、肝、肺、胃、心、骨骼肌、脾、小肠、脂肪、脑、卵巢和睾丸,其中头孢他美在肾、肝、肺中的浓度较高,与盐酸头孢他美酯临床适应症一致;6 h时几乎从组织中完全清除,在组织中无蓄积.
参考文献:
[1]李才正,孙家钰,王颖,等.单次静滴注射用头孢他美钠I期临床试验[J].四川大学学报(医学版),2014,45(4):637-641.
[2]Noh K,Kimb E,Kangc W,et al.Quantitativedeterminationofcefetametinhumanplasmabyliquidchromatography-massspectrometry:Aresearcharticle[J].Biomed Chromatogr,2011,25(7):779-782.
[3]Wyss R,Bucheli F.Determinationofcefetametanditsorallyactiveester,cefetametpivoxyl,inbiologicalfluidsbyhighperformanceliquidchromatography[J].J Chromatogr,1988,430(1):81-92.
[4]李菁华,马琳,史红艳,等.注射头孢菌素头孢他美钠β-内酰胺酶稳定性研究[J].微生物学杂志,2001,21(4):56-57.
[5]俞绍鑫,吴朝倩.盐酸头孢他美酯的药理与临床应用[J].中国抗生素杂志,2001,26(2):153-159.
[6]何周康,阳利龙,祝文兵,等.头孢他美酯分散片在人体内的相对生物利用度及生物等效性[J].华西药学杂志,2006,21(6):541-543.
[7]彭晓珊,唐映红.盐酸头孢他美酯体内和体外抗菌作用研究[J].中国医药科学杂志,2014,4(1):33-36.
Pharmacokinetics and Tissues Distribution of Cefetamet Sodium for Injection in Rats
SUNWenxia,TIANYuan,BIANQilong,CHENGQiang
(Sichuan Industrial Institute of Antibiotics, Chengdu University, Chengdu 610052, China)
Abstract:The paper investigates the pharmacokinetics and tissues distribution of cefetamet sodium for injection in rats,and provides evidence for clinical rational drug use.180 SD rats were randomly divided into 36 groups,and received IV cefetamet sodium at the dose levels of 50,100,1 000 mg·kg(-1),respectively.Their blood was drawn at different time with the serum being isolated.The other 36 SD rats were randomly divided into 3 groups,and were intravenously injected 100 mg·kg(-1) cefetamet sodium respectively and then various tissues were collected at different time,which were further made into homogenate.The concentration of cefetamet in serum and various tissues were analyzed by HPLC method.The pharmacokinetic parameters were calculated by 3p97 software.The results showed that the pharmacokinetic parameters demonstrated in cefetamet in SD rats were consistent with two-compartment model.The main pharmacokinetic parameters of cefetamet at different dose levels(low,medium,high) were listed as follows:C(max)(66.70±21.59),(216.90±43.22) and (1 972.70±125.54) μg·mL(-1), t(1/2β)(1.49±0.20),(1.36±0.20) and (1.27±0.16) h,AUC((0~12))(139.05±27.93),(293.01±65.55) and (2 627.32±134.92) μg·h·mL(-1).After being intravenously injected,the concentration of cefetamet sodium in tissues reached the highest after an hour,which was indicated from high to low successively in kidney,liver,lungs,stomach,heart,skeletal muscle,spleen,intestine,brain,ovary and testicle.A conclusion is drawn that the concentration of cefetamet after IV injection of cefetamet sodium is higher in rat’s serum and partial tissues without accumulation.
Key words:cefetamet sodium;pharmacokinetics;tissues distribution;HPLC
中图分类号:R969.1
文献标志码:A
作者简介:孙文霞(1980 — ), 女, 硕士, 助理研究员, 从事药物代谢动力学研究.
基金项目:成都大学校青年基金(2014XQCKS10)资助项目.
收稿日期:2015-11-24.
文章编号:1004-5422(2016)01-0005-04
