体质量指数与基因型交互作用对华法林稳定治疗剂量的影响
2016-04-21李晓琪王绪云
刘 佳,李晓琪,王绪云,杨 洁,尹 彤
体质量指数与基因型交互作用对华法林稳定治疗剂量的影响
刘 佳,李晓琪,王绪云,杨 洁,尹 彤*
(解放军总医院心内科,北京 100853)
明确体质量指数(BMI)与华法林稳定剂量的相关性,并分析BMI与基因型对华法林剂量的交互作用。前瞻性募集解放军总医院自2010年1月至2014年12月连续收治的首次接受华法林抗凝治疗并达到稳定抗凝的患者427例,采集抗凝相关基线和临床数据。利用Pearson相关以及多元线性回归分析BMI与华法林稳定剂量的独立相关性,应用广义线性模型分析BMI和基因型交互作用对华法林稳定剂量的影响。华法林稳定剂量与BMI呈正相关(B=0.47,95% CI:0.30~0.63,<0.001)。BMI每增加一个单位,华法林周剂量增加0.40mg。利用方程式:10.47+0.40×BMI 能够预测华法林稳定治疗的周剂量。根据基因型进行分层后发现,携带相关基因型CYP2C9*3和VKORC1-1639G>A的患者BMI与华法林稳定剂量依然呈正相关(:0.23~0.37,<0.05),基因型和BMI之间对华法林剂量的影响无交互作用(PCYP2C9×BMI=0.87,PVKORC1×BMI=0.58)。BMI和华法林稳定治疗剂量之间呈正相关,且不受基因型影响,BMI与基因型共同影响华法林的稳定治疗剂量。
华法林;体质量指数;基因型;稳定治疗剂量
华法林(warfarin)是使用最广泛的一线口服抗凝药,可用于治疗静脉血栓栓塞以及其他高凝状态疾病。由于华法林的治疗窗窄,使用不当极易导致患者发生严重出血。因此,临床上一直将如何安全有效地使用华法林作为关注的重点和难题[1]。多种因素会影响华法林的稳定剂量和疗效,包括日常饮食、药物间相互作用、疾病状态等临床环境。近年来,随着药物基因组学研究的不断深入,大量研究表明,CYP2C9和VKORC1基因多态性是造成个体间华法林稳定剂量差异的主要原因[2,3]。国内外专家据此建立了华法林的剂量预测方程,但是方程中纳入的临床环境因素存在很大差异[4−6]。在已知的临床环境因素中,体质量指数(body mass index,BMI)与华法林剂量之间的相关研究较为少见。已有的研究发现[7−9],体质量或BMI能影响华法林的起始剂量以及达到治疗剂量的时间。但相关研究主要基于西方人群,而基于亚洲人群的研究并不多见。另外,BMI与基因型的交互作用对华法林剂量的影响亦不明确。在目前建立的华法林剂量预测方程中,是否应同时纳入基因型和BMI尚存在争议。鉴于此,本研究拟明确BMI与华法林稳定剂量的相关性,并分析BMI与CYP2C9和VKORC1基因型的交互作用对华法林剂量的影响。
1 对象与方法
1.1 研究对象
前瞻性募集解放军总医院自2010年1月至2014年12月连续收治的首次接受华法林抗凝治疗并达到稳定抗凝的患者427例。入选标准:(1)临床信息完整;(2)接受华法林抗凝治疗≥3个月且达到稳定剂量。排除标准:(1)严重肝、肾、血液系统疾病;(2)恶性肿瘤;(3)临床信息缺失;(4)血压>180/110mmHg;(5)妊娠哺乳期。所有患者均签署知情同意书。研究方案经医院伦理委员会批准。
1.2 方法
采集基线资料以及与华法林治疗相关的信息[治疗指征、稳定剂量、国际标准化比值(internationalnormalized ratio,INR)等]。华法林稳定剂量:患者连续3次门诊复查(间隔≥1周)INR维持在目标范围的剂量。
1.3 基因分型
采集患者外周血全血提取基因组DNA,将CYP2C9基因外显子7的基因片段VKORC1基因启动子进行聚合酶链反应(polymerase chain reaction,PCR)扩增,采用多重SNaPshot SNP分型技术检测CYP2C9*3(rs1057910)、VKORC1-1639G>A(rs9923231)基因多态性。PCR产物直接使用ABI 3730自动序列分析仪(美国应用生物系统公司)进行测序。使用Sequencher软件(美国基因编码公司)对序列进行分析,然后目视比较。根据基因分型结果将患者分为携带者和非携带者。各突变位点上下游引物以及延伸引物分别如下。(1)CYP2C9*3。上游引物:5'TCAGCTAAAGTCCAGGAAGAG3'。下游引物:5'AACATGGAGTTGCAGTGTAGG3'。延伸引物:5'TTTTTTTTTTTTTTTTTTTTTTTTTTTTTGCACGAGGTCCAGAGATAC3'。(2)VKORC1-1639G>A。上游引物:5'GCTTGTCTTAAACTCC3'。下游引物:5’TGAGAAACAGCATCTGGAGAG3'。延伸引物:5'TTTTTTAGGCGTGAGCCACCGCACC3'。参照序列为来自GenBank的CYP2C9、VKORC1基因组序列。
1.4 统计学处理
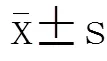
2 结 果
2.1 一般情况
427例患者中,男性231例(54%),女性196例(46%),年龄(56.36±15.70)岁。华法林周剂量为5.81~52.5(21.01±7.25)mg。BMI为16.14~43.56(24.87±3.92)kg/m2(表1)。
2.2 BMI与华法林剂量的相关性分析
通过对BMI值由低到高划分和对应患者华法林的周剂量研究发现,随着BMI的增加,患者的华法林周剂量呈增加趋势,且BMI>31kg/m2的患者周剂量明显增加(表2)。经Pearson相关分析发现,华法林稳定剂量与BMI呈正相关(=0.27,<0.001;图1)。BMI每增加一个百分点,华法林周剂量增加0.40mg。据此建立华法林稳定治疗的平均周剂量预测方程为:10.47+0.40×BMI。在纳入了年龄、性别、生活习惯、合并用药、并发症以及基因型在内的多种因素进行多元线性回归分析后,发现BMI与华法林稳定剂量依然具有相关性(B=0.47,95%CI:0.30~0.63,<0.001)。

表1 患者的基线特征以及基因型分布
BMI: body mass index; INR: international normalized ratio
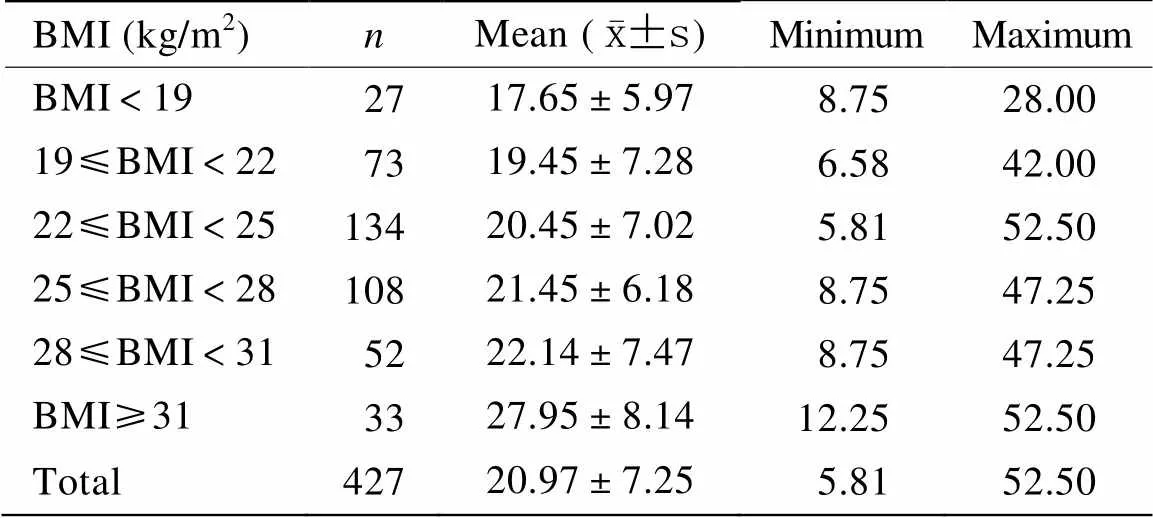
表2 不同BMI组患者的华法林周剂量
BMI: body mass index
2.3 基因型与华法林剂量的相关性分析
基因型检测发现,各基因的多态性均达到Hardy-Weinberg平衡(>0.05),样本具有群体代表性:10.54%患者携带CYP2C9*3基因型;82.90%患者携带VKORC1(−1639G>A)AA基因型;17.10%患者携带VKORC1(−1639G>A)GA+GG基因型。比较不同基因型患者的周剂量后发现,CYP2C9*3携带者的华法林治疗剂量显著降低(16.6721.52,<0.001),VKORC1(−1639G>A)携带者的华法林治疗剂量显著增加(25.7620.73,<0.001)。
2.4 基因型与BMI对华法林剂量影响的交互作用分析
根据基因型进行分层后,应用广义线性模型分析BMI和基因型对华法林稳定剂量影响的交互作用。结果发现,BMI与华法林稳定剂量的正相关性并不受基因型携带状态的影响(:0.23~0.37,<0.05;表3)。根据WHO标准[10]将患者分为普通组(BMI<25kg/m2)和超重组(BMI≥25 kg/m2)分析后进一步证实上述结果(<0.05),且表明两个基因型与BMI之间不存在对华法林稳定剂量影响的交互作用(PCYP2C9×BMI=0.87,PVKORC1×BMI=0.58;图2)。
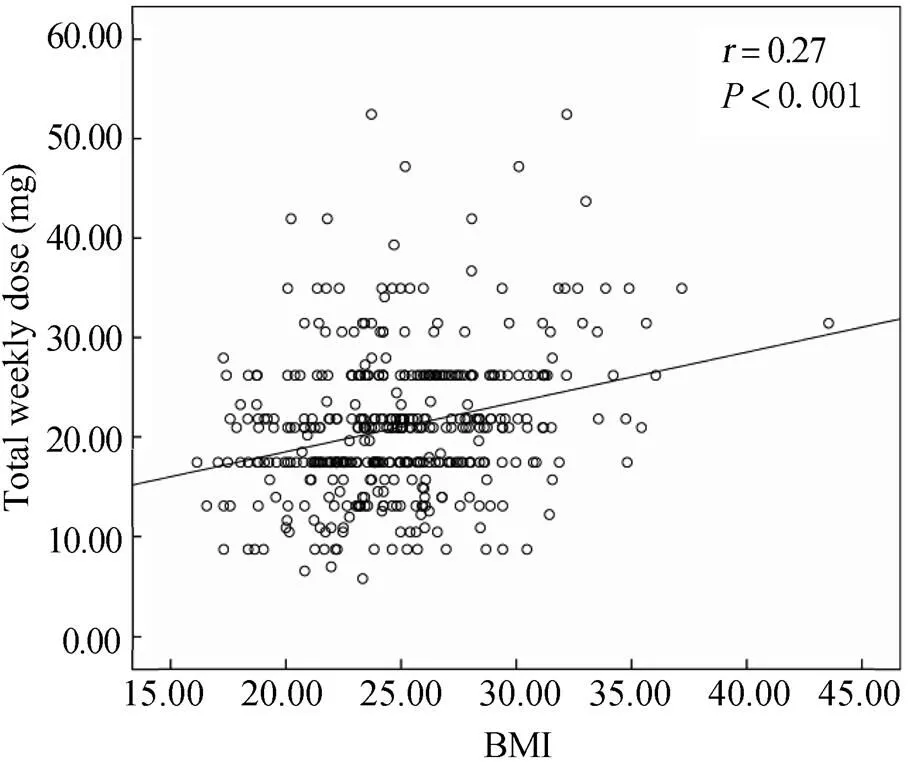
图1 周剂量与BMI的双变量分析
Figure 1 Bivariate analysis of total weekly dose and body mass index BMI: body mass index
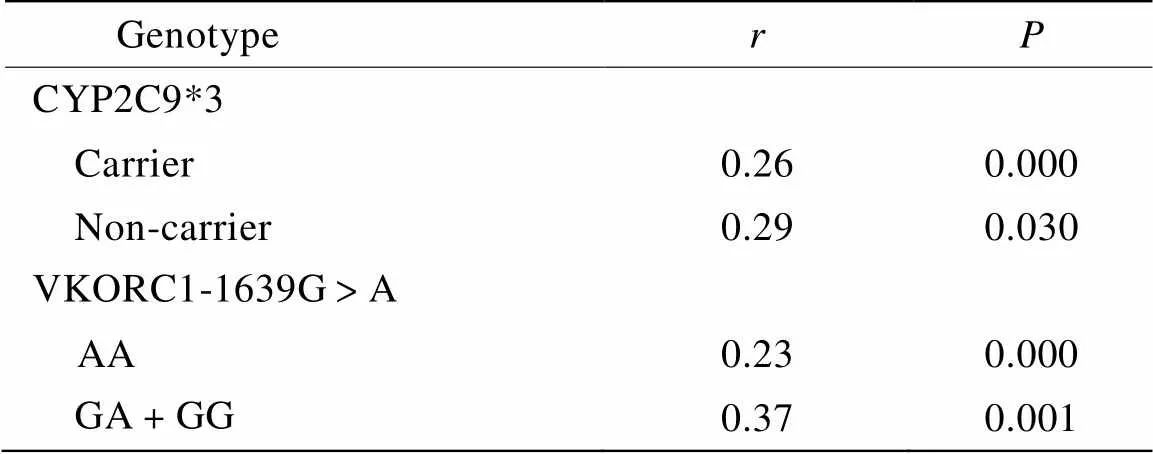
表3 不同基因型患者BMI与华法林稳定剂量相关分析
BMI: body mass index
3 讨 论
尽管新型口服抗凝药已经相继出现并应用于临床,但是由于新药存在价格昂贵、易致出血以及缺乏拮抗药等缺点,应用范围受到了一定限制。因此,华法林仍然广泛应用于临床。近年来,随着华法林药物基因组学技术的发展,为了提高华法林使用的安全性,国内外专家一直致力于华法林剂量预测模型的建立。然而,影响华法林稳定剂量的因素很多,目前已知的华法林剂量个体间差异的影响因素还很局限,因此,在药物基因组学研究基础上,深入探索华法林的代谢及其临床环境影响因素,对于剂量预测模型的建立至关重要。
本研究发现,BMI对华法林周剂量的影响非常显著,BMI每增加1个百分点,华法林周剂量可增加0.40mg,这表明高BMI患者将需要较高剂量的华法林达到并维持治疗目标范围内的INR值。Wallace等[5]的研究发现,肥胖和病态肥胖患者需要较长的时间才能达到华法林稳定剂量;而且他们的华法林平均日剂量也高于平均值。该研究认为,临床医师应为肥胖患者增加40%~50%的华法林初始剂量。我们的研究进一步证实了高BMI患者也需要增加维持剂量的华法林,以达到稳定的抗凝治疗水平。体表面积对剂量也存在影响。Gage等[11]发现体表面积每增加0.25m2,稳定剂量增加11%。另1项研究[12]也发现患者的稳定剂量和体表面积相关,但在建立的剂量预测回归模型中并没有发挥显著的作用。有国外学者提出了BMI与华法林稳定剂量呈正相关,而我们首次在汉族人群中发现了这一相关性,且发现该相关性不受剂量相关的CYP2C9和VKORC1基因型分布的影响。目前已有大量关于华法林药物基因学剂量预测模型建立的研究发表,但是在所建立的方程模型中,纳入的临床环境因素差别很大[6,13−15]。我们的研究发现,BMI在不同基因型分布的患者中均与华法林剂量密切相关,而且与基因型之间无交互作用。这表明BMI与基因型对华法林剂量的影响是独立发挥作用的,并可能协同影响华法林的剂量。因此,在以后的华法林剂量预测模型中,有必要同时纳入基因型和BMI作为参考变量。
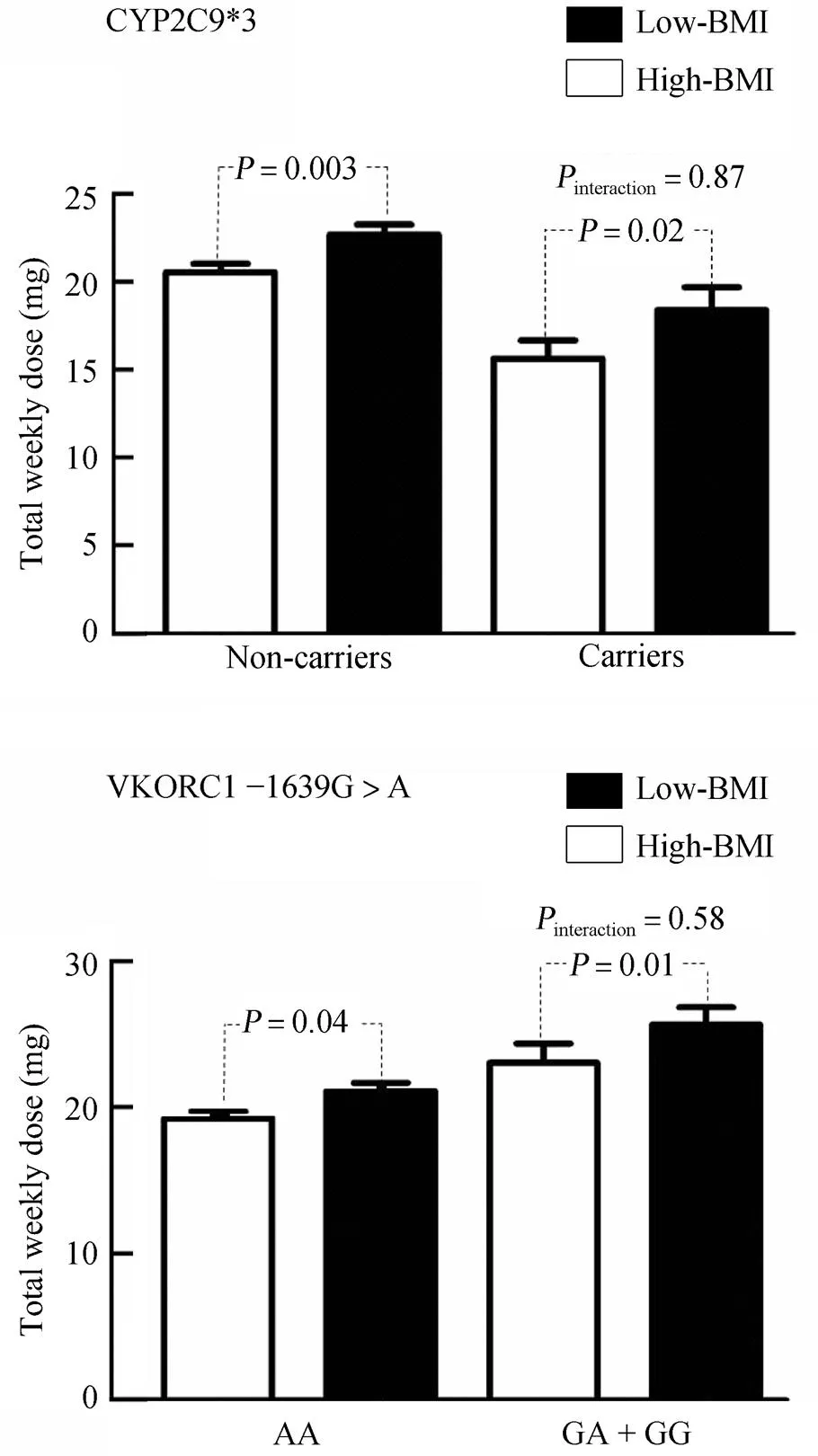
图2 基因型与BMI的交互作用对华法林稳定剂量影响
Figure 2 Interaction between genotype and BMI on warfarin dose BMI: body mass index
本研究发现,BMI和华法林周稳定剂量呈正相关,该相关性不受CYP2C9和VKORC1基因型分布的影响,BMI与CYP2C9和VKORC1基因型共同影响华法林的稳定剂量。本研究也存在一定的局限性:(1)未考虑饮食因素对华法林剂量的影响;(2)未分析药物间相互作用的影响,许多药物会通过增加或减少的华法林的代谢影响华法林的治疗剂量;(3)使用BMI作为衡量指标具有局限性,因为该指标无法区分患者体内尤其是年轻患者的脂肪和肌肉的差异,未来研究中可以考虑纳入腰围或其他指标证实本研究的结果。
[1] Yang YM, Yan HB, Zhu J,. Interpretation of the new atrial fibrillation treatment guidelines by the American Heart Association/American College of Cardiology/Heart Rhythm Society[J]. Chin J Cardiol, 2014, 42(11): 971−973. [杨艳敏, 颜红兵, 朱 俊, 等. 解读美国心脏学会/美国心脏病学学会/心律协会最新心房颤动治疗指南[J]. 中华心血管病杂志, 2014, 42(11): 971−973.]
[2] Yang J, Xu B, Zhang YX,. The follow-up study of 375 patients treated with warfarin anticoagulation[J]. Chin J Pharmacoepidemiol, 2011, 20(5): 221−224. [杨 洁, 徐 斌, 张玉霄, 等. 375例口服华法林抗凝治疗患者的跟踪调查[J]. 药物流行病学杂志, 2011, 20(5): 221−224.]
[3] Yin T, Miyata T. Warfarin dose and the pharmacogenomics of CYP2C9 and VKORC1—rationale and perspectives[J]. Thromb Res, 2007, 120(1): 1−10.
[4] Yoo SH, Nah HW, Jo MW,. Age and body weight adjusted warfarin initiation program for ischaemic stroke patients[J]. Eur J Neurol, 2009, 16(10): 1100−1105.
[5] Wallace JL, Reaves AB, Tolley EA,. Comparison of initial warfarin response in obese patientsnon-obese patients[J]. J Thromb Thrombolysis, 2013, 36(1): 96−101.
[6] Gage BF, Eby C, Johnson JA,. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin[J]. Clin Pharmacol Ther, 2008, 84(3): 326−331.
[7] Absher RK, Moore ME, Parker MH. Patient-specific factors predictive of warfarin dosage requirements[J]. Ann Pharmacother, 2002, 36(10): 1512−1517.
[8] Meyer zu Schwabedissen C, Mevissen V, Schmitz F,. Obesity is associated with a slower response to initial phenprocoumon therapy whereas CYP2C9 genotypes are not[J]. Eur J Clin Pharmacol, 2006, 62(9): 713−720.
[9] Mueller JA, Patel T, Halawa A,. Warfarin dosing and body mass index[J]. Ann Pharmacother, 2014, 48(5): 584−588.
[10] World Health Organization.Obesity: preventing and managing the global epidemic.Report of a WHO consultation[J].World Health Organ Tech Rep Ser, 2000, 894: i−xii, 1−253.
[11] Gage BF, Fihn SD, White RH. Management and dosing of warfarin therapy[J]. Am J Med, 2000, 109(6): 481−488.
[12] Kamali F, Khan TI, King BP,. Contribution of age, body size, and CYP2C9 genotype to anticoagulant response to warfarin[J]. Clin Pharmacol Ther, 2004, 75(3): 204−212.
[13] Huang SW, Chen HS, Wang XQ,. Validation of VKORC1 and CYP2C9 genotypes on interindividual warfarin maintenance dose: a prospective study in Chinese patients[J]. Pharmacogenet Genomics, 2009, 19(3): 226−234.
[14] Lenzini P, Wadelius M, Kimmed S,. Integration of genetic, clinical, and INR data to refine warfarin dosing[J]. Clin Pharmacol Ther, 2010, 87(5): 572−578.
[15] International Warfarin Pharmacogenetics Consortium, Klein TE, Altman RB,. Estimation of the warfarin dose with clinical and pharmacogenetic data[J]. N Engl J Med, 2009, 360(8): 753−764.
(编辑: 吕青远)
Interaction between body mass index and genotype affects stable dose of warfarin: a prospective study of 427 cases
LIU Jia, LI Xiao-Qi, WANG Xu-Yun, YANG Jie, YIN Tong*
(Institute of Geriatric Cardiology, Chinese PLA General Hospital, Beijing 100853, China)
To illustrate the correlation of body mass index (BMI) with stable dose of warfarin, and analyze the interaction between BMI and genotypes on warfarin dose.A total of 427 consecutive stable anti-coagulated patients taking warfarin for the first time were recruited prospectively in our hospital from January 2010 to December 2014. Anticoagulant treatment related baseline and clinical data were collected. The correlation between weekly stable dose of warfarin and BMI was analyzed with Pearson correlation and multivariate linear regression analyses. The interaction between BMI and genotypes on the stable dose was analyzed with generalized linear model.BMI was positively correlated with the stable dose of warfarin (B=0.47, 95%CI: 0.30−0.63,<0.001). The average dose of warfarin was increased by 0.40mg as BMI increasing by 1 unit. The equation of 10.47±0.40×BMI could predict the average weekly dose of warfarin. After stratified by genotypes, a positive correlation was found between BMI and stable warfarin dose among the CYP2C9*3 and VKORC1-1639G>A carriers (: 0.23 to 0.37,<0.05). There was no interaction between genotype and BMI (PCYP2C9×BMI=0.87, PVKORC1×BMI=0.58) on warfarin dose.There is a positive correlation between BMI and stable dose of warfarin, which is not affected by genotypes. BMI and genotypes could influence warfarin stable dose collaboratively.
warfarin; body mass index; genotype; stable dose
(7152129) and(2012FC-TSYS-3043).
R973.2
A
10.11915/j.issn.1671-5403.2016.01.001
2015−07−30;
2015−09−01
北京市自然科学基金面上项目(7152129); 解放军总医院临床扶持基金(2012FC-TSYS-3043)
尹 彤, E-mail: yintong2000@yahoo.com
